Μαρία Π. Γιαβροπούλου
Τμήμα Κλινικής και Μοριακής Ενδοκρινολογίας, ΠΓΝΘ ΑΧΕΠΑ,
Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης,
Ιωάννης Γ. Γιώβος
Τμήμα Κλινικής και Μοριακής Ενδοκρινολογίας, ΠΓΝΘ ΑΧΕΠΑ,
Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης,
Σταύρος Μανώλαγας
Division of Endocrinology and Metabolism, UAMS center for osteoporosis
and metabolic bone diseases, Little Rock, Arkansas, USA
1. Εισαγωγή
Η οστεοπόρωση αποτελεί ένα σημαντικό ιατρικό πρόβλημα που παρουσιάζεται ως απόρροια της μακροζωϊας και της αλλαγής στον τρόπο ζωής του δυτικού κυρίως κόσμου. Ως οστεοπόρωση ορίζουμε τη σκελετική διαταραχή που χαρακτηρίζεται από ελάττωση της οστικής πυκνότητας με συνοδό διαταραχή της μικροαρχιτεκτονικής του οστίτη ιστού που οδηγεί σε σημαντική μείωση της οστικής αντοχής και αυξημένο κίνδυνο κατάγματος (1).
Καθ ‘όλη τη διάρκεια της ζωής, ’’το γηρασμένο οστό’’ επαναρροφάται περιοδικά από τους οστεοκλάστες (οστική απορρόφηση) για να αντικατασταθεί από νέο οστίτη ιστό που παράγεται από τους οστεοβλάστες (οστική κατασκευή). Αυτή η διαδικασία της οστικής ανακατασκευής συμβαίνει σε συγκεκριμένες οστικές περιοχές που έχουν υποστεί τραυματισμό και χρήζουν επιδιόρθωσης. Η οστική απορρόφηση και η οστική κατασκευή δρουν πάντοτε συντονισμένα κατά τρόπο που να επιτρέπει την εύρυθμη λειτουργία του οστίτη ιστού. Σε καταστάσεις, ωστόσο, που υπερισχύει η οστική απορρόφηση (2,3), έχουμε ελάττωση της οστικής μάζας και δημιουργία οστεοπόρωσης.
Ως κορυφαία οστική μάζα ορίζεται η μέγιστη οστική μάζα που θα αποκτήσει ένας οργανισμός κατά τη διάρκεια της ανάπτυξης και σκελετικής του αύξησης μέχρι και την τρίτη δεκαετία της ζωής. Η απόκτηση χαμηλής κορυφαίας οστικής μάζας μπορεί να συμβάλλει στην ανάπτυξη της οστεοπόρωσης στη μετέπειτα ζωή. Ωστόσο, το γήρας, η ανεπάρκεια των στεροειδών του φύλου, η οξείδωση των λιπιδίων, η μειωμένη σωματική δραστηριότητα, η χρήση γλυκοκορτικοειδών, και η προδιάθεση για πτώσεις λόγω μυϊκής αδυναμίας και μειωμένων αντανακλαστικών ισορροπίας που επέρχονται με την πάροδο της ηλικίας αποτελούν επίσης σημαντικούς παράγοντες αύξησης του κινδύνου κατάγματος.
Η διάγνωση της οστεοπόρωσης ή η εκτίμηση του μελλοντικού καταγματικού κινδύνου στηρίζονται σχεδόν αποκλειστικά στο προσδιορισμό της οστικής μάζας με μελέτες απεικόνισης, όπως η απορροφησιομετρία διπλής ενέργειας ακτίνων Χ (DXA) (Πίνακας 1) και η ποσοτική αξονική τομογραφία (QCT).
Oι μέθοδοι αυτοί είναι πολύ σημαντικές και αξιόπιστες στην κλινική πράξη, ωστόσο είναι σημαντικό να συγκρατήσει κανείς ότι η νόσος είναι η ευθραυστότητα των οστών και η μειωμένη οστική πυκνότητα, όπως αυτή προσδιορίζεται με τη μέθοδο DXA, είναι μόνο ένας από τους πολλούς παράγοντες κινδύνου.
2. Απόκτηση κορυφαίας οστικής μάζας
Όπως έχει ήδη αναφερθεί η κορυφαία οστική μάζα είναι η μέγιστη οστική μάζα που επιτυγχάνεται μέχρι την ηλικία των 30 ετών και εξαρτάται τόσο από γενετικούς, όσο και από περιβαλλοντικούς παράγοντες (διατροφή, διαβίωση) καθώς και από τον τύπο του οστού.
2.1 Γενετικοί παράγοντες
Κατά ένα ποσοστό η διακύμανση που παρατηρείται στην οστική πυκνότητα μεταξύ των ανθρώπων έχει γενετική βάση. Σε συσχετιστικές μελέτες γονιδιωματικής κλίμακας (genome wide association studies) έχουν μέχρι στιγμής εντοπιστεί περίπου 80 γονιδιακοί τόποι που επηρεάζουν την οστική πυκνότητα (4, 5). Ένας σημαντικός αριθμός από τα γονίδια αυτά σχετίζονται με τα ενδοκυττάρια μονοπάτια μεταγωγής σήματος Wnt/β-κατενίνης και RANK/RANKL/OPG και τις σηματοδοτικές οδούς που ενεργοποιούνται κατά τη διαφοροποίηση των μεσεγχυματικών κυττάρων.
Η συμμετοχή, ωστόσο, των γενετικών παραγόντων στη διαμόρφωση της οστικής πυκνότητας είναι μικρή και ένα μικρό ποσοστό των διακυμάνσεων της οστικής πυκνότητας εξηγείται από γονιδιακές παραλλαγές. Μέχρι σήμερα, δεν υπάρχουν –αντίστοιχες μελέτες αναφορικά με την ύπαρξη γενετικών παραγόντων που να σχετίζονται με τον κίνδυνο κατάγματος ή την οστική απώλεια. Ως εκ τούτου, παραμένει ασαφές εάν τα ίδια γονίδια που καθορίζουν την οστική πυκνότητα μπορούν να επηρεάσουν το ρυθμό της οστικής απώλειας, ή τον αυξημένο καταγματικό κίνδυνο. που παρατηρούνται με την εμμηνόπαυση στις γυναίκες και με την προχωρημένη ηλικία και στα δύο φύλα,
2.2 Περιβαλλοντικοί παράγοντες
Η απόκτηση της βέλτιστης κορυφαίας οστικής μάζας αντανακλά σε μεγάλο βαθμό την αύξηση του μεγέθους του σώματος και τη δράση του μηχανικού φορτίου στο σκελετό που προέρχεται κυρίως από την ανάπτυξη της μυϊκής μάζας (6). Κατά την περίοδο της ανάπτυξης η αύξηση του σωματικού βάρους συνοδεύεται από την αύξηση της μυϊκή μάζας και της μυϊκής δύναμης. Βελτιστοποίηση της αντοχής των οστών κατά τη διάρκεια αυτής της περιόδου μπορεί να μειώσει σημαντικά το μελλοντικό κίνδυνο κατάγματος. Ωστόσο, η μέγιστη ανάπτυξη των μυών προηγείται της απόκτησης κορυφαίας οστικής πυκνότητας η οποία συμβαίνει ανεξάρτητα από την ανάπτυξη του μυϊκού ιστού. Ως εκ τούτου, η συμβολή της μονάδας οστού και μυός (muscle–bone Unit, MBU) στην απόκτηση της κορυφαίας οστικής μάζας παραμένει ασαφής.
Η σωματική δραστηριότητα κατά τη διάρκεια της παιδικής ηλικίας αυξάνει την οστική μάζα και την πυκνότητα (7), αλλά για τη διατήρηση της οστικής πυκνότητας στην ενήλικο ζωή απαιτείται συνεχής άσκηση. Αντιθέτως, τα χρόνια νοσήματα κατά τη διάρκεια της παιδικής ηλικίας επηρεάζουν αρνητικά την οστική μάζα και οστική αντοχή οδηγώντας σε αυξημένο κίνδυνο καταγμάτων είτε στην παιδική ηλικία είτε αργότερα κατά την ενήλικο ζωή λόγω μειωμένης κορυφαίας οστικής μάζας (8). Οι παράγοντες κινδύνου για την απόκτηση μειωμένης οστικής μάζας στα παιδιά περιλαμβάνουν:
- Κακή σωματική ανάπτυξη
- Καθυστερημένη ωρίμανση
- Υποσιτισμό
- Μειωμένη φυσική δραστηριότητα
- Χρόνια νοσήματα
- Χορήγηση φαρμάκων που επηρεάζουν τον οστικό μεταβολισμό, όπως τα γλυκοκορτικοειδή.
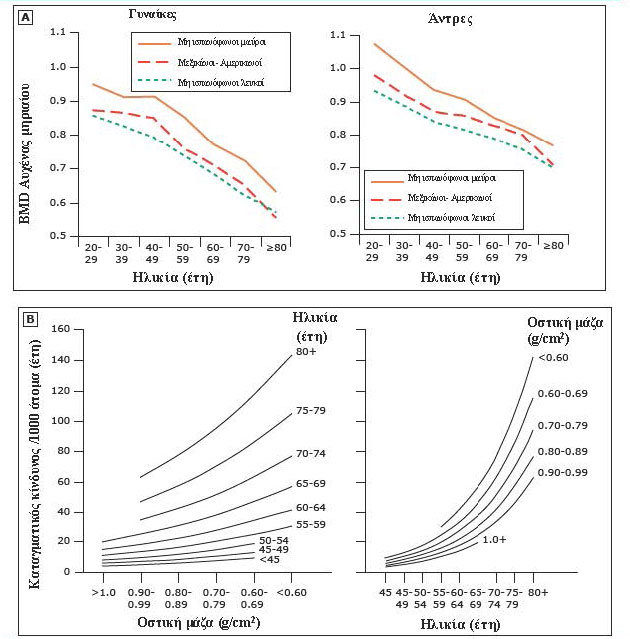
Εικόνα 1. (Α) Η οστική απώλεια ξεκινά από την τρίτη δεκαετία της ζωής και στα δύο φύλα. Τα στοιχεία είναι από επιδημιολογική μελέτη παρακολούθησης του πρώτου Εθνικού Συστήματος Υγείας και Διατροφής (NHANES), όπου ένα εθνικά αντιπροσωπευτικό δείγμα μη ιδρυματοποιημένων πολιτών παρακολουθήθηκαν για ένα μέγιστο διάστημα 22 ετών. Συνολικά 2879 Καυκάσιοι άνδρες ηλικίας 45 έως 74 ετών στην αρχή της μελέτης (1971-1975) παρατηρήθηκαν μέχρι το 1992 [Looker AC, et al. Int Οστεοπόρωση 1998: 8:468]. (Β) Η ηλικία αποτελεί περισσότερο καθοριστικό παράγοντα στον κίνδυνο κατάγματος από την οστική μάζα σε ανθρώπους. Τα στοιχεία προέρχονται από μία μελέτη παρατήρησης 521 λευκών γυναικών πάνω από ένα μέσο όρο 6,5 ετών με επανειλημμένες μετρήσεις οστικής μάζας στο περιφερικό άκρο της κερκίδας. Εντοπίστηκαν συνολικά 138 μη σπονδυλικά κατάγματα σε 3388 άτομα/έτη, καθώς η παρουσία κατάγματος διαβαθμίστηκε ανάλογα με την ηλικία και την οστική μάζα. Η συχνότητα εμφάνισης καταγμάτων στη συνέχεια τοποθετήθηκε σε ένα λογαριθμικό γραμμικό μοντέλο μαζί με την ηλικία και την οστική μάζα [Hui SL, et αϊ. J Clin Invest 1988:81:1804]. Ανατύπωση με την άδεια του καθηγητού Σ. Μανώλαγα [Endocr Rev 2010: 31:266. Copyright © 2010 Endocrine Society]
3. Γήρας
Σε αμφότερα τα φύλα το ισοζύγιο μεταξύ οστικής κατασκευής και οστικής απορρόφησης αποκλίνει υπέρ της οστικής απορρόφησης με την πάροδο της ηλικίας (Εικόνα 1). Η οστική απώλεια που σχετίζεται με την ηλικία ξεκινά αμέσως μετά την απόκτηση της κορυφαίας οστικής μάζας αλλά γίνεται μεγαλύτερη μετά την ηλικία των 65 ετών. Οι άνδρες, ωστόσο, είναι λιγότερο πιθανό να αναπτύξουν οστεοπόρωση συγκριτικά με τις γυναίκες για δύο κυρίως λόγους. Πρώτον, γιατί κατά κανόνα αποκτούν περισσότερη οστική μάζα κατά την εφηβεία, και δεύτερο, γιατί η οστική απώλεια που συμβαίνει λόγω γήρανσης, είναι μικρότερη διότι, σε αντίθεση με τις γυναίκες, οι άντρες δεν βιώνουν το ισοδύναμο της εμμηνόπαυσης που συνεπάγεται την απότομη πτώση των επιπέδων των ορμονών του φύλου. Οι ηλικιωμένοι οι οποίοι διαμένουν σε οίκους ευγηρίας παρουσιάζουν μεγαλύτερο καταγματικό κίνδυνο. Ογδόντα πέντε τοις εκατό των γυναικών άνω των 80 ετών που διαμένουν σε οίκο ευγηρίας, έχουν οστεοπόρωση και ο κίνδυνος μη σπονδυλικών καταγμάτων και καταγμάτων του ισχίου είναι 2.5 – 3.5 φορές πιο μεγάλος (9).
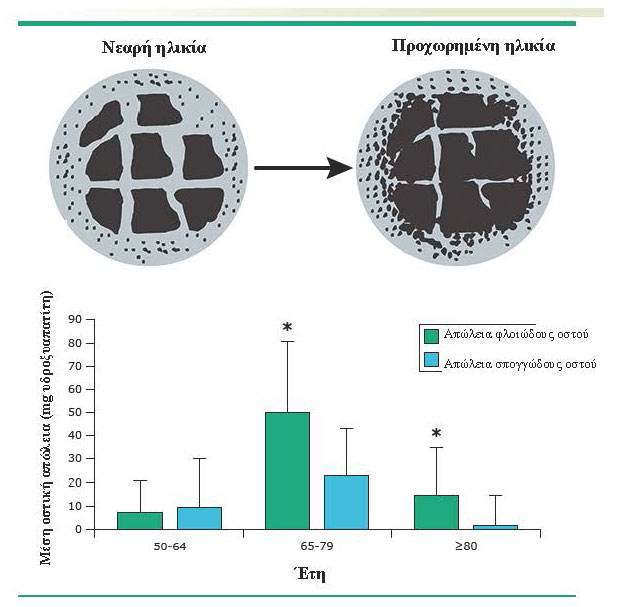
Αναφορικά με την εντόπιση των καταγμάτων, τα περισσότερα κατάγματα μετά την ηλικία των 65 ετών συμβαίνουν σε σκελετικές περιοχές που αποτελούνται κυρίως από φλοιώδες οστούν. Η υψηλής ανάλυσης περιφερική αξονική τομογραφία στην περιοχή της κερκίδας και των μηριαίων οστών (μετά θάνατον δείγματα) των γυναικών μεταξύ 50 και 80 ετών έδειξε ότι το μεγάλυτερο ποσοστό της οστικής απώλειας που παρατηρείται στην τρίτη ηλικία είναι αποτέλεσμα της αυξημένης ενδοφλοιϊκής πόρωσης (Eικόνα 2) (10).
Εικόνα 2. Η μάζα του υδροξυαπατίτη μειώνεται με την ηλικία. Σε μία μελέτη προσδιορίσθηκε με τη χρήση υψηλής ανάλυσης περιφερικής αξονικής τομογραφίας του περιφερικού άκρου της κερκίδας σε 122 λευκές γυναίκες, με μέση ηλικία 62,8 (εύρος 27 ως 98) έτη. Σημειωτέον ότι το μεγαλύτερο ποσοστό της οστικής απώλειας μετά την ηλικία των 65 ετών παρατηρείται στο φλοιώδες οστούν. Η πόρωση του φλοιώδους οστού μετρήθηκε χρησιμοποιώντας ηλεκτρονική μικροσκοπία σάρωσης σε μετα-θάνατον δείγματα μηριαίων οστών από 24 γυναίκες με μέση ηλικία 69 (εύρος 29 προς 99) ετών και απεικονίζεται σε σχηματικό τρόπο.* Ρ <0.0001. Αναδημοσίευση από: RM Zebaze, Ghasem-Zadeh Α, Bohte A, et al. Lancet 2010: 375:1729. Ειδική άδεια από την Elsevier για το up todate με επιφύλαξη παντός δικαιώματος.
Εκτός από τις επιπτώσεις της στην οστική μάζα, η γήρανση αυξάνει τον κίνδυνο καταγμάτων και με άλλους μηχανισμούς (αύξηση συχνότητας των πτώσεων, ανεπάρκεια βιταμίνης D), ανεξάρτητα από την οστική μάζα. Για την ίδια οστική πυκνότητα έχει δειχθεί ότι η κατά 20 έτη μεγαλύτερη ηλικία συνοδεύεται από τετραπλή αύξηση του κινδύνου κατάγματος (Εικόνα 2) (11). Επιπλέον, η πόρωση του φλοιώδους οστού αυξάνεται κατά 176% και 259 % από 20 έως 90 ετών (Εικόνα 2).
3.1 Mυϊκή δύναμη
Mειώνεται κατά 10 με 20% ανά δεκαετία μετά την ηλικία των 50 ετών. Η μείωση αυτή αυξάνει τον κίνδυνο των πτώσεων, και ίσως και τη σοβαρότητα των πτώσεων, αλλά έχει επίδραση και στα μηχανικά φορτία που εφαρμόζονται από το μυϊκό σύστημα στους σπονδύλους και στα μακρά οστά κατά τη διάρκεια των καθημερινών δραστηριοτήτων.
3.2 Oξειδωτικό στρες
Aποτελεί ένα κοινό παθογενετικό μηχανισμό διαφόρων εκφυλιστικών διαταραχών που σχετίζονται με τη γήρανση, συμπεριλαμβανομένης της οστεοπόρωσης (12, 13). Η αύξηση στα επίπεδα των ελευθέρων ριζών οξυγόνου (ROS) φαίνεται ότι σχετίζεται με τη μείωση της οστικής κατασκευής που παρατηρείται στην προχωρημένη ηλικία, καθώς επίσης και με την αύξηση της οστικής απορρόφησης που προκαλείται από την ανεπάρκεια οιστρογόνων (13). Η αυξημένη παραγωγή ελευθέρων ριζών οξυγόνου από τους ίδιους τους οστεοβλάστες επάγει την απόπτωσή τους και μειώνει την οστική κατασκευή. Επιπλέον, η παραγωγή ελευθέρων ριζών οξυγόνου αποτελεί την αναγκαία προϋπόθεση για την επαγωγή της οστεοκλαστογένεσης, αυξάνοντας την επιβίωση των ώριμων οστεοκλαστών μέσω της ενδοκυττάριας οδού RANKL/RANK/ OPG.
4. Ανεπάρκεια των στεροειδών του φύλου
Η οστική απώλεια που προκαλείται από την ανεπάρκεια οιστρογόνων και ανδρογόνων είναι απόρροια της αύξησης του αριθμού των οστεοβλαστών και των οστεοκλαστών και ασύμμετρης αύξησης της οστικής κατασκευής και απορρόφησης, εις βάρος της πρώτης. Αντιθέτως, παρουσία οιστρογόνων και ανδρογόνων μειώνεται η οστική απορρόφηση και διατηρείται ισορροπία μεταξύ της οστικής κατασκευής και απορρόφησης σε κάθε οστική μονάδα ανακατασκευής.
4.1 Οιστρογόνα
Η απώλεια του φλοιώδους οστού στις γυναίκες είναι στενά συνδεδεμένη με την έλλειψη οιστρογόνων (14), ενώ η απώλεια σπογγώδους οστού σχετίζεται περισσότερο με την ηλικία και είναι ανεξάρτητη από τα επίπεδα των οιστρογόνων (13, 14).
Η εξαρτώμενη από την ηλικία απώλεια του σπογγώδους οστού στη σπονδυλική στήλη επιταχύνεται μετά την εμμηνόπαυση, όπως αυξάνεται και η συχνότητα των καταγμάτων στον καρπό, στη σπονδυλική στήλη, και στο ισχίο. Στην περίοδο μεταξύ της εμμηνόπαυσης και της ηλικίας των 75 ετών, οι γυναίκες χάνουν περίπου το 22% της συνολικής οστικής τους μάζας. Το 13,3 % αυτής της απώλειας οφείλεται στη γήρανση και το 7,7% οφείλεται στην ανεπάρκεια των οιστρογόνων.
Στον αυχένα του μηριαίου οστού, το 14% της παρατηρούμενης απώλειας αποδίδεται στη γήρανση και μόνο το 5,3% στην ανεπάρκεια των οιστρογόνων (15).
Η επιταχυνόμενη φάση της οστικής απώλειας του σπογγώδους κυρίως οστού που προκαλείται από την εμμηνόπαυση οφείλεται κυρίως στη διάτρηση των δοκίδων και απώλεια της συνδετικότητάς των.
Η περίοδος αυτή ακολουθείται από μία δεύτερη περίοδο που χαρακτηρίζεται από βραδύτερο ρυθμό οστικής απώλειας και επηρεάζει κυρίως τις περιοχές του φλοιώδους οστού.
Η βραδύτερη αυτή φάση οστικής απώλειας εμφανίζεται εξίσου και στα δύο φύλα και συνδέεται με τη μείωση του αριθμού των οστεοβλαστών, τη μείωση του ρυθμού οστικής κατασκευής και τη μείωση του αριθμού των δοκίδων του σπογγώδους οστού, όπως έχουν δείξει μελέτες με ιστομορφομετρική ανάλυση σε ηλικιωμένους άνδρες και μετεμμηνοπαυσιακές γυναίκες με οστεοπόρωση (16, 17).
Η ετερογένεια των αποτελεσμάτων αναφορικά με τον οστικό μεταβολισμό που παρατηρούνται μεταξύ της οξείας ανεπάρκειας των οιστρογόνων (πρώτη φάση της εμμηνόπαυσης) και της παρατεταμένης οιστρογονικής ανεπάρκειας (σε ηλικιωμένες γυναίκες) αντανακλά σε μεγαλό βαθμό την επίδραση των μοριακών μηχανισμών που εμπλέκονται στη διαδικασία της γήρανσης.
Η ανεπάρκεια οιστρογόνων μπορεί επίσης να συμβάλλει στην ανάπτυξη της οστεοπόρωσης στους άνδρες (18). Τα οιστρογόνα που προέρχονται από την αρωματοποίηση των ανδρογόνων και δρούν μέσω του οιστρογονικού υποδοχέα (ER) είναι σημαντικά για τον οστικό μεταβολισμό των ανδρών όπως αποδεικνύεται από μελέτες του οστικού μεταβολισμού σε άνδρες που φέρουν μεταλλάξεις στον υποδοχέα των οιστρογόνων ή στο ένζυμο της αρωματάσης. Σε ανάλογα συμπεράσματα οδηγούμαστε και από τα αποτελέσματα βραχυπρόθεσμων κλινικών μελέτων με χορήγηση των αναστολέων της αρωματάσης (19). Επιπλέον, σε αρκετές κλινικές μελέτες παρατηρηθηκε συσχέτιση μεταξύ της μείωσης των επιπέδων της βιοδιαθέσιμης οιστραδιόλης, αλλά όχι της τεστοστερόνης, και της οστικής μάζας σε ηλικιωμένους άνδρες (14).
Σε μοριακό επίπεδο in vivo μελέτες έδειξαν ότι η έλλειψη του οιστρογονικού υποδοχέα τύπου α (ERα) εκλεκτικά στους οστεοκλάστες έχει επίδραση στον οστικό φαινότυπο μόνο των θηλέων επίμυων σε αντίθεση με την έλλειψη του ERα από τα προγονικά κύτταρα των οστεοβλαστών που προκαλεί μείωση της οστικής μάζας του φλοιώδους οστού και στα δύο φύλα. Δεν έχουν ακόμα εξακριβωθεί πλήρως οι μοριακοί μηχανισμοί δράσης των οιστρογόνων στον οστικό μεταβολισμό των ανδρών. Από τα ως τώρα δεδομένα, ωστόσο, φαίνεται ότι οι αρνητικές επιπτώσεις της οιστρογονικής ανεπάρκειας στην ανδρική οστεοπόρωση περιορίζονται στο φλοιώδες οστούν και προκύπτουν από την απώλεια της θετικής δράσης των οιστρογόνων στη λειτουργία των οστεοβλαστών. Η δράση αυτή περιλαμβάνει την προστασία των προγονικών κυττάρων των οστεοβλαστών από τις αρνητικές επιδράσεις των ελευθέρων ριζών οξυγόνου και την αντι-αποπτωτική τους δράση στους ώριμους οστεοβλάστες και στα οστεοκύτταρα.
Ωστόσο, παραμένει άγνωστο αν, και σε ποιό βαθμό, μικρές διαφορές των επιπέδων των οιστρογόνων στην κυκλοφορία συμβάλλουν σε αλλαγές των δεικτών του οστικού μεταβολισμού ή της οστικής πυκνότητας σε ηλικιωμένους άνδρες, λαμβάνοντας υπόψην ότι παρόμοιες μικρές διαφορές δεν φαίνεται να μεταβάλλουν την οστική πυκνότητα προεμμηνοπαυσιακών και περιεμμηνοπαυσιακών γυναικών (20). Επιπλέον, η απώλεια σπογγώδους οστού σε ηλικιωμένους άνδρες σχετίζεται κατά κύριο λόγο με τη λέπτυνση, αντί της διάτρησης των δοκίδων του σπογγώδους οστού που παρατηρείται στη ταχεία φάση της οστικής απώλειας μετά την εμμηνόπαυση (21).
4.1.1 Mηχανισμός δράσης των οιστρογόνων
Οι αλλαγές στον κύκλο οστικής εναλλαγής που συνοδεύουν την εμμηνόπαυση, οφείλονται εν μέρει στις άμεσες δράσεις των οιστρογόνων στα οστικά κύτταρα (οι υποδοχείς οιστρογόνων είναι παρόντες τόσο στους οστεοβλάστες όσο και στους οστεοκλάστες). Τα οιστρογόνα προάγουν την οστεοβλαστογένεση εις βάρος της λιπογένεσης από τα πρόδρομα μεσεγχυματικά κύτταρα (22), αυξάνουν τον πολλαπλασιασμό των οστεοβλαστών (23) και την παραγωγή οστεοβλαστικών πρωτεϊνών όπως [π.χ. o ινσουλινόμορφος παράγοντας-1, (IGF-1), το προκολλαγόνο τύπου Ι, ο ογκόμορφος αυξητικός παράγοντας–β (TGF-β) και οι oστικές μορφογενετικές πρωτεΐνες, (BMPs)], ενώ παράλληλα αναστέλλουν την απόπτωση των οστεοβλαστών (24) και των οστεοκυττάρων (25).
In vivo μελέτες, είχαν αρχικά δείξει ότι η έναρξη της θεραπείας υποκατάστασης με οιστρογόνα συνήθως προκαλεί μία σχετική μείωση του αριθμού και της δραστηριότητας των οστεοβλαστών (26), το οποίο εξηγείται από τη στενή σύζευξη της δραστηριότητας των οστεοβλαστών και των οστεοκλαστών που αρχικά υπερισχύει της αναβολικής δράσης των οιστρογόνων. Μελέτες σε εμμηνοπαυσιακές γυναίκες, ωστόσο, έδειξαν ότι οι υψηλές συγκεντρώσεις οιστρογόνων αυξάνουν ορισμένες ιστομορφομετρικές παραμέτρους της δραστηριότητας των οστεοβλαστών (π.χ. μέσο πάχος του τοιχώματος), πιθανόν μέσω επαγωγής της σύνθεσης αυξητικών παραγόντων από τους οστεοβλάστες (27).
Εκτός από τις άμεσες δράσεις στα οστικά κύτταρα η αντι-οστεοκλαστική δραστηριότητα των οιστρογόνων ενισχύεται και από την ανασταλτική τους δράση στα κύτταρα του μυελού των οστών και στα μονοπύρηνα, τα οποία παράγουν κυτοκίνες όπως η ιντερλευκίνη-1 και 6 (IL-l, IL-6) και ο νεκρωτικός παράγοντας των όγκων–α (TNF-α), που αποτελούν ισχυρούς διεγέρτες της οστεοκλαστογένεσης και οστεοκλαστικής δραστηριότητας (28-34). Η χορήγηση ανασταλτών του TNF-α και της ιντερλευκίνης 6, μειώνουν σημαντικά την οστική απώλεια σε μετεμμηνοπαυσιακές γυναίκες (35). Επίσης τα οιστρογόνα αυξάνουν την παραγωγή του ογκόμορφου αυξητικού παράγοντα–β (TGF-β), που δρά ανασταλτικά στην οστεοκλαστογένεση μέσω της ρύθμισης της παραγωγής του ΤNF-α από τα Τ-λεμφοκύτταρα (36, 37). Εκτός του οστίτη ιστού τα οιστρογόνα ρυθμίζουν την έκφραση και δράση συστηματικών ορμονών που σχετίζονται με τον οστικό μεταβολισμό όπως η ωοθυλακιοτρόπος ορμόνη (FSH) (38) και η αυξητική ορμόνη (GH) (39). Παράλληλα τα οιστρογόνα έχουν και αντι-οξειδωτικές δράσεις (40) ελαττώνοντας τις ελεύθερες ρίζες οξυγόνου και μειώνοντας με αυτόν τον τρόπο την απόπτωση των οστεοκυττάρων (41) ενώ αυξάνουν τα επίπεδα του νιτρικού οξειδίου (ΝΟ) συνεισφέροντας έτσι στη συνολική τους αντι-οστεοκλαστική δραστηριότητα (42) (Σχήμα 1).

Σχήμα 1. Μηχανισμοί δράσης των οιστρογόνων στον οστικό μεταβολισμό.
4.2 Ανδρογόνα
Τα ανδρογόνα είναι επίσης κριτικής σημασίας για την εύρυθμη λειτουργία του ανδρικού σκελετού, όπως αποδεικνύεται από τη χαμηλή οστική μάζα των ανδρών με ιδιοπαθή υπογοναδοτροπικό υπογοναδισμό ή γενετικών συνδρόμων που παρουσιάζουν διαφόρων βαθμών αντίσταση στα ανδρογόνα. Όπως έχει ήδη αναφερθεί η αντι-οστεοαπορροφητική δράση των οιστρογόνων μεσολαβείται κυρίως μέσω του υποδοχέα τους ERα στους οστεοκλάστες αλλά αυτό συμβαίνει μόνο στο σκελετό των θηλέων και όχι των αρρένων επίμυων (43, 44). Κατ’επέκταση η προστατευτική δράση των ανδρογόνων επί του σπογγώδους οστού δεν μπορεί να μεσολαβείται μέσω της δράσης των ανδρογόνων που έχουν υποστεί αρωματοποίηση στον οιστρογονικό υποδοχέα τύπου α. Το μη αρωματοποιημένο ανδρογόνο διϋδροτεστοστερόνη προστατεύει από την οστική απώλεια σε in vivo πειράματα ορχεκτομηθέντων επίμυων (45, 46). Επιπλέον, η μάζα και η αρχιτεκτονική του σπογγώδους οστού διατηρείται σε άνδρες με ομόζυγο ανενεργό μετάλλαξη του οιστρογονικού υποδοχέα τύπου α, υποδεικνύοντας ότι ο υποδοχέας ανδρογόνων (AR) μπορεί να διατηρήσει άθικτο το σπογγώδες οστό απουσία του ERα (47). Ως εκ τούτου, στο βαθμό που η ανδρική οστεοπόρωση είναι αποτέλεσμα της αύξησης της οστικής απορρόφησης λόγω της ανεπάρκειας των στεροειδών του φύλου, αυτό μπορεί να προκύψει μόνο από τη μείωση της δράσης των ανδρογόνων.
Παρά τα σημαντικά επιτεύγματα των τελευταίων ετών στη μελέτη της παθογένειας της ανδρικής οστεοπόρωσης ο βαθμός της συμβολής της γήρανσης αλλά και της ανεπάρκειας των ανδρογόνων ή των οιστρογόνων παραμένει εν πολλοίς άγνωστος.
5. Ο ρόλος των κυτταροκινών
Η γήρανση αλλά και η ανεπάρκεια οιστρογόνων ενοχοποιούνται εξίσου για τη σημαντική αύξηση των ελευθέρων ριζών οξυγόνου που συμβαίνει σε κυτταρικό επίπεδο στο μυελό των οστών με την πάροδο της ηλικίας και η οποία σχετίζεται με αύξηση του πληθυσμού των Τ και Β λεμφοκυττάρων, ενεργοποίηση της ενδοκυττάριας οδού της NF-kB και αυξημένη παραγωγή οστεοκλαστογενετικών κυτοκινών όπως οι ιντερλευκίνες 1, 6 και 7 (IL-1, IL-6, IL-7), ο παράγοντας νέκρωσης των όγκων (TNF), η προσταγλανδίνη Ε2, ο M-CSF και RANKL. Αντιθέτως, παρουσία οιστρογόνων ή μη αρωματοποιημένων ανδρογόνων η ενδοκυττάρια σηματοδοτική οδός NF-kB δεν ενεργοποιείται (40, 48). Ο βαθμός στον οποίο οι έμμεσες δράσεις των οιστρογόνων (ή ανδρογόνων) στα Τ και Β λεμφοκύτταρα συνεισφέρουν στη συνολική αντι-οστεοαπορροφητική δράση των στεροειδών του φύλου καθώς και η σημασία των δράσεων αυτών στην παθογένεια της οστεοπόρωσης παραμένουν ασαφείς (49, 50).
6. Ο ρόλος των οστεοκυττάρων
Τα οστεοκύτταρα αποτελούν ώριμους οστεοβλάστες που βρίσκονται ‘θαμένοι’ στη θεμέλιο ουσία του οστίτη ιστού. Σε αντίθεση με τους οστεοκλάστες και τους οστεοβλάστες, που είναι σχετικά βραχύβια κύτταρα και καταλαμβάνουν μόνο ένα μικρό κλάσμα της επιφάνειας του οστού, (51) τα οστεοκύτταρα βρίσκονται σε όλο το σκελετό, είναι πολύ περισσότερα από τους οστεοκλάστες (1000 φορές) ή τους οστεοβλάστες (10 φορές), έχουν μεγάλη διάρκεια ζωής, και ο θάνατός τους εξαρτάται κατά κύριο λόγο από την ηλικία του οστίτη ιστού (52). Λόγω της θέσεώς τους και του πολύπλοκου δίκτυου που σχηματίζουν, τα οστεοκύτταρα δρουν ως μηχανοστάτες αντιλαμβανόμενα τα ερεθίσματα από το περιβάλλον και ρυθμίζοντας ανάλογα με τις εκάστοτε ανάγκες κάθε οστικής μεταβολικής μονάδας την οστική ανακατασκευή. Τα πιο πρόσφατα δεδομένα καθιστούν τα οστεοκύτταρα ως τα κύτταρα-ενορχηστρωτές της οστικής εναλλαγής που ελέγχουν τόσο την οστική κατασκευή όσο και την οστική απορρόφηση. Mελέτες από in vivo πειράματα με ιστο-ειδική έκφραση των κυτοκινών RANKL και OPG, έδειξαν ότι τα οστεοκύτταρα αποτελούν τις, κύριες πηγές τους (51, 53). Ένας ακόμα μηχανισμός ρύθμισης της οστεοκλαστογένεσης από τα οστεοκύτταρα είναι μέσω του κυτταρικού θανάτου τους. Τα οστεοκύτταρα αποπίπτουν στις περιοχές των μικροκακώσεων και προσελκύουν τους οστεοκλάστες με τελικό αποτέλεσμα την απομάκρυνση τους. Η παρουσία ‘ζωντανών’ οστεοκυττάρων αποτελεί την κύρια και αναγκαία συνθήκη για την καταστολής της ενεργοποίησης των οστεοκλαστών και τη διατήρηση της οστικής μάζας (54). Eπίσης, μέσω της παραγωγής της σκληροστίνης ρυθμίζουν το σηματοδοτικό μονοπάτι Wnt στους οστεοβλάστες ελέγχοντας την οστεοβλαστογένεση και κατ’επέκταση την ομοιοστατική προσαρμογή του οστού στη μηχανική φόρτιση (55) (Σχήμα 2).
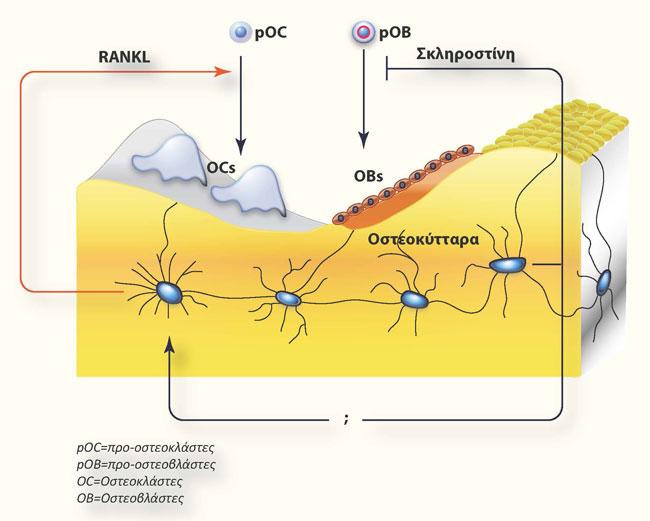
Σχήμα 2. Μοντέλο που απεικονίζει μηχανισμούς με τους οποίους τα οστεοκύτταρα μπορούν να ελέγχουν την οστική απορρόφηση και οστική κατασκευή. Οι οστεοκλάστες και οι οστεοβλάστες σε μία οστική μεταβολική μονάδα του σπογγώδους οστού προέρχονται από τα αντίστοιχα πρόδρομα κύτταρα. Τα οστεοκύτταρα μεταβάλλουν το ρυθμό της οστικής ανακατασκευής από τον έλεγχο του σχηματισμού οστεοκλαστών μέσω παραγωγής RANKL. και ελέγχουν την ισορροπία μεταξύ της οστικής κατασκευής και απορρόφησης μέσω της παραγωγής σκληροστίνης. Jinhu Xiong και Charles A. O’Brien J BoneMiner Res. 2012: 27:499-505.
6.1 Aπόπτωση των οστεοκυττάρων
Έχει αποδειχθεί από μελέτες σε πειραματόζωα ότι η βιωσιμότητα των οστεοκυττάρων αποτελεί σημαντικό παράγοντα της οστικής αντοχής, ανεξάρτητα από την απώλεια της οστικής μάζας (2, 52). Ως εκ τούτου η απόπτωση των οστεοκυττάρων σχετίζεται με παθολογικές καταστάσεις όπως η οστεοπόρωση και η οστεοαρθρίτιδα και οδηγεί σε αύξηση της οστικής ευθραστότητας, η οποία οφείλεται σε απώλεια της ικανότητας του οστίτη ιστού να αντιλαμβάνεται τις μικροκακώσεις και να κατευθύνει τις διαδικασίες επιδιόρθωσης μέσω του συντονισμού της δράσης οστεοβλαστών και οστεοκλαστών. Ο κυτταρικός θάνατος των οστεοκυττάρων μπορεί να προκληθεί από μία πλειάδα παραγόντων, όπως η στέρηση του οξυγόνου σε συνθήκες ακινητοποίησης του σκελετού, η ανεπάρκεια των οιστρογόνων και η χορήγηση γλυκοκορτικοειδών (2). Επίσης, η ιντερλευκίνη-1 και ο παράγοντας νέκρωσης των όγκων-α που αυξάνονται στην ανεπάρκεια οιστρογόνων επίσης προκαλούν την απόπτωση των οστεοκυττάρων. Στον αντίποδα έχουν περιγραφεί αρκετοί παράγοντες που ελαττώνουν ή και αναστέλλουν την απόπτωση τους. Σε αυτούς συμπεριλαμβάνονται τα οιστρογόνα και οι εκλεκτικοί τροποποιητές των οιστρογόνων (SERMS), τα διφωσφονικά, η καλσιτονίνη, ο συνδέτης του υποδοχέα CD40, η καλβιδίνη (calbindin -28 k), οι χημειοτακτικοί παράγοντες των μονοκυττάρων (MCP-1και 3) και η μηχανική φόρτιση μέσω της παραγωγής προσταγλανδινών. Ωστόσο, πάροτι η αναστολή της οστεοκυτταρικής απόπτωσης μπορεί να μειώσει την οστική απώλεια που προκαλείται λόγω προχωρημένης ηλικίας ή λόγω χρήσης γλυκοκορτικοειδών, η απόπτωση των οστεοκυττάρων είναι σημαντική και αναγκαία σε περιπτώσεις επιδιόρθωσης των μικροκακώσεων του οστίτη ιστού (2, 52). Όταν τα οστεοκύτταρα αποπίπτουν εκκρίνουν σήματα που μπορούν να οδηγήσουν στη στράτευση των οστεοκλαστών αλλά και των οστεοβλαστών σε γειτονικές περιοχές, ενεργοποιώντας παράλληλα την οστεοκλαστογένεση και την οστεοβλαστογένεση. Αναφορικά με τους οστεοβλάστες, η σκληροστίνη είναι ο μόνος γνωστός παράγοντας που εκκρίνεται αποκλειστικά από τα οστεοκύτταρα και δρώντας παρακρινικά επηρεάζει αρνητικά την οστεοβλαστογένεση, με αποτέλεσμα η απόπτωση των οστεοκυττάρων να καταργεί την ανασταλτική δράση της σκληροστίνης στους οστεοβλάστες επάγοντας την οστική παραγωγή.
Για τις οστεοκλάστες υπάρχουν αρκετές μελέτες που επιβεβαιώνουν ότι η απόπτωση των οστεοκυττάρων είναι ικανή για να ενεργοποιήσει τη στράτευση των οστεοκλαστών και την οστική απορρόφηση, αν και παραμένει άγνωστος ο ακριβής μηχανισμός που ενεργοποιείται για τη διαδικασία αυτή. Αρκετές μελέτες αναφέρονται στον ενδεχόμενο ρόλο του μεταγραφικού παράγοντα του εξαρτώμενου από την υποξία (HIF-1) ο οποίος αυξάνεται στην ακινησία και σε καταστάσεις στέρησης οξυγόνου και φαίνεται ότι συμμετέχει στη ρύθμιση της οστεοκλαστογένεσης όταν αυτή ενεργοποιείται από την απόπτωση των οστεοκυττάρων (2). Σε συνεργασία με την πρωτεΐνη που κωδικοποιεί το ογκοκατασταλτικό γονίδιο p53 φαίνεται να συμμετέχει στη διαδικασία της απόπτωσης αλλά παράλληλα είναι ισχυρός ενεργοποιητής του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (Vascular endothelial growthfactor, VEGF) που έχει αγγειογενετικές και οστεοκλαστογενετικές ιδιότητες. Επιπλέον η υποξία στα σημεία ενός κατάγματος προκαλεί την απελευθέρωση από τα οστεοκύτταρα χημειοτακτικών παραγόντων όπως είναι η οστεοποντίνη. Η οστεοποντίνη με τη σειρά της δρα ως οστεοκλαστικός χημειοτακτικός παράγοντας ενισχύοντας την προσκόλληση των οστεοκλαστών στην οστική επιφάνεια, ενώ παράλληλα ενεργοποιεί τη στράτευση μεσεγχυματικών κυττάρων του στρώματος στις περιοχές που έχουν υποστεί το κάταγμα για την περαιτέρω ενίσχυση της αποκατάστασης της οστικής απώλειας.
6.2 Έκπτωση του αριθμού των οστεοκυττάρων με την πάροδο της ηλικίας
Η ελάττωση του αριθμού των οστεοκυττάρων που συμβαίνει με την αύξηση της ηλικίας σχετίζεται με μείωση της οστικής αντοχής. Το οξειδωτικό στρες, η υποξία, η περίσσεια γλυκοκορτικοειδών, η ανεπάρκεια οιστρογόνων και οι αλλαγές που παρατηρούνται στον οστίτη ιστό που περιβάλλει τα βοθρία σε συνδυασμό με την έκκριση διαφόρων κυτοκινών είναι μερικοί από τους παράγοντες που εμπλέκονται στην αύξηση του ρυθμού θανάτου των οστεοκυττάρων με την πάροδο της ηλικίας (40) (Σχήμα 3). Σε συνθήκες στρες τα οστεοκύτταρα ενεργοποιούν μία διαδικασία αυτοσυντήρησης που καλείται “αυτοφαγία”. Η αυτοφαγία προάγει την αντίσταση και ανθεκτικότητα των οστεοκυττάρων στην απόπτωση που προκαλείται από το οξειδωτικό στρες, ενώ η έκφραση των σχετιζόμενων με την αυτοφαγία γονιδίων ελαττώνεται με την αύξηση της ηλικίας (56). Σε in vivo πειράματα, ποντίκια που στερούνται τη διαδικασία της αυτοφαγίας εκλεκτικά στα οστεοκύτταρα λόγω εκλεκτικής αποσιώπησης του γονιδίου που σχετίζεται με την αυτοφαγία (ΑΤG) και κωδικοποιεί μια κλάσης 3 φωσφοϊνοσιτίδη-3 κινάση που είναι απαραίτητη για τη δημιουργία αυτοφαγοσώματος, εμφανίζουν ελαττωμένη οστική πυκνότητα (56).
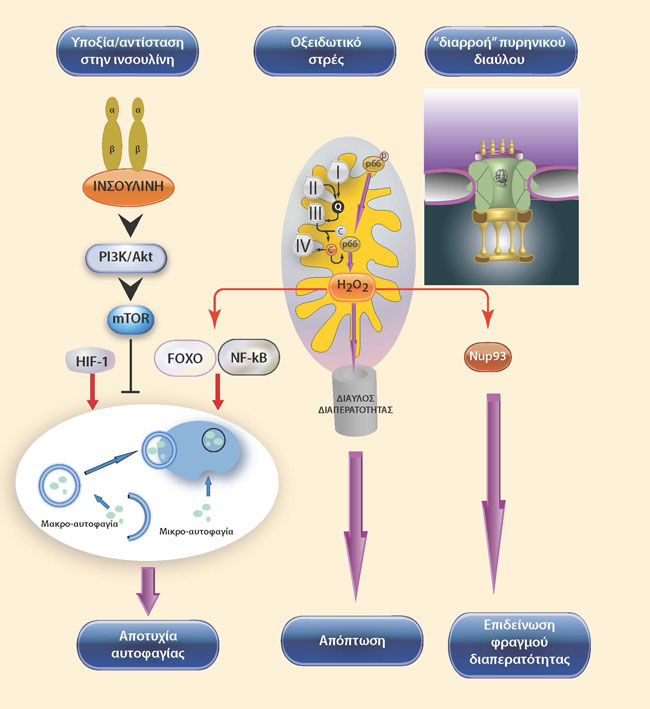
Σχήμα 3. Πιθανοί μηχανισμοί μείωσης του αριθμού των οστεοκυττάρων λόγω της συσσώρευσης του οξειδωτικού στρες (ΟΣ) με την πάροδο της ηλικίας. Η παραγωγή του υπεροξειδίου του υδρογόνου (Η2Ο2) και άλλων αντιδραστικών ριζών του οξυγόνου, που παράγονται κατά τη διάρκεια του αερόβιου μεταβολισμού στο εσωτερικό των μιτοχονδρίων, αυξάνει με την προχωρημένη ηλικία. Αυτή η αύξηση ενισχύεται με τη φωσφορυλίωση της ρ66, η οποία οξειδώνει το κυτοχρώμα c (C) που απελευθερώνεται από την αλυσίδα μεταφοράς ηλεκτρονίων, και ανοίγει τους διάυλους διαπερατότητας που οδηγούν σε απόπτωση. Τα κύτταρα προσπαθούν να εξουδετερώσουν τις αρνητικές συνέπειες της αύξησης του ΟΣ με διάφορους μηχανισμούς, όπως με την αύξηση της αυτοφαγίας, που ενισχύεται από την ενεργοποίηση μεταγραφικών παραγόντων, όπως οι FoxOs και NF-kB. Η ανεπάρκεια της διαδικασίας της αυτοφαγίας λόγω προχωρημένης ηλικίας συμβάλλει περαιτέρω στην απόπτωση των κυττάρων. Επιπλέον, με την προχωρημένη ηλικία, τα μετα-μιτωτικά κύτταρα αδυνατούν να διατηρήσουν άθικτη την πυρηνική μεμβράνη με αποτέλεσμα της διαρροή ουσιών από τους πυρηνικούς πόρους που προκαλείται από την οξείδωση των πρωτεϊνών της πυρηνικής μεμβράνης όπως το Nup-93. Stavros C. Manolagas and A. Michael Parfitt Trends Endocrinol Metab. 2010: 21: 369–374.
Το μηχανικό φορτίο αποτελεί μία ακόμα απαραίτητη συνθήκη για την επιβίωση των οστεοκυττάρων και η απουσία φυσιολογικών επιπέδων μηχανικής φόρτισης αυξάνει την οστεοκυτταρική απόπτωση και κατ’επέκταση την οστική απορρόφηση, ενώ ελαττώνει την οστική μάζα και την οστική αντοχή. Τέλος τα οστεοκύτταρα αποτελούν πολύ σημαντικούς κυτταρικούς υποδοχείς της δράσης των οιστρογόνων και των ανδρογόνων στον οστίτη ιστό.
Τα στεροειδή των γονάδων ελαττώνουν την απόπτωση των οστεοβλαστών και των οστεοκυττάρων. Ως εκ τούτου η ανεπάρκεια οιστρογόνων και ανδρογόνων που παρατηρείται στη γεροντική ηλικία αυξάνει την απόπτωση των οστεοκυττάρων (54).
Συμπερασματικά, η αύξηση της ηλικίας επιφέρει ένα πλήθος από μεταβολές στο ανθρώπινο σώμα γενικά αλλά και στο σκελετό ειδικότερα, με αποτέλεσμα την αναμενόμενη μείωση της οστικής μάζας και οστικής αντοχής στο γηράσκοντα σκελετό. Ο κύριος αποδέκτης των αλλαγών αυτών σε επίπεδο οστίτη ιστού είναι τα οστεοκύτταρα.
7. Ο ρόλος των γλυκοκορτικοειδών
Η ενδογενής ή φαρμακευτική περίσσεια γλυκοκορτικοειδών αποτελεί μία πολύ συνηθισμένη αιτία οστεοπόρωσης. Σε αντίθεση με τη μετεμμηνοπαυσιακή οστεοπόρωση, στην οστεοπόρωση από γλυκοκορτικοειδή ο ρυθμός της οστικής ανακατασκευής είναι χαμηλός και ο κυρίαρχος μηχανισμός είναι η μειωμένη οστική κατασκευή όπως παρατηρείται με την οστική απώλεια που συμβαίνει με την πάροδο της ηλικίας. Επιπλέον, η περίσσεια γλυκοκορτικοειδών, μειώνει την αντοχή των οστών δυσανάλογα με τις δυσμενείς επιπτώσεις της στην οστική μάζα (57). H μακροχρόνια θεραπεία (> 3 μήνες) με γλυκοκορτικοειδή μπορεί να προκαλέσει κατάγματα της σπονδυλικής στήλης, των πλευρών και των ισχίων πριν ακόμα γίνει εμφανής οποιαδήποτε μείωση στην οστική μάζα, γεγονός που υποδεικνύει τις διαταραχές στη μικροαρχιτεκτονική και συνεπώς στην ποιότητα του οστού που συμβαίνουν ανεξάρτητα και προηγούνται της μείωσης της οστικής πυκνότητας. Τα επιβλαβή αποτελέσματα της περίσσειας γλυκοκορτικοειδών στα οστά είναι συνάρτηση της άμεσης αρνητκή επίδρασής τους στα οστικά κύτταρα (58-61), αλλά και των έμμεσων δράσεων στο μεταβολισμό του ασβεστίου και στη μείωση των επιπέδων των στεροειδών των γονάδων.
Σε κυτταρικό επίπεδο, η περίσσεια γλυκοκορτικοειδών καταστέλλει την οστεοβλαστογένεση και επάγει την απόπτωση των οστεοβλαστών και των οστεοκυττάρων ενώ παράλληλα παρατείνει τη διάρκεια ζωής των οστεοκλαστών. Μεταβολές στην παραγωγή κυτοκινών και αυξητικών παραγόντων, όπως οι ινσουλινόμορφοι αυξητικοί παράγοντες (IGFs) και οι δεσμευτικές πρωτεΐνες τους (IGFBPs), και σε ενδοκυττάρια μονοπάτια μεταγωγής σήματος όπως η οδός Wnt/β-κατενίνης συμμετέχουν επίσης στις δυσμενείς επιπτώσεις των γλυκοκορτικοειδών στον οστικό μεταβολισμό.
Η ενδογενής παραγωγή γλυκοκορτικοειδών και η ευαισθησία των περιφερικών ιστών, συμπεριλαμβανομένου του οστίτη ιστού, στη δράση τους αυξάνονται με την ηλικία, συμβάλλοντας έτσι στις δυσμενείς επιπτώσεις του γήρατος στον οστικό μεταβολισμό και στην ανάπτυξη οστεοπόρωσης. Η αυξημένη ευαισθησία στα γλυκοκορτικοειδή είναι αποτέλεσμα της αυξημένης έκφρασης στα οστικά κύτταρα της 11β-υδροξυστεροειδικής αφυδρογονάσης (11β-HSD) τύπου 1, το ένζυμο που μετατρέπει την ανενεργό κορτιζόνη σε κορτιζόλη που είναι η βιοδραστική της μορφή. Σε αμφότερες τις καταστάσεις, γήρανση και υπερκορτιζολισμός (είτε φαρμακευτικός είτε αυξημένη ενδογενής παραγωγή), η αυξημένη απόπτωση των οστεοκυττάρων ευθύνεται κατά κύριο λόγο για την απώλεια της οστικής αντοχής που προηγείται της απώλειας της οστικής πυκνότητας και είναι η κύρια αιτία της αναντιστοιχίας μεταξύ της οστικής πυκνότητας και του αυξημένου καταγματικού κινδύνου σε ασθενείς με οστεοπόρωση που προκαλείται απο γλυκοκορτικοειδή (56, 62). Παράλληλα τόσο στη γήρανση όσο και στην περίσσεια γλυκοκορτικοειδών, ο όγκος του αγγειακού συστήματος των οστών και των διαφόρων διαλυτών που μεταφέρονται από τη συστηματική κυκλοφορία στο βοθριοσωληνώδες σύστημα που σχηματίζεται από τα σώματα και τους δενδρίτες των οστεοκυττάρων μειώνεται, προκαλώντας έτσι τη μείωση της σκελετικής ενυδάτωσης. Σε μοριακό επίπεδο παρατηρείται μείωση της αγγειογένεσης απόρροια της μείωσης της παραγωγής του αγγειακoύ ενδοθηλιακού αυξητικού παράγοντα (VEGF) από οστεοβλάστες/οστεοκύτταρα, καθώς και μείωση της δράσης του VEGF. Οι αλλαγές αυτές πυροδοτούν μία αλυσίδα μοριακών μηχανισμών, που έχει ως αποτέλεσμα την αφυδάτωση του οστού και τη μείωση της οστικής αντοχής όπως αποδεικνύεται από την άμεση γειτονία των κυτταρικών διεργασιών των οστεοκυττάρων με το αγγειακό σύστημα του οστού. Συνεπώς ένας ακόμη μηχανισμός της αρνητικής επίδρασης των ενδογενών γλυκοκορτικοειδών στα οστά και της αυξημένης σκελετικής ευθραυστότητας που επέρχεται με το γήρας είναι η μείωση της οστικής αγγειογένεσης του όγκου του αγγειακού συστήματος και της μεταφοράς διαλυτών ουσιών μέσω του βοθριο-σωληνώδους συστήματος των οστεοκυττάρων.
8. Ο ρόλος των οξειδωμένων λιπιδίων
Κλινικές, επιδημιολογικές καθώς και in vivo μελέτες, αποκαλύπτουν τα τελευταία χρόνια σημαντικές συσχετίσεις μεταξύ του κινδύνου οστεοπόρωσης, αθηροσκλήρωσης, και καρδιαγγειακών παθήσεων (63-65). Ο κίνδυνος οστεοπόρωσης και οι αγγειακές επασβεστώσεις αυξάνουν παράλληλα με την άνοδο της ηλικίας και ο βαθμός της επασβέστωσης της αορτής είναι αντιστρόφως ανάλογος της οστικής πυκνότητας ενώ συνδέεται άμεσα με τον καταγματικό κίνδυνο σε μετεμμηνοπαυσιακές γυναίκες (66). Οι γυναίκες που βρίσκονται στο υψηλότερο τεταρτημόριο κινδύνου για αθηροσκλήρωση παρουσιάζουν τέσσερις φορές μεγαλύτερη ετήσια απώλεια οστικής μάζας από τις γυναίκες που βρίσκονται στο χαμηλότερο τεταρτημόριο. Η οξείδωση των λιπιδίων διαδραματίζει έναν κρίσιμο ρόλο στην ανάπτυξη της αθηρογένεσης (67) και το ενδοκυττάριο οξειδωτικό στρες που προκύπτει από την αυξημένη οξείδωση και τη διαταραχή της ενδοκυττάριας σηματοδοτικής οδού Wnt μπορεί να παρέχει μια μηχανιστική εξήγηση της υποκείμενης παθοφυσιολογίας (68).
9. Συμπεράσματα
Παρότι η οστεοπόρωση χρησιμοποιείται πολλές φορές ως συνώνυμο της μειωμένης οστικής μάζας, σε πολλές περιπτώσεις το χαρακτηριστικό αυτό απουσιάζει. Το μικρό μέγεθος των οστών, η μη καλή μακρο-αρχιτεκτονική του οστού (όπως για παράδειγμα το αυξημένο μήκος του αυχένα του μηριαίου οστού), η διαταραχή της οστικής μικροαρχιτεκτονικής, η πόρωση του φλοιώδους οστού, η μείωση της οστικής ποιότητας και η μειωμένη βιωσιμότητα των οστεοκυττάρων είναι μερικοί από τους-εως τώρα γνωστούς παράγοντες- που συμμετέχουν στην ελάττωση της οστικής αντοχής.
Η υποκείμενη παθοφυσιολογία της αυξημένης οστικής ευθραυστότητας που παρατηρείται με την πάροδο της ηλικίας είναι πολυπαραγοντική. Η απόκτηση χαμηλής κορυφαίας οστικής μάζας πιθανώς να συμβάλλει στην ανάπτυξη της οστεοπόρωσης αργότερα στη ζωή. Ωστόσο, το γήρας, η ανεπάρκεια των στεροειδών του φύλου, η ελάττωση της φυσικής δραστηριότητας, η χρήση των γλυκοκορτικοειδών, η οξείδωση των λιπιδίων και η ενδεχόμενη αυξημένη τάση για πτώσεις είναι από τους κύριους παράγοντες που ενέχονται στον αυξημένο καταγματικό κίνδυνο. Ο κυρίαρχος παθογενετικός μηχανισμός πιθανότατα ποικίλλει από το ένα άτομο στο άλλο, όπως συμβαίνει και με άλλα πολυπαραγοντικά νοσήματα όπως η υπέρταση. Επιπλέον, στο ίδιο άτομο, οι υποκείμενοι μηχανισμοί της οστικής απώλειας μπορούν να τροποποιηθούν με το χρόνο. Έτσι, μια αύξηση στην οστική απορρόφηση στην πρωϊμη φάση μετά την εμμηνόπαυση δύναται να ακολουθηθεί από μειωμένο οστικό σχηματισμό αργότερα στη ζωή μιας γυναίκας.
Με τη συνεχή πρόοδο στην κατανόηση της παθοφυσιολογίας αυτής της πολύπλοκης νόσου και τις καινοτόμες τεχνικές που εφαρμόζονται στη γενετική και την πρωτεομική, καθώς και τις βελτιωμένες μεθόδους απεικόνισης, είναι λογικό να αναμένουμε ότι στο εγγύς μέλλον θα έχουμε μια ουσιαστική ανακατάταξη στη διάγνωση της οστεοπόρωσης αλλά και εξατομίκευση της θεραπείας της με βάση τους υποκείμενους παθογενετικούς μηχανισμούς.
Βιβλιογραφία
1. Nih Consensus Development Panel on Osteoporosis Prevention D, Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA : the journal of the American Medical Association. 2001 Feb 14;285(6):785-95. PubMed PMID: 11176917.
2. Manolagas SC. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocrine reviews. 2000 Apr;21(2):115-37. PubMed PMID: 10782361.
3. Manolagas SC, Kousteni S, Jilka RL. Sex steroids and bone. Recent progress in hormone research. 2002;57:385-409. PubMed PMID: 12017554.
4. Duncan EL, Danoy P, Kemp JP, Leo PJ, McCloskey E, Nicholson GC, et al. Genome-wide association study using extreme truncate selection identifies novel genes affecting bone mineral density and fracture risk. PLoS genetics. 2011 Apr;7(4):e1001372. PubMed PMID: 21533022. Pubmed Central PMCID: 3080863.
5. Estrada K, Styrkarsdottir U, Evangelou E, Hsu YH, Duncan EL, Ntzani EE, et al. Genome-wide meta-analysis identifies 56 bone mineral density loci and reveals 14 loci associated with risk of fracture. Nature genetics. 2012 May;44(5):491-501. PubMed PMID: 22504420. Pubmed Central PMCID: 3338864.
6. Looker AC, Melton LJ, 3rd, Borrud LG, Shepherd JA. Lumbar spine bone mineral density in US adults: demographic patterns and relationship with femur neck skeletal status. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2012 Apr;23(4):1351-60. PubMed PMID: 21720893.
7. Crabtree NJ, Kibirige MS, Fordham JN, Banks LM, Muntoni F, Chinn D, et al. The relationship between lean body mass and bone mineral content in paediatric health and disease. Bone. 2004 Oct;35(4):965-72. PubMed PMID: 15454104.
8. Wetzsteon RJ, Kalkwarf HJ, Shults J, Zemel BS, Foster BJ, Griffin L, et al. Volumetric bone mineral density and bone structure in childhood chronic kidney disease. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2011 Sep;26(9):2235-44. PubMed PMID: 21590737. Pubmed Central PMCID: 3304436.
9. Vu MQ, Weintraub N, Rubenstein LZ. Falls in the nursing home: are they preventable? Journal of the American Medical Directors Association. 2006 Mar;7(3 Suppl):S53-8, 2. PubMed PMID: 16500282.
10. Zebaze RM, Ghasem-Zadeh A, Bohte A, Iuliano-Burns S, Mirams M, Price RI, et al. Intracortical remodelling and porosity in the distal radius and post-mortem femurs of women: a cross-sectional study. Lancet. 2010 May 15;375(9727):1729-36. PubMed PMID: 20472174.
11. Hui SL, Slemenda CW, Johnston CC, Jr. Age and bone mass as predictors of fracture in a prospective study. The Journal of clinical investigation. 1988 Jun;81(6):1804-9. PubMed PMID: 3384952. Pubmed Central PMCID: 442628.
12. Balaban RS, Nemoto S, Finkel T. Mitochondria, oxidants, and aging. Cell. 2005 Feb 25;120(4):483-95. PubMed PMID: 15734681.
13. Manolagas SC. From estrogen-centric to aging and oxidative stress: a revised perspective of the pathogenesis of osteoporosis. Endocrine reviews. 2010 Jun;31(3):266-300. PubMed PMID: 20051526. Pubmed Central PMCID: 3365845.
14. Khosla S, Melton LJ, 3rd, Riggs BL. The unitary model for estrogen deficiency and the pathogenesis of osteoporosis: is a revision needed? Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2011 Mar;26(3):441-51. PubMed PMID: 20928874. Pubmed Central PMCID: 3179298.
15. Recker R, Lappe J, Davies K, Heaney R. Characterization of perimenopausal bone loss: a prospective study. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2000 Oct;15(10):1965-73. PubMed PMID: 11028449.
16. Parfitt AM, Villanueva AR, Foldes J, Rao DS. Relations between histologic indices of bone formation: implications for the pathogenesis of spinal osteoporosis. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1995 Mar;10(3):466-73. PubMed PMID: 7785469.
17. Han ZH, Palnitkar S, Rao DS, Nelson D, Parfitt AM. Effects of ethnicity and age or menopause on the remodeling and turnover of iliac bone: implications for mechanisms of bone loss. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1997 Apr;12(4):498-508. PubMed PMID: 9101361.
18. Smith EP, Boyd J, Frank GR, Takahashi H, Cohen RM, Specker B, et al. Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man. The New England journal of medicine. 1994 Oct 20;331(16):1056-61. PubMed PMID: 8090165.
19. Santen RJ, Brodie H, Simpson ER, Siiteri PK, Brodie A. History of aromatase: saga of an important biological mediator and therapeutic target. Endocrine reviews. 2009 Jun;30(4):343-75. PubMed PMID: 19389994.
20. Sowers MR, Greendale GA, Bondarenko I, Finkelstein JS, Cauley JA, Neer RM, et al. Endogenous hormones and bone turnover markers in pre- and perimenopausal women: SWAN. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2003 May;14(3):191-7. PubMed PMID: 12730778.
21. Ebeling PR. Clinical practice. Osteoporosis in men. The New England journal of medicine. 2008 Apr 3;358(14):1474-82. PubMed PMID: 18385499.
22. Okazaki R, Inoue D, Shibata M, Saika M, Kido S, Ooka H, et al. Estrogen promotes early osteoblast differentiation and inhibits adipocyte differentiation in mouse bone marrow stromal cell lines that express estrogen receptor (ER) alpha or beta. Endocrinology. 2002 Jun;143(6):2349-56. PubMed PMID: 12021200.
23. Fujita M, Urano T, Horie K, Ikeda K, Tsukui T, Fukuoka H, et al. Estrogen activates cyclin-dependent kinases 4 and 6 through induction of cyclin D in rat primary osteoblasts. Biochemical and biophysical research communications. 2002 Nov 29;299(2):222-8. PubMed PMID: 12437973.
24. Gohel A, McCarthy MB, Gronowicz G. Estrogen prevents glucocorticoid-induced apoptosis in osteoblasts in vivo and in vitro. Endocrinology. 1999 Nov;140(11):5339-47. PubMed PMID: 10537165.
25. Tomkinson A, Reeve J, Shaw RW, Noble BS. The death of osteocytes via apoptosis accompanies estrogen withdrawal in human bone. The Journal of clinical endocrinology and metabolism. 1997 Sep;82(9):3128-35. PubMed PMID: 9284757.
26. Vedi S, Compston JE. The effects of long-term hormone replacement therapy on bone remodeling in postmenopausal women. Bone. 1996 Nov;19(5):535-9. PubMed PMID: 8922654.
27. Bord S, Beavan S, Ireland D, Horner A, Compston JE. Mechanisms by which high-dose estrogen therapy produces anabolic skeletal effects in postmenopausal women: role of locally produced growth factors. Bone. 2001 Sep;29(3):216-22. PubMed PMID: 11557364.
28. Kameda T, Mano H, Yuasa T, Mori Y, Miyazawa K, Shiokawa M, et al. Estrogen inhibits bone resorption by directly inducing apoptosis of the bone-resorbing osteoclasts. The Journal of experimental medicine. 1997 Aug 18;186(4):489-95. PubMed PMID: 9254647. Pubmed Central PMCID: 2199029.
29. Syed F, Khosla S. Mechanisms of sex steroid effects on bone. Biochemical and biophysical research communications. 2005 Mar 18;328(3):688-96. PubMed PMID: 15694402.
30. Manolagas SC, Jilka RL. Bone marrow, cytokines, and bone remodeling. Emerging insights into the pathophysiology of osteoporosis. The New England journal of medicine. 1995 Feb 2;332(5):305-11. PubMed PMID: 7816067.
31. Ryan MR, Shepherd R, Leavey JK, Gao Y, Grassi F, Schnell FJ, et al. An IL-7-dependent rebound in thymic T cell output contributes to the bone loss induced by estrogen deficiency. Proceedings of the National Academy of Sciences of the United States of America. 2005 Nov 15;102(46):16735-40. PubMed PMID: 16267136. Pubmed Central PMCID: 1283799.
32. Cenci S, Toraldo G, Weitzmann MN, Roggia C, Gao Y, Qian WP, et al. Estrogen deficiency induces bone loss by increasing T cell proliferation and lifespan through IFN-gamma-induced class II transactivator. Proceedings of the National Academy of Sciences of the United States of America. 2003 Sep 2;100(18):10405-10. PubMed PMID: 12923292. Pubmed Central PMCID: 193574.
33. Rogers A, Eastell R. Effects of estrogen therapy of postmenopausal women on cytokines measured in peripheral blood. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1998 Oct;13(10):1577-86. PubMed PMID: 9783546.
34. Sunyer T, Lewis J, Collin-Osdoby P, Osdoby P. Estrogen’s bone-protective effects may involve differential IL-1 receptor regulation in human osteoclast-like cells. The Journal of clinical investigation. 1999 May 15;103(10):1409-18. PubMed PMID: 10330423. Pubmed Central PMCID: 408450.
35. Charatcharoenwitthaya N, Khosla S, Atkinson EJ, McCready LK, Riggs BL. Effect of blockade of TNF-alpha and interleukin-1 action on bone resorption in early postmenopausal women. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2007 May;22(5):724-9. PubMed PMID: 17295604.
36. Kimble RB, Srivastava S, Ross FP, Matayoshi A, Pacifici R. Estrogen deficiency increases the ability of stromal cells to support murine osteoclastogenesis via an interleukin-1and tumor necrosis factor-mediated stimulation of macrophage colony-stimulating factor production. The Journal of biological chemistry. 1996 Nov 15;271(46):28890-7. PubMed PMID: 8910536.
37. Gao Y, Qian WP, Dark K, Toraldo G, Lin AS, Guldberg RE, et al. Estrogen prevents bone loss through transforming growth factor beta signaling in T cells. Proceedings of the National Academy of Sciences of the United States of America. 2004 Nov 23;101(47):16618-23. PubMed PMID: 15531637. Pubmed Central PMCID: 534514.
38. Sun L, Peng Y, Sharrow AC, Iqbal J, Zhang Z, Papachristou DJ, et al. FSH directly regulates bone mass. Cell. 2006 Apr 21;125(2):247-60. PubMed PMID: 16630814.
39. Friend KE, Hartman ML, Pezzoli SS, Clasey JL, Thorner MO. Both oral and transdermal estrogen increase growth hormone release in postmenopausal women–a clinical research center study. The Journal of clinical endocrinology and metabolism. 1996 Jun;81(6):2250-6. PubMed PMID: 8964860.
40. Almeida M, Han L, Martin-Millan M, Plotkin LI, Stewart SA, Roberson PK, et al. Skeletal involution by age-associated oxidative stress and its acceleration by loss of sex steroids. The Journal of biological chemistry. 2007 Sep 14;282(37):27285-97. PubMed PMID: 17623659. Pubmed Central PMCID: 3119455.
41. Mann V, Huber C, Kogianni G, Collins F, Noble B. The antioxidant effect of estrogen and Selective Estrogen Receptor Modulators in the inhibition of osteocyte apoptosis in vitro. Bone. 2007 Mar;40(3):674-84. PubMed PMID: 17174166.
42. Ralston SH. The Michael Mason Prize Essay 1997. Nitric oxide and bone: what a gas! British journal of rheumatology. 1997 Aug;36(8):831-8. PubMed PMID: 9291850.
43. Nakamura T, Imai Y, Matsumoto T, Sato S, Takeuchi K, Igarashi K, et al. Estrogen prevents bone loss via estrogen receptor alpha and induction of Fas ligand in osteoclasts. Cell. 2007 Sep 7;130(5):811-23. PubMed PMID: 17803905.
44. Martin-Millan M, Almeida M, Ambrogini E, Han L, Zhao H, Weinstein RS, et al. The estrogen receptor-alpha in osteoclasts mediates the protective effects of estrogens on cancellous but not cortical bone. Molecular endocrinology. 2010 Feb;24(2):323-34. PubMed PMID: 20053716. Pubmed Central PMCID: 2817608.
45. Vanderschueren D, Van Herck E, Suiker AM, Visser WJ, Schot LP, Bouillon R. Bone and mineral metabolism in aged male rats: short and long term effects of androgen deficiency. Endocrinology. 1992 May;130(5):2906-16. PubMed PMID: 1572302.
46. Vandenput L, Boonen S, Van Herck E, Swinnen JV, Bouillon R, Vanderschueren D. Evidence from the aged orchidectomized male rat model that 17beta-estradiol is a more effective bone-sparing and anabolic agent than 5alpha-dihydrotestosterone. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2002 Nov;17(11):2080-6. PubMed PMID: 12412816.
47. Smith EP, Specker B, Bachrach BE, Kimbro KS, Li XJ, Young MF, et al. Impact on bone of an estrogen receptor-alpha gene loss of function mutation. The Journal of clinical endocrinology and metabolism. 2008 Aug;93(8):3088-96. PubMed PMID: 18505767. Pubmed Central PMCID: 2729204.
48. Almeida M, Han L, Ambrogini E, Bartell SM, Manolagas SC. Oxidative stress stimulates apoptosis and activates NF-kappaB in osteoblastic cells via a PKCbeta/p66shc signaling cascade: counter regulation by estrogens or androgens. Molecular endocrinology. 2010 Oct;24(10):2030-7. PubMed PMID: 20685851. Pubmed Central PMCID: 2954638.
49. Weitzmann MN, Pacifici R. Estrogen deficiency and bone loss: an inflammatory tale. The Journal of clinical investigation. 2006 May;116(5):1186-94. PubMed PMID: 16670759. Pubmed Central PMCID: 1451218.
50. Lee SK, Kadono Y, Okada F, Jacquin C, Koczon-Jaremko B, Gronowicz G, et al. T lymphocyte-deficient mice lose trabecular bone mass with ovariectomy. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2006 Nov;21(11):1704-12. PubMed PMID: 17002560.
51. Xiong J, Onal M, Jilka RL, Weinstein RS, Manolagas SC, O’Brien CA. Matrix-embedded cells control osteoclast formation. Nature medicine. 2011 Oct;17(10):1235-41. PubMed PMID: 21909103. Pubmed Central PMCID: 3192296.
52. Manolagas SC, Parfitt AM. What old means to bone. Trends in endocrinology and metabolism: TEM. 2010 Jun;21(6):369-74. PubMed PMID: 20223679. Pubmed Central PMCID: 2880220.
53. Kramer I, Halleux C, Keller H, Pegurri M, Gooi JH, Weber PB, et al. Osteocyte Wnt/beta-catenin signaling is required for normal bone homeostasis. Molecular and cellular biology. 2010 Jun;30(12):3071-85. PubMed PMID: 20404086. Pubmed Central PMCID: 2876685.
54. Manolagas SC, Parfitt AM. For whom the bell tolls: distress signals from long-lived osteocytes and the pathogenesis of metabolic bone diseases. Bone. 2013 Jun;54(2):272-8. PubMed PMID: 23010104. Pubmed Central PMCID: 3574964.
55. Winkler DG, Sutherland MK, Geoghegan JC, Yu C, Hayes T, Skonier JE, et al. Osteocyte control of bone formation via sclerostin, a novel BMP antagonist. The EMBO journal. 2003 Dec 1;22(23):6267-76. PubMed PMID: 14633986. Pubmed Central PMCID: 291840.
56. Onal M, Piemontese M, Xiong J, Wang Y, Han L, Ye S, et al. Suppression of autophagy in osteocytes mimics skeletal aging. The Journal of biological chemistry. 2013 Jun 14;288(24):17432-40. PubMed PMID: 23645674. Pubmed Central PMCID: 3682543.
57. Weinstein RS, Jilka RL, Parfitt AM, Manolagas SC. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. Potential mechanisms of their deleterious effects on bone. The Journal of clinical investigation. 1998 Jul 15;102(2):274-82. PubMed PMID: 9664068. Pubmed Central PMCID: 508885.
58. Weinstein RS, Nicholas RW, Manolagas SC. Apoptosis of osteocytes in glucocorticoid-induced osteonecrosis of the hip. The Journal of clinical endocrinology and metabolism. 2000 Aug;85(8):2907-12. PubMed PMID: 10946902.
59. Weinstein RS, Chen JR, Powers CC, Stewart SA, Landes RD, Bellido T, et al. Promotion of osteoclast survival and antagonism of bisphosphonate-induced osteoclast apoptosis by glucocorticoids. The Journal of clinical investigation. 2002 Apr;109(8):1041-8. PubMed PMID: 11956241. Pubmed Central PMCID: 150947.
60. Jia D, O’Brien CA, Stewart SA, Manolagas SC, Weinstein RS. Glucocorticoids act directly on osteoclasts to increase their life span and reduce bone density. Endocrinology. 2006 Dec;147(12):5592-9. PubMed PMID: 16935844. Pubmed Central PMCID: 1819400.
61. Weinstein RS. Clinical practice. Glucocorticoid-induced bone disease. The New England journal of medicine. 2011 Jul 7;365(1):62-70. PubMed PMID: 21732837.
62. Manolagas SC. Corticosteroids and fractures: a close encounter of the third cell kind. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2000 Jun;15(6):1001-5. PubMed PMID: 10841168.
63. Mani A, Radhakrishnan J, Wang H, Mani A, Mani MA, Nelson-Williams C, et al. LRP6 mutation in a family with early coronary disease and metabolic risk factors. Science. 2007 Mar 2;315(5816):1278-82. PubMed PMID: 17332414. Pubmed Central PMCID: 2945222.
64. Parhami F, Tintut Y, Beamer WG, Gharavi N, Goodman W, Demer LL. Atherogenic high-fat diet reduces bone mineralization in mice. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2001 Jan;16(1):182-8. PubMed PMID: 11149483.
65. Schulz E, Arfai K, Liu X, Sayre J, Gilsanz V. Aortic calcification and the risk of osteoporosis and fractures. The Journal of clinical endocrinology and metabolism. 2004 Sep;89(9):4246-53. PubMed PMID: 15356016.
66. Navab M, Ananthramaiah GM, Reddy ST, Van Lenten BJ, Ansell BJ, Fonarow GC, et al. The oxidation hypothesis of atherogenesis: the role of oxidized phospholipids and HDL. Journal of lipid research. 2004 Jun;45(6):993-1007. PubMed PMID: 15060092.
67. Manolagas SC, Almeida M. Gone with the Wnts: beta-catenin, T-cell factor, forkhead box O, and oxidative stress in age-dependent diseases of bone, lipid, and glucose metabolism. Molecular endocrinology. 2007 Nov;21(11):2605-14. PubMed PMID: 17622581.
68. Almeida M, Ambrogini E, Han L, Manolagas SC, Jilka RL. Increased lipid oxidation causes oxidative stress, increased peroxisome proliferator-activated receptor-gamma expression, and diminished pro-osteogenic Wnt signaling in the skeleton. The Journal of biological chemistry. 2009 Oct 2;284(40):27438-48. PubMed PMID: 19657144. Pubmed Central PMCID: 2785673.
Created: October 28, 2014
Last update: October 28, 2014