Ε. Κούκου
Διευθύντρια ΕΣΥ-Νοσοκομείο-Μαιευτήριο «Έλενας Βενιζέλου», Αθήνα
1. Φυσιολογία θυρεοειδούς στην εγκυμοσύνη
Η ανάγκη υποστήριξης του νεοσχηματιζόμενου οργανισμού παράλληλα με την ανάγκη κάλυψης των αυξημένων μεταβολικών αναγκών και την συντήρηση της υγείας της μητέρας έχει σαν αποτέλεσμα σημαντικές αλλαγές στην φυσιολογία της θυρεοειδικής λειτουργίας. Οι αλλαγές αυτές υπαγορεύονται από φυσιολογικές μεταβολές που χαρακτηρίζουν την εγκυμοσύνη και που είναι επιγραμματικά η αύξηση της συγκέντρωσης των οιστρογόνων, η αύξηση των επιπέδων της hCG και η αύξηση της νεφρικής σπειραματικής διήθησης (Πίνακας 1).
Πίνακας 1. Παράγοντες που επηρεάζουν την φυσιολογία του θυρεοειδούς κατά την κύηση.
| Φυσιολογικές μεταβολές | Επακόλουθες αλλαγές στην θυρεοειδική φυσιολογία |
| Αύξηση νεφρικής κάθαρσης | Αύξηση της νεφρικής κάθαρσης Ιωδίου |
| Αύξηση των επιπέδων της hCG | Αύξηση των FT3 και FT4, Καταστολή της TSH |
| Αύξηση των επιπέδων της TBG | Αύξηση των T3 και T4 |
| Αύξηση όγκου πλάσματος | Αύξηση του όγκου κατανομής των Τ3 και Τ4 |
| Ανάπτυξη πλακούντα και δράση της αποϊωδινάσης ΙΙΙ | Αύξηση του ρυθμού αποδομής και επακόλουθης παραγωγής Τ3 και Τ4 |
1.1. Προσαρμογή του θυρεοειδούς στην κύηση σε φυσιολογικές συνθήκες ιωδοεπάρκειας
Οι θυρεοειδικές ορμόνες Τ3 και Τ4 στο αίμα κυκλοφορούν συνδεδεμένες με πρωτεΐνες που παράγονται στο ήπαρ, κυρίως τη δεσμευτική σφαιρίνη της θυροξίνης (thyroxine-binding globulin, TBG), τη λευκωματίνη και την τρανσθυρετίνη ή προλευκωματίνη. Παρά το γεγονός, ότι η συγκέντρωση της TBG στο αίμα είναι πολύ μικρότερη των άλλων δύο «μεταφορέων» πρωτεϊνών, περίπου τα δύο τρίτα της θυροξίνης είναι συνδεδεμένα και μεταφέρονται από την TBG, λόγω της μεγάλης συγγένειάς της με τις θυρεοειδικές ορμόνες.
Στην κύηση, αφ΄ενός η συγγένεια των τριών «μεταφορέων» πρωτεϊνών προς τις θυρεοειδικές ορμόνες δεν αλλάζει, αφ’ ετέρου τα επίπεδα της λευκωματίνης και της τρανσθυρετίνης παραμένουν σταθερά ή και λίγο ελαττώνονται προς το τρίτο τρίμηνο. Η συγκέντρωση της TBG όμως αυξάνεται σταδιακά, φτάνει σε μέγιστη συγκέντρωση -επίπεδα μέχρι και 2 1/2 φορές υψηλότερα από εκείνα προ της σύλληψης – περί την 20η εβδομάδα και σταθεροποιείται σ’ αυτά τα επίπεδα μέχρι το τέλος (Εικόνα 1). Η αύξηση αυτή της TBG, οφείλεται κυρίως σε αύξηση της ηπατικής της παραγωγής αλλά και σε αύξηση του χρόνου ημιζωής της, λόγω ελαττωμένης ηπατικής κάθαρσης. Μετά τον τοκετό τα επίπεδα της TBG, όπως και των Τ3 και Τ4, επιστρέφουν στα προ κύησης επίπεδα μέσα σε 4-6 εβδομάδες.
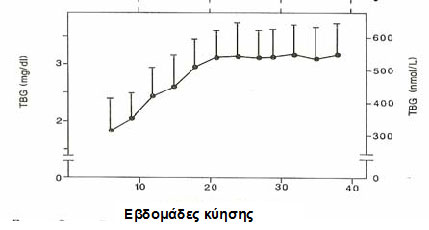
Εικόνα 1. Μεταβολές των επιπέδων της TBG σε σχέση με την ηλικία κύησης (The Regulation of Thyroid Function in Pregnancy: Pathways of Endocrine Adaptation from Physiology to Pathology. Glinoer D. Endocr Rev 1997;18).
Οι «μεταβολές» αυτές στους μεταφορείς των θυρεοειδικών ορμονών με την πρόοδο της κύησης έχουν σαν αποτέλεσμα πάνω από 75% της θυροξίνης να συνδέεται με την TBG. Αυτή η γρήγορη και σημαντική αύξηση της TBG, άρα και της συνδεδεμένης Τ4 έχει σαν αποτέλεσμα την ελαφρά ελάττωση της ελεύθερης Τ4 (FT4), η οποία προκαλεί, μέσω του αρνητικού feedback, μια παροδική διέγερση του υποθαλαμο-υποφυσιακού- θυρεοειδικού άξονα και αύξηση της παραγωγής θυροξίνης για να διατηρηθεί σταθερή η συγκέντρωση των ελευθέρων κλασμάτων των θυρεοειδικών ορμονών και να επιτευχθεί νέα ισορροπία. Απαραίτητη προϋπόθεση, για την επίτευξη και μάλιστα έγκαιρη της ισορροπίας αυτής, είναι η επάρκεια Ιωδίου και η λειτουργική ακεραιότητα του θυρεοειδούς. Έτσι σε υγιείς έγκυες γυναίκες σε περιβάλλον ιωδοεπάρκειας η ελάττωση της συγκέντρωσης των ελεύθερων κλασμάτων των θυρεοειδικών ορμονών είναι οριακή, σε ποσοστό 10-15% (1,2,3).
Η ανάγκη αύξησης της παραγωγής θυρεοειδικών ορμονών κατά την κύηση, η οποία υπολογίζεται σε 1,5 φορές εκείνης προ της κύησης, οφείλεται πέραν της αύξησης της TBG που προαναφέρθηκε και σε άλλους παράγοντες απότοκους της κύησης αυτής καθ΄εαυτής.
Η έκκριση της hCG αρχίζει πολύ νωρίς στην κύηση και κορυφώνεται περί την 9η-11η εβδομάδα. Τα επίπεδα διατηρούνται στο μέγιστο (~ 30-100 U/l) για μερικές μόνον μέρες και μετά σταδιακά υποχωρούν έως ~5-10 U/L περί την 20η εβδομάδα και παραμένουν στα επίπεδα αυτά μέχρι το πέρας της κύησης. Η κύρια δράση της hCG είναι η παραγωγή της προγεστερόνης για την υποστήριξη της κύησης, ενώ διεγείρει επίσης την παραγωγή τεστοστερόνης από τους όρχεις του εμβρύου και είναι ως εκ τούτου απαραίτητη για τη φυσιολογική σεξουαλική διαμόρφωση του άρρενος εμβρύου.
Επιπλέον, η hCG, η οποία έχει την ίδια α-υπομονάδα όπως η TSH, έχει και θυρεοειδοτρόπο δράση. Έτσι, με την «εγκατάσταση» του πλακούντα η σταδιακή αύξηση των επιπέδων της έχει σαν αποτέλεσμα την άμεση διέγερση των θυρεοειδικών κυττάρων και μια μικρή, παροδική αύξηση της παραγωγής θυρεοειδικών ορμονών συνήθως εντός των φυσιολογικών ορίων περί το τέλος του πρώτου τριμήνου. Αυτή έχει σαν αποτέλεσμα την αναστολή του υποφυσιακού- θυρεοειδικού άξονα: μεταξύ των εβδομάδων 8ης και 14ης της κύησης οπότε παρατηρείται ελάττωση των επιπέδων της TSH, κατοπτρικά αντίθετη με την αύξηση της hCG (Εικόνα 2). Δεδομένου ότι η δραστικότητα της hCG στον υποδοχέα της TSH είναι περίπου το 1/100 της TSH, στις περισσότερες περιπτώσεις αυτή η διεγερτική επίδραση της hCG στον θυρεοειδή είναι μικρής διάρκειας και σημαντικότητας: μόνο στο 20% των κυήσεων παρατηρείται πλήρης καταστολή της TSH και μετά διέγερση με ΤRΗ, και στο 1/10 των γυναικών αυτών, δηλαδή στο 2% των κυήσεων, η θυρεοτροπική αυτή δράση της hCG μπορεί να προκαλέσει τη γνωστή «παροδική υπερθυροξιναιμία της κύησης» (4).
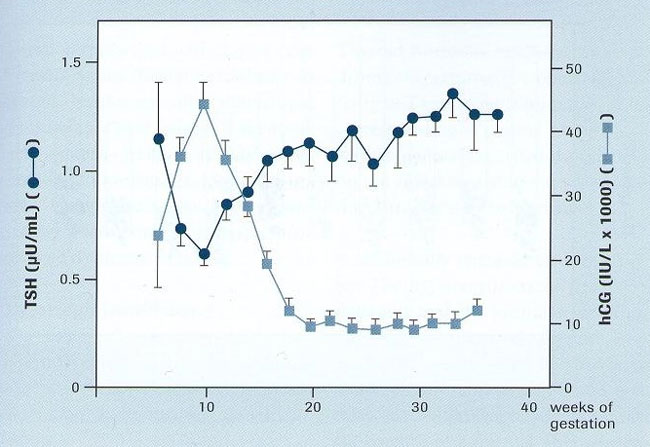
Εικόνα 2. TSH και hCG πλάσματος κατά την κύηση 606 υγιείς έγκυες γυναίκες (Glinoer, et al. J Clin Endocrinol Metab 1990;71:276-287).
Τέλος, λόγω μεταβολής της δραστηριότητας των αποϊωδινασών μεταβάλλεται/ αυξάνεται και ο περιφερικός μεταβολισμός των θυρεοειδικών ορμονών, γεγονός που καθιστά αναγκαία την αυξημένη θυρεοειδική παραγωγή. Αυτό συμβαίνει σε όλη την διάρκεια της κύησης, αλλά κυρίως στο δεύτερο ήμισυ. Από τα τρία ένζυμα που καταλύουν την αποϊωδίωση των θυρεοειδικών ορμονών στους ιστούς, η δραστηριότητα της αποϊωδινάσης Ι, η οποία μετατρέπει την Τ4 σε Τ3 σε ήπαρ, νεφρούς και θυρεοειδή δεν φαίνεται να μεταβάλλεται ιδιαίτερα κατά την κύηση. Η αποϊωδινάση ΙΙ, η οποία επίσης μετατρέπει την Τ4 σε Τ3 εκφράζεται κυρίως στον εγκέφαλο και την υπόφυση. Στον πλακούντα εκφράζεται κυρίως στο πρώτο τρίμηνο και είναι σχεδόν μη ανιχνεύσιμη προς το τέλος της κύησης και η δράση της έχει σαν αποτέλεσμα την σταθερή τοπική παραγωγή Τ3, ιδιαίτερα όταν τα επίπεδα της Τ4 είναι χαμηλά. Η αποϊωδινάση ΙΙΙ εκφράζεται κυρίως στον εγκέφαλο, στο εμβρυϊκό ήπαρ και στον πλακούντα και μετατρέπει την Τ4 σε reverse T3. Πιστεύεται ότι κύρια δράση της είναι να εμποδίζει την ανεξέλεγκτη διέλευση μητρικών θυρεοειδικών ορμονών προς το έμβρυο. Αν και η δραστηριότητά της (ανά mg DNA) ελαττώνεται με την πρόοδο της κύησης, η συνολική της δραστηριότητα αυξάνει κατά το β τρίμηνο, δεδομένου ότι αυξάνει η επιφάνεια του πλακούντα (5).
Το ιώδιο απορροφάται ταχέως από τον γαστρεντερικό σωλήνα και μαζί με το ιώδιο που παράγεται από τον περιφερικό καταβολισμό των θυρεοειδικών ορμονών (και των ιωδιοτυροσινών), κατανέμεται στο εξωκυττάριο υγρό και αποτελεί την εξωθυρεοειδική δεξαμενή του ανόργανου Ιωδίου που τροφοδοτεί δυναμικά τα δύο όργανα που κυρίως ενέχονται στον μεταβολισμό του τον θυρεοειδή αδένα και τους νεφρούς.
Στην κύηση, ήδη από τις πρώτες εβδομάδες, αυξάνει η νεφρική σπειραματική διήθηση και μαζί της η νεφρική κάθαρση του Ιωδίου με αποτέλεσμα υποχρεωτική συνεχή ¨απώλεια¨ ιωδίου, που έχει σαν αποτέλεσμα την ελάττωση των επιπέδων του ανόργανου ιωδίου στο αίμα και προκαλεί την αντιρροπιστική αύξηση της θυρεοειδικής κάθαρσης του Ιωδίου μέχρι και 60 ml/min και την αύξηση της παροχής ιωδίου στον θυρεοειδή αδένα ούτως ώστε να διατηρηθεί απρόσκοπτη η παραγωγή ορμονών. Πέρα όμως από την αυξημένη απώλεια ιωδίου στα ούρα καθ΄όλη τη διάρκεια της κύησης, από τα μέσα του δευτέρου και κατά το τρίτο τρίμηνο υπάρχει απώλεια/παροχή ιωδίου από την μητέρα προς το έμβρυο μέσω του πλακούντα για την σύνθεση θυρεοειδικών ορμονών από τον εμβρυϊκό θυρεοειδή. Σε περιβάλλον ιωδοεπάρκειας, που οι ενδοθυρεοειδικές αποθήκες ιωδίου είναι πλήρεις, η υποχρεωτική αυτή απώλεια ιωδίου αυξάνει μεν το μεταβολικό έργο του θυρεοειδούς, αλλά δεν δημιουργεί προβλήματα στην λειτουργία του. Σε περιβάλλον όμως μη επάρκειας ή και έλλειψης ιωδίου οι φυσιολογικές προσαρμογές που αναφέρθηκαν ανωτέρω δεν επαρκούν, οπότε και εκδηλώνεται διαταραχή της θυρεοειδικής λειτουργίας και ανάπτυξη βρογχοκήλης (1,2,3).
1.2. Προσαρμογή της θυρεοειδικής λειτουργίας κατά την κύηση σε περιβάλλον μη επαρκούς πρόσληψης ιωδίου
Η απαραίτητη ημερήσια πρόσληψη ιωδίου, σύμφωνα με τις οδηγίες της ΠΟΥ είναι 150 μg (6). Απ’ αυτά ~ 80 μg χρησιμοποιούνται για την παραγωγή θυρεοειδικών ορμονών. Αν η πρόσληψη αυτή δεν είναι επαρκής και σταθερή, η παραγωγή των θυρεοειδικών ορμονών διατηρείται εις βάρος όμως των ενδοθυρεοειδικών αποθηκών ιωδίου και με την πάροδο του χρόνου επέρχεται «φυσιολογική» προσαρμογή του συστήματος με αύξηση της θυρεοειδικής πρόσληψης ιωδίου, αύξηση της αναλογίας Τ3/Τ4 των παραγομένων ορμονών, «επαναρρύθμιση» της υπόφυσης σε υψηλότερα επίπεδα TSH και υπερτροφία του θυρεοειδούς.
Στην κύηση όπως προαναφέρθηκε, υπάρχει πρώτον αύξηση της νεφρικής κάθαρσης του ιωδίου (1,3-1,5 φορές της βασικής), η οποία οδηγεί σε «απώλεια» ιωδίου και ταυτόχρονη αύξηση της θυρεοειδικής κάθαρσης του ιωδίου, μέχρι και 60-100 ml/min. Επιπλέον, υπάρχει αυξημένη μέχρι και 1,5 φορά, παραγωγή θυρεοειδικών ορμονών η οποία απαιτεί ~ 120 μg ιωδίου ημερησίως. Σε καταστάσεις μη επαρκούς πρόσληψης ιωδίου οι αυξημένες αυτές ανάγκες οδηγούν σε περαιτέρω άδειασμα των ήδη επηρεασμένων αποθηκών ιωδίου και στον φαύλο κύκλο της προαναφερθείσης «φυσιολογικής» προσαρμογής του συστήματος με αύξηση της θυρεοειδικής πρόσληψης ιωδίου, αύξηση της αναλογίας Τ3/Τ4 των παραγομένων ορμονών μέχρι και υποθυροξιναιμία, «επαναρρύθμιση» της υπόφυσης σε υψηλότερα επίπεδα TSH και υπερτροφία του θυρεοειδούς (Εικόνα 3), που επιδεινώνονται περαιτέρω με την από τα μέσα του δευτέρου και το τρίτο τρίμηνο απώλεια/ παροχή ιωδίου από την μητέρα προς το έμβρυο μέσω του πλακούντα για την σύνθεση θυρεοειδικών ορμονών από τον εμβρυϊκό θυρεοειδή. Η σχετική αυτή υπερέκκριση της FT3, στην αρχή της κύησης επί ιωδοανεπάρκειας έχει σαν αποτέλεσμα την ελαχιστοποίηση της παροδικής, από την hCG, υπερέκκρισης της FT4, απαραίτητης για την εμβρυϊκή εγκεφαλική ανάπτυξη. Αν δε συνυπάρχει και λανθάνουσα υπολειτουργία του θυρεοειδούς δεν επιτρέπει την ανάλογη επί ανάλογη αύξηση της TSH με αποτέλεσμα την μη αναγνώριση της παθολογικής αυτής κατάστασης στην κρίσιμη περίοδο της οργανογένεσης (1,2,3,7,8) .
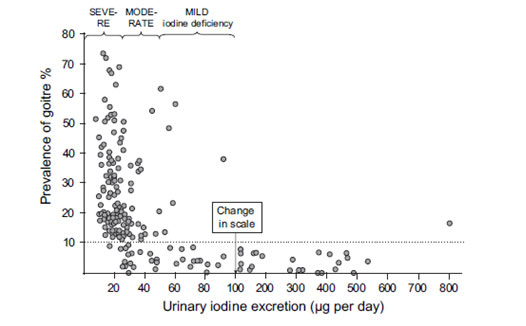
Εικόνα 3. Αύξηση της επίπτωσης βρογχοκήλης επί ανεπάρκειας ιωδίου (Laurberg et al. Best Pract Res Clin Endocrinol Metabol 2010;24:13–27).
1.3. Φυσιολογικές μεταβολές / επίπεδα θυρεοειδικών ορμονών και TSH κατά την κύηση
Επιγραμματικά οι μεταβολές που προκύπτουν από την προσαρμογή θυρεοειδικής λειτουργίας στην κύηση είναι: αύξηση της σύνθεσης των θυρεοειδικών ορμονών, αύξηση της σύνθεσης και των επιπέδων της θυρεοδεσμευτικής σφαιρίνης (TBG) και ελάττωση των επιπέδων της TSH περί το τέλος του πρώτου τριμήνου, κατοπτρικά με την αύξηση της hCG κατά την φάση αυτή.
Δεδομένης της γνωστής μεγάλης σημασίας της ακέραιης θυρεοειδικής λειτουργίας για την καλή έκβαση της κύησης και την εξέλιξη του εμβρύου, είναι απαραίτητη η γνώση των μεταβολών αυτών και η αναγνώριση των φυσιολογικών επιπέδων διακύμανσής τους σε όλη την διάρκεια της κύησης, ώστε να είναι δυνατή η έγκαιρη και έγκυρη αναγνώριση παθολογικών παρεκκλίσεων και η αντιμετώπισή τους.
TSH. Σε συνθήκες ιωδοεπάρκειας, τα επίπεδα της θυρεοειδοτρόπου ορμόνης είναι χαμηλότερα στο πρώτο τρίμηνο, υπό την έμμεση κατασταλτική δράση της hCG, αυξάνονται κατά το δεύτερο και παραμένουν σταθερά μέχρι το τέλος της κύησης (9,10,11). Σ’ ένα σημαντικό μάλιστα ποσοστό (~20%) είναι δυνατόν να είναι κατεσταλμένα (Εικόνα 4). Η καταστολή αυτή των επιπέδων της TSH φαίνεται να είναι μεγαλύτερη σε δίδυμες κυήσεις (9).
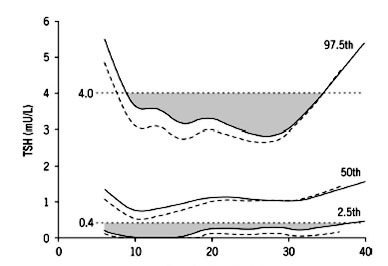
Εικόνα 4. Μεταβολές της TSH κατά την κύηση. Αποτελέσματα από 13,599 μονόδυμες (συνεχής γραμμή) και 132 δίδυμες (διακεκομμένη γραμμή) κυήσεις. Φυσιολογικά εκτός κύησης επίπεδα TSH 4,0 και 0,4 mU/L (Dashe et al. Obstet Gynecol 2005;106:753–7).
Θυρεοειδικές ορμόνες. Οι ολικές συγκεντρώσεις των Τ3 και Τ4 αυξάνουν σημαντικά από την έναρξη της κύησης, προοδευτικά μέχρι την 20η περίπου εβδομάδα, οπότε φθάνουν και στο μέγιστο (~1,5 Χ βασική τιμή), σαν αποτέλεσμα της αύξησης της TBG. Η ελεύθερη θυροξίνη (FT4) αποτελεί μόνο ένα μικρό κλάσμα (0,02%) της ολικής θυροξίνης και είναι δύσκολο να μετρηθεί. Η μέθοδος που βασίζεται στην equilibrium dialysis είναι η πλέον ακριβής αναλυτικά και αποτελεί τη μέθοδο αναφοράς, έναντι της οποίας συγκρίνονται όλες οι άλλες, εμπορικά διαθέσιμες, μέθοδοι για τον προσδιορισμό της (12).
Στη βιβλιογραφία υπάρχει ακόμα διχογνωμία όσον αφορά τον τύπο (ελεύθερο ή ολικό κλάσμα) και τον τρόπο μέτρησης των θυρεοειδικών ορμονών. Όπως ήδη αναφέρθηκε, οι ολικές συγκεντρώσεις των Τ3 και Τ4 αυξάνουν σημαντικά από την έναρξη της κύησης, προοδευτικά μέχρι την 20η περίπου εβδομάδα, οπότε φθάνουν και στο μέγιστο (~1,5 Χ βασική τιμή), σαν αποτέλεσμα της αύξησης της TBG. Αν λοιπόν χρησιμοποιηθεί η ολική Τ4 θα πρέπει να προσαρμοσθεί το εύρος των φυσιολογικών τιμών πολλαπλασιάζοντας των φυσιολογικών τιμών εκτός κύησης επί 1,5. Δεδομένου όμως ότι η ολική Τ4 φτάνει σε πλατώ περί το μέσον της κύησης, μια τέτοια προσαρμογή των τιμών θα είναι έγκυρη μόνο κατά το δεύτερο ήμισυ της κύησης. Ο έμμεσος προσδιορισμός της ελεύθερης θυροξίνης είναι αξιόπιστος, αλλά είναι δύσκολο να χρησιμοποιηθεί στην καθημερινή κλινική πράξη.
Ο άμεσος προσδιορισμός της FT4 με εμπορικά διαθέσιμες ανοσοαναλύσεις είναι πλέον η συνήθης πρακτική. Πρέπει όμως να σημειωθεί ότι παλαιότερες μελέτες σύγκρισης των αποτελεσμάτων προσδιορισμού της FT4 με equilibrium dialysis και εμπορικά διαθέσιμες ανοσοαναλύσεις (13,14) είχαν δείξει ότι σε καταστάσεις, όπως το τρίτο τρίμηνο της κύησης οπότε η δεσμευτική ικανότητα του ορού είναι υψηλή, η FT4 προσδιορίζεται σημαντικά χαμηλότερη στις δεύτερες και επιπλέον οι χρησιμοποιούμενες τιμές αναφοράς σ’ αυτές προέρχονται από γενικό πληθυσμό. Ως εκ τούτου, όπως έχει ήδη προταθεί και δημοσιευθεί από αρκετούς ερευνητές, είναι απαραίτητη η στοιχειοθέτηση του φυσιολογικού εύρους των ελεύθερων κλασμάτων των θυρεοειδικών ορμονών στα τρία τρίμηνα της κύησης για κάθε εργαστήριο ή μέθοδο μέτρησης (15,16).
Ανεξάρτητα από τη μέθοδο μέτρησης (17) που χρησιμοποιείται, η διακύμανση της FT4 κατά την κύηση είναι χαρακτηριστική: Μετά από μια μικρή και παροδική αύξηση κατά το πρώτο τρίμηνο λόγω της θυρεοτροπικής δράσης της hCG, ακολουθεί μια σταδιακή ελάττωση των επιπέδων των ελευθέρων κλασμάτων των θυρεοειδικών ορμονών με την πρόοδο της κύησης (σαν αποτέλεσμα της αύξησης της TBG-νόμος δράσης των μαζών) (Εικόνα 5). Σε συνθήκες ιωδοεπάρκειας, η ελάττωση αυτή είναι μικρή (~10%) και εντός των φυσιολογικών ορίων, δυνατόν όμως να είναι σημαντική (~20-25%) σε συνθήκες ιωδιοανεπάρκειας.
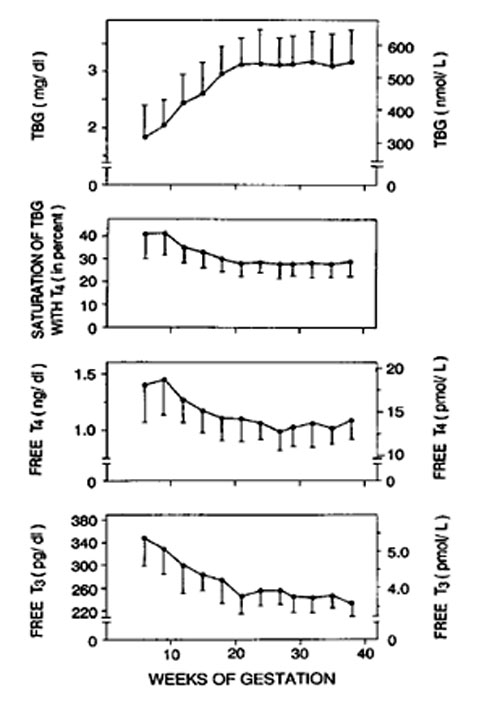
Εικόνα 5. Μεταβολές των TBG και fT4 / T3 συγκεντρώσεων στην κύηση [Glinoer D 1993 Thyroid regulation during pregnancy. In: Delange F, Dunn JT, Glinoer D (eds) Iodine Deficiency in Europe: A Continuing Concern. NATO ASI Series (Vol 241). Plenum Press, New York, pp 181–190].
2. Υπερθυρεοειδισμός και κύηση
O υπερθυρεοειδισμός δεν είναι ιδιαίτερα συχνός στην κύηση, με επιπολασμό 0,05-3% των κυήσεων. Οι περισσότερες γυναίκες έχουν την νόσο πριν την έναρξη της κύησης και είναι ήδη σε θεραπεία, ενώ νέα διάγνωση στην αρχή της κύησης είναι ασυνήθιστη δεδομένου ότι η ενεργός νόσος σχετίζεται με μειωμένη γονιμότητα. Επί πλέον η διάγνωσή του συχνά διαλάθει ή καθυστερεί, αφού τα συνήθη συμπτώματα και σημεία του υπερθυρεοειδισμού, όπως η νευρικότητα, η αυξημένη εφίδρωση και η ταχυκαρδία παρατηρούνται στις περισσότερες φυσιολογικές κυήσεις. Η εμφάνιση παροδικού υπερθυρεοειδισμού που συνοδεύει την υπερέμεση της κύησης μπορεί επίσης να περιπλέξει τη διάγνωση κατά το πρώτο μισό της εγκυμοσύνης (18).
2.1. Αιτιολογία
Όπως και εκτός κύησης, ο υπερθυρεοειδισμός είναι δυνατόν να είναι αυτοάνoσης αιτιολογίας ή μη (Πινακας 2). Η νόσος του Graves’ είναι η πιο κοινή αιτία υπερθυρεοειδισμού αυτοάνοσης αιτιολογίας στην εγκυμοσύνη. Έχει αναφερθεί σε περίπου 0,5% των κυήσεων. Όπως και σε άλλες αυτοάνοσες ασθένειες, η δραστηριότητα της νόσου του Graves’ επιδεινώνεται κατά τη διάρκεια του πρώτου τριμήνου της κύησης και μειώνεται κατά τη διάρκεια του τελευταίου μισού της κύησης, για να επιδεινωθεί και πάλι κατά την περίοδο της λοχείας (19,20,21).
Πίνακας 2. Οι αιτίες του υπερθυρεοειδισμού στην κύηση.
| Νόσος Graves’ |
| Παροδικός υπερθυρεοειδισμός της κύησης |
| Τοξική πολυοζώδης βρογχοκήλη |
| Τοξικό αδένωμα |
| Υποξεία θυρεοειδίτιδα |
| Struma ovarii |
Η πιο κοινή αιτία μη ανοσολογικής αιτιολογίας υπερθυρεοειδισμού στην κύηση είναι ο παροδικός υπερθυρεοειδισμός της υπερέμεσης (transient hyperthyroidism of hyperemesis gravidarum), που ορίζεται ως «παροδικός υπερθυρεοειδισμός που περιορίζεται στο πρώτο τρίμηνο της εγκυμοσύνης και χαρακτηρίζεται από αυξημένα επίπεδα FT4 και κατασταλμένα και/ή μη ανιχνεύσιμα επίπεδα TSH ορού, ελλείψει στοιχείων αυτοανοσίας του θυρεοειδούς». Εμφανίζεται στο 1-3% όλων των κυήσεων και οφείλεται μάλλον στην φυσιολογική διέγερση του θυρεοειδούς από τα υψηλά επίπεδα της χοριακής γοναδοτροπίνης στην αρχή της κύησης. Καλείται και υπερθυρεοειδισμός της υπερέμεσης γιατί εμφανίζεται περίπου στο 50% των γυναικών με υπερέμεση (18,22,23).
2.2. Διάγνωση
Όπως ήδη έχει αναφερθεί, πολλά από τα συμπτώματα του υπερθυρεοειδισμού όπως ταχυκαρδία, ζεστό και υγρό δέρμα, και συστολικό φύσημα μπορεί να είναι παρόντα σε φυσιολογική κύηση. Η απώλεια βάρους, ο τρόμος, η ύπαρξη βρογχοκήλης ή η εμφάνιση σημείων αυτοάνοσης αιτιολογίας υπερθυρεοειδισμού, όπως οφθαλμοπάθεια ή προκνημιαίο μυξοίδημα θέτουν σοβαρά την υποψία της νόσου, η οποία πρέπει να επιβεβαιωθεί εργαστηριακά (19,21,24,25).
Η διάγνωση του υπερθυρεοειδισμού πρέπει πάντοτε να επιβεβαιώνεται με τη μέτρηση των επιπέδων της ελεύθερης Τ4 και της TSH. Ωστόσο, στον ορό η συγκέντρωση Τ4 (ολικής και ελεύθερης) ποικίλλει κατά τη διάρκεια της φυσιολογικής εγκυμοσύνης. (Για τις φυσιολογικές μεταβολές των θυρεοειδικών ορμονών και της TSH κατά την κύηση βλέπε ανωτέρω). Οι μέθοδοι της υγρής χρωματογραφίας και της φασματομετρίας μάζας είναι οι πλέον αξιόπιστες για τον προσδιορισμό των επιπέδων των θυρεοειδικών ορμονών στην κύηση, όμως δεν είναι διαθέσιμες στην καθημέρα κλινική πράξη (βλέπε αντίστοιχο κεφάλαιο). Το φυσιολογικό εύρος αναφοράς, για συγκεντρώσεις TSH κατά τη διάρκεια κάθε τριμήνου της εγκυμοσύνης, θα πρέπει να αναπτυχθεί από κάθε εργαστήριο.
Ο προσδιορισμός των αντισωμάτων κατά του υποδοχέα του TSH (TRAb) είναι ένα σημαντικό στοιχείο στην αξιολόγηση των ασθενών με υπερθυρεοειδισμό Graves κατά τη διάρκεια της εγκυμοσύνης. Τα υψηλά επίπεδα TRAb, 3-5 φορές πάνω από τα φυσιολογικά όρια, διαπερνούν τον πλακουντιακό φραγμό και μπορεί να επηρεάσουν την λειτουργία του εμβρυϊκού και νεογνικού θυρεοειδούς. H διαπλακουντιακή διέλευση των διεγερτικών αντισωμάτων TRAb έχει σαν αποτέλεσμα τη διέγερση του εμβρυικού θυρεοειδούς και την ανάπτυξη υπερθυρεοειδισμού με ταχυκαρδία, ενδομήτρια καθυστέρηση της ανάπτυξης, καρδιακή ανεπάρκεια, καθώς και ανάπτυξη βρογχοκήλης στο έμβρυο (26,27).
Έως και 5% των νεογνών των μητέρων με νόσο Graves’ είναι δυνατόν να αναπτύξουν υπερθυρεοειδισμό με το μηχανισμό αυτό. Στις περιπτώσεις που η έγκυος είναι σε αγωγή με αντιθυρεοεδικά, η κλινική εκδήλωση του εμβρυϊκού υπερθυρεοειδισμού είναι δυνατόν να καθυστερήσει δεδομένου ότι τα αντιθυρεοειδικά φάρμακα καθαίρονται γρηγορότερα από την κυκλοφορία του εμβρύου σε σχέση με τα αντισώματα (28).
Η διαφορική διάγνωση μεταξύ παροδικού υπερθυρεοειδισμού της υπερέμεσης και πραγματικού υπερθυρεοειδισμού είναι πολύ σημαντική. Η υπερέμεση (Hyperemesis Gravidarum, HG) χαρακτηρίζεται από σοβαρή ναυτία και έμετο (έναρξη στις 4-6 εβδομάδες κύησης), αφυδάτωση, κετονουρία και σε σοβαρές περιπτώσεις, διαταραχές της ηπατικής λειτουργίας και των ηλεκτρολυτών, που συχνά απαιτούν νοσηλεία της εγκύου. Οι θυρεοειδικές ορμόνες είναι σε υπερθυρεοειδικά επίπεδα στο 70% των γυναικών με υπερέμεση, ωστόσο οι περιφερικές ορμόνες θα ομαλοποιηθούν αυτόματα περί την 15η εβδομάδα της κύησης, ενώ η TSH δυνατόν να παραμείνει κατασταλμένη για λίγες ακόμα εβδομάδες. Η αντιμετώπιση είναι συμπτωματική, ενώ δεν απαιτείται αντιθυρεοειδική θεραπεία. Δεν υπάρχουν στοιχεία αρνητικής επίδρασης στην έκβαση της κύησης, πλην μιας βιβλιογραφικής αναφοράς για χαμηλότερο βάρος γέννησης των νεογνών (18,22,23).
2.3. Θεραπεία
Η άμεση και αποτελεσματική θεραπεία του υπερθυρεοειδισμού είναι υψίστης σημασίας για την πρόληψη επιπλοκών τόσο από την πλευρά της μητέρας όσο και, του εμβρύου και νεογνού (29,30,31).
Τα αντιθυρεοειδικά παραμένουν η θεραπεία εκλογής. Ο στόχος είναι η χρησιμοποίηση της μικρότερης δυνατής δόσης ώστε να διατηρηθούν τα επίπεδα της FT4 στο άνω ένα τρίτο των φυσιολογικών ορίων εκτός κύησης. Δεδομένου ότι τα αντιθυρεοειδικά διέρχονται τον πλακούντα, οι μεγάλες δόσεις είναι δυνατόν να επηρεάσουν την εμβρυϊκή θυρεοειδική λειτουργία. Η δόση θα πρέπει να αναπροσαρμόζεται κάθε δύο έως τέσσερις εβδομάδες. Η παρουσία ανιχνεύσιμης TSH είναι ένδειξη ελάττωσης της δόσης.
Τόσον οι θειοναμίδες, -καρβιμαζόλη,μεθιμαζόλη (ο μεταβολίτης της καρβιμαζόλης-, όσον και η προπυλθειουρακίλη είναι αποτελεσματικά στην αναστολή της βιοσύνθεσης των θυρεοειδικών ορμονών κατά τη διάρκεια της εγκυμοσύνης. Η προπυλθειουρακίλη είναι όμως το προτιμώμενο φάρμακο κατά την κύηση καθόσον η καρβιμαζόλη και μεθιμαζόλη αναφέρεται ότι έχουν τερατογόνο δράση. Παλαιότερες μελέτες ανέφεραν επίσης μικρότερη μεταφορά της προπυλθειουρακίλης μέσω του πλακούντα έναντι της μεθιμαζόλης (32,33), αλλά πιο πρόσφατες μελέτες αιμάτωσης του πλακούντα in vitro δεν επιβεβαίωσαν αυτήν την υπεροχή.
Επιπλέον, τα δύο φάρμακα δεν φαίνεται να έχουν καμία διαφορά όσον αφορά την επίδρασή τους στην λειτουργία του εμβρυϊκού και νεογνικού θυρεοειδούς (34). Σύμφωνα με τις οδηγίες της Αμερικανικής Θυρεοειδολογικής Εταιρείας (30) η έναρξη της θεραπείας, ιδιαίτερα κατά τις πρώτες 12 εβδομάδες της κύησης, οπότε ολοκληρώνεται η εμβρυική οργανογένεση, γίνεται με προπυλθειουρακίλη, η οποία στην συνέχεια πρέπει να αντικατασταθεί με θειοναμίδη, δεδομένου του αυξημένου κινδύνου ηπατικής δυσπραγίας με την προπυλθειουρακίλη. Πέρα από την πιθανότητα πρόκλησης υποθυρεοειδισμού του εμβρύου και την πιθανή τερατογόνο δράση, η χρήση αντιθυρεοειδικών δεν σχετίζεται με μακροπρόθεσμη δυσμενή επίδραση στην ψυχοκινητική ανάπτυξη των ατόμων που εκτέθηκαν ενδομήτρια στην αγωγή αυτή.
Η δόση έναρξης της προπυλθειουρακίλης είναι σχετικά υψηλή, 300 – 450 mg την ημέρα, (μέχρι 600 mg ημερησίως). Δίδεται σε δύο έως τρεις διαιρεμένες δόσεις. Βελτίωση παρατηρείται συνήθως μετά από μία εβδομάδα θεραπείας, αλλά πλήρης ύφεση επέρχεται μετά τέσσερις έως έξι εβδομάδες. Μόλις ο υπερθυρεοειδισμός ελεγχθεί, η δόση θα πρέπει να μειώνεται σταδιακά κατά ένα τέταρτο έως ένα τρίτο κάθε τρεις έως τέσσερις εβδομάδες.
Η δόση έναρξης της μεθιμαζόλης είναι 10-20 mg / ημέρα άπαξ ημερησίως.
Η χορήγηση λεβοθυροξίνης μαζί με αντιθυρεοειδικά στα πλαίσια του σχήματος «μπλοκ και αντικατάσταση» δεν είναι σκόπιμη κατά την εγκυμοσύνη, καθώς η ποσότητα του αντιθυρεοειδικού μπορεί να είναι μεγάλη σε σχέση με το ποσό της θυροξίνης που διασχίζει τον πλακούντα, οδηγώντας σε εμβρυϊκή βρογχοκήλη και υποθυρεοειδισμό.
Δεν υπάρχει συναίνεση όσον αφορά τη διάρκεια της θεραπείας με αντιθυρεοειδικά. Ορισμένοι προτείνουν τη διακοπή του φαρμάκου στο τρίτο τρίμηνο ή μετά από τέσσερις έως 12 εβδομάδες θεραπείας με επακόλουθη στενή παρακολούθηση, όμως η πιθανότητα υποτροπής είναι μεγάλη. Πάντως σε ασθενείς με μικρή διάρκεια κλινικών συμπτωμάτων, χαμηλό τίτλο αντισωμάτων και μικρή βρογχοκήλη, όπου επετεύχθη ευθυρεοειδισμός με μικρές δόσεις αντιθυρεοειδικών είναι δυνατή η διακοπή της αγωγής τις τελευταίες 4-8 εβδομάδες της κύησης. Πρέπει πάντως να σημειωθεί ότι σε σπάνιες περιπτώσεις, το στρες της έναρξης του τοκετού, η καισαρική τομή ή και μια λοίμωξη δυνατόν να επιδεινώσουν τον υπερθυρεοειδισμό μέχρι και την ανάπτυξη θυρεοτοξικής καταιγίδας (thyrotoxic storm) (35,36).
Οι β-αδρενεργικοί αναστολείς, όπως η προπρανολόλη, μπορεί να χρησιμοποιηθούν για μερικές εβδομάδες για τη βελτίωση των αδρενεργικών συμπτωμάτων του υπερθυρεοειδισμού. Η παρατεταμένη χρήση τους όμως μπορεί να οδηγήσει σε περιορισμένη ανάπτυξη του εμβρύου και μετά τον τοκετό σε βραδυκαρδία του νεογνού και υπογλυκαιμία.
Η θυρεοειδεκτομή συνιστάται μόνο για τις ασθενείς που απαιτούν υψηλές δόσεις αντιθυρεοειδικών, ή στη σπάνια περίπτωση εμφάνισης σοβαρής αλλεργίας.
Η χορήγηση ραδιενεργού ιωδίου, (Ι131) για θεραπεία του υπερθυρεοειδισμού, όπως και για διαγνωστικές εξετάσεις στην κύηση αντενδείκνυται. Ως εκ τούτου, η χρήση του σε γυναίκες αναπαραγωγικής ηλικίας που ενδέχεται να μείνουν έγκυες πρέπει να γίνεται μετά από τεστ κύησης (37). Ωστόσο, επειδή παρά τις προφυλάξεις, υπάρχουν αναφορές για ακατάλληλη χορήγηση ραδιενεργού ιωδίου στην κύηση πρέπει να σημειωθούν τα εξής:
- Η θυρεοειδική πρόσληψη Ιωδίου στο έμβρυο ξεκινά μετά την 12η εβδομάδα, επομένως η έκθεση σε Ι131 πριν από τις 12 εβδομάδες δεν σχετίζεται με δυσλειτουργία του εμβρυϊκού θυρεοειδούς. Συνεπώς, θεωρείται ότι χορήγηση έως και 555 MBq Ι131 για υπερθυρεοειδισμό κατά τη διάρκεια του πρώτου τριμήνου, δεν θέτει σε κίνδυνο τη λειτουργία του θυρεοειδούς του εμβρύου, ενώ η ακτινοβόληση ολόκληρου του σώματος του εμβρύου θεωρείται χαμηλή και δεν δικαιολογεί διακοπή της κύησης.
- Μετά την 13η εβδομάδα ο εμβρυϊκός θυρεοειδής δεσμεύει Ι και επιπλέον οι ιστοί του εμβρύου είναι πιο ευαίσθητοι στην ακτινοβολία. Επομένως, η χορήγηση I131 μετά από αυτή την ηλικία κύησης δυνητικά οδηγεί σε σημαντική ακτινοβόληση του εμβρυϊκού θυρεοειδή με αποτέλεσμα βιοχημικό υποθυρεοειδισμό ακόμη και κρετινισμό του νεογνού.
- Ωστόσο, η πιθανότητα αυτών των επιδράσεων δεν έχει αποδειχθεί και, ανάλογα με την περίπτωση, μελέτες δοσιμετρίας είναι αναγκαίες για την ακριβή παροχή συμβουλών στην ασθενή όσον αφορά, για παράδειγμα, τη διακοπή της κύησης.
Αν η εγκυμοσύνη συνεχισθεί, η λήψη αίματος από τον ομφάλιο λώρο θα επιτρέψει την διάγνωση εμβρυϊκού υποθυρεοειδισμού και η θεραπεία συνίσταται στη χορήγηση μεγάλων δόσεων θυροξίνης στην μητέρα καθ΄όλη την διάρκεια της κύησης. Μετά τον τοκετό το νεογνό θα πρέπει να εξετασθεί για πιθανές επιδράσεις της ακτινοβολίας και να τεθεί άμεσα σε αγωγή υποκατάστασης με θυροξίνη
2.4. Θεραπεία του υπερθυρεοειδισμού κατά τη διάρκεια της λοχείας
Οι γυναίκες με ιστορικό νόσου Graves κατά τη διάρκεια της εγκυμοσύνης διατρέχουν υψηλότερο κίνδυνο υποτροπής κατά τη διάρκεια της λοχείας. Τόσον η προπυλθειουρακίλη όσον και η μεθιμαζόλη εκκρίνονται στο γάλα (η προπυλθειουρακίλη λιγότερο λόγω της εκτεταμένης δέσμευσής της με την αλβουμίνη) και έχουν εκφρασθεί ανησυχίες σχετικά με την ασφάλεια του θηλασμού στις γυναίκες που λαμβάνουν αντιθυρεοειδικά φάρμακα. Ωστόσο, τώρα είναι γνωστό ότι μόνο περιορισμένες ποσότητες προπυλθειουρακίλης και μεθιμαζόλης συγκεντρώνονται στο γάλα και η χρήση μικρών δόσεων αντιθυρεοειδικών φαρμάκων (PTU έως 300 mg, και MMI έως 20-30 mg ημερησίως) κατά τη διάρκεια της γαλουχίας δεν έχει αποδειχθεί ότι επηρεάζει τα επίπεδα των ορμονών του θυρεοειδούς ή την ανάπτυξη του βρέφους. Ωστόσο, για λόγους ασφαλείας, τα βρέφη των οποίων οι μητέρες λαμβάνουν αντιθυρεοειδικά φάρμακα κατά τη διάρκεια της γαλουχίας πρέπει να παρακολουθούνται με έλεγχο της θυρεοειδικής λειτουργίας και τα αντιθυρεοειδικά φάρμακα θα πρέπει να λαμβάνονται σε διαιρεμένες δόσεις αμέσως μετά το τάισμα. Η χρήση ραδιενεργού Ι αντενδείκνυται επί θηλασμού, δυνατόν όμως να χρησιμοποιηθεί μετά τον απογαλακτισμό και με χρήση ακτινοπροστασίας για το βρέφος.
3. Υποθυρεοειδισμός και κύηση
3.1. Συχνότητα και αιτιολογία υποθυρεοειδισμού κατά τη διάρκεια της εγκυμοσύνης
Η συχνότητα εμφάνισης του υποθυρεοειδισμού ποικίλλει από ανάλογα με τη χώρα και τα διαγνωστικά κριτήρια που χρησιμοποιήθηκαν, αλλά και την ηλικία κύησης κατά την οποία ετέθη η διάγνωση. Στις ανεπτυγμένες χώρες εκτιμάται συχνότητα 0,3-0,5% για τον κλινικό υποθυρεοειδισμό και 2-3% για τον υποκλινικό υποθυρεοειδισμό (38,39,40,41).
Σημειώνεται ότι σε έγκυες γυναίκες με ΣΔΤ1 η εμφάνιση του υποθυρεοειδσμού είναι πολύ συχνότερη (27% – 45%) (42,43). Σε παγκόσμιο επίπεδο, η πιο σημαντική αιτία μητρικού υποθυρεοειδισμού είναι η έλλειψη ιωδίου, η οποία είναι γνωστό ότι επηρεάζει πάνω από 1,2 δισεκατομμύρια άτομα παγκοσμίως. Υψηλός τίτλος θυρεοειδικών αντισωμάτων βρίσκεται στο 5-15% των φυσιολογικών γυναικών αναπαραγωγικής ηλικίας και, όταν η διατροφική πρόσληψη ιωδίου είναι επαρκής, η κύρια αιτία του υποθυρεοειδισμού κατά τη διάρκεια της εγκυμοσύνης είναι η χρόνια αυτοάνοση θυρεοειδίτιδα. Άλλα αίτια είναι ο ιατρογενής υποθυρεοειδισμός μετά από λήψη Ι131, μετά από θυρεοειδεκτομή ή μετα-ακτινικός, ο υποθυρεοειδισμός από λήψη φαρμάκων όπως πχ λίθιο ή κατά την θεραπεία υπερθυρεοειδισμού.
3.2. Κλινική εικόνα και διάγνωση
Τα συμπτώματα και σημεία του υποθυρεοειδισμού (αύξηση βάρους, ευαισθησία στο κρύο, ξηρό δέρμα, κόπωση, υπνηλία, δυσκοιλιότητα, κλπ) είναι δυνατόν να θέσουν ή να αυξήσουν την κλινική υποψία υποθυρεοειδισμού κατά την εγκυμοσύνη, δεδομένου όμως ότι μερικά από τα συμπτώματα αυτά συχνά χαρακτηρίζουν την κύηση, η διάγνωση μπορεί να καθυστερήσει ή να διαλάθει (44,45).
Ο έλεγχος της θυρεοειδικής λειτουργίας επιβεβαιώνει τη διάγνωση. Η αύξηση της TSH υποδηλώνει πρωτοπαθή υποθυρεοειδισμό και η μέτρηση των επιπέδων της Τ4 διακρίνει τον υποκλινικό από τον κλινικό υποθυρεοειδισμό, ανάλογα με το αν η ελεύθερη T4 είναι εντός ή σαφώς κάτω από τα φυσιολογικά, για την ηλικία κύησης, όρια. Ο προσδιορισμός των αντισωμάτων του θυρεοειδούς, κατά της υπεροξειδάσης και της θυρεοσφαιρίνης (TPO-Ab και TG-Ab), επιβεβαιώνει την αυτοάνοση προέλευση της διαταραχής.
Μετά την σύλληψη, κατά τις 4-8 εβδομάδες με την δράση των οιστρογόνων τα επίπεδα της θυρεοδεσμευτικής σφαιρίνης (TBG) αυξάνονται με αποτέλεσμα την αύξηση των επιπέδων της ολικής θυροξίνης. Παράλληλα η θυρεοτροπική δράση της ανθρώπινης χοριακής γοναδοτροπίνης (hCG) προκαλεί μείωση της θυρεοειδοτρόπου ορμόνης (TSH) κατά το πρώτο τρίμηνο, έτσι ώστε οι έγκυες γυναίκες έχουν χαμηλότερες συγκεντρώσεις ορού TSH από τις μη έγκυες. Επί πλέον, αν και η μέτρηση της FT4 ορού στην κύηση περιπλέκεται από την αυξημένη TBG και την μειωμένη συγκέντρωση λευκωματίνης που μπορεί να επηρεάσουν την αξιοπιστία των μετρήσεων, αρκετές μελέτες αναφέρουν επίσης μια σημαντική μείωση στις συγκεντρώσεις της ελεύθερης θυροξίνης ορού με την πρόοδο της κύησης. Ως εκ τούτου το ανώτατο όριο για TSH θα πρέπει να είναι 2,5 mIU/L κατά το πρώτο τρίμηνο, και 3,0 mIU / L κατά το δεύτερο και τρίτο τρίμηνο.
Επιπλέον, κατώτερο φυσιολογικό όριο θεωρείται 0,1 mIU/L στο πρώτο τρίμηνο, 0,2 mIU /L στο δεύτερο, και 0,3 mIU / L στο τρίτο. Η μη εφαρμογή/ χρήση των ειδικών για τα τρία τρίμηνα επιπέδων αναφοράς οδηγεί σε υποτίμηση του υποθυρεοειδισμού και υπερεκτίμηση του υπερθυρεοειδισμού στην κύηση (βλέπε και αντίστοιχο κεφάλαιο).
3.3. Συνέπειες υποθυρεοειδισμού στην κύηση
Ο ενεργός κλινικός υποθυρεοειδισμός συνδέεται σαφώς με σοβαρές ανεπιθύμητες ενέργειες. Η πλέον γνωστή επιπλοκή είναι ο μειωμένος δείκτης νοημοσύνης (IQ) σε βρέφη που γεννήθηκαν από μητέρες με υποθυρεοειδισμό και ήταν η πρώτη που περιγράφεται από τους Haddow συνεργάτες το 1999 (46). Στην αναδρομική αυτή μελέτη, οι συγγραφείς επέλεξαν 62 έγκυες γυναίκες με τιμές TSH ορού πάνω από το 98ο εκατοστημόριο για όλες τις έγκυες γυναίκες (n = 25.216) σε συνδυασμό με τις χαμηλές τιμές FT4. Τα παιδιά των γυναικών αυτών υποβλήθηκαν σε τεστ IQ (Wechsler Intelligence Scale για Παιδιά, 3η έκδοση) στην ηλικία των 7-9 ετών και βρέθηκε ότι ο δείκτης νοημοσύνης τους ήταν 4 μονάδες χαμηλότερος από εκείνον της ομάδας ελέγχου (p = 0.06). Επιπλέον, 15% των παιδιών των γυναικών αυτών είχαν δείκτη νοημοσύνης μικρότερο ή ίσο με 85 έναντι 5% των παιδιών της ομάδας των ευθυρεοειδικών μητέρων. Οι 48 από τις 62 αυτές γυναίκες δεν έλαβαν αγωγή υποκατάστασης με λεβοθυροξίνη κατά την κύηση. Το IQ των παιδιών αυτών ήταν κατά μέσο όρο 7 μονάδες χαμηλότερο από την ομάδα ελέγχου (P = 0,005), ενώ 19% από αυτά είχαν δείκτη νοημοσύνης μικρότερο ή ίσο με 85.
Όσον αφορά τις μαιευτικές επιπλοκές έχουν περιγραφεί αυξημένος κίνδυνος αποβολής αλλά και αυξημένος κίνδυνος για θνησιγενές νεογνό και περιγεννητικό θάνατο. Άλλες επιπλοκές που σχετίζονται με υποθυρεοειδισμό στην κύηση είναι ο πρόωρος τοκετός, η εμφάνιση υπέρτασης κύησης, η αποκόλληση του πλακούντα και η αιμορραγία μετά τον τοκετό (47,48,49,50,51,52,53,54).
Παρά τη σοβαρότητα των επιπλοκών που σχετίζονται με τον υποθυρεοειδισμό, λίγες είναι οι μελέτες παρέμβασης. Αναφέρεται πάντως μείωση της πιθανότητας αυτόματης αποβολής (4 έναντι 31%) (49), μέχρι και ελαχιστοποίηση των μαιευτικών και νεογνικών επιπλοκών επί επαρκούς θυρεοειδικής υποκατάστασης (55,56).
3.4. Θεραπεία
Η λεβοθυροξίνη είναι το φάρμακο εκλογής για τη θεραπεία του υποθυρεοειδισμού. Στις γυναίκες με ιστορικό υποθυρεοειδισμού συνιστάται έλεγχος και αναπροσαρμογή της δόσης πριν την έναρξη της κύησης, ούτως ώστε η TSH να είναι μικρότερη από 2,5 mIU/L. Το ίδιο επίπεδο TSH θα πρέπει να διατηρηθεί κατά τη διάρκεια της πρώτου τριμήνου, και δεν θα πρέπει να υπερβαίνει το 3,0 mIU/L κατά τη διάρκεια του δεύτερου και του τρίτου τριμήνου.
Για να επιτευχθεί αυτό το αποτέλεσμα, η δοσολογία της θυροξίνης θα πρέπει να αυξάνεται στην αρχή της εγκυμοσύνης κατά 30-50 %, ανάλογα με την αιτία του υποθυρεοειδισμού: σε υποθυρεοειδισμό λόγω θυρεοειδίτιδας Hashimoto, η αύξηση είναι μικρότερη, πιθανόν λόγω υπολειπόμενης θυρεοειδικής λειτουργίας, σε αντίθεση με τον υποθυρεοειδισμό λόγω θυρεοειδεκτομής, όπου η αύξηση της δόσης θυροξίνης είναι δυνατόν να φθάνει το 100%.
Αν ο κλινικός υποθυρεοειδισμός διαγνωστεί κατά τη διάρκεια της εγκυμοσύνης, η αποκατάσταση ευθυρεοειδισμού όσον το δυνατόν ταχύτερα και η παρακολούθηση κατά την πρόοδο της κύησης ως ανωτέρω, είναι ζωτικής σημασίας.
3.5. Μεμονωμένη υποθυροξιναιμία
Ως μεμονωμένη υποθυροξιναιμία χαρακτηρίζεται η κατάσταση με χαμηλά επίπεδα fT4 με φυσιολογική TSH ορού. Αποδίδεται σε ανεπάρκεια ιωδίου, οπότε ο θυρεοειδής στρέφεται στην παραγωγή τριιωδοθυρονίνης, έχει όμως παρατηρηθεί και σε ιωδοεπαρκείς πληθυσμούς (57). Πρέπει επίσης να σημειωθεί ότι με βάση τον ορισμό των φυσιολογικών ορίων κατά την Γκαουσιανή κατανομή, 2.5% των υγιών εγκύων γυναικών θα έχουν συγκεντρώσεις fT4 κάτω από το κατώτερο όριο αναφοράς.
Η μεμονωμένη υποθυροξιναιμία έχει συσχετισθεί, χωρίς επιβεβαίωση, με πρόωρο τοκετό, μακροσωμία και ΣΔκύησης και εενδοκοιλιακή αιμορραγία (58,59), ενώ επίσης έχει αναφερθεί αρνητική συσχέτιση με την νευροψυχική ανάπτυξη των νεογνών (60,61).
Δεδομένου όμως ότι είναι ασαφές, εάν η συσχέτιση μεταξύ υποθυροξιναιμίας και των πιθανών δυσμενών αποτελεσμάτων της οφείλονται σε έλλειψη ιωδίου ή νόσο του θυρεοειδούς της μητέρας, δεν συνιστάται αγωγή με θυροξίνη, θα πρέπει όμως να διασφαλίζεται η επάρκεια Ιωδίου στην διατροφή της εγκύου (60).
4. Θυρεοειδίτιδα μετά τον τοκετό (Post Partum Thyroiditis)
Θυρεοειδίτιδα μετά τον τοκετό καλείται η εμφάνιση de novo αυτοάνοσης νόσου του θυρεοειδούς, εξαιρουμένης της νόσου του Graves, κατά το πρώτο έτος μετά τον τοκετό.
Η κλινική εικόνα της διαταραχής ποικίλλει. Στην κλασική της μορφή, εκδηλώνεται με συμπτώματα υπερθυρεοειδισμού, ακολουθεί μια παροδική φάση υποθυρεοειδισμού και τέλος επιστροφή στον ευθυρεοειδισμό αν και σε μερικές περιπτώσεις (50%) ο υπερθυρεοειδισμός παραμένει. Οσον αφορά την θεραπεία, η θυρεοτοξική φάση δεν απαιτεί συνήθως αλλά και δεν ανταποκρίνεται σε αγωγή με αντιθυρεοειδικά. Η χορήγηση λεβοθυροξίνης στην υποθυρεοειδισκή φάση εξαρτάται από την βαρύτητα των συμπτωμάτων και από το αν η ασθενής θηλάζει ή προγραμματίζει επόμενη κύηση σύντομα και είναι παροδική, για 6-12 μήνες συνολικά, εκτός και αν έχουμε μόνιμο υποθυρεοειδισμό (29,62).
Η θυρεοειδιτιδα μετά τον τοκετό είναι μια αυτοάνοση διαταραχή του θυρεοειδούς που εμφανίζεται το πρώτο έτος μετά τον τοκετό. Η ανοσολογική φύση της διαταραχής υποστηρίζεται από το γεγονός ότι εμφανίζεται μετά τον τοκετό, σε μια φάση ανοσολογικής ανάκαμψης της λεχωϊδος και από το γεγονός ότι εμφανίζεται συχνότερα (30-50%) επί ύπαρξης θετικών αυτοαντισωμάτων του θυρεοειδούς [αντισώματα θυρεοειδικής υπεροξειδάσης (TPOAb) και/ ή αντισωμάτων θυρεοσφαιρίνης] κατά το πρώτο τρίμηνο της κύησης, και μάλιστα όσον υψηλότερος είναι ο τίτλος τόσο μεγαλύτερη η πιθανότητα εμφάνισης της διαταραχής (62,63).
Επιπλέον ιστολογική μελέτη του θυρεοειδούς μετά από παρακέντηση δια λεπτής βελόνης έχει δείξει λεμφοκυτταρική διήθηση παρόμοια εκείνης που παρατηρείται σε άτομα με σιωπηλή θυρεοειδίτιδα, ενώ έχουν αναφερθεί και ανοσολογικές μεταβολές όπως μείωση των ρυθμιστικών Τ-λεμφοκυττάρων και ειδικός HLA απλότυπος (64,65).
5. Οζώδης νόσος και καρκίνος θυρεοειδούς στην κύηση
Ο όγκος του θυρεοειδούς αυξάνει κατά την κύηση (66) και η εγκυμοσύνη θεωρείται ένας από τους παράγοντες κινδύνου για ανάπτυξη και αύξηση των θυρεοειδικών όζων. Εν τούτοις δεν είναι σαφές αν η επίπτωση των θυρεοειδικών όζων είναι μεγαλύτερη στην κύηση.
Η διαγνωστική στρατηγική για τη διερεύνηση και παρακολούθηση των θυρεοειδικών όζων είναι παρόμοια σε έγκυες και μη έγκυες γυναίκες, αν και η χρήση του σπινθηρογραφήματος αντενδείκνυται κατά την εγκυμοσύνη. Η λήψη πλήρους ατομικού και κληρονομικού ιστορικού καθώς και κλινική εξέταση και ο έλεγχος της θυρεοειδικής λειτουργίας συμπληρώνονται με υπερηχογράφημα του θυρεοειδούς για προσδιορισμό των χαρακτηριστικών των όζων, ενώ η παρακέντηση με λεπτή βελόνα (Fine Needle Aspiration, FNA) είναι διαδικασία ασφαλής και με μεγάλη διαγνωστική ακρίβεια.
Η πρόγνωση του διαφοροποιημένου καρκίνου του θυρεοειδούς που διαγιγνώσκεται κατά την διάρκεια της κύησης είναι παρόμοια αν η χειρουργική επέμβαση εκτελεσθεί κατά τη διάρκεια ή μετά την κύηση, επομένως η επέμβαση μπορεί να καθυστερήσει για μετά τον τοκετό. Συνιστάται πάντως υπερηχογραφική παρακολούθηση και πιθανόν αγωγή με θυροξίνη με στόχο την καταστολή της TSH σε 0,1-1,5 mU/l. Εάν η χειρουργική επέμβαση είναι αναγκαία η ασφαλέστερη χρονική περίοδος είναι το 2ο τρίμηνο. Οι καλοήθεις όζοι του θυρεοειδούς δεν χρειάζονται αντιμετώπιση κατά την κύηση παρά μόνον αν υπάρχει ταχεία ανάπτυξη ή συμπτώματα πίεσης στα παρακείμενα όργανα (29,67). ΟΙ έγκυες γυναίκες με προϋπάρχοντα διαφοροποιημένο καρκίνο θυρεοειδούς συνεχίζουν την αγωγή με θυροξίνη με στόχο την καταστολή της TSH ανάλογα με τον κίνδυνο καταστολής, όπως και εκτός κύησης. Η δόση της λεβοθυροξίνης αυξάνει κατά την διάρκεια της κύησης, όπως και επί πρωτοπαθούς υποθυρεοειδισμού και επιβάλλεται έλεγχος της θυρεοειδικής λειτουργίας ανά 4-6 εβδομάδες ώστε να διασφαλιστεί ότι οι στόχοι της θεραπείας πληρούνται (29,67).
Εικόνα 6. Σύνοψη των μεταβολών της θυρεοειδικής φυσιολογίας κατά την κύηση σε συνθήκες επαρκούς και μη πρόσληψης ιωδίου (Glinoer D. The Regulation of Thyroid Function in Pregnancy: Pathways of Endocrine Adaptation from Physiology to Pathology. Endocr Reviews 1997;18).
6. Επιγραμματικά
- Τα φυσιολογικά όρια των θυρεοειδικών ορμονών κατά την κύηση διαφέρουν εκείνων εκτός κύησης.
- Ο υποθυρειδισμός είναι συχνός κατά την κύηση (~3%) και η μη αντιμετώπισή του σχετίζεται με κακή έκβαση της εγκυμοσύνης.
- Επί υποθυρεοειδισμού οι ανάγκες σε λεβοθυροξίνη αυξάνουν κατά την κύηση. Επιβάλλεται η γρήγορη ομαλοποίηση της TSH και παρακολούθηση των επιπέδων της ανά 4-6 εβδομάδες.
- Η λεβοθυροξίνη πρέπει να χορηγείται το πρωί 30-60 λεπτά πριν το πρωϊνό και τουλάχιστον 4-6 ώρες πριν από την λήψη των συμπληρωμάτων σιδήρου και ασβεστίου.
- Ο υπερθυρεοειδισμός πρέπει να αντιμετωπίζεται πριν από την κύηση.
- Τα αντιθυρεοειδικά φάρμακα είναι δυνατόν να χρησιμοποιηθούν κατά την κύηση. Στόχος της θεραπείας είναι η διατήρηση των επιπέδων των θυρεοειδικών ορμονών στα ανώτερα φυσιολογικά όρια.
- Η μενονωμένη υποθυροξιναιμία δεν απαιτεί θεραπεία, συνιστάται όμως η αποκατάσταση της ιωοδοπενίας.
Βιβλιογραφία
1. Glinoer D. The Regulation of Thyroid Function in Pregnancy: Pathways of Endocrine Adaptation from Physiology to Pathology. Endocrine Reviews 1997 Vol. 18, No. 3
2. Glinoer D. Pregnancy and Iodine. Thyroid 2001 Volume 11, Number 5
3. Glinoer D. The Maternal Handling of Iodine and Metabolism of Thyroid Hormone during Pregnancy. In The thyroid and the brain. Morreale de Escobar, de Vijlder, Butz and Hostalek (eds), Schattauer, 2003
4. Hershman J. Physiological and pathological aspects of the effect of human chorionic gonadotropin on the thyroid. Best Practice και Research Clinical Endocrinology και Metabolism 2004 Vol. 18, No. 2, pp. 249–265
5. Orozco A, Valverde-R C, Olvera A, García-G C. Iodothyronine deiodinases: a functional and evolutionary perspective. J Endocrinol. 2012 Nov;215(2):207-19.
6. WHO, UNICEF, ICCIDD. Assessment of the iodine deficiency disorders and monitoring their elimination. Geneva (Switzerland): World Health Organization; 2007
7. Morreale de Escobar G, Obrego´n Μ, Escobar del Rey F. Maternal thyroid hormones early in pregnancy and fetal brain development. Best Practice και Research Clinical Endocrinology και Metabolism 2004 Vol. 18, No. 2, pp. 225–248
8. Laurberg P, Cerqueira C, Ovesen L et al. Iodine intake as a determinant of thyroid disorders in populations. Best Practice και Research Clinical Endocrinology και Metabolism 2010, Feb;24(1):13-27
9. Braunstein GD, Hershman JM Comparison of serum pituitary thyrotropin and chorionic gonadotropin concentrations throughout pregnancy. J Clin Endocrinol Metab. 1976 Jun; 42(6):1123-6
10. Glinoer D, de Nayer P, Bourdoux P, Lemone M, Robyn C, van Steirteghem A, Kinthaert J, Lejeune B Regulation of maternal thyroid during pregnancy.J Clin Endocrinol Metab. 1990 Aug; 71(2):276-87
11. Lambert-Messerlian G, McClain M, Haddow J, et al. First- and Second-Trimester thyroid hormone reference data in pregnant women: a FaSTER (First- and Second-Trimester Evaluation for aneuploidy) Research Consortium study. Am J Obstet Gynecol 2008, 199(1)
12. Soldin OP, Tractenberg RE, Hollowell JG, et al. Trimester-specific changes in maternal thyroid hormone, thyrotropin, and thyroglobulin concentrations during gestation: trends and associations across trimesters in iodine sufficiency. 2004, 14(12):1084-90
13. Sapin R and d’Herbomez M. Free Thyroxine measured by equilibrium Dialysis and nine immunoassays in Sera with various Seum Thyroxine-binding Capacities. Clinical Chemistry 2003 49 (9)
14. Lee R, Spencer C, Mestman et al. Free T4 immunoassays are flawed during pregnancy. Am J Obstet Gynecol 2009,200 (3)
15. Gilbert R, Hadlow N, Walsh J, et al. Assessment of thyroid function during pregnancy: first-trimester (weeks 9–13) reference intervals derived from Western Australian women. Med J Austral 2008, 189: 250–253
16. Vila L, Serra-Prat M, Palomera E, et al. Reference Values for Thyroid Function Tests in Pregnant Women Living in Catalonia, Spain. Thyroid 2010 20(2)
17. Anckaert E, Poppe K, Van Uytfanghe K, et al. FT4 immunoassays may display a pattern during pregnancy similar to the equilibrium dialysis ID-LC/tandem MS candidate reference measurement procedure in spite of susceptibility towards binding protein alterations. Clin Chim Acta. 2010 6;411(17-18):1348-53
18. Tan JYL, Loh KC, Yeo GSH, Chee YC. Transient hyperthyroidism of hyperemesis gravidarum. An International Journal of Obstetrics and Gynaecology. 2002;109(6):683–688.
19. Mestman JH. Hyperthyroidism in pregnancy. Best Practice και Research Clinical Endocrinology και Metabolism. 2004;18:67–88
20. Amino N, Tanizawa O, Mori H, et al. Aggravation of thyrotoxicosis in early pregnancy and after delivery in Graves’ disease. Journal of Clinical Endocrinology και Metabolism. 1982;55:108–112
21. Lazarus JH. Thyroid disorders associated with pregnancy: etiology, diagnosis, and management.Treatments in Endocrinology. 2005;4(1):31–41.
22. Niebyl JR. Nausea and vomiting in pregnancy. The New England Journal of Medicine 2010; 363: 1544–1560.
23. Goodwin TM, Montoro M, Mestman J et al. The role of chorionic gonadotropin in transient hyperthyroidism of hyperemesis gravidarum. Journal of Clinical Endocrinology and Metabolism 1992; 75: 1333–1337.
24. Azizi F, Amouzegar A. Management of hyperthyroidism during pregnancy and lactation. European Journal of Endocrinology. 2011;164(6):871–876
25. Davis LE, Lucas MJ, Hankins GDV, Roark ML, Cunningham FG. Thyrotoxicosis complicating pregnancy. American Journal of Obstetrics and Gynecology. 1989;160(1):63–70.
26. Peleg D, Cada S, Peleg A, Ben-Ami M. The relationship between maternal serum thyroid-stimulating immunoglobulin and fetal and neonatal thyrotoxicosis. Obstetrics and Gynecology. 2002;99(6):1040–1043 66-69
27. Laurberg P, Nygaard B, Glinoer D, Grussendorf M, Orgiazzi J. Guidelines for TSH-receptor antibody measurements in pregnancy: results of an evidence-based symposium organized by the European Thyroid Association. Eur J Endocrinol 1998;139:584-90
28. Polak M, Le Gac I, Vuillard E, Guibourdenche J, Leger J, Toubert ME, et al. Fetal and neonatal thyroid function in relation to maternal Graves’ disease. Best Pract Res Clin Endocrinol Metab 2004;18:289-302.
29. Stagnaro-Green A, Abalovich M, Alexander E et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011 21(10), 1081–1125
30. De Groot LJ, Abalovich M, Alexander EK et al. Management of thyroid dysfunction during pregnancy and postpartum: an endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2012 97(8), 2543–2565
31. 31.Alamdari S, Fereidoun Azizi, Hossein Delshad, Farzaneh Sarvghadi, Atieh Amouzegar, and Ladan MehranJ Management of Hyperthyroidism in Pregnancy: Comparison of Recommendations of American Thyroid Association and Endocrine Society. Thyroid Res. 2013; 2013: 878467
32. Mandel SJ, Brent GA, Larsen PR. Review of antithyroid drugs during pregnancy and report of a case of aplasia cutis. Thyroid 1994;4:129-33.
33. Momotani N, Noh J, Oyanagi H. Antithyroid drug therapy for Graves’ disease during pregnancy: optimal regimen for fetal thyroid status. New England Journal of Medicine. 1986 315(1):24–28
34. Azizi F, Khoshniat M. Bahrainian M, Hedayati M. Thyroid function and intellectual development of infants nursed by mother taking methimazole. J Clin Endocrinol Metab 2000;85:3233-8.
35. Pugh S, Lalwani K, Awal A. Thyroid storm as a cause of loss of consciousness following anaesthesia for emergency caesarean section. Anaesthesia. 1994 Jan;49(1):35-7.
36. Menon V, McDougall WW, Leatherdale BA. Thyrotoxic crisis following eclampsia and induction of labour. Postgrad Med J. 1982 May;58(679):286-7)
37. Royal College of Physicians. Radioiodine in the management of benign thyroid disease: clinical guidelines. Report of a working party 2007. www.rcplondon.ac.uk/pubs
38. Glinoer D: The systematic screening and management of hypothyroidism and hyperthyroidism during pregnancy. Trends Endocrinol Metab 1998 9: 403,
39. Glinoer D, Rihai M, Grün JP, Kinthaert J: Risk of subclinical hypothyroidism in pregnant women with autoimmune thyroid disorders. J Clin Endocrinol Metab 1994 79:197
40. Klein RZ, Haddow JE, Faix JD, et al: Prevalence of thyroid deficiency in pregnant women. Clin Endocrinol 1991 35:41
41. Allan WC, Haddow JE, Palomaki GE, et al: Maternal thyroid deficiency and pregnancy complications: implications for population screening. J Med Screen 2000 7:127
42. Gallas PR, Stolk RP, Bakker K, et al: Thyroid dysfunction during pregnancy and in the first postpartum year in women with diabetes mellitus type 1. Eur J Endocrinol 2002 147:443
43. Jovanovic-Peterson I, Peterson CM: De novo clinical hypothyroidism in pregnancies complicated by type I diabetes. Am J Obstet Gynecol 1988 159:442-446
44. Stagnaro-Green A, Pearce E. Thyroid disorders in pregnancy. Nat Rev Endocrinol. 2012 Nov;8(11):650-8.
45. Yazbeck CF, Sullivan SD. Thyroid disorders during pregnancy. Med Clin North Am. 2012 Mar;96(2):235-56
46. Haddow JE, Palomaki GE, Allan WC et al, Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med. 1999 Aug 19;341(8):549-55
47. Negro, R, Schwartz, A, , Gismondi, R, et al, Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy. J Clin Endocrinol Metab 2010 95:E44–E48 (Abstract)
48. 48. Idris, I, Srinivasan, R, , Simm, A et al, Effects of maternal hyperthyroidism during early gestation on neonatal and obstetric outcome. Clin Endocrinol (Oxf) 2006 65:133–135
49. Abalovich, M, Gutierrez, S, Alcaraz, G, et al, Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 2002 12:63–68
50. Stagnaro-Green, A Maternal thyroid disease and preterm delivery. J Clin Endocrinol Metab 2009 94:21–25 (Abstract)
51. Allan, WC, , Haddow, JE, , Palomaki, GE et al, Maternal thyroid deficiency and pregnancy complications: Implications for population screening. J Med Screen 2000 7:127–130
52. Casey, BM, , Dashe, JS, , Wells, CE et al, Subclinical hypothyroidism and pregnancy outcomes. Obstet Gynecol 2005 105:239–245
53. Pop, VJ, , Brouwers, EP, , Wijnen, H, et al, Low concentrations of maternal thyroxin during early gestation: a risk factor of breech presentation? BJOG 2005 111:925–930
54. Ishikawa, N, The relationship between neonatal developmental dysplasia of the hip and maternal hyperthyroidism. J Pediatr Orthop 2008 28:432–434
55. Tan TO, Cheng YW, Caughey AB. Are women who are treated for hypothyroidism at risk for pregnancy complications? Am J Obstet Gynecol. 2006 May;194(5):e1-3
56. Negro R. Re-thinking the definitions of subclinical thyroid disease in pregnancy. J Endocrinol Invest. 2011 Sep;34(8):620-2
57. Morreale de EG, Obregon MJ, Escobar del RF. Is neuropsychological development related to maternal hypothyroidism or to maternal hypothyroxinemia? J. Clin. Endocrinol.Metab. 2000 85(11),3975–3987.
58. Cleary-Goldman J, Malone FD, Lambert-Messerlian G et al. Maternal thyroid hypofunction and pregnancy outcome. Obstet. Gynecol. 2008 112(1), 85–92
59. Casey BM, Dashe JS, Spong CY et al. Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy. Obstet. Gynecol. 2007 109(5), 1129–1135
60. Pop VJ, Kuijpens JL, van Baar AL et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin. Endocrinol. (Oxf.) 1999 50(2), 149–155
61. Pop VJ, Brouwers EP, Vader HL et al. Maternal hypothyroxinaemia during early pregnancy and subsequent child development: a 3-year follow-up study. Clin. Endocrinol. (Oxf.) 2003 59(3), 282–288
62. Stagnaro-Green A. Clinical review 152: postpartum thyroiditis. J. Clin. Endocrinol.Metab. 2002 87(9), 4042–4047
63. Lazarus JH. The continuing saga of postpartum thyroiditis. J Clin Endocrinol Metab. 2011 Mar;96(3):614-6.
64. Parkes AB, Darke C, Othman S, Thomas M, Young N, Richards CJ, Hall R, Lazarus JH. Major histocompatibility complex class II and complement polymorphisms in postpartum thyroiditis. Eur J Endocrinol. 1996 Apr;134(4):449-53.
65. Badenhoop K, Walfish PG, Rau H, Fischer S, Nicolay A, Bogner U, Schleusener H, Usadel KH. Susceptibility and resistance alleles of human leukocyte antigen (HLA) DQA1 and HLA DQB1 are shared in endocrine autoimmune disease. J Clin Endocrinol Metab. 1995 Jul;80(7):2112-7.
66. Glinoer D, De NP, Bourdoux P et al. Regulation of maternal thyroid during pregnancy. J. Clin. Endocrinol. Metab. 1990 71(2), 276–287
67. Cooper DS, Doherty GM, Haugen BR et al. Revised American thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009 19(11), 1167–1214
Created: October 27, 2014
Last update: October 27, 2014

