Γρηγόρης Ευφραιμίδης
Ενδοκρινολόγος, διδάκτωρ του Πανεπιστημίου του Άμστερνταμ
Εισαγωγή
Η νόσος του Graves’ είναι μια αποκλειστικά ανθρώπινη νόσος και κατατάσσεται στις αυτοάνοσες οργανοειδικές νόσους, καθώς τα κλινικά και παθολογοανατομικά χαρακτηριστικά της αφορούν αποκλειστικά σε ένα όργανο. Στην κλασική της μορφή χαρακτηρίζεται από υπερθυρεοειδισμό, δηλαδή από υπερβολική παραγωγή θυρεοειδικών ορμονών και από διάχυτη μεγέθυνση του θυρεοειδή αδένα. Πολύ συχνά αλλά όχι πάντοτε συνοδεύεται και από μια μοναδική φλεγμονώδη διαταραχή των οφθαλμών, την οφθαλμοπάθεια Graves’. Η παρουσία της οφθαλμοπάθειας καθιστά τη διάγνωση της νόσου Graves’ σχεδόν βέβαιη.
1. Ιστορικά στοιχεία
Η νόσος πήρε το όνομά της από τον Ιρλανδό γιατρό Robert James Graves.
- 1835: πρώτη αναφορά της τοξικής διάχυτης βρογχοκήλης από τον Graves.
- 1825: περιγραφή της νόσου από Caleb Hillier Parry (Bath, England) και πρώτη σύνδεση με
- θυρεοειδή.
- 1805: περιγραφή της νόσου από Giuseppe Flajani (Rome, Italy) χωρίς όμως να συνδέει τη νόσο με το θυρεοειδή αδένα, περιέγραψε διάχυτο οίδημα του τραχήλου το οποίο ονόμασε “βρογχοκήλη”.
- 1840: Ο Carl A. von Basedow (Germany) συνέδεσε τη νόσο με την οφθαλμοπάθεια και περιέγραψε για πρώτη φορά το σύνδρομο στο σύνολο του (εξόφθαλμος, βρογχοκήλη, αίσθημα παλμών).
- 1880: Ο Ludwig Rehn πραγματοποιεί την πρώτη θυρεοειδεκτομή. 1911: Ο Marine προτείνει θεραπεία της νόσου με διάλυμα Lugol.
- 1940s: περιγραφή του αντιθυρεοειδικού φαρμάκου θειουρία και έναρξη θεραπείας με ραδιενεργό ιώδιο.
- 1956: Ανακάλυψη του παράγοντα LATS (long-acting thyroid stimulator – παράγων διέγερσης του θυρεοειδούς μακράς δράσης) από Adams και purees και αργότερα η αναγνώριση του ως αντίσωμα.
2. Επιδημιολογικά δεδομένα
Η νόσος Graves’ είναι η πιο συχνή αιτία θυρεοτοξίκωσης σε χώρες με επάρκεια ιωδίου.
Οι όροι θυρεοτοξίκωση και υπερθυρεοειδισμός δεν πρέπει να συγχέονται. Θυρεοτοξίκωση είναι το κλινικό σύνδρομο που οφείλεται στα αυξημένα επίπεδα θυρεοειδικών ορμονών στον ορό. Ο υπερθυρεοειδισμός αναφέρεται στην αυξημένη παραγωγή και έκκριση μεγάλων ποσοτήτων ελεύθερης θυρεοειδικών ορμονών από το θυρεοειδή αδένα. Είναι φανερό ότι θυρεοτοξίκωση μπορεί να έχουμε από αυξημένη χορήγηση εξωγενούς θυροξίνης ή στην αυξημένη απελευθέρωση θυρεοειδικών ορμονών στην υποξεία θυρεοειδίτιδα χωρίς τη συνύπαρξη αυξημένης παραγωγής τους.
Πολλές μελέτες στο παρελθόν προσπάθησαν να εκτιμήσουν τη συχνότητα της νόσου Graves’ στο γενικό πληθυσμό (Πίνακας 1). Πρόκειται για μελέτες που δεν είναι άμεσα συγκρίσιμες καθώς έγιναν σε διαφορετικούς πληθυσμούς, με ποικίλη εθνική σύσταση και με διαφορετικά διαγνωστικά εργαλεία σε διαφορετικές χρονικές περιόδους. Μια μετα-ανάλυση υπολόγισε τον επιπολασμό της νόσου περίπου στο 1% (1).
Η περιεκτικότητα της δίαιτας σε ιώδιο είναι καθοριστικός παράγοντας για τον προσδιορισμό της συχνότητας της νόσου. Έρευνες από την Ελβετία, Σουηδία, Νέα Ζηλανδία, Βρετανία και Δανία έδειξαν αύξηση της επίπτωσης της θυρεοτοξίκωσης μετά από εμπλουτισμό της δίαιτας με ιώδιο (2,3,4,5,6,7). Τέλος, όταν έγινε σύγκριση παρόμοιων γενετικά πληθυσμών που διέφεραν στην πρόσληψη ιωδίου (της ιωδοεπαρκούς Ισλανδίας και ιωδοανεπαρκούς Ανατολικής Γιουτλάνδης στη Δανία) διαπιστώθηκε ελαφρώς υψηλότερη επίπτωση της νόσου Graves’ στον ιωδοεπαρκή από ότι στον ιωδοανεπαρκή πληθυσμό ενώ αντίθετα ήταν τα ευρήματα αναφορικά με όλες τις αιτίες της θυρεοτοξίκωσης (8).
Η νόσος Graves’ εμφανίζεται σε όλες τις ηλικίες, συμπεριλαμβανομένης και της παιδικής ηλικίας (4). Η ηλικιακή αιχμή παρουσιάζεται στην 4η με 6η δεκαετία.
Πίνακας 1. Συχνότητα νόσου Graves’ στο γενικό πληθυσμό.
| ΗΠΑ | 0,4% | (9) |
| Ιταλία | 0,6% | (10) |
| Ην. Βασίλειο | 1,1-1,6% | (11,12) |
| Σουηδία |
25/100.000/έτος |
(13) |
3. Περιβάλλον και Νόσος Graves’
Η νόσος Graves’ παρουσιάζει σχετικά χαμηλή διείσδυση σε διδύμους καθώς και στους συγγενείς πρώτου βαθμού, γεγονός που αποτελεί σαφή ένδειξη ότι περιβαλλοντικοί παράγοντες διαδραματίζουν βασικό ρόλο στην παθογένεια της νόσου (14-16).
Κάπνισμα. Η σχέση του καπνίσματος με την νόσο Graves’ είναι εδώ και χρόνια γνωστή και αναμφισβήτητη. Υπάρχουν πολλές αναδρομικές μελέτες που παρέχουν επαρκείς αποδείξεις για τον αυξημένο κίνδυνο που διατρέχουν οι καπνιστές για την ανάπτυξη της νόσου Graves’ και της οφθαλμοπάθειας Graves’. Επιπλέον οι καπνιστές με νόσο Graves’ που λαμβάνουν αντιθυρεοειδική αγωγή έχουν μεγαλύτερη πιθανότητα υποτροπής μετά την διακοπή της αγωγής φαινόμενο περισσότερο έκδηλο στις γυναίκες. Η πρώτη και σίγουρα μια από τις πιο σημαντικές θεραπευτικές οδηγίες που πρέπει να λάβουν οι ασθενείς με νόσο Graves’ είναι η επείγουσα διακοπή του καπνίσματος. Θα πρέπει ο ασθενής με νόσο Graves’ να αντιληφθεί πλήρως τις συνέπειες του καπνίσματος στην εξέλιξη και την έκβαση της θεραπείας της νόσου.
Stress. Από τις πρώτες κιόλας περιγραφές της νόσου του Graves’ είχε διαπιστωθεί η σχέση του ψυχικού στρες ως εκλυτικός παράγοντας της νόσου. Πολλοί ερευνητές σε συγχρονικές-διατμηματικές (cross sectional) μελέτες βασισμένες σε ερωτηματολόγια παρατήρησαν αυξημένη επίπτωση των στρεσογόνων γεγονότων μερικούς μήνες πριν την εμφάνιση της νόσου Graves’ (17-20). Κάποια από αυτά τα γεγονότα θα μπορούσαν να θεωρηθούν περισσότερο ως αποτέλεσμα του 2 υπερθυρεοειδισμού στον ψυχισμό των ασθενών παρά ως αίτια του. Οι ασθενείς με νόσο Graves’ είναι αγχώδεις, ευερέθιστοι, επομένως είναι λογικό να παρουσιάζουν και να αναφέρουν ενδοοικογενειακούς διαπληκτισμούς ή διαπληκτισμούς στο εργασιακό τους περιβάλλον. Απ’ την άλλη κάποια γεγονότα είναι αντικειμενικά στρεσογόνα όπως είναι οι οικονομικές δυσκολίες ή η ανεργία. Και σ’ αυτήν όμως την περίπτωση υπάρχει το αντεπιχείρημα ότι ασθενείς με νόσο Graves’ αντιλαμβάνονται το ίδιο γεγονός με μεγαλύτερη ψυχική ένταση απ’ ότι τα υπόλοιπα άτομα που δεν πάσχουν από νόσο Graves’ (18). Επιπλέον, ο προϋπάρχον υποκλινικός υπερθυρεοειδισμός πιθανόν προκαλεί μεταβολή στην συμπεριφορά των ασθενών και οι ασθενείς με νόσο Graves’ ανησυχούν περισσότερο για την υγεία τους και γενικά ανακαλούν στρεσογόνα γεγονότα πιο εύκολα. Με τα δεδομένα αυτά οι κλινικές μελέτες που δείχνουν τη σχέση μεταξύ στρες και νόσου Graves’ θα μπορούσαν να θεωρηθούν εσφαλμένες (biased). Από την άλλη το θεωρητικό-βιολογικό υπόβαθρο της πιθανής σχέσης μεταξύ στρες και νόσου Graves’ είναι ισχυρό: Κατά το χρονικό διάστημα της έκθεσης στο stress παρατηρείται ανοσιακή καταστολή. Με την απομάκρυνση του ερεθίσματος και την άρση του στρες εμφανίζεται το φαινόμενο rebound δηλαδή ανοσιακή υπερδραστηριότητα η οποία με τη σειρά της πυροδοτεί την αυτοανοσία (21,22).
Φύλο. Η νόσος του Graves’ είναι συχνότερα αλλά όχι αποκλειστικά ασθένεια των γυναικών. Ο λόγος εμφάνισης ανδρών/γυναικών στη νόσο Graves’ έχει υπολογιστεί σε 5-10/1 σε όλες τις ηλικιακές ομάδες (10,11). Η ερμηνεία για αυτή την υπεροχή των γυναικών δεν είναι σαφής. Η κύηση είναι σίγουρα ένας σημαντικός παράγοντας κινδύνου και έχει παρατηρηθεί ότι ο κίνδυνος ανάπτυξης νόσου Graves’ αυξάνει 4-8 φορές στον πρώτο χρόνο της λοχείας (21). Από την άλλη, έχει παρατηρηθεί ότι η συχνότερη εμφάνιση της νόσου Graves’ μετά την κύηση δεν αλλάζει με τον αριθμό των κυήσεων (Rotondi 2008) γεγονός που δεν μπορεί να υποστηρίξει τον ρόλο της λοχείας ως παράγοντα κινδύνου για την εμφάνιση της νόσου Graves’. Επίσης στην ίδια ομάδα γυναικών παρατηρήθηκε ότι η περίοδος λοχείας είναι παράγοντας κινδύνου για την υποτροπή της νόσου Graves’ μετά την διακοπή των αντιθυρεοειδικών φαρμάκων (23).
4. Αντισώματα εναντίον του υποδοχέα της TSH
Πολλές μελέτες έγιναν για τη μελέτη των αντισωμάτων έναντι του υποδοχέα της TSH (TSHR-Abs) από το 1956 που έγινε η πρώτη περιγραφή τους ως και σήμερα.
Τα TSHR-Abs διακρίνονται ανάλογα με τη βιολογική τους συμπεριφορά σε:
- διεγερτικά του υποδοχέα αντισώματα (TSAbs): τα TSAbs προσδένονται και διεγείρουν τον υποδοχέα της TSH με τελικό αποτέλεσμα τον υπερθυρεοειδισμό.
- ανασταλτικά του υποδοχέα αντισώματα (TBAbs): τα TBAbs προσδένονται και μπλοκάρουν τον υποδοχέα, προκαλώντας την αυτοάνοση ατροφική
- θυρεοειδοπάθεια με τελικό αποτέλεσμα τον υποθυρεοειδισμό. Τα TBAbs συνυπάρχουν έως και στο 1/3 των περιπτώσεων νόσου Graves’ με τα διεγερτικά αντισώματα (24).
- ουδέτερα TSHR-Abs: συνδέονται με τον υποδοχέα χωρίς περαιτέρω βιολογική δράση.
Όπως αναφέρθηκε τα διεγερτικά TSAbs συνδέονται με τον υποδοχέα της TSH και δρουν ως αγωνιστές προκαλώντας υπερθυρεοειδισμό. Η ίδια η φύση παρέχει αποδείξεις για το ρόλο των TSAbs στην παθογένεια της νόσου Graves’: η διαπλακουντιακή μεταφορά των αντισωμάτων από την έγκυο στο έμβρυοο προκαλεί παροδική νεογνική θυρεοτοξίκωση, η οποία ιάται με την εξαφάνιση των TSHR-Abs από τον ορό του νεογνού. Επιπλέον, μελέτες απέδειξαν ότι τα TSHR-Abs συνδέονται με τον υποδοχέα της TSH (25-28).
Η πιο διαδεδομένη μέθοδος μέτρησης των TSHR-Abs στις μέρες μας είναι η μέτρηση των θυρεοειδο-κατασταλτικών ανοσοσφαιρινών (ΤΒΙΙ- TSΗ receptor binding inhibiting immunoglobulins). Η μέθοδος στηρίζεται στην ικανότητα των αντισωμάτων να καταστέλλουν τη σύνδεση ραδιοσεσημασμένης TSH σε εκχυλίσματα χοίρειας θυρεοειδικής μεμβράνης. Οι μέθοδοι της πρώτης αυτής γενιάς είχαν χαμηλή διαγνωστική ευαισθησία (70-90%) (29). Το 2000 περίπου αναπτύχθηκε νέα μέθοδος με την αντικατάσταση των εκχυλισμάτων από ανθρώπινο ανασυνδιασμένο υποδοχέα TSH. Οι δεύτερης γενιάς μέθοδοι παρουσιάζουν ευασθησία >90% ανάλογα το cut-off. Οι Costagliola et al διαπίστωσαν ευαισθησία 98,8% με cut-off το 1 IU/l (30). Η ύπαρξη των TBII αρνητικών ασθενών έχει συσχετιστεί με μικρότερου βαθμού θυρεοτοξίκωση και με μη εμφάνιση οφθαλμοπάθειας (31). Πιθανολογείται ότι οι ασθενείς αυτοί έχουν εξαιρετικά χαμηλές συγκεντρώσεις ΤΒΙΙ με αποτέλεσμα να μην είναι μετρήσιμες από τις διαθέσιμες μεθόδους. Έχει επίσης προταθεί η παραγωγή TSHR-Abs αποκλειστικά εντός του θυρεοειδικού ιστού (32). Το μειονέκτημα της μεθόδου είναι ότι δεν είναι σε θέση να διακρίνει τους βιολογικούς υποτύπους των TSHR-Abs (διεγερτικά ή ανασταλτικά του υποδοχέα της TSH αντισώματα).
Άλλη μέθοδος προσδιορισμού των TSHR-Abs είναι η μέτρηση της θυρεοδιεγερτικής ανοσοφαιρίνης (thyroid stimulating immunoglobulin). Η μέθοδος στηρίζεται στο γεγονός ότι η TSH διεγείρει την παραγωγή c-AMP στο θυρεοειδικό κύτταρο. Η TSI διεγείρει επίσης την παραγωγή c-AMP και επομένως οι μετρήσεις της βιοδραστικότητας των TSI σχετίζονται με την ικανότητα αύξησης παραγωγής c-AMP σε κυτταρικές σειρές με έκφραση υποδοχέων TSH (επιμολυσμένα με ανθρώπινο TSH υποδοχέα κύτταρα CHO). Η συγκεκριμένη μέθοδος πλεονεκτεί σε σχέση με τα TBII στο γεγονός ότι προσδιορίζει μόνο τα διεγερτικά TSHR-Abs. Πρόκειται όμως για σχετικά ακριβότερη μέθοδο προς το παρόν και είναι τεχνικά δυσκολότερη στην εφαρμογή της.
5. Κλινικές εκδηλώσεις
Η νόσος Graves’ παρουσιάζει όλες τις κλινικές εκδηλώσεις της θυρεοτοξίκωσης. Επιπλέον όμως παρουσιάζει και κλινικές εκδηλώσεις ανεξάρτητες από την υπερπαραγωγή των θυροειδικών ορμονών και οι οποίες είναι μοναδικές για τη νόσο Graves’. Τέτοιες είναι η οφθαλμοπάθεια Graves’ και η διηθητική δερματοπάθεια (τοπικό ή προκνημιαίο μυξοίδημα). Η ύπαρξη των τελευταίων κάνει τη διάγνωση της νόσου Graves’ σχεδόν βέβαιη.(Πίνακας 2).
Θυρεοειδής:
- συνήθως συμμετρική μεγέθυνση του αδένα, βρογχοκήλη
Δέρμα:
- θερμό, λεπτό, υγρό
- ερυθηματώδεις παλάμες
- ονυχόλυση, λέπτυνση ονύχων, χαρακτηριστική περιφερική ονυχόλυση του παράμεσου (Plummer’s nail)
- μελάγχρωση (εμφανίζεται σε σοβαρές περιπτώσεις Graves’, οφείλεται στη διαταραχή του μεταβολισμού κορτιζόλης που οδηγεί σε αύξηση της ACTH)
- λέπτυνση τριχών, αλωπεκία
- κνησμός, κνίδωση, δερμογραφισμός
- διηθητική δερματοπάθεια
- συνύπαρξη με λεύκη
Καρδιαγγειακό:
- αύξηση καρδιακού ρυθμού, ταχυκαρδία, αίσθημα παλμών
- καρδιακή ανεπάρκεια
- συστολική υπέρταση
- κολπική μαρμαρυγή (εμφανίζεται στο 10-20% των ασθενών και ειδικότερα στους ηλικιωμένους ασθενείς. Η κολπική μαρμαρυγή ανατάσσεται αυτόματα με τη θεραπεία του υπερθυρεοειδισμού στο 60% των ασθενών σε διάστημα ως 4 μήνες).
Μεταβολικές – Ενδοκρινικές εκδηλώσεις:
- δυσανεξία στο θερμό
Λιπίδια:
- χαμηλή ολική και HDL χοληστερόλη
- χαμηλός λόγος ολικής/HDL χοληστερόλης
Υπεργλυκαιμία:
- Ο υπερθυρεοειδισμός σχετίζεται αφενός με αυξημένη ευαισθησία των β-κυττάρων του παγκρέατος στη γλυκόζη και επομένως με αυξημένη παραγωγή ινσουλίνης, αφετέρου με ανταγωνιστική δράση στην περιφερική δράση της ινσουλίνης. Το τελικό αποτέλεσμα συνήθως είναι διαταραχή ανοχής γλυκόζης και υπεργλυκαιμία επειδή υπερισχύει η ανταγωνιστική δράση στην περιφέρεια.
Επινεφρίδια:
- μείωση της σφαιρίνης δέσμευσης κορτικοστεροειδών (CBG)
Αναπνευστικό:
- δύσπνοια, δύσπνοια προσπάθειας
- αύξηση κατανάλωσης Ο2 και παραγωγής CO2 (υποξαιμία, υπερκαπνία)
- ατροφία αναπνευστικών μυών
- απόφραξη τραχείας από μεγάλη βρογχοκήλη
Γαστρενετρικό:
- αυξημένη όρεξη
- μείωση σωματικού βάρους κυρίως λόγω αυξημένου μεταβολικού ρυθμού και δευτερευόντως λόγω αυξημένης κινητικότητας εντέρου. Η αυξημένη κινητικότητα προκαλεί δυσαπόρροφηση και διάρροια.
- υπερφαγία (μερικοί ασθενείς, κυρίως στις νεαρές ηλικίες, μπορεί να παρουσιάσουν αύξηση του σωματικού βάρους λόγω της υπερφαγίας)
- ανορεξία σε ηλικιωμένους ασθενείς
- δυσφαγία από μεγάλη βρογχοκήλη
- διαταραχής ηπατικής βιοχημείας, ειδικά αυξημένη αλκαλική φωσφατάση και σπάνια χολόσταση (σημαντική μέτρηση των ηπατικών ενζύμων πριν την έναρξη θεραπείας με θειοναμίδες)
Αιματολογικό:
- ορθόχρωμη ορθοκυτταρική αναιμία
- αυξημένη φερριτίνη ορού
- ήπια λευκοπενία με σχετική λεμφοκυττάρωση (σημαντική μέτρηση των λευκών αιμοσφαιρίων πριν την έναρξη θεραπείας με θειοναμίδες)
Ουρογεννητικό:
- συχνουρία, νυκτουρία
- στις γυναίκες ολιγομηννόροια και ανωορρηκτικοί κύκλοι, σε σοβαρό υπερθυρεοειδισμό μέχρι και αμηνόρροια, αύξηση SHBG
- στους άνδρες αυξημένη μετατροπή τεστοστερόνης σε οιστραδιόλη με αποτέλεσμα αυξημένα επίπεδα οιστραδιόλης, γυναικομαστία, μειωμένη libido και διαταραχές στυτικής λειτουργίας, αύξηση SHBG
Οστά:
- διέγερση οστικής επαναρρόφησης, αυξημένο ασβέστιο ορού, μειωμένη παραθορμόνη, αυξημένη αποβολή ασβεστίου στα ούρα
- μείωση οστικής πυκνότητας κυρίως φλοιώδους οστού
- τελικό αποτέλεσμα οστεοπόρωση και αυξημένος κίνδυνος κατάγματος σε χρόνια υπερθυρεοειδικούς ασθενείς
- θυρεοειδική ακροπάθεια: πληκτροδακτυλία και περιοστίτιδα στα μετακάρπια και στις φάλλαγες, πάχυνση οστών και μαλακών ιστών των περιφερικών άκρων
Νευροψυχιατρικές εκδηλώσεις:
- διαταραχές συμπεριφοράς και προσωπικότητας (ψύχωση, κατάθλιψη)
- άγχος, ευερεθιστότητα, ανησυχία, συναισθηματική αστάθεια
- λογόρροια
- αϋπνία
- διαταραχές συγκέντρωσης, σύγχυση, διαταραχές μνήμης
- τρόμος άκρων χειρών
- ζωηρά τενόντια αντανακλαστικά
Γηριατρική:
- % των ηλικιωμένων ασθενών εμφανίζει παρόμοια συμπτώματα με τους νεώτερους ασθενείς
- πολλοί εμφανίζουν απάθεια (apathetic thyrotoxicosis)
- μικρότερη πιθανότητα για εμφάνιση βρογχοκήλης
- μεγαλύτερη πιθανότητα απώλειας βάρους και δύσπνοιας σε σχέση με νεώτερους ασθενείς
- μεγαλύτερη πιθανότητα εμφάνισης κολπικής μαραμαρυγής και σοβαρότερης οφθαλμοπάθειας
Πίνακας 2. Συμπτώματα νόσου Graves’ και συχνότητα εμφάνισης τους.
| Συμπτώματα | Συχνότητα % |
| Νευρικότητα | 80-95 |
| Κόπωση | 50-80 |
| Αίσθημα παλμών | 65-95 |
| Δύσπνοια | 65-80 |
| Απώλεια βάρους | 50-85 |
| Δυσανεξία στο θερμό | 40-90 |
| Μειωμένη αντοχή | 45-85 |
| Ολιγομηνόρροια | 45-80 |
| Αυξημένη όρεξη | 10-65 |
| Αυξημένη εφίδρωση | 50-90 |
| Διάρροια | 8-33 |
| Σημεία από οφθαλμούς | 50-80 |
6. Κλινική Διάγνωση
Τα χαρακτηριστικά γνωρίσματα της νόσου Graves’ είναι η διάχυτη βρογχοκήλη, τα συμπτώματα και τα σημεία της θυρεοτοξίκωσης και η χαρακτηριστική οφθαλμοπάθεια. Η έναρξη των συμπτωμάτων είναι συνήθως σταδιακή αλλά η εξέλιξη της νόσου είναι σχετικά γρήγορη, εντός εβδομάδων ή μηνών (33). Σε κάποιες περιπτώσεις ήπια συμπτώματα μπορεί να προϋπάρχουν για χρόνια πριν τη διάγνωση.
Ο τυπικός ασθενής με νόσο Graves’ διαμαρτύρεται για νευρικότητα, αίσθημα παλμών, μείωση σωματικού βάρους παρά την αυξημένη όρεξη και κόπωση. Στην κλινική εξέταση θα πρέπει να αναζητηθούν σημεία από τους οφθαλμούς. Πολύ συχνά είναι παρούσα μια μεγάλη, συμμετρική βρογχοκήλη, εύκολα ψηλαφητή. Ο τυπικός λεπτός τρόμος των άκρων χειρών μπορεί εύκολα να διαπιστωθεί. Η εξέταση του καρδιαγγειακού αποκαλύπτει ταχυκαρδία και ισχυρούς καρδιακούς ήχους, σε μερικές περιπτώσεις αρρυθμία και κολπική μαρμαρυγή.
Στις κλασικές περιπτώσεις Graves’ η διάγνωση μπορεί να τεθεί μόνο από την κλινική εξέταση. Στις ήπιες όμως περιπτώσεις και σε περιπτώσεις ηλικιωμένων ασθενών που τα συμπτώματα δεν είναι τόσο προφανή και τόσο έντονα θα χρειαστεί φυσικά και επιπλέον εργαστηριακή διερεύνηση για να τεθεί η διάγνωση.
7. Εργαστηριακές εξετάσεις
7.1. Εξετάσεις θυρεοειδικής λειτουργίας
Η έρευση χαμηλής ή μη ανιχνεύσιμης TSH θέτει τη διάγνωση της θυρεοτοξίκωσης. Η παράλληλη μέτρηση των Τ4 και Τ3 είναι απαραίτητη για την ασφαλή διάγνωση της θυρεοτοξίκωσης. Η ολική Τ4 και ολική Τ3 είναι σχετικά φθηνές και αξιόπιστες εξετάσεις. Δεν πρέπει να ξεχνάμε ότι σε περιπτώσεις ύπαρξης αυξημένων δεσμευτικών πρωτεϊνών των θυρεοειδικών ορμονών (thyroxine-binding globulin TBG) όπως είναι η κύηση, η λήψη αντισυλληπτικών και η χρόνια ηπατική νόσος, μπορεί να έχουμε ψευδώς υψηλές τιμές ολικής Τ4 και Τ3. Η μέτρηση των ελευθέρων κλασμάτων των θυρεοειδικών ορμονών είναι πιο ασφαλής αλλά πιο ακριβή μέθοδος. Στις περιοχές με επάρκεια ιωδίου η μέτρηση μόνο των TSH και ελευθέρης Τ 4 επαρκούν συνήθως για να τεθεί η διάγνωση της θυρεοτοξίκωσης. Σε περιοχές όμως που δεν υπάρχει επάρκεια ιωδίου θα χρειαστεί και η μέτρηση της Τ3 καθώς σε ένα 12% των υπερθυρεοειδικών ασθενών η ελεύθερη Τ4 είναι φυσιολογική αλλά η ελεύθερη Τ3 είναι αυξημένη. Η κατάσταση αυτή ονομάζεται Τ3-τοξίκωση.
7.2 Μέτρηση αντισωμάτων
Τα αντισώματα TPO και Tg είναι θετικά στο 90% και 50-60% των ασθενών με νόσο Graves’ αντίστοιχα. Η μέτρηση τους είναι συμπληρωματική στη διάγνωση της Graves’ χωρίς να είναι απαραίτητη.
Η μέτρηση των TSHRAbs είναι ειδική και ευαίσθητη για τη νόσο του Graves’. Όπως αναφέρθηκε το 98-99% των ασθενών θα έχουν θετικά TSHRAb με τη δεύτερης γενιάς μεθόδους προσδιορισμού των αντισωμάτων. Παρά όμως τη μεγάλη ευαισθησία και ειδικότητα δεν παύει να πρόκειται για μια ακριβή εξέταση. Επομένως θα πρέπει να γίνεται σε επιλεγμένες περιπτώσεις όταν η κλινική εικόνα και οι εξετάσεις της θυρεοειδικής λειτουργίας δε θέτουν σαφή διάγνωση. Συγκεκριμένα, η μέτρηση τους θα χρειαστεί στη διαφορική διάγνωση έγκυων γυναικών με θυρεοτοξίκωση, στην οζώδη παραλλαγή της βρογχοκήλης σε νόσο Graves’ (όταν δηλαδή δεν έχουμε διάχυτη αλλά οζώδη βρογχοκήλη) και σε περιπτώσεις ευθυρεοειδικού εξόφθαλμου (εξόφθαλμος χωρίς θυρεοτοξίκωση, εμφανίζεται σε <1% ασθενών με οψαλμοπάθεεια, προσοχή όμως η διάγνωση δεν αποκλείεται αν τα αντισώματα είναι αρνητικά).
Ο δευτεροπαθής νεογνικός υπερθυρεοειδισμός εμφανίζεται μετά από διαπλακουντιακή μεταφορά διεγερτικών του υποδοχέα της TSH αντισωμάτων από μητέρα με νόσο Graves’ στο έμβρυο. Είναι σπάνιος και αφορά στο 1% των κυήσεων γυναικών με νόσο Graves’).
Ο εμβρυϊκός θυρεοειδής τη 12η εβδομάδα είναι ικανός να παράγει θυρεοσφαιρίνη και την 20η ανταποκρίνεται στην παρουσία της TSH αλλά και των TSAb. Επιπλέον είναι γνωστό ότι στο τελευταίο τρίμηνο αυξάνεται η διαπλακουντιακή μεταφορά ανοσοσφαιρινών.
Με τα δεδομένα αυτά ερμηνεύεται η εμφάνιση εμβρυϊκού υπερθυρεοειδισμού στο δεύτερο μισό της εγκυμοσύνης σε γυναίκες με υψηλό τίτλο TSAb. Συνιστάται η μέτρηση των TSAb σε έγκυες με νόσο Graves’ καθώς και σε έγκυες που έχουν λάβει οριστική θεραπεία (ραδιενεργό ιώδιο ή χειρουργείο) για νόσο Graves’ προκειμένου να προβλεφθεί πιθανή νεογνική θυρεοτοξίκωση. Στην πρώτη περίπτωση (έγκυες με ενεργό νόσο Graves’) συνιστάται η μέτρηση των αντισωμάτων την 28η εβδομάδα και προσεκτική παρακολούθηση του εμβρύου αν τα αντισώματα είναι άνω των τιμών αναφοράς. Στις γυναίκες που είχαν λάβει οριστική θεραπεία για νόσο Graves’ η μέτρηση των αντισωμάτων συνιστάται να γίνεται το 1ο τρίμηνο και επί θετικού αποτελέσματος επανάληψη την 28η εβδομάδα. Στις ευθυρεοειδικές έγκυες που έχουν λάβει στο παρελθόν αντιθυρεοειδικά φάρμακα δε χρειάζεται έλεγχος αντισωμάτων καθώς σε αυτές τις γυναίκες είναι δεδομένο ότι δεν υπάρχει διεγερτικός παράγων από τη στιγμή που είναι ευθυρεοειδικές.
7.3 Σπινθηρογράφημα
Πριν την ανάπτυξη ευαίσθητων μεθόδων μέτρησης της TSH, το σπινθηρογράφημα ήταν απαραίτητο για τη διάγνωση της νόσου Graves’. Κάτι τέτοιο δεν ισχύει πλεόν. H 24ωρη πρόσληψη του ραδιενεργού ιωδίου (radioactive iodine uptake, RAIU) και το σπινθηρόγραφημα θυρεοειδούς απαιτούνται σε συγκεκριμένες περιπτώσεις: στη διαφορική διάγνωση σιωπηλής ή υποξείας θυρεοειδίτιδας, τεχνητής (factitious) θυρεοτοξίκωσης και στη θυρεοτοξίκωση από αμιοδαρόνη τύπου ΙΙ. Η μέτρηση RAIU είναι επίσης χρήσιμη στον υπολογισμό της δόσης του ραδιενεργού ιωδίου για τη θεραπεία της Graves’. Το σπινθηρογράφημα θα βοηθήσει επίσης στις περιπτώσεις Graves’ με οζώδη διαμόρφωση του αδένα.
7.4. Υπερηχογράφημα
Στο υπερηχογράφημα θυρεοειδούς ο θυρεοειδής εμφανίζεται τυπικά υποηχοϊκός, λόγω της μείωσης του κολλοειδούς, της αυξημένης αγγείωσης και της λεμφοκυτταρικής διήθησης. Η χαρακτηριστική αυτή εικόνα μπορεί να φανεί χρήσιμη στη διαφορική διάγνωση περιπτώσεων θυρεοτοξίκωσης για την επιβεβαίωση της αυτοάνοσης προέλευσης της. Με το υπερηχογράφημα μπορούμε επίσης να μετρήσουμε το μέγεθος του αδένα.
8. Θεραπεία
8.1. β-αδρενεργικοί ανταγωνιστές
Πολλά από τα συμπτώματα της νόσου Graves’ οφείλονται στην αυξημένη β-αδρενεργική ευαισθησία και δραστηριότητα. Το γεγονός αυτό ερμηνεύει την ικανότητα των β-αναστολέων να προκαλούν τάχιστη ύφεση των συμπτωμάτων (αίσθημα παλμών, ταχυκαρδία, τρόμος, άγχος, δυσανεξία στο θερμό) (34) και για το λόγο αυτό οι β-αναστολείς διαδραματίζουν κεντρικό ρόλο στον πρώιμο έλεγχο των συμπτωμάτων της θυρεοτοξίκωσης. Οι β-αναστολείς δεν επηρεάζουν την σύνθεση, την έκκριση ή την ιστική δράση των θυρεοειδικών ορμονών. Η προπρανολόλη σε δόσεις μεγαλύτερες των 160 mg την ημέρα μειώνει με βραδύ ρυθμό τη συγκέντρωση της Τ3 έως και 30% (35) μέσω της αναστολής της 5-μονοαποιωδινάσης (η οποία μετατρέπει την Τ4 σε Τ3). Το αποτέλεσμα αυτής της δράσης της προπανολόλης γίνεται εμφανές μετά από 7 με 10 μέρες από την έναρξη της χορήγησής της και γι’ αυτό το λόγο συνιστάται η χορήγηση της μόνο για τον έλεγχο των αδρενεργικών συμπτωμάτων. Οι νεότεροι β-αναστολείς ατενολόλη, αλπρενολόλη και μετοπρολόλη προκαλούν παρομοίως ήπια μείωση της Τ3 ενώ η σοταλόλη και η ναβολόλη δεν παρουσιάζουν παρόμοια δράση. Επομένως οι β- αδρενεργικοί αναστολείς είναι πολύτιμο όπλο στον άμεσο έλεγχο των αδρενεργικών συμπτωμάτων του υπερθυρεοειδισμού και μπορούν να χορηγούνται σε ασθενείς με νόσο του Graves’ που δεν έχουν αντένδειξη για λήψη β-αναστολέων (βρογχικό άσθμα, ΧΑΠ, περιφερική αγγειοπάθεια, φαινόμενο Raynaud, βραδυκαρδία κ.α.). Δεν έχει διαπιστωθεί υπεροχή κάποιου αναστολέα έναντι των άλλων (οι νεότεροι αναστολείς εμφανίζουν μεγαλύτερο χρόνο δράσης ή μεγαλύτερη καρδιοεκλεκτικότητα). Οι β-αναστολείς μπορούν να συγχορηγηθούν με θειοναμίδες ή να χορηγηθούν ως μονοθεραπεία πριν την χορήγηση του ραδιενεργού ιωδίου ή ως προεγχειρητική προετοιμασία. Υπάρχει αναφορά στην οποία παρατηρήθηκε αύξηση του κινδύνου των αυτόματων αποβολών σε έγκυες γυναίκες με υπερθυρεοειδισμό που έλαβαν προπρανολόλη και θειοναμίδες σε σύγκριση με όσες έλαβαν μόνο θειοναμίδες (36). Η παρατήρηση αυτή εγείρει ερωτηματικά για την χρήση των β-αναστολέων στη θεραπεία του υπερθυρεοειδισμού στην εγκυμοσύνη.
8.2. Θειοναμίδες
Οι θειοναμίδες (μεθιμαζόλη, καρβιμαζόλη και προπυλθειουρακίλη) αποτελούν αποτελεσματική θεραπεία του υπερθυρεοειδισμού και χρησιμοποιούνται ήδη εδώ και πολλά χρόνια, από τις αρχές της δεκαετίας του 1940. Η κύρια δράση τους είναι η διακοπή της παραγωγής των θυρεοειδικών ορμονών μέσω της αναστολής της οργανοποίησης του ιωδίου και της σύζευξης των ιωδοτυροσινών. Η καρβιμαζόλη δεν αποτελεί η ίδια ενεργό ουσία αλλά μετατρέπεται σε μεθιμαζόλη στον οργανισμό και επομένως έχει παρόμοια με τη μεθιμαζόλη δράση και χαρακτηριστικά. Η προπυλθειουρακίλη έχει και ένα επιπλέον χαρακτηριστικό: σταματά μερικώς τη μετατροπή της Τ4 σε Τ3 στους περιφερικούς ιστούς χωρίς όμως η ιδιότητα αυτή να έχει κάποια ιδιαίτερη κλινική σημασία. Σε γενικές γραμμές, η μεθιμαζόλη προτιμάτε από την προπυλθειουρακίλη, με την εξαίρεση του πρώτου τριμήνου της κύησης, και αυτό κυρίως γιατί έχει ταχύτερη δράση (είναι 10 φορές πιο δραστική) και έχει λιγότερες ανεπιθύμητες ενέργειες (Πίνακας 3). Τόσο η μεθιμαζόλη όσο και η προπυλθειουρακίλη είναι εξαιρετικά αποτελεσματικές στον φαρμακευτικό έλεγχο του υπερθυρεοειδισμού και οι παρενέργειες τους είναι συγκρίσιμες με μια μικρή υπεροχή της μεθιμαζόλης στον τομέα αυτό. Η επιλογή επομένως μεταξύ μεθιμαζόλης και προπυλθειουρακίλης είναι περισσότερο θέμα προσωπικής προτίμησης. Όπως ελέχθη οι θειοναμίδες αναστέλλουν την παραγωγή νέων θυρεοειδικών ορμονών. Δεν συμβαίνει όμως το ίδιο και με την απελευθέρωση των ήδη παραχθέντων και αποθηκευμένων στον αδένα ορμονών. Έτσι, ευθυρεοειδισμός επιτυγχάνεται μόνο εφόσον εξαντληθούν τα αποθέματα των ενδοθυρεοειδικών ορμονών και των αποθηκών του ιωδίου. Πρόκειται για διαδικασία που συνήθως απαιτεί μία με έξι εβδομάδες. Ασθενείς με μεγάλες βρογχοκήλες, άφθονα αποθέματα θυρεοειδικών ορμονών και ειδικά παρουσία περίσσειας ιωδίου, παρουσιάζουν καθυστερημένη απάντηση στις θειοναμίδες.
Πίνακας 3. Φαρμακολογικές ιδιότητες θειοναμιδών. Σύγκριση μεθιμαζόλης, προπυλθειουρακίλης.
| Μεθιμαζόλη |
Προπυλθειουρακίλη |
|
| Σχετική δραστικότητα | >10 (ως 50) | 1 |
| Σχετικός χρόνος απόκρισης | ταχύτερος | βραδύτερος |
| Οδός χορήγησης | per os | per os |
| Σύνδεση με πρωτεΐνες ορού | ασήμαντη | 75% |
| Χρόνος ημίσειας ζωής (ώρες) | 4-6 | 1-2 |
| Χρόνος δράσης (ώρες) | >24 | 12-24 |
| Ανεκτικότητα | καλύτερη | χειρότερη |
| Διαπλακουντιακή μεταφορά | χαμηλή | χαμηλότερη |
| Επίπεδα στο μητρικό γάλα | χαμηλά | χαμηλότερα |
| Αναστολή αποιωδινασών | όχι | ναι |
Υποτροπή. Το μεγαλύτερο πρόβλημα των θειοναμιδών είναι τα σχετικά μεγάλα ποσοστά υποτροπών της νόσου Graves’ που εμφανίζονται μετά τη διακοπή τους. Παρατεταμένης διάρκειας ύφεση της νόσου σε ασθενείς που έλαβαν θειοναμίδες για ένα με δύο έτη αναφέρονται σε ποσοστά που κυμαίνονται από 15 έως 80%. Συνήθως όμως είναι 20 με 30% ανάλογα με τη διάρκεια της παρακολούθησης των ασθενών (37-40). Ωστόσο τις τελευταίες δεκαετίες έχει παρατηρηθεί μείωση στον ρυθμό ύφεσης της νόσου πιθανότατα λόγω του εμπλουτισμού της δίαιτας σε ιώδιο (41,42).
Η ύφεση της νόσου υπό και μετά την θεραπεία με θειοναμίδες πιθανόν να μην είναι αποτέλεσμα της θεραπείας αυτής καθεαυτής. Έχει υποστηριχτεί ότι η ίδια φυσική ιστορία της νόσου οδηγεί σε αυτόματη ύφεση και ότι οι θειοναμίδες απλά επιταχύνουν αυτό το φαινόμενο. Για παράδειγμα ασθενείς με ήπιο υπερθυρεοειδισμό που έλαβαν μόνο προπανολόλη (η οποία δεν επηρεάζει την παραγωγή των θυρεοειδικών ορμονών) διαπιστώθηκε ότι παρουσίασαν το ίδιο ποσοστό ύφεσης με αυτό ασθενών που έλαβαν θειοναμίδες (43).
Οι παράγοντες που σχετίζονται με μεγαλύτερη πιθανότητα ύφεσης είναι:
- Επίπεδα αντισωμάτων TSHRAbs: Ασθενείς αρνητικοί για TSHRAbs αντισώματα κατά τη διάγνωση ή όσοι αρνητικοποιούν τα TSHRAbs αντισώματα κατά τη διάρκεια της θεραπείας εμφανίζουν μεγαλύτερα ποσοστά ύφεσης.
- Φύλο: Οι γυναίκες εμφανίζουν πιο συχνά ύφεση από τους άντρες (44).
- Μέγεθος βρογχοκήλης: Μικρή βρογχοκήλη ή μείωση του μεγέθους του θυρεοειδούς κατά τη διάρκεια της θεραπείας εμφανίζουν μεγαλύτερα ποσοστά ύφεσης.
- Ηλικία: Ηλικία > 40 ετών σχετίζεται με μεγαλύτερα ποσοστά ύφεσης (44). Στα παιδιά φαίνεται ότι παρατεταμένη χορήγηση θειοναμιδών οδηγεί σε μεγαλύτερη πιθανότητα ύφεσης (38,45,46).
- Κάπνισμα: Η διακοπή του καπνίσματος αυξάνει την πιθανότητα ύφεσης (47)
- Παρουσία οφθαλμοπάθειας Graves’ (48)
- Γονότυποι HLA-DR3 (49), CTLA-4
Κανείς από τους παράγοντες αυτούς δεν έχει την απαιτούμενη ειδικότητα ή ευαισθησία για να προβλέψει την έκβαση της θεραπείας με θειοναμίδες.
Πότε συμβαίνει υποτροπή; Οι περισσότερες περιπτώσεις υποτροπών συμβαίνουν 3 με 6 μήνες μετά τη διακοπή της θεραπείας με θειοναμίδες και περισσότερο από τα δύο τρίτα των ασθενών θα υποτροπιάσουν εντός διετίας. Ωστόσο υποτροπή μπορεί να εμφανιστεί και πολύ αργότερα, μετά από έτη (50,51). Η υποτροπή της νόσου αποτελεί ισχυρή ένδειξη για μόνιμη θεραπεία του υπερθυρεοειδισμού με χορήγηση ραδιενεργού ιωδίου ή με θυρεοειδεκτομή.
Δόση. Ασθενείς με μικρή βρογχοκήλη και ήπιο υπερθυρεοειδισμό ίσως χρειαστούν αρχικά μικρές δόσεις, 10-15 mg μεθιμαζόλης ημερησίως. Σε αυτούς τους ασθενείς η χορήγηση μεγαλύτερης δόσης δεν φαίνεται να είναι και περισσότερο αποτελεσματική. Η δόση μπορεί να αυξηθεί μετά από 4 με 6 εβδομάδες αν διαπιστωθεί είτε κλινικά είτε βιοχημικά ότι ο ασθενής παραμένει υπερθυρεοειδικός.
Ασθενείς με μεγαλύτερη βρογχοκήλη και σοβαρότερο υπερθυρεοειδισμό χρειάζονται μεγαλύτερη αρχική δόση, 20 με 40 mg μεθιμαζόλης την ημέρα ή 200 με 400 mg προπυλοθειουρακίλης την ημέρα (10mg μεθιμαζόλης 2-3 φορές την ημέρα ή 15 mg δύο φορές την ημέρα). Μετά την έναρξη της θεραπείας οι ασθενείς θα πρέπει να ελεγχθούν σε διάστημα 4 με 6 εβδομάδων τόσο κλινικά όσο και βιοχημικά. Δεν πρέπει να παραληφθεί η μέτρηση της Τ3 εκτός από τη μέτρηση της freeT4. Τα επίπεδα της Τ3 μπορεί να παραμείνουν υψηλά ακόμα όταν η freeT4 έχει επανέλθει σε φυσιολογικά επίπεδα. Έχει βρεθεί ότι ασθενείς με “καθ’ υπεροχή Τ3” νόσο Graves’ ανταποκρίνονται φτωχότερα στη θεραπεία με θειοναμίδες (52). Αντίθετα, η μέτρηση της TSH μπορεί να οδηγήσει σε εσφαλμένα συμπεράσματα (53). Η καταστολή παραγωγής της TSH από την υπόφυση κατά την περίοδο του υπερθυρεοειδισμού μπορεί να επιμείνει για μήνες ακόμα και μετά την επαναφορά του Τ3 και Τ4 στα φυσιολογικά επίπεδα. Δεν είναι σπάνιο το φαινόμενο συνύπαρξης χαμηλής TSH με φυσιολογικές freeT4 και Τ3 για αρκετούς μήνες μετά την έναρξη της θεραπείας με θειοναμίδες. Όταν η TSH επανέλθει στα φυσιολογικά επίπεδα η μέτρηση της Τ3 δεν κρίνεται πλέον απαραίτητη.
Μετά λοιπόν την έναρξη της θεραπείας με θειοναμίδες και της χορήγησης των απαιτούμενων σύμφωνα με τα παραπάνω αρχικών δόσεων, το θεραπευτικό πλάνο έχει δύο εναλλακτικές προσεγγίσεις:
- Χορήγηση των θειοναμιδών στη χαμηλότερη δυνατή δόση για τη διατήρηση κλινικού και βιοχημικού ευθυρεοειδισμού, έλεγχος κάθε έναν με τρεις μήνες και επαναξιολόγηση της δόσης αναλόγα.
- Χορήγηση σταθερής δόσης θειοναμιδών σε συνδυασμό με λεβοθυροξίνη προκειμένου να αποφευχθεί ο ιατρογενής υποθυρεοειδισμός (block and replacement).
Δεν υπάρχουν δεδομένα που να υποστηρίζουν την υπεροχή της μιας στρατηγικής έναντι της άλλης τόσο όσον αφορά στο χρόνο εμφάνισης πιθανής υποτροπής όσο και στη μείωση των επιπέδων των TSH-R αντισωμάτων (με την εξαίρεση μιας έρευνας από την Ιαπωνία (54)). Σε θεωρητικό επίπεδο η block and replacement θεραπεία πλεονεκτεί διότι επιτρέπει τη χορήγηση μεγαλύτερων δόσεων θειοναμιδών και επομένως εκμεταλλεύεται τη θεωρητική-πιθανή ανοσοκατασταλτική τους δράση. Από την άλλη μεριά οι υψηλές αυτές δόσεις ενέχουν μεγαλύτερο ποσοστό ανεπιθύμητων ενεργειών. Επιπλέον η block and replacement θεραπεία επιτρέπει τον επανέλεγχο του ασθενούς σε αραιότερα χρονικά διαστήματα καθώς και τη ρύθμιση ασθενών που εμφανίζουνε συχνές βιοχημικές διακυμάνσεις.
Ανεξάρτητα από την τελική θεραπευτική στρατηγική που θα επιλεχθεί η θεραπεία διατηρείται για 12 με 24 μήνες και μετά από αυτό το διάστημα συνήθως διακόπτεται. Από μερικούς ενδοκρινολόγους συνιστάται η μέτρηση των αντισωμάτων πριν τη διακοπή της θεραπείας και επί ανεύρεσης υψηλού τίτλου αυτών η συνέχιση της θεραπείας για μερικούς ακόμη μήνες (55). Τέλος, έχει διαπιστωθεί ότι η παρατεταμένη χορήγηση θειοναμιδών για πολλά χρόνια (πάνω από 10 έτη) είναι ασφαλής και αποτελεσματική (56).
Ανεπιθύμητες ενέργειες. Περίπου το 5-6% των ασθενών (από 1 έως 15%) θα εμφανίσουν ήπιες ανεπιθύμητες ενέργειες. Κνησμός, δερματικό εξάνθημα και λιγότερο συχνά ουρτικάρια είναι οι πιο συχνές δερματικές εκδηλώσεις (57). Σχετικά συχνές είναι και οι αρθραλγίες. Οι ήπιες αυτές ανεπιθύμητες ενέργειες συνήθως υποχωρούν αυτόματα. Ωστόσο είναι κοινή πρακτική με την εμφάνιση των ανεπιθύμητων ενεργειών να διακόπτεται η χορήγηση των θειοναμιδών και να αντικαθίσταται η μία κατηγορία θειοναμιδών από άλλη. Συνιστάται η χορήγηση αντισταμινικών σε περίπτωση ήπιας αλλεργικής αντίδρασης. Η ήπια αύξηση των ηπατικών ενζύμων κατά την διάρκεια χορήγησης θειοναμιδών είναι δύσκολο να διακριθεί αν οφείλεται στις θειοναμίδες ή στην ίδια την θυρεοτοξίκωση. Η συχνή παρακολούθηση των ηπατικών ενζύμων είναι απαραίτητη διότι η τοξική ηπατίτιδα μπορεί να εμφανιστεί αιφνίδια.
Οι σοβαρές ανεπιθύμητες ενέργειες είναι σπάνιες και παρατηρούνται σε περίπου τρεις στους χίλιους ασθενείς (57,58). Ακοκιοκκυταραιμία (<500/mm3) μπορεί να εμφανιστεί τόσο με τη χορήγηση μεθιμαζόλης όσο και με την προπυλθειουρακίλη. Εμφανίζεται πιο συχνά στους ηλικιωμένους ασθενείς, χωρίς να αποκλείεται οποιαδήποτε άλλη ηλικιακή ομάδα. Συνήθως αναπτύσσεται τους πρώτους 3 με 4 μήνες από την έναρξη της θεραπείας. Η ακοκκιοκυταραιμία εγκαθίσταται αιφνίδια, σε διάστημα ημερών, επομένως ακόμα και η εβδομαδιαία μέτρηση των λευκών αιμοσφαιρίων δεν μπορεί να την προβλέψει ή να την προλάβει. Τυπικά η ακοκκιακυταραιμία εκδηλώνεται κλινικά με πυρετό και συμπτώματα λοίμωξης συνήθως του ανώτερου αναπνευστικού. Επομένως οι ασθενείς θα πρέπει να βρίσκονται σε εγρήγορση στην περίπτωση που εμφανίσουν τέτοιου είδους συμπτώματα και να προχωρήσουν άμεσα σε μέτρηση των λευκών αιμοσφαιρίων. Τα λευκά αιμοσφαίρια θα πρέπει πάντοτε να μετρώνται πριν από την έναρξη της θεραπείας διότι ήπιου βαθμού λευκοπενία είναι συχνή στους ασθενείς με Graves’ και επομένως ενδέχεται να παρερμηνευθεί αργότερα ως αντίδραση στις θειοναμίδες. Με τη διαπίστωση ακοκκιοκυταραιμίας ο ασθενής πρέπει να διακόψει άμεσα το φάρμακο και θα πρέπει να χορηγηθούν αντιβιοτικά ευρέος φάσματος και αυξητικοί παράγοντες για τη διέγερση των αιμοποιητικών κυττάρων από τον μυελό των οστών. Ο αριθμός των λευκών συνήθως επανέρχεται σε 2 με 3 εβδομάδες.
Χολοστατική (πιο συχνά εμφανιζόμενη με την μεθιμαζόλη) ή νεκρωτική (πιο συχνά εμφανιζόμενη με την προπυλθειουρακίλη) ηπατίτιδα είναι ακόμα μια σοβαρή αλλά σπάνια επιπλοκή των θειοναμιδών και η οποία σχετίζεται με σημαντική νοσηρότητα και καμιά φορά απαιτεί ακόμα και την μεταμόσχευση ήπατος.(R).
Αγγειίτιδα και ένα σύνδρομο προσομοιάζον με λύκο είναι ακόμα πιο σπάνια παρενέργεια. Στην περίπτωση εμφάνισης πολύ σοβαρών επιπλοκών θα πρέπει να αναζητηθούν άλλες εκτός των θειοναμιδών θεραπευτικές προσεγγίσεις για τη θυρεοτοξίκωση διότι οι θειοναμίδες παρουσιάζουν διασταυρούμενη αντίδραση και επομένως η αλλαγή από τη μια κατηγορία στην άλλη δεν εξασφαλίζει τη μη εμφάνιση εκ νέου των παρενεργειών αυτών.
8.3. Θεραπεία με ραδιενεργό ιώδιο
Όπως έχει ήδη αναφερθεί, ο στόχος της θεραπείας της νόσου Graves’ είναι αφενός η ταχεία βελτίωση των συμπτωμάτων του υπερθυρεοειδισμού (β-blockers) και αφετέρου η καταστολή της υπερπαραγωγής των θυρεοειδικών ορμονών από τον αδένα (χορήγηση των θειοναμιδών, ραδιενεργού ιωδίου ή θυρεοειδεκτομή).
Τα ραδιενεργά ισότοπα του ιωδίου χρησιμοποιούνται για τη θεραπεία της νόσου Graves’ ήδη από τη δεκαετία του 1940. Μεταξύ των ραδιενεργών ισοτόπων του ιωδίου, το Ι131 είναι το ισότοπο εκλογής για τη θεραπεία του υπερθυρεοειδισμού. Το 1131 χορηγείται σε μορφή πόσιμης κάψουλας ή πόσιμου διαλύματος. Απορροφάται ταχέως από το στομάχι , προσλαμβάνεται από το θυρεοειδικό ιστό και η β-ακτινοβολία του προκαλεί εκτεταμένη ιστική βλάβη. Το πρώιμο αποτέλεσμα είναι η νέκρωση των θυλακικών κυττάρων και η απόφραξη των αγγείων, φαινόμενο που ολοκληρώνεται σε διάστημα εβδομάδων ή μηνών. Επομένως η αναστολή της θυρεοειδκής λειτουργίας αναμένεται σε 6-18 εβδομάδες. Τα απώτερα αποτελέσματα της ακτινοβόλησης με Ι131 είναι η ατροφία και η ίνωση του θυρεοειδή και η χρόνια φλεγμονώδης αντίδραση που προσομοιάζει με αυτήν της θυρεοειδίτιδας Hashimoto. Τα απώτερα αυτά φαινόμενα ευθύνονται για την ανάπτυξη του υποθυρεοειδισμού ακόμα και έτη μετά τη χορήγηση του Ι131. (59)
Το ραδιενεργό ιώδιο χρησιμοποιείται ευρέως στις ΗΠΑ για τη θεραπεία τόσο του αυτοάνοσου υπερθυρεοειδισμού (ν.Graves’) όσο και των υπόλοιπων μορφών υπερθυρεοειδισμού (τοξικό αδένωμα, πολυοζώδης τοξική βρογχοκήλη). Έρευνα του 1991 διαπίστωσε ότι σε μια υποθετική περίπτωση νόσου Graves’ το 69% των ενδοκρινολόγων που ασχολούνται με τις θυρεοειδικές παθήσεις στη Βόρεια Αμερική θα επέλεγε το ραδιενεργό ιώδιο ως θεραπεία εκλογής σε αντιδιαστολή με το 22% και το 11% των ευρωπαίων και των ιαπώνων συναδέρφων τους (60).
Στόχος της θεραπείας με ραδιενεργό ιώδιο. Πρωταρχικός στόχος της χορήγησης του ραδιενεργού ιωδίου στη νόσο του Graves’ είναι η καταστροφή αρκετού θυρεοειδικού ιστού ώστε να επέλθει η θεραπεία του υπερθυρεοειδισμού, με μια μόνο δόση Ι131. Τρεις είναι οι πιθανές καταλήξεις μετά τη χορήγηση Ι131.
- Μετακτινική επίτευξη ευθυρεοειδισμού για το υπόλοιπο της ζωής του ασθενούς. Παλαιότερα αυτή η έκβαση θεωρούνταν το ιδανικό σενάριο. Κάτι τέτοιο δεν υποστηρίζεται πλέον, ειδικά σε ασθενείς με προυπάρχουσα οφθαλμοπάθεια στους οποίους το ευκταίο είναι η κατά το δυνατό μεγαλύτερη καταστροφή των θυρεοειδικών αντιγόνων.
- Ο ασθενής να παραμένει θυρεοτοξικός. Στην περίπτωση αυτή έχουμε αστοχία της θεραπείας και θα χρειαστεί επαναχορήγηση Ι131 σε δεύτερο χρόνο.
- Ανάπτυξη μόνιμου μετακτινικού υποθυρεοειδισμού. Στις μέρες μας, η έκβαση αυτή θεωρείται ως η αποδεκτή κατάληξη της χορήγησης Ι 131 και αυτό γιατί η διόρθωση του υποθυρεοειδισμού είναι εύκολη, ασφαλής και φθηνή ενώ ταυτόχρονα εκλείπει ο κίνδυνος υποτροπής της Graves’ ή εμφάνισης/επιδείνωσης της οφθαλμοπάθειας.
Ενδείξεις. Νόσος Graves’, τοξικό αδένωμα, πολυοζώδης τοξική βρογχοκήλη.
Ραδιενεργό ιώδιο και θειοναμίδες. Το ραδιενεργό ιώδιο μπορεί να χορηγηθεί ως πρώτη θεραπεία στη νόσο Graves’ ειδικά αν οι β-blockers αντιμετωπίζουν ικανοποιητικά τα συμπτώματα της θυρεοτοξίκωσης. Η πρακτική αυτή ακολουθείται κυρίως στις ΗΠΑ. Στη χώρα μας οι περισσότεροι ασθενείς λαμβάνουν θεραπεία με θειοναμίδες πριν από τη χορήγηση του Ι131.
Οι θειοναμίδες πλεονεκτούν του Ι 131σε μερικά σημεία. Η μεθιμαζόλη επαναφέρει τη θυρεοειδική λειτουργία στο φυσιολογικό ταχύτερα από το ραδιενεργό ιώδιο (61,62). Η επιτυχής θεραπεία του υπερθυρεοειδισμού επετεύχθη στο 97% των ασθενών που έλαβαν μεθιμαζόλη μετά από 12 βδομάδες ενώ το 14% των ασθενών που έλαβαν ραδιενεργό ιώδιο χρειάστηκαν και δεύτερη δόση (63,64). Τέλος, υπάρχει η πιθανότητα παροδικής επιδείνωσης του υπερθυρεοειδισμού μετακτινικά, γεγονός που μπορεί να προληφθεί με τη χορήγηση θειοναμιδών πριν τη χορήγηση ραδιενεργού ιωδίου.
Δεν πρέπει να ξεχνάμε ότι η χορήγηση των θειοναμιδών προκαλεί μια μέτριου βαθμού ακτινοαντίσταση με αποτέλεσμα να αυξάνει η πιθανότητα αστοχίας της θεραπείας με Ι131.
Η θεραπεία με θειοναμίδες πριν τη χορήγηση ραδιενεργού ιωδίου ενδείκνυται στις εξής κατηγορίες ασθενών:
- ηλικιωμένοι και ειδικά όσοι έχουν άλλες ασθένειες όπως στεφανιαία νόσο.
- ασθενείς με έντονο υπερθυροειδισμό και έντονα συμπτώματα.
Δεν υπάρχει συμφωνία στο πότε πρέπει να γίνει διακοπή των θειοναμιδών σε σχέση με τη χορήγηση του Ι131. Τα περισσότερα κέντρα συμφωνούν στη διακοπή 3-8 μέρες πριν τη χορήγηση του Ι131, επανέναρξη 3 μέρες μετά και σταδιακή διακοπή σε διάστημα 4-18 εβδομάδων ανάλογα με τα αποτελέσματα των εργαστηριακών εξετάσεων και το βαθμό μείωσης του μεγέθους του αδένα.
Αντενδείξεις.
- Εγκυμοσύνη/Γαλουχία. Τόσο η εγκυμοσύνη όσο και η περίοδος της γαλουχίας αποτελούν απόλυτη αντένδειξη για τη χορήγηση Ι131. Είναι απαραίτητος ο αποκλεισμός πιθανής κύησης κατά τη χορήγηση του ραδιενεργού ιωδίου. Ο εμβρυικός θυρεοειδής αρχίζει να παράγει ορμόνες από την 10η με 12η εμβρυϊκή εβδομάδα και επομένως το 1131 θα κατέστρεφε τον εμβρυικό θυρεοειδή και θα οδηγούσε σε κρετινισμό. Στην περίπτωση της ακούσιας λήψης ραδιενεργού ιωδίου από έγκυο υπάρχει η πιθανότητα το νεογνό να είναι ευθυρεοειδικό, υπερθυρεοειδικό (65) ή και υποθυρεοειδικό (66) και θα πρέπει μετά τον τοκετό να λαμβάνονται όλα τα απαραίτητα μέτρα προς όλες τις κατεύθυνσεις . Εναλλακτικά , μπορεί να γίνει έλεγχος της θυρεοειδικής λειτουργίας του εμβρύου την 20η εβδομάδα της κύησης με καθετηριασμό της ομφαλικής φλέβας.
- Παιδική και εφηβική ηλικία. Το ατύχημα στο Τσερνόμπιλ έδειξε ότι ο νεογνικός θυρεοειδής είναι επιρρεπής στην ανάπτυξη καρκίνου μετά από έκθεση του αδένα στα ραδιοισότοπα (68, 69). Βέβαια οι έρευνες αυτές έγιναν σε παιδιά που εκτέθηκαν σε μεγάλες ποσότητες και για μεγάλη διάρκεια σε ραδιοισότοπα του ιωδίου και επομένως δεν μπορούν να εξαχθούν ασφαλή συμπεράσματα και για τη χορήγηση 1131 για τη θεραπεία της Graves’ στα παιδιά. Σε κάθε περίπτωση και κυρίως λόγω της αβεβαιότητας ανάπτυξης καρκίνου στα υπόλοιπα πλην του θυρεοειδή όργανα δε συνιστάται η χορήγηση ραδιενεργού ιωδίου σε άτομα κάτω των 16-18 ετών.
- Οφθαλμοπάθεια Graves‘. Φαίνεται ότι η χορήγηση Ι131 μπορεί να προκαλέσει την ανάπτυξη ή την επιδείνωση μιας ήδη υπάρχουσας οφθαλμοπάθειας Graves’. Συνήθως οι μεταβολές που προκαλούνται είναι ήπιες και αναστρέψιμες, ειδικά σε περιπτώσεις ασθενών με ήπια οφθαλμοπάθεια Graves’. Παρόλα αυτά, συνιστάται η χορήγηση γλυκοκορτικοειδών για την πρόληψη πιθανής επιδείνωσης της οφθαλμοπάθειας. Το 1998 δημοσιεύθηκε στο NEJM έρευνα στην οποία μελετήθηκαν 443 ασθενείς με νόσο Graves’ χωρίς ή με ήπια οφθαλμοπάθεια. Σε όλους χορηγήθηκε ραδιενεργό ιώδιο σε δόση που υπολογίστηκε με δόση-πλάνο μεταξύ 120-150μCi (βλ. παράγραφο δόση). Οι ασθενείς χωρίστηκαν σε 3 ομάδες: οι ασθενείς της πρώτης ομάδας έλαβαν μόνον ιώδιο, στους ασθενείς της δεύτερης ομάδας χορηγήθηκε μετακτινικά πρεδνιζόνη για 3 μήνες συνολικά και στους ασθενείς της τρίτης ομάδας χορηγήθηκε μετακτινικά μεθιμαζόλη για 18 μήνες. Δεκαπέντε τοις εκατό της πρώτης ομάδας, 0%της δεύτερης και 2% της τρίτης εμφάνισαν ή επιδείνωσαν οφθαλμοπάθεια Graves’ (69) (Εικόνα 2). Όποτε χρειαστεί επομένως η χορήγηση γλυκοκορτικοειδούς συνιστάται το παρακάτω σχήμα: δόση πρεδνιζόνης 0.4-0.5mg/kg βάρους σώματος, έναρξη 2-3 μέρες μετά τη χορήγηση του ιωδίου, σταθερή δόση για ένα μήνα και σταδιακή διακοπή (tappering) για τους επόμενους 2 μήνες. Η κατάσταση είναι διαφορετική στις περιπτώσεις μέτριας ή σοβαρής οφθαλμοπάθεια Graves’, στις οποίες οι περισσότεροι ειδικοί είτε δε χορηγούν ραδιενεργό ιώδιο ή (εάν χορηγήσουν) συγχορηγούν οπωσδήποτε γλυκοκορτικοειδή. Μια άλλη προσέγγιση στις περιπτώσεις αυτές είναι η αναμονή για ένα έτος και αν η οφθαλμοπάθεια παραμένει σταθερή επανέξεταση της απόφασης για χορήγηση του ραδιενεργού ιωδίου. Η σοβαρή οφθαλμοπάθεια Graves’ αποτελεί για πολλούς ενδοκρινολόγους αν όχι απόλυτη, σχετική αντένδειξη χορήγησης ραδιενεργού ιωδίου.
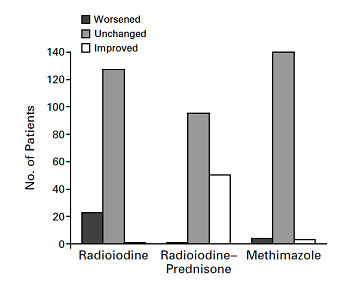
Εικόνα 1. Αλλαγές στο βαθμό οφθαλμοπάθειας σε ασθενείς με υπερθυρεοειδισμό που έλαβαν θεραπεία με ραδιενεργό ιώδιο, ραδιενεργό ιώδιο και πρεδνιζόνη και μεθιμαζόλη (69).
Δόση. Έχει βρεθεί ότι η δόση του ραδιενεργού ιωδίου σχετίζεται άμεσα τόσο με το βαθμό ίασης της νόσου Graves’ όσο όμως και με την εμφάνιση υποθυρεοειδισμού αργότερα (63,70). Επομένως, συνήθως η δόση που θα επιτύχει ίαση του υπερθυρεοειδισμού θα οδηγήσει και σε υποθυρεοειδισμό και έτσι οι χαμηλές δόσεις ραδιενεργού ιωδίου ενέχουν μεγάλη πιθανότητα αστοχίας της θεραπείας και ανάγκης επαναχορήγησης ραδιενεργού ιωδίου σε διάστημα 6-24 μηνών (71,72). Η συνολική επίπτωση του μετακτινικού υποθυρεοειδισμού προσεγγίζει το 40% στην 5ετία και το 60% ή και περισσότερο στη 10ετία. Επομένως μόνο περίπου το 1/3 των ασθενών θα παραμείνουν ευθυρεοειδικοί στη 10ετία από τη χορήγηση (73).
Από την άλλη πλευρά μεγαλές δόσεις ραδιενεργού ιωδίου δε σημαίνει απαραίτητα και μεγαλύτερος βαθμός επίτευξης ίασης. Μεγάλες δόσεις συνήθως χρειάζονται ασθενείς με αστοχία κατά την πρώτη χορήγηση, ασθενείς με μεγάλη βρογχοκήλη και ασθενείς που έχουν λάβει αντιθυρεοειδικά φάρμακα και έχουν αναπτύξει ραδιοαντίσταση.
Η κατάλληλη δόση I131 εξατομικεύεται. Παράγοντες που διαδραματίζουν ρόλο στον υπολογισμό της δόσης είναι η ηλικία, τα επίπεδα της θυροξίνης στο αίμα, η προηγούμενη χρήση αντιθυρεοειδικών φαρμάκων, η πρόσληψη ιωδίου με τη διατροφή. Οι πιο σημαντικοί όμως παράγοντες είναι το μέγεθος του αδένα και η 24ωρη πρόσληψη του ραδιενεργού ιωδίου (radioactive iodine uptake, RAIU). Μια σταθερή δόση μεταξύ 10-15mCi ανάλογα με το μέγεθος του αδένα συνήθως είναι αρκετή για τη θεραπεία του υπερθυρεοειδισμού από νόσο Graves’.
Υπάρχει η δυνατότητα υπολογισμού της δόσης με βάση τον τύπο:
Δόση ραδιεν. ιωδίου (mCi) = (μέγεθος αδένα (gr) X δόση-πλάνο (μCi/gr)) / (uptake) Χ 1000
Το μειονέκτημα του υπολογισμού της δόσης είναι η απαραίτητη μέτρηση του RAIU γεγονός που επιβαρύνει τον ασθενή σε χρόνο, ταλαιπωρία και έξοδα. Από την άλλη μεριά η μέτρηση του RAIU θα σιγουρέψει τη διάγνωση και θα ελαχιστοποιήσει την πιθανότητα αστοχίας σε ασθενείς που έχουν μεγάλη βρογχοκήλη και χαμηλό RAIU. Η δόση-πλάνο διαφοροποιείται στα διάφορα κέντρα και κυμαίνεται από 80 ως 200μCi/g Με τη χορήγηση ως δόσης-πλάνο από 150-200 μCi/g θα επιτευχθεί θεραπεία στο περίπου το 70% των ασθενών, το 25% θα χρειαστεί δεύτερη δόση και οι υπόλοιποι ίσως χρειαστούν τρίτη ή και τέταρτη δόση Ι131.
Προσοχή πρέπει να δοθεί στους ασθενείς σε αιμοκάθαρση καθώς είναι γνωστό ότι το ιώδιο αποβάλλεται από τα ούρα. Οι δόσεις του ραδιενεργού ιωδίου που χορηγούνται στις περιπτώσεις Graves’ είναι σχετικά χαμηλές συγκρινόμενες με τις δόσεις του θεραπευτικού ραδιενεργού ιωδίου που χορηγούνται στον καρκίνο του θυρεοειδούς. Επομένως ελάχιστο ποσοστό του ραδιενεργού ιωδίου απομένει για να αποβληθεί από τα ούρα καθώς το περισσότερο έχει προσληφθεί στον θυρεοειδικό ιστό. Σε κάθε περίπτωση αιμοκάθαρση είναι απαραίτητη στη χρονική στιγμή της μέγιστης πρόσληψης του ραδιενεργού ιωδίου από το θυρεοειδή, δηλαδή περίπου 10 ώρες από τη χορήγηση του.
Παρενέργειες / Ασφάλεια. Βραχυπρόθεσμες: Οφθαλμοπάθεια Graves’ (βλ. αντενδείξεις) και Μετακτινική οξεία θυρεοειδίτιδα. Η τελευταία εμφανίζεται σπάνια με χαρακτηριστικό πόνο στον τράχηλο και στην κατάποση 3-4 μέρες μετακτινικά και μπορεί να θεραπευτεί με αντιφλεγμονώδη φάρμακα. Η καταστροφή του θυρεοειδή από το Ι131 έχει ως αποτέλεσμα την απελευθέρωση των αποθηκευμένων στον αδένα θυρεοειδκών ορμονών και την εμφάνιση συμπτωμάτων θυρεοτοξίκωσης εβδομάδες μετά τη χορήγηση του Ι131. Η πρόληψη του φαινόμενου μπορεί να γίνει με τη χορήγηση θειοναμιδών μερικούς μήνες πριν και τη διακοπή τους 3-8 μέρες μετά τη χορήγηση Ι131.
Μακροπρόθεσμες: Η χορήγηση ραδιενεργού ιωδίου ήγειρε πάντοτε ερωτήματα για τη πιθανή καρκινογενετική δράση του I131. Καμία συσχέτιση μεταξύ θεραπείας με ραδιενεργό ιώδιο για υπερθυρεοειδισμό και καρκίνο του θυρεοειδούς δεν έχει βρεθεί σε μεγάλες επιδημιολογικές μελέτες (73). Παρομοίως, δεν έχει βρεθεί αυξημένος κίνδυνος για λευχαιμία ή για συμπαγής όγκους (73). Μια μόνο έρευνα από τη Σουηδία διαπίστωσε μια μικρή αύξηση του κινδύνου για καρκίνο του στομάχου στη 10ετία (74), ευρήματα όμως που δεν επιβεβαιώθηκαν σε μεγάλες επιδημιολογικές μελέτες στο Ηνωμένο Βασίλειο (73) ή στις ΗΠΑ (75). Δεν έχουν επίσης βρεθεί γενετικές ανωμαλίες σε απογόνους ασθενών που έλαβαν I131 (76) ή χρωμοσωμικές βλάβες σε παιδιά και εφήβους (77). Η εμπειρία άνω των 50 ετών στη χορήγηση Ι131 έχει δείξει ότι οι πιθανοί απώτεροι κίνδυνοι είναι αμελητέοι αν όχι ανύπαρκτοι.
Παρακολούθηση. Μετά τη χορήγηση του Ι131 οι ασθενείς πρέπει να παρακολουθούνται για την πιθανότητα είτε ανάπτυξης υποθυρεοειδισμού είτε εμμονής ή υποτροπής της Graves’. Υποθυρεοειδισμός που αναπτύσσεται στον πρώτο χρόνο μετακτινικά ενδέχεται να είναι παροδικός. Παρόλα αυτά η πλειοψηφία αυτών των ασθενών θα αναπτύξουν μόνιμο υποθυρεοειδισμό στα επόμενα 2 με 11 χρόνια.
Από όσους γίνουν ευθυρεοειδικοί άμεσα μετακτινικά, οι περισσότεροι θα αναπτύξουν υποθυρεοειδισμό με ένα ρυθμό 2-3% κατά έτος λόγω της χρόνιας φλεγμονώδους αντίδρασης (βλ. παραπάνω). Κάποιοι θα εμφανίσουν υποτροπή της Graves’ λόγω της διέγερσης των υπολειμμάτων του θυρεοειδή από τα TSHRAbs.
Έξι με οκτώ βδομάδες μετακτινικά είναι απαραίτητη η μέτρηση της free T4 και στη συνέχεια, ανάλογα με το αποτέλεσμα και το μέγεθος του θυρεοειδή, κάθε τέσσερις με έξι βδομάδες. Η μέτρηση της TSH ενδέχεται να οδηγήσει σε εσφαλμένα συμπεράσματα καθώς μπορεί να παραμείνει κατεσταλμένη για βδομάδες ή ακόμα και μήνες παρόλο που ο ασθενής θα είναι ευ- ή ακόμα και υποθυρεοειδικός (78,79). Στην περίπτωση ανέρευσης χαμηλής fT4 και χαμηλής TSH, είναι απαραίτητη η μέτρηση της Τ3 για να διαφοροδιαγνωστεί εμμένων υπερθυρεοειδισμός (υψηλή Τ3) ή παροδικός κεντρικός υποθυρεοειδισμός (Τ3 φυσιολογική ή χαμηλή) σχετιζόμενος με αργή αποκάτασταση του άξονα υποθαλάμου-υπόφυσης-θυρεοειδή. Αργότερα, η μέτρηση μόνο της TSH κάθε 6-12 μήνες είναι αρκετή.
8.4. Θυρεοειδεκτομή
Και η θυρεοειδεκτομή θα πρέπει να έχει ως στόχο την αποκατάσταση της έκκρισης θυρεοειδικών ορμονών σε φυσιολογικά επίπεδα και την πρόληψη της υποτροπής της νόσου Graves’. Η μερική θυρεοειδεκτομή μπορεί να πετύχει τον πρώτο στόχο αλλά δεν εξαλείφει τον κίνδυνο μιας μελλοντικής υποτροπής. Η σχεδόν ολική θυρεοειδεκτομή μειώνει δραματικά τον κίνδυνο μελλοντικής υποτροπής αλλά παρουσιάζει φυσικά μεγαλύτερη πιθανότητα ανάπτυξης μετεγχειρητικού υποθυρεοειδισμού. Το ίδιο ισχύει και για την ολική θυρεοειδεκτομή, η οποία όμως έχει ως επιπλέον πλεονέκτημα την θεωρητική αφαίρεση όλων των θυρεοειδικών αυτοαντιγόνων γεγονός που επιδρά θετικά στην εξέλιξη και θεραπεία μιας υπάρχουσας οφθαλμοπάθειας Graves’.
Η προεγχειρητική προετοιμασία του υπερθυρεοειδικού ασθενή είναι εκ των ουκ άνευ. Όταν υπάρχει η πολυτέλεια του χρόνου συνιστάται η θεραπεία με θειοναμίδες ούτως ώστε ο ασθενής να γίνει ευθυρεοειδικός και επιπλέον οι ενδοθυρεοειδικές ορμονικές αποθήκες να αδειάσουν και να αποφευχθεί μια πιθανή θυρεοτοξική κρίση λόγω διεγχειρητικής απελευθέρωσης των θυρεοειδικών ορμονών. Στις περιπτώσεις επείγοντος χειρουργείου όταν για παράδειγμα ο ασθενής είναι έντονα υπερθυρεοειδικός και παρουσιάζει μειωμένη ανεκτικότητα στις θειοναμίδες ή όταν δεν δύναται να συμμορφωθεί με την χορήγηση των θειοναμιδών, συνιστάται η προεγχειρητική χορήγηση ιωδίου για δέκα μέρες ή η συγχορήγηση προπανολόλης και ιωδίου. Σε εξαιρετικά επείγουσες περιπτώσεις η χορήγηση από του στόματος χολοκυστογραφικών παραγόντων είναι ο ταχύτερος τρόπος για την επίτευξη ευθυρεοειδισμού.
Η θυρεοειδεκτομή σε ασθενείς με νόσο Graves’ εκτός από τις γνωστές επιπλοκές (τραυματισμός λαρυγγικού νεύρου, υποπαραθυρεοειδισμός, αιμορραγία) ενέχει τον κίνδυνο της θυρεοτοξικής κρίσης, κάτι που στις μέρες μας συναντάται σπάνια . Μετεγχειρητικά στις περιπτώσεις της σχεδόν ολικής θυρεοειδεκτομής και της ολικής θυρεοειδεκτομής η ανάπτυξη μετεγχειρητικού υποθυρεοειδισμού είναι αναμενόμενη επιπλοκή η οποία όμως θεραπεύεται εύκολα και οικονομικά με τη χορήγηση λεβοθυροξίνης. Στις περιπτώσεις που μετεγχειρητικά έχει απομείνει θυρεοειδικό υπόλειμμα υπάρχει πάντα η πιθανότητα υποτροπής του υπερθυρεοειδισμού και για το λόγο αυτό οι ασθενείς αυτοί θα πρέπει να έχουν τακτική παρακολούθηση.
Βιβλιογραφία
1. Jacobson DL, Gange SJ, Rose NR, et al: Epidemiology and estimated population burden of selected autoimmune diseases in the United States. Clin Immunol Immunopathol 1997;; 84:223-243.
2. Barker DJP, Phillips DIW: Current incidence of thyrotoxicosis and past prevalence of goitre in 12 British towns. Lancet 1984;; 2:567-570.
3. Brownlie BE, Wells JE: The epidemiology of thyrotoxicosis in New Zealand: incidence and geographical distribution in north Canterbury, 1983-1985. Clin Endocrinol Oxf 1990;; 33:249-259.
4. Bulow Pedersen I, Laurberg P, Knudsen N, et al: Increase in incidence of hyperthyroidism predominantly occurs in young people after iodine fortification of salt in Denmark. J Clin Endocrinol Metab 2006;; 91:3830–3834.2006
5. Burgi H, Kohler M, Morselli B: Thyrotoxicosis incidence in Switzerland and benefit of improved iodine supply.Lancet 1998;; 352:1034.
6. Laurberg P, Jorgensen T, Perrild H, et al: The Danish investigation on iodine intake and thyroid disease, DanThyr: status and perspectives. Eur J Endocrinol 2006;; 155:219-228.
7. Lundgren E, Christensen Borup S: Decreasing incidence of thyrotoxicosis in an endemic goitre inland area of Sweden. Clin Endocrinol 1990;; 33:133-138.
8. Laurberg P, Pedersen KM, Vestergaard H, et al: High incidence of multinodular toxic goitre in the elderly population in a low iodine intake area vs. high incidence of Graves’ disease in the young in a high iodine intake area: comparative surveys of thyrotoxicosis epidemiology in East-Jutland Denmark and Iceland. J Intern Med 1991;; 229:415-420.
9. Furszyfer J, Kurland LT, McConahey WM, et al: Epidemiologic aspects of Hashimoto’s thyroiditis and Graves’ disease in Rochester Minnesota (1935-1967), with special reference to temporal trends. Metabolism 1972;; 21:197-204
10. Aghini-Lombardi F, Antonangeli L, Martino E, et al: The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. J Clin Endocrinol Metab 1999;; 84:561-566.
11. Tunbridge W, Evered DC, Hall R, et al: The spectrum of thyroid disease in a community: the Whickham survey. Clin Endocrinol Oxf 1977;; 7:481-493.
12. Vanderpump MP, Tunbridge WM, French JM, et al: The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol Oxf 1995;; 43:55-68.
13. Abraham-Nordling M, Torring O, Lantz M, et al: Incidence of hyperthyroidism in Stockholm, Sweden, 2003¬2005. Eur J Endocrinol 2008;; 158:823-827.
14. Brix TH, Christensen K, Niels VH, et al: Genetic versus environment in Graves’ disease—a population based twin study. Thyroid 1997;; 7(suppl):13.
15. Jacobson EM, Tomer Y: The genetic basis of thyroid autoimmunity. Thyroid 2007;; 17:949-961.
16. Prummel MF, Strieder T, Wiersinga WM: The environment and autoimmune thyroid diseases. Eur J Endocrinol 2004;; 150:605-618.
17. Bagnasco M, Bossert I, Pesce G: Stress and autoimmune thyroid diseases. Neuroimmunomodulation 2007;; 13:309-317.2006.
18. Chiovato L, Pinchera A: Stressful life events and Graves’ disease. Eur J Endocrinol 1996;; 134:680-682.
19. Dayan CM: Stressful life events and Graves’ disease revisited. Clin Endocrinol 2001;; 55:15-19.
20. Mizokami T, Wu Li A, El-Kaissi S, et al: Stress and thyroid autoimmunity. Thyroid 2004;; 14:1047-1055.
21. Amino N, Tada H, Hidaka Y: Postpartum autoimmune thyroid syndrome: a model of aggravation of autoimmune disease. Thyroid 1999;; 9:705-713.
22. Fountoulakis S, Tsatsoulis A: On the pathogenesis of autoimmune thyroid disease: a unifying hypothesis. Clinical Endocrinology 2004; 60;4:397-409.
23. Rotondi M, Pirali B, Lodigiani S, et al: The postpartum period and the onset of Graves’ disease: an overestimated risk factor. Eur J Endocrinol 2008;; 159:161-165.
24. Tada H, Mizuta I, Takano T, Tatsumi K, Izumi Y, Hidaka Y, et al. Blocking-type anti-TSH receptor antibodies and relation to responsiveness to antithyroid drug therapy and remission in Graves’ disease. Clin Endocrinol2003;58:403-8.
25. Davies TF, Ando T, Lin RY, et al: Thyrotropin receptor-associated diseases: from adenomata to Graves disease. J Clin Invest 2005;; 115:1972-1983.
26. Rapoport B, Chazenbalk GD, Jaume JC, et al: The thyrotropin (TSH) receptor: interaction with TSH and autoantibodies. Endocr Rev 1998;; 19:673-716.
27. Rapoport B, McLachlan SM: The thyrotropin receptor in Graves’ disease. Thyroid 2007;; 17:911-922.
28. Rees Smith B, McLachlan SM, Furmaniak J: Autoantibodies to the thyrotropin receptor. Endocr Rev 1988;; 9:106-121.
29. Massart, C., Hody, B., Mouchel, L., Edan, G. & Nicol, M.: Assays for thyrotropin-receptor binding and thyroid-stimulating antibodies in sera from patients with Graves’ disease. Clinical Chemistry 1986 ;32, 1332-1335.
30. Costagliola S, Morgenthaler NG, Hoermann R, et al: Second generation assay for thyrotropin receptor antibodies has superior diagnostic sensitivity for Graves’ disease. J Clin Endocrinol Metab 1999;; 84:90-97.
31. Vos XG, Smit N, Endert E, Tijssen JG, Wiersinga WM. Frequency and characteristics of TBII-seronegative patients in a population with untreated Graves’ hyperthyroidism: a prospective study. Clin Endocrinol 2008;69: 311-317.
32. Sugenoya A, Kobayashi S, Kasuga Y, et al: Evidence of intrathyroidal accumulation of TSH receptor antibody in Graves’ disease. Acta Endocrinol (Copenh) 1992;; 126:416-418.
33. Effraimidis G , Strieder TG , Tijssen JG , Wiersinga WM: Natural history of the transition from euthyroidism to overt autoimmune hypo- or hyperthyroidism: a prospective study. Eur J Endocrinol 2011;164:107-113
34. Henderson JM, Portmann L, Van Melle G, et al: Propranolol as an adjunct therapy for hyperthyroid tremor. Eur Neurol 1997;; 37:182-185.
35. Wiersinga WM, Touber JL. The influence of beta-adrenoceptor blocking agents on plasma thyroxine and triiodothyronine. J Clin Endocrinol Metab 1977;; 45:293.
36. Sherif IH, Oyan WT, Bosairi S, Carrascal SM. Treatment of hyperthyroidism in pregnancy. Acta Obstet Gynecol Scand 1991;; 70:461.
37. Hedley AJ, Young RE, Jones SJ, et al: Antithyroid drugs in the treatment of hyperthyroidism of Graves’ disease: long-term follow-up of 434 patients. Scottish Automated Follow-Up Register Group. Clin Endocrinol Oxf 1989;; 31:209-218.
38. Kaguelidou F, Alberti C, Castanet M, et al. Predictors of autoimmune hyperthyroidism relapse in children after discontinuation of antithyroid drug treatment. J Clin Endocrinol Metab 2008;; 93:3817.
39. Schleusener H, Schwander J, Fischer C, et al: Prospective multicentre study on the prediction of relapse after antithyroid drug treatment in patients with Graves’ disease [published erratum appears in Acta Endocrinol (Copenh) 1989 Aug;;121(2):304]. Acta Endocrinol Copenh 1989;; 120:689-701.
40. Vitti P, Rago T, Chiovato L, et al: Clinical features of patients with Graves’ disease undergoing remission after antithyroid drug treatment. Thyroid 1997;; 7:369-375.
41. Solomon BL, Evaul JE, Burman KD, et al: Remission rates with antithyroid drug therapy: continuing influence of iodine intake?. Ann Intern Med 1987;; 107:510-512.
42. Wartofsky L: Low remission after therapy for Graves disease. Possible relation of dietary iodine with antithyroid therapy results. JAMA 1973;; 226:1083-1088.
43. Codaccioni JL, Orgiazzi J, Blanc P, et al. Lasting remissions in patients treated for Graves’ hyperthyroidism with propranolol alone: a pattern of spontaneous evolution of the disease. J Clin Endocrinol Metab 1988;;67:656.
44. Allahabadia A, Daykin J, Holder RL, et al. Age and gender predict the outcome of treatment for Graves’ hyperthyroidism. J Clin Endocrinol Metab 2000;; 85:1038.
45. Leger J, Gelwane G, Kaguelidou F, et al. Positive impact of long-term antithyroid drug treatment on the outcome of children with Graves’ disease: national long-term cohort study. J Clin Endocrinol Metab 2012;; 97:110.
46. Lippe BM, Landaw EM, Kaplan SA. Hyperthyroidism in children treated with long term medical therapy: twenty-five percent remission every two years. J Clin Endocrinol Metab 1987;; 64:1241.
47. Glinoer D, de Nayer P, Bex M, Belgian Collaborative Study Group on Graves’ Disease. Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves’ hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study. Eur J Endocrinol 2001;;144:475.
48. Eckstein AK, Lax H, Losch C, et al. Patients with severe Graves’ ophthalmopathy have a higher risk of relapsing hyperthyroidism and are unlikely to remain in remission. Clin Endocrinol (Oxf) 2007;; 67:607.
49. Jacobson EM, Huber A, Tomer Y: The HLA gene complex in thyroid autoimmunity: from epidemiology to etiology. J Autoimmun 2008;; 30:58-62.
50. Feldt-Rasmussen U, Schleusener H, Carayon P: Meta-analysis evaluation of the impact of thyrotropin receptor antibodies on long term remission after medical therapy of Graves’ disease. J Clin Endocrinol Metab 1994;; 78:98-102.
51. Lamberg BA, Salmi J, Wagar G, et al: Spontaneous hypothyroidism after antithyroid treatment of hyperthyroid Graves’ disease. J Endocrinol Invest 1981;; 4:399-402.
52. Takamatsu J, Hosoya T, Naito N, et al. Enhanced thyroid iodine metabolism in patients with triiodothyronine-¬predominant Graves’ disease. J Clin Endocrinol Metab 1988;; 66:147.
53. Ross DS, Daniels GH, Gouveia D. The use and limitations of a chemiluminescent thyrotropin assay as a single thyroid function test in an out-patient endocrine clinic. J Clin Endocrinol Metab 1990;; 71:764.
54. Hashizume K, Ichikawa K, Sakurai A, et al: Administration of thyroxine in treated Graves’ disease—effects on the level of antibodies to thyroid stimulating hormone receptors and on the risk of recurrence of hyperthyroidism. N Engl J Med 1991;; 324:947-953.
55. Bahn Chair RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011;; 21:593.
56. Chen JJ, Ladenson PW. Discordant hypothyroxinemia and hypertriiodothyroninemia in treated patients with hyperthyroid Graves’ disease. J Clin Endocrinol Metab 1986;; 63:102.
57. Cooper DS: Antithyroid drugs. N Engl J Med 1984;; 311:1353-1362.Review
58. Romaldini JH, Werner MC, Bromberg N, et al: Adverse effects related to antithyroid drugs and their dose regimen. Exp Clin Endocrinol 1991;; 97:261-264.
59. Dobyns BM, Vickery AL, Maloof F, et al: Functional and histologic effects of therapeutic doses of radioiodine therapy for hyperthyroidism. J Clin Endcrinol Metab 1953;; 13:548.
60. Wartofsky L, Glinoer D, Solomon B, et al. Differences and similarities in the diagnosis and treatment of Graves’ disease in Europe, Japan, and the United States. Thyroid 1991;; 1:129.
61. Okamura K, Ikenoue H, Shiroozu A, et al. Reevaluation of the effects of methylmercaptoimidazole and propylthiouracil in patients with Graves’ hyperthyroidism. J Clin Endocrinol Metab 1987;; 65:719.
62. Ross DS, Daniels GH, De Stefano P, et al. Use of adjunctive potassium iodide after radioactive iodine (131I) treatment of Graves’ hyperthyroidism. J Clin Endocrinol Metab 1983;; 57:250.
63. Alexander EK, Larsen PR. High dose of (131)1 therapy for the treatment of hyperthyroidism caused by Graves’ disease. J Clin Endocrinol Metab 2002;; 87:1073.
64. Nakamura H, Noh JY, Itoh K, et al. Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves’ disease. J Clin Endocrinol Metab 2007;; 92:2157.
65. Evans PM, Webster J, Evans WD, et al. Radioiodine treatment in unsuspected pregnancy. Clin Endocrinol (Oxf) 1998;; 48:281.
66. Berg GE, Nystrom EH, Jacobsson L, et al. Radioiodine treatment of hyperthyroidism in a pregnant women. J Nucl Med 1998;; 39:357.
67. Baverstock K, Egloff B, Pinchera A, et al: Thyroid cancer after Chernobyl. Nature 1992;; 359:21-22.
68. Pacini F, Vorontsova T, Demidchik EP, et al: Post-Chernobyl thyroid carcinoma in Belarus children and adolescents: comparison with naturally occurring thyroid carcinoma in Italy and France. J Clin Endocrinol Metab 1997;; 82:3563-3569.
69. Bartalena L, Marcocci C, Bogazzi F, et al. Relation between therapy for hyperthyroidism and the course of Graves’ ophthalmopathy. N Engl J Med 1998;; 338:73.
70. Allahabadia A, Daykin J, Sheppard MC, et al. Radioiodine treatment of hyperthyroidism-prognostic factors for outcome. J Clin Endocrinol Metab 2001;; 86:3611.
71. Goolden AW, Stewart JS. Long-term results from graded low dose radioactive iodine therapy for thyrotoxicosis. Clin Endocrinol (Oxf) 1986;; 24:217.
72. Rapoport B, Caplan R, DeGroot LJ. Low-dose sodium iodide I 131 therapy in Graves disease. JAMA 1973;; 224:1610.
73. Franklyn JA, Daykin J, Drolc Z, et al: Long-term follow-up of treatment of thyrotoxicosis by three different methods. Clin Endocrinol Oxf 1991;; 34:71-76.
74. Hall P, Holm LE: Late consequences of radioiodine for diagnosis and therapy in Sweden. Thyroid 1997;;7:205-208.
75. Ron E, Doody MM, Becker DV, et al: Cancer mortality following treatment for adult hyperthyroidism. Cooperative Thyrotoxicosis Therapy Follow-up Study Group. JAMA 1998;; 280:347-355
76. Graham GD, Burman KD: Radioiodine treatment of Graves’ disease. An assessment of its potential risks. Ann Intern Med 1986;; 105:900-905.
77. Federico G, Boni G, Fabiani B, et al: No evidence of chromosome damage in children and adolescents with differentiated thyroid carcinoma after receiving 131I radiometabolic therapy, as evaluated by micronucleus assay and microarray analysis. Eur J Nucl Med Mol Imaging 2008.
78. Davies PH, Franklyn JA, Daykin J, Sheppard MC. The significance of TSH values measured in a sensitive assay in the follow-up of hyperthyroid patients treated with radioiodine. J Clin Endocrinol Metab 1992;; 74:1189.
79. Uy HL, Reasner CA, Samuels MH. Pattern of recovery of the hypothalamic-pituitary-thyroid axis following radioactive iodine therapy in patients with Graves’ disease. Am J Med 1995;; 99:173.
80. Rotondi M, Cappelli C, Pirali B, et al: The effect of pregnancy on subsequent relapse from Graves’ disease following a successful course of anti-thyroid drug therapy. J Clin Endocrinol Metab 200
Created: October 25, 2014
Last update: October 25, 2014

