Μαργαρίτα Γκοτσίνα, Κώστας Β. Μάρκου
Ιατρικό Τμήμα Πανεπιστημίου Πατρών
Πρόλογος
Η ιωδοπενία, έχει πολλές δυσμενείς επιπτώσεις στον άνθρωπο, χαρακτηριζόμενες ως ιωδιοπενικές διαταραχές, εξαιτίας της ανεπαρκούς παραγωγής θυρεοειδικών ορμονών. Εκτιμάται ότι παγκοσμίως δυο δισεκατομμύρια άτομα έχουν ανεπαρκή πρόσληψη ιωδίου και ιδιαίτερα οι περιοχές της νότιας Ασίας και της Υποσαχάριας Αφρικής. Ωστόσο το 50% του πληθυσμού στην Ευρώπη παραμένει ήπια ιωδιοπενικό, και η πρόσληψη ιωδίου σε άλλες βιομηχανικές χώρες, συμπεριλαμβανομένου των Ηνωμένων Πολιτειών και της Αυστραλίας, έχουν μειωθεί κατά τα τελευταία έτη. Η έλλειψη ιωδίου στη διάρκεια της εγκυμοσύνης και τη βρεφική ηλικία, ίσως επηρεάσει την σωματική ανάπτυξη και νευροανάπτυξη του απογόνου και αυξάνει τη θνησιμότητα του βρέφους. Η έλλειψη ιωδίου στη διάρκεια της παιδικής ηλικίας μειώνει τη σωματική ανάπτυξη, τη πνευματική και κινητική λειτουργία. Οι μέθοδοι εκτίμησης της ιωδοπενίας συμπεριλαμβάνουν τη μέτρηση της συγκέντρωσης του ιωδίου στα ούρα, το βαθμό της βρογχοκήλης , τη μέτρηση της συγκεντρώσεως της TSH στο νεογνό και της θυρεοσφαιρίνης στο πλάσμα. Η εκτίμηση των επιπέδων του ιωδίου στην εγκυμοσύνη είναι δύσκολη, και παραμένει ασαφές εάν η πρόσληψη ιωδίου σε αυτές τις ομάδες είναι επαρκής, οδηγώντας σε εκκλήσεις για χορήγηση συμπληρωμάτων ιωδίου κατά τη διάρκεια της εγκυμοσύνης σε αρκετές βιομηχανικές χώρες. Στις περισσότερες χώρες, η καλύτερη στρατηγική ελέγχου της ιωδοπενίας στο πληθυσμό, είναι η προσεκτική επιτήρηση της ιωδίωσης του αλατιού, ενός από τους ποιο αποδοτικούς τρόπους, από άποψη κόστους-οφέλους, συμβολής στην οικονομική και κοινωνική ανάπτυξη. Η επίτευξη της ιδανικής ημερήσιας πρόσληψης ιωδίου 150-250 μg/dl/ημέρα για ενήλικες), ίσως ελαχιστοποιεί το ποσοστό των δυσλειτουργιών του θυρεοειδούς αδένα στο πληθυσμό. Η εξασφάλιση επαρκών επιπέδων ιωδίου στη διάρκεια παρεντερικής σίτισης είναι ιδιαίτερα σημαντική στα πρόωρα καθώς η χρήση ιωδιούχου βάμματος έχει μειωθεί. Η εισαγωγή ιωδιούχου αλατιού σε περιοχές χρόνιας ιωδιοπενίας, ίσως παροδικά αυξάνει την επίπτωση των θυρεοειδικών δυσλειτουργιών, αλλά γενικά ο κίνδυνος από υπερβολική πρόσληψη ιωδίου είναι μικρότερος από τους σημαντικούς κινδύνους της ιωδοπενίας.
Εισαγωγή
Το ιώδιο με ατομικό βάρος 126,9 είναι ένα βασικό συστατικό των ορμονών που παράγονται από το θυρεοειδή αδένα. Οι θυρεοειδικές ορμόνες και επομένως και το ιώδιο είναι απαραίτητα για τη ζωή των θηλαστικών. Το 1811, ο γάλλος Courtois ανακάλυψε το ιώδιο, ως ατμό ιώδους χρώματος, που προέκυπτε κατά την παρασκευή πυρίτιδας για το στρατό του Ναπολέοντα, από στάχτη φυκιών. Ο Gay-Lussac το αναγνώρισε ως ένα νέο χημικό στοιχείο και το ονόμασε ιώδιο, από το ελληνικό ιώδες, λόγω του χρώματος των ατμών του. Η παρουσία ιωδίου στο θυρεοειδή αδένα ανακαλύφθηκε το 1895 από τον Baumann (1). Το 1917, οι Marine και Kimball, έδειξαν ότι διόγκωση του θυρεοειδούς αδένα (βρογχοκήλη), προκλήθηκε από ιωδοπενία και ότι μπορούσε να προληφθεί με χορήγηση συμπληρώματος ιωδίου (2). Η πρόληψη της βρογχοκήλης μέσω ιωδίωσης του αλατιού, ξεκίνησε για πρώτη φορά στην Ελβετία και τις Ηνωμένες Πολιτείες στις αρχές του 1920.
Το 1980, έγινε η πρώτη παγκόσμια εκτίμηση του Παγκόσμιου Οργανισμού Υγείας του επιπολασμού βρογχοκήλης που έδειξε ότι 20-60% του παγκόσμιου πληθυσμού είχε ιωδιοπενία και/ή βρογχοκήλη, κυρίως στις αναπτυσσόμενες χώρες. Ωστόσο δόθηκε μικρή σημασία στην ιωδιοπενία σε κατά τα άλλα υγιείς πληθυσμούς στις περισσότερες χώρες. Η βρογχοκήλη ως μια διόγκωση του τραχήλου, αποτελούσε κυρίως κοσμητικό πρόβλημα. Αυτό άλλαξε την περίοδο 1970 έως 1990, όπου ελεγχόμενες μελέτες σε ιωδιοπενικές περιοχές, έδειξαν ότι η λήψη συμπληρώματος ιωδίου όχι μόνο περιόρισε την εμφάνιση νέων περιπτώσεων κρετινισμού, αλλά μείωσε τη βρεφική θνητότητα και βελτίωσε τη γνωστική λειτουργία του υπόλοιπου πληθυσμού (3). Οι διαταραχές ιωδιοπενίας αφορούν πιθανά 1,5 δισεκατομμύρια άτομα. Τα προγραμμάτων κατά των διαταραχών της ιωδιοπενίας, είχαν και σαφείς πολιτικούς στόχους, λόγω του ότι θα μπορούσαν να αποφευχθούν ανθρώπινες, οικονομικές και κοινωνικές συνέπειες, μέσω της καθολικής ιωδίωσης του αλατιού, μια χαμηλού κόστους παρέμβαση. Από το 1990, η εξάλειψη της ιωδοπενίας αποτελεί αναπόσπαστο κομμάτι πολλών εθνικών στρατηγικών διατροφής (4).
1. Οικολογία
Το ιώδιο ως στοιχειακό ιώδιο (I–) είναι ευρέως (αλλά άνισα) κατανεμημένο στο γήινο περιβάλλον. Σε πολλές περιοχές η απόπλυση των επιφανειακών εδαφών από παγετώνες, πλημμύρες και διαβρώσεις έχουν ως αποτέλεσμα τα υποκείμενα εδάφη να είναι φτωχά σε ιώδιο και το περισσότερο να βρίσκεται στους ωκεανούς. Η συγκέντρωση του στοιχειακού ιωδίου στα θαλασσινά νερά είναι περίπου 50μg/L. Τα ιόντα στοιχειακού ιωδίου στο θαλασσινό νερό οξειδώνονται στο στοιχειακό ιώδιο, το οποίο εξατμίζεται στην ατμόσφαιρα και επιστρέφει στο έδαφος με τη βροχή, ολοκληρώνοντας έτσι τον κύκλο του (5).
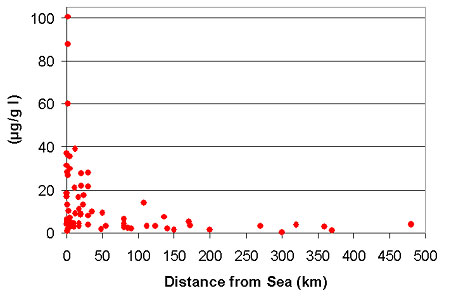
Σχήμα 1. Το περιεχόμενο ιώδιο στο έδαφος σε σχέση με την απόσταση από τη θάλασσα (6).
Ωστόσο η ανακύκλωση αυτή του ιωδίου σε κάποιες περιοχές είναι αργή και ατελής, αφήνοντας το έδαφος και το πόσιμο νερό χωρίς ιώδιο. Οι καλλιέργειες στα εδάφη αυτά θα είναι επίσης φτωχές σε ιώδιο και οι άνθρωποι καθώς και τα ζώα που καταναλώνουν τρόφιμα που καλλιεργούνται σε αυτά τα εδάφη θα εμφανίσουν ιωδιοπενία. Στα λαχανικά που αναπτύσσονται σε αυτά τα εδάφη, η συγκέντρωση του ιωδίου μπορεί να φτάνει τα 10μg/kg ξηρού βάρους, συγκριτικά με συγκεντρώσεις του 1mg/kg σε φυτά που αναπτύσσονται σε εδάφη με επαρκή περιεκτικότητα σε ιώδιο.
Εδάφη φτωχά σε περιεκτικότητα ιωδίου, εμφανίζονται συχνά σε ορεινές περιοχές όπως οι Άλπεις, οι Άνδεις, η οροσειρά Άτλας, η οροσειρά των Ιμαλάιων και σε περιοχές με συχνές πλημμύρες, ειδικά στη νότια και νοτιοανατολική Ασία, (για παράδειγμα η πεδιάδα του Γάγγη ποταμού στη βορειοανατολική Ινδία). Παρόλο που αρκετές περιοχές της ενδοχώρας, συμπεριλαμβανομένου της κεντρικής Ασίας και Αφρικής, κεντρικής και ανατολικής Ευρώπη είναι ιωδιοπενικές, ωστόσο η ιωδιοπενία μπορεί να επηρεάσει τόσο παράκτιους όσο και νησιωτικούς πληθυσμούς. Η ιωδοπενία στους πληθυσμούς αυτούς θα επιμείνει έως ότου το ιώδιο εισαχθεί στην τροφική αλυσίδα μέσω εμπλουτισμού της διατροφής με ιώδιο, (π.χ ιωδίωση του αλατιού) ή εισαχθούν τρόφιμα που παράγονται εκτός της ιωδιοπενικής περιοχής.
2. Διατροφικές πηγές ιωδίου
Η περιεκτικότητα των περισσότερων τροφών και αφεψημάτων σε ιώδιο είναι χαμηλή. Τα συνήθη καταναλισκόμενα τρόφιμα παρέχουν 3 έως 80μg ιωδίου ανά μερίδα (7,8). Οι τροφές θαλασσινής προέλευσης έχουν υψηλότερη περιεκτικότητα σε ιώδιο, λόγω του ότι τα θαλασσινά φυτά και ζώα συγκεντρώνουν το ιώδιο από το θαλασσινό νερό. Το ιώδιο σε οργανική μορφή, βρίσκεται σε υψηλά ποσά σε ορισμένα φύκια. Οι κάτοικοι παράκτιων περιοχών της Ιαπωνίας, των όποιων η διατροφή περιέχει μεγάλα ποσά φυκιών, έχουν αξιοσημείωτη υψηλή πρόσληψη ιωδίου, που ανέρχεται στα 50 έως 80 μg/ημέρα. Στις Ηνωμένες Πολιτείες, η μέση διατροφική πρόσληψη ιωδίου στα μέσα της δεκαετίας του ’90 εκτιμήθηκε στα 240 – 300 μg/ημέρα στους άνδρες και 190 – 210 μg/ημέρα στις γυναίκες (9), με κύριες διατροφικές πηγές ιωδίου το ψωμί και το γάλα (10). Στην Ελβετία, βάσει άμεσης διατροφικής ανάλυσης, η μέση διατροφική πρόσληψη του ιωδίου κυμαίνεται στα 140 μg/ημέρα και προέρχεται κύρια από το ψωμί και τα γαλακτοκομικά προϊόντα (8). Σε πολλές χώρες, η χρήση ιωδιούχου μαγειρικού ή επιτραπέζιου αλατιού στα νοικοκυριά, αποτελεί μια επιπλέον πηγή πρόσληψης ιωδίου. Ο βρασμός, το ψήσιμο και η κονσερβοποίηση τροφίμων που περιέχουν ιωδιούχο αλάτι, προκαλούν μόνο μικρές απώλειες του περιεχόμενου σε αυτές ιωδίου (11).
Η περιεκτικότητα των τροφίμων σε ιώδιο επηρεάζεται επίσης από χημικές ενώσεις, οι οποίες περιέχουν ιώδιο και χρησιμοποιούνται στην άρδευση, στα λιπάσματα και τις ζωοτροφές. Τα ιωδιοφόρα που χρησιμοποιούνται ως αντισηπτικά στη κτηνοτροφία, μπορεί να αυξήσουν το περιεχόμενο ιώδιο στα γαλακτοκομικά προϊόντα. Παραδοσιακά, το ιώδιο χρησιμοποιήθηκε στη παραγωγή ψωμιού, ως βελτιωτικό της ζύμης, αλλά έχει πλέον αντικατασταθεί. Η ερυθροσίνη είναι μια συνθετική κόκκινη χρωστική, με υψηλή περιεκτικότητα σε ιώδιο, η οποία χρησιμοποιείται ευρέως σε τρόφιμα, καλλυντικά και φαρμακευτικά προϊόντα. Τα συμπληρώματα διατροφής συχνά περιέχουν ιώδιο. Σύμφωνα με δεδομένα από τη τρίτη καταμέτρηση εθνικής υγείας και εξέταση θρέψης (NHANES III, Third National Health And Nutrition Examination Survey) στις ΗΠΑ, 12% των ανδρών και 15% των μη εγκύων γυναικών έλαβαν διατροφικό συμπλήρωμα που περιείχε ιώδιο, και η μέση πρόσληψη ιωδίου από το συμπλήρωμα ήταν περίπου 140 μg/ημέρα (9). Άλλες διατροφικές πηγές ιωδίου αποτελούν οι ταμπλέτες καθαρισμού νερού, ακτινολογικά σκιαγραφικά μέσα, φάρμακα (πχ 200 mg αμιωδαρόνης, περιέχουν 75 mg ιωδίου), και αντισηπτικά δέρματος (π.χ η ιωδιούχος ποβιδόνη περιέχει περίπου 10 mg/ml).
3. Απορρόφηση και μεταβολισμός του ιωδίου
Το ιώδιο λαμβάνεται με την τροφή σε διάφορες χημικές μορφές. Ως στοιχειακό ιώδιο (I–), απορροφάται γρήγορα και σχεδόν πλήρως από το στομάχι και το λεπτό έντερο (12). Ως ιωδιούχο άλας, μορφή η οποία χρησιμοποιείται ευρέως στην ιωδίωση του άλατος, διασπάται αρχικά στο έντερο και στη συνέχεια απορροφάται ως στοιχειακό ιώδιο. Σε υγιή άτομα, η απορρόφηση του ιωδίου είναι μεγαλύτερη από 90% (13). Σε μοντέλα ζώων, ο συμμεταφορέας νατρίου/ιωδίου, ο οποίος εκφράζεται λειτουργικά στην κορυφαία επιφάνεια της κυτταρικής μεμβράνης των κυττάρων του εντερικού επιθηλίου, μεσολαβεί ενεργητικά στην απορρόφηση του ιωδίου (14).
Ο όγκος κατανομής του ιωδίου που απορροφάται, είναι σχεδόν ισοδύναμος με τον όγκο του εξωκυττάριου υγρού (15). Το ιώδιο απομακρύνεται από την κυκλοφορία κύρια μέσω του θυρεοειδούς αδένα και των νεφρών, και ενώ η νεφρική κάθαρση του ιωδίου είναι αρκετά σταθερή, η θυρεοειδική κάθαρση ποικίλει ανάλογα με την πρόσληψη του ιωδίου. Σε συνθήκες επαρκούς χορήγησης ιωδίου, δε προσλαμβάνεται περισσότερο από το 10% του ιωδίου από το θυρεοειδή. Σε καταστάσεις χρόνιας ιωδοπενίας, το ποσοστό αυτό μπορεί να υπερβεί το 80% (15-17). Στη διάρκεια της γαλουχίας ο μαζικός αδένας προσλαμβάνει το ιώδιο και το εκκρίνει στο μητρικό γάλα προκειμένου να το παρέχει στο νεογνό (18). Οι σιελογόνοι αδένες, το γαστρικό επιθήλιο, και τα χοριοειδή πλέγματα προσλαμβάνουν επίσης μικρές ποσότητες ιωδίου. Το ιώδιο στο αίμα μεταβολίζεται γρήγορα και σε φυσιολογικές συνθήκες ο χρόνος ημισείας ζωής του είναι περίπου δέκα ώρες, ο οποίος μειώνεται σε καταστάσεις υπερλειτουργίας του θυρεοειδούς αδένα καθώς και σε καταστάσεις ιωδιοπενίας ή υπερθυρεοειδισμού (15-17).
Το σώμα υγιών ενηλίκων περιέχει 15-20 mg ιωδίου, από το οποίο το 70-80% βρίσκονται στο θυρεοειδή αδένα (19). Σε χρόνια ιωδοπενία, το περιεχόμενο ιώδιο στο θυρεοειδή μειώνεται κάτω από 20 μg. Σε περιοχές πλούσιες σε ιώδιο, ο θυρεοειδής αδένας ενός ενήλικα προσλαμβάνει περίπου 60 μg ιωδίου την ημέρα, προκειμένου να αντισταθμίσει τις απώλειες και να διατηρήσει τη σύνθεση των θυρεοειδικών ορμονών (15-17). Ο συμμεταφορέας νατρίου/ιωδίου, αποτελεί μια διαμεμβρανική πρωτεΐνη στη βασικοπλάγια μεμβράνη των θυρεοειδικών θυλακικών κυττάρων, και μεταφέρει ιώδιο εντός του θυρεοειδούς αδένα σε κλίση συγκέντρωσης 20 με 50 φορές μεγαλύτερη από αυτή του πλάσματος (20). Το γονίδιο του συμμεταφορέα νατρίου/ιωδίου στον άνθρωπο, εδράζεται στο χρωμόσωμα 19 και κωδικοποιεί μια πρωτεΐνη 643 αμινοξέων (21). Ο συμμεταφορέας νατρίου/ιωδίου συγκεντρώνει ιώδιο με διαδικασία ενεργού μεταφοράς, η οποία χρησιμοποιεί την ενέργεια που παράγεται από την μετακίνηση του νατρίου ενδοκυτταρικά ενάντια στην κλίση συγκέντρωσης (20). Η μείωση της θυρεοειδικής πρόσληψης του ιωδίου, σε καταστάσεις υπερβολικής διατροφικής χορήγησης ιωδίου, οφείλεται σε μείωση της έκφρασης του συμμεταφορέα νατριου/ιωδίου (22).
Στην κορυφαία επιφάνεια των θυρεοειδικών κυττάρων, το ιόν του ιωδίου οξειδώνεται σε μια αντίδραση οργανοποίησης, η οποία περιλαμβάνει τη θυρεοειδική υπεροξειδάση και το υπεροξείδιο του υδρογόνου. Το ενεργό άτομο ιωδίου προστίθεται σε υπολείμματα τυροσίνης στο μόριο της θυρεοσφαιρίνης, προκειμένου να παραχθούν μονοιωδιοτυροσίνη και διιωδιοτυροσίνη, οι πρόδρομοι των θυρεοειδικών ορμονών (23). Η θυρεοειδική υπεροξειδάση, καταλύει στη συνέχεια την ένωση των ιωδοτυροσινών της θυρεοσφαιρίνης, μέσω ενός αιθερικού δεσμού για να σχηματιστούν οι θυρεοειδικές ορμόνες (23,24). Η σύνδεση δύο μορίων διιωδιοτυροσίνης οδηγεί στην παραγωγή της τετρα-ιωδοθυρονίνης ή θυροξίνης (Τ4), ενώ η σύνδεση ενός μορίου μονοιωδιοτυροσίνης και ενός μορίου διιωδοοτυροσίνης στην παραγωγή της τριιωδοθυρονίνης (Τ3). Έτσι, η Τ3 είναι δομικά ίδια με τη Τ4, αλλά έχει ένα ιώδιο λιγότερο (στη θέση 5 στον εξωτερικό δακτύλιο). Το ιώδιο αποτελεί το 65% και το 59% του βάρους των Τ4 και Τ3 αντίστοιχα. Στο θυρεοειδή αδένα, η ώριμη θυρεοσφαιρίνη περιέχει 0,1 έως 1,0% του βάρους της ως ιώδιο και αποθηκεύεται στον αυλό του κολλοειδούς στα θυλάκια του θυρεοειδούς αδένα. Μετά από ενδοκυττάρωση, πρωτεάσες των λυσοσωμάτων και ενδοσωμάτων, διασπούν την θυρεοσφαιρίνη και απελευθερώνουν Τ4 και Τ3 στην κυκλοφορία. Ο μεταβολισμός των Τ3 και Τ4 στη περιφέρεια- ο χρόνος ημίσειας ζωής της Τ4 είναι 5-8 ημέρες και της Τ3 1,5-3 ημέρες- απελευθερώνει μοριακό ιώδιο το οποίο εισέρχεται στο πλάσμα και είτε προσλαμβάνεται πάλι από το θυρεοειδή αδένα είτε απεκκρίνεται από τα νεφρά (25). Πάνω από το 90% του προσλαμβανομένου ιωδίου εκκρίνεται τελικά στα ούρα με ένα πολύ μικρό ποσό να αποβάλλεται με τα κόπρανα.
3.1. Προσαρμογή του θυρεοειδούς αδένα στην ιωδοπενία
Ο θυρεοειδής αδένας προσαρμόζεται στη χαμηλή διατροφική πρόσληψη ιωδίου με αξιοσημείωτη τροποποίηση της δραστηριότητας του, προκαλούμενη από αύξηση της έκκρισης της θυρεοτρόπου ορμόνης (TSH) από την υπόφυση. Στα περισσότερα άτομα, μείωση της πρόσληψης του ιωδίου κάτω από τα 100 μg την ημέρα, έχει ως αποτέλεσμα την αύξηση της έκκριση της θυρεοειδοτρόπου ορμόνης, η οποία αυξάνει με τη σειρά της τη θυρεοειδική κάθαρση του ανόργανου ιωδίου του πλάσματος, μέσω διέγερσης, σε μεταγραφικό επίπεδο, της έκφρασης του συμμεταφορέα νατρίου-ιωδίου. Καθώς μεγαλύτερο κλάσμα του κυκλοφορούντος ανιόντος του ιωδίου προσλαμβάνεται από το θυρεοειδή αδένα , μειώνεται η νεφρική απέκκριση του ιωδίου. Η θυρεοτρόπος ορμόνη διεγείρει επίσης τη διάσπαση της θυρεοσφαιρίνης και έτσι τη σύνθεση και απελευθέρωση κύρια της Τ3 στην κυκλοφορία (27). Για όσο χρονικό διάστημα η ημερήσια πρόσληψη ιωδίου παραμένει πάνω από το κατώφλι των περίπου 50μg την ημέρα, πάρα την μείωση του οργανικού ιωδίου στο πλάσμα, η απόλυτη πρόσληψη ιωδίου από το θυρεοειδή αδένα παραμένει επαρκής, και το περιεχόμενο στο θυρεοειδή αδένα ιώδιο εντός των φυσιολογικών ορίων (10 – 20 mg). Κάτω από το αυτό το κατώφλι, παρά την υψηλή κλασματική πρόσληψη του ανόργανου ιωδίου από το θυρεοειδή, μειώνεται η απόλυτη πρόσληψη και επομένως το περιεχόμενο στον αδένα ιώδιο με αποτέλεσμα πολλά άτομα να αναπτύσσουν βρογχοκήλη (28).
Στη μεγάλες κολλοειδείς βρογχοκήλες, το μόριο της θυρεοσφαιρίνης είναι παθολογικό μειώνοντας την αποτελεσματικότητα της στη σύνθεση των θυρεοειδικών ορμονών (29). Αρχικά, οι βρογχοκήλες χαρακτηρίζονται από διάχυτη, ομοιογενή διόγκωση, αλλά συχνά στο πέρασμα του χρόνου αναπτύσσονται οζίδια (Εικόνα 1). Αρκετά οζίδια του θυρεοειδούς αδένα, προέρχονται από μια σωματική μετάλλαξη και είναι μονοκλωνικής προέλευσης (30). Οι μεταλλάξεις φαίνεται να εμφανίζονται πιθανότερα σε οζίδια κάτω από την επίδραση παράγοντα που επάγει την αύξηση, όπως η ιωδιοπενία. Παρόλο που η ιωδιοπενία προκαλεί ανάπτυξη διάχυτης βρογχοκήλης σε όλες τις ηλικιακές ομάδες, είναι επίσης συνδεδεμένη με την αυξημένη εμφάνιση πολυοζώδους τοξικής βρογχοκήλης, η οποία παρατηρείται κυρίως σε γυναίκες άνω των 50 ετών (31). Το χαρακτηριστικό μοτίβο των κυκλοφορούντων ορμονών στα παιδιά σε περιοχές μέτριας έως σοβαρής ιωδιοπενίας είναι η αυξημένη θυρεοτρόπος ορμόνη, η χαμηλή θυροξίνη πλάσματος, και η υψηλή έως φυσιολογική Τ3, Αυτό το μοτίβο παρατηρείται και στους ενήλικες, αλλά είναι λιγότερο αναμενόμενο και μπορεί να απουσιάζει (32). Η συγκέντρωση της θυρεοσφαιρίνης του ορού, είναι τυπικά αυξημένη (33). Θυρεοειδική ανεπάρκεια και κρετινισμός εμφανίζονται συνήθως μόνο σε περιοχές χρόνιας σοβαρής ιωδιοπενίας, όπου τα άτομα παρουσιάζουν χαμηλά επίπεδα κυκλοφορούντων θυροειδικών ορμονών και δραματικά αυξημένα επίπεδα TSH (34,35). Θα πρέπει να τονιστεί, ότι η επίδραση της ιωδιοπενίας στην ανάπτυξη της βρογχοκήλης και της θυρεοειδικής υπολειτουργίας ποικίλει ανάμεσα στους διάφορους πληθυσμούς και τα άτομα, ακόμα και σε ενδημικές περιοχές. Διατροφικοί, περιβαλλοντικοί και /ή γενετικοί παράγοντες οι οποίοι ευθύνονται για την ποικιλότητα στην εκδήλωση της ιωδοπενίας από τη μία περιοχή στην επόμενη παραμένουν σε μεγάλο βαθμό απροσδιόριστοι.

Εικόνα 1. Κάτοικος του Αζερμπαϊτζάν (Δική μας περίπτωση).
3.2. Βρογχοκηλογόνες ουσίες
Διατροφικές ουσίες οι οποίες παρεμβαίνουν στο μεταβολισμό των θυρεοειδικών ορμονών μπορούν να επιδεινώσουν τις επιδράσεις της ιωδοπενίας και ορίζονται ως βρογχοκηλογόνες (36). Σταυρανθή λαχανικά (μπρόκολο, λάχανο, κουνουπίδι, γογγύλια, ελαιοκράμβη) περιέχουν γλυκοσινολάτες, οι μεταβολίτες των οποίων ανταγωνίζονται τη θυρεοειδική πρόληψη του ιωδίου. Παρόμοια, η κασάβα, οι γίγαντες, ο λιναρόσπορος, το ζαχαρόχορτο και οι γλυκοπατάτες περιέχουν κυανογόνους γλυκοζίτες, οι οποία δύναται να μεταβολίζονται σε θειοκυανικά, τα οποία ανταγωνίζονται επίσης τη πρόσληψη ιωδίου από το θυρεοειδή αδένα. Για παράδειγμα, η λιναμαρίνη είναι ένας γλυκοζίτης ο οποίος βρίσκεται στη κασάβα, η οποία αποτελεί βασικό τρόφιμο σε αρκετές αναπτυσσόμενες χώρες. Εάν δεν εφαρμοστούν σωστές τεχνικές μαγειρέματος προκειμένου να αφαιρεθεί η λαμαναρίνη, αυτή υδρολύεται στο έντερο απελευθερώνοντας κυανίδια, τα οποία μεταβολίζονται σε θειοκυανικό άλας (37). Το κάπνισμα σχετίζεται επίσης με αυξημένα επίπεδα θειοκυνανικών αλάτων στο πλάσμα τα οποία ίσως ανταγωνίζονται τη μεταφορά ιωδίου μέσω του συμμεταφορέα νατρίου/ιωδίου τόσο στο θυρεοειδή αδένα, όσο και στο εκκριτικό επιθήλιο του θηλάζοντα μαζικού αδένα. Το κάπνισμα στη γαλουχία συνδέεται με μειωμένα επίπεδα ιωδίου στο μητρικό γάλα (38).
Η σόγια και το κεχρί περιέχουν φλαβονοειδή τα οποία ίσως επηρεάζουν τη δραστηριότητα της θυρεοειδικής υπεροξειδάσης. Η χρήση τροποποιημένου/έτοιμου γάλατος με βάση τη σόγια χωρίς τη προσθήκη ιωδίου, μπορεί να οδηγήσει στη δημιουργία βρογχοκήλης και υποθυρεοειδισμού σε βρέφη, αλλά και σε υγιείς ενήλικες η κατανάλωση προϊόντων σόγιας φαίνεται να έχει αμελητέα επίδραση στη θυρεοειδική λειτουργία (39). Ακάθαρτο πόσιμο νερό, ίσως περιέχει χημικές ενώσεις/ουσίες, οι οποίες εμποδίζουν τη θυρεοειδική ιωδίωση, και βιομηχανικά απόβλητα, συμπεριλαμβανομένου της ρεσορκινόλης και του φθαλικού οξέος, ίσως να είναι επίσης βρογχοκηλογόνες ουσίες (36). Το υπερχλωρικό άλας είναι ένας ανταγωνιστικός αναστολέας της θυρεοειδικής πρόσληψης ιωδίου (40), ωστόσο εξάμηνη έκθεση σε δόσεις υπερχλωρικού άλατος έως και 3mg ημερησίως, δεν έχει επίδραση στη πρόσληψη του ιωδίου από το θυρεοειδή ή στα επίπεδα θυρεοειδικών ορμονών στο πλάσμα (41). Φαίνεται ότι οι περισσότερες από αυτές τις βρογχοκηλογόνες ουσίες, δεν έχουν μείζονα κλινική επίπτωση εκτός και εάν συνυπάρξουν με ιωδιοπενία.
Η έλλειψη σεληνίου, σιδήρου ή βιταμίνης Α, επιδεινώνει τις επιπτώσεις της ιωδιοπενίας. Η υπεροξειδάση της γλουταθειόνης και οι αποιωδινάσες είναι ένζυμα που εξαρτώνται από το σελήνιο. Έτσι, σε καταστάσεις έλλειψης σεληνίου, η συσσώρευση υπεροξειδίου, ίσως προκαλεί βλάβη τους θυρεοειδούς αδένα, ενώ η ανεπάρκεια των αποιωδινασών επηρεάζει το μεταβολισμό των θυρεοειδικών ορμονών με αποτελέσματα οι διαταραχές αυτές, να συμβάλουν στην αιτιολογία του μυξοιδηματικού κρετινισμού (42). Η έλλειψη σιδήρου μειώνει την εξαρτώμενη από την αίμη δράση της θυρεοειδικής υπεροξειδάσης στο θυρεοειδή αδένα και επηρεάζει τη σύνθεση των θυρεοειδικών ορμονών. Σε παιδιά με βρογχοκήλη, η σιδηροπενική αναιμία αμβλύνει την αποτελεσματικότητα της προφυλακτικής χορήγησης του ιωδίου, ενώ η χορήγηση συμπληρωμάτων σιδήρου βελτιώνει την αποτελεσματικότητα της χορήγησης ιωδιούχου ελαίου και ιωδιούχου αλατιού (43). Οι έγκυες είναι ιδιαίτερα ευάλωτες στη σιδηροπενική αναιμία και χαμηλά επίπεδα σιδήρου στη μητέρα έχουν ως αποτέλεσμα υψηλότερες συγκεντρώσεις TSH και χαμηλότερα επίπεδα θυροξίνης στην εγκυμοσύνη σε περιοχή οριακής ιωδιοπενίας (44). Η έλλειψη βιταμίνης Α σε παιδιά με ιωδιοπενία αυξάνει τη διέγερση της TSH και τον κίνδυνο ανάπτυξης βρογχοκήλης, μέσω μείωσης της καταστολής του γονιδίου β της TSH στην υπόφυση, η οποία διαμεσολαβείται από την βιταμίνη Α (45,46).
4. Απαιτήσεις σε ιώδιο
Έχουν χρησιμοποιηθεί διάφορες μέθοδοι, προκειμένου να εκτιμηθούν οι απαιτήσεις σε ιώδιο. Η ημερήσια πρόσληψη και μεταβολισμός ραδιενεργού ιωδίου μπορούν να χρησιμοποιηθούν για το σκοπό αυτό, δεδομένου ότι τα προς εξέταση άτομα έχουν επαρκή επίπεδα ιωδίου και είναι ευθυρεοειδικά (19,47,49). Αρκετές μελέτες έχουν εκτιμήσει τις απαιτήσεις σε ιώδιο από μελέτες ισοζυγίου, αλλά αυτές έχουν σοβαρούς περιορισμούς (50-54). Συγκεκριμένα, πολλές προσλαμβανόμενες ουσίες περιέχουν μη αναγνωρισμένο ιώδιο, και επομένως ο αυστηρός έλεγχος της πρόσληψης του ιωδίου καθίσταται δύσκολος και επιπλέον λόγω της ανάγκης να εκτιμήσουμε το ιώδιο εντός του θυρεοειδούς αδένα (επιπρόσθετα της πρόσληψης και έκκρισης του ιωδίου), ακόμα και σε παρατεταμένες μελέτες ισοζυγίου, η ισορροπία ίσως δεν είναι ξεκάθαρα αποδεδειγμένη (50).
4.1. Ορισμοί
Οι ακόλουθοι ορισμοί προέρχονται από το Αμερικανικό Ινστιτούτο Ιατρικής (9) (Πίνακας 1).
- Η εκτιμώμενη μέση απαίτηση (EAR, estimated average requirement) είναι η ημερήσια πρόσληψη ιωδίου η οποία ικανοποιεί τις απαιτήσεις του μισού των υγιών ατόμων σε συγκεκριμένο στάδιο του κύκλου της ζωής. Δεν χρησιμοποιείται για την εκτίμηση της πρόσληψης σε ατομικό επίπεδο, αλλά μπορεί να χρησιμοποιηθεί για ομαδική εκτίμηση της πρόσληψης.
- Η συνιστώμενη ημερήσια χορήγηση ιωδίου (RDA, recommended daily allowance), είναι η μέση ημερήσια πρόσληψη ιωδίου, η οποία είναι επαρκής να ικανοποιήσει τις απαιτήσεις σε ιώδιο του 97-98% του υγιή πληθυσμού σε ένα στάδιο ζωής. Δύναται να χρησιμοποιηθεί ως στόχος για την ημερήσια πρόσληψη ιωδίου σε ατομικό επίπεδο. Ο RDA προέρχεται από τον EAR, λαμβάνοντας υπόψη την εκτιμώμενη ποικιλότητα σε ατομικές απαιτήσεις.
- Η επαρκή πρόσληψη (AI, adequate intake), δίνεται εάν υπάρχουν ανεπαρκή επιστημονικά δεδομένα υπολογισμού του EAR. Για παράδειγμα, η επαρκής πρόσληψη ιωδίου στα νηπιακή ηλικία, βασίζεται σε παρατηρήσεις μέσης πρόσληψης ιωδίου από υγιή τελειόμηνα βρέφη, που θηλάζουν σε μη ιωδιοπενικές περιοχές. Η επαρκής πρόσληψη μπορεί να χρησιμοποιηθεί ως στόχος για ατομική πρόσληψη.
Ο ακόλουθος ορισμός προέρχονται από τον Παγκόσμιο Οργανισμό Υγείας (55).
- Η συνιστώμενη διατροφική πρόσληψη για το ιώδιο (RNI, recommended nutrient uptake), είναι η πρόσληψη που εκτιμάται να καλύπτει τις ανάγκες σχεδόν όλων των υγιών ατόμων σε καθορισμένο στάδιο του κύκλου ζωής.
Πίνακας 1. Συνιστώμενη πρόσληψη ιωδίου (μg/μέρα) σε ηλικιακές και πληθυσμιακές κατηγορίες.
| Ηλικιακή κατηγορία | >ΙΟΜ (9) | Ηλικιακή κατηγορία | ΠΟΥ (55) | |
| >EAR | AI ή RDA | RNI< | ||
| Βρέφη 0 – 12 μηνών | 110-130 | Παιδιά 0-5ετών |
90 |
|
| Παιδιά 1 – 8 ετών | 65 | 90 | Παιδιά 6-12ετών | 120 |
| Παιδιά 9 – 13 ετών | 73 | 120 | ||
| Ενήλικες ≥ 14 ετών | 95 | 150 | Ενήλικες >12 ετών | 150 |
| Έγκυες | 160 | 220 | Έγκυες | 250 |
| Θηλάζουσες | 200 | 290 | Θηλάζουσες | 250 |
4.2. Ενηλικίωση
Ο μεταβολισμός του ιωδίου, η πρόσληψη ραδιενεργού ιωδίου από το θυρεοειδή αδένα και μελέτες ισοζυγίου σε ευθυροειδικούς ενήλικες πρότειναν ότι οι ημερήσιες ανάγκες σε ιώδιο είναι 91-96 μg/ημέρα (19,47,51). Δεν υπάρχουν δεδομένα που προτείνουν ότι οι μέσες απαιτήσεις σε ιώδιο στους ενήλικες ποικίλουν ανάλογα με την ηλικία. Έτσι η εκτιμώμενη μέση απαίτηση σε ιώδιο για άνδρες και γυναίκες (όχι εγκύους και σε όχι σε γαλουχία), άνω των δεκατεσσάρων ετών, έχει οριστεί στα 95 μg/ημέρα (9). Η αντίστοιχη συνιστώμενη ημερήσια πρόσληψη είναι τα 150 μg ημερησίως (9). Αυτό έρχεται σε συμφωνία με τις συστάσεις του παγκόσμιου οργανισμού υγείας για επαρκή ημερήσια πρόσληψη ιωδίου της τάξεως των 150 μg για άνδρες και γυναίκες που δεν κυοφορούν και δεν θηλάζουν (55)
4.3. Εγκυμοσύνη και θηλασμός
Οι απαιτήσεις σε ιώδιο στη διάρκεια της εγκυμοσύνης είναι αυξημένες λόγω α) αύξησης της παράγωγης της Τ4 στη μητέρα για του διατήρηση μητρικού ευθυρεοειδισμού και της μεταφοράς των θυρεοειδικών ορμονών στο έμβρυο στην αρχή του πρώτου τριμήνου, προ της έναρξης λειτουργίας του θυρεοειδούς αδένα του εμβρύου, β) μεταφοράς ιωδίου στο έμβρυο ιδιαίτερα σε προχωρημένη εγκυμοσύνη και γ) αύξησης της νεφρικής κάθαρσης του ιωδίου (56). Τελευταία η αύξηση αυτή αμφισβητείται (57) (Περισσότερα στο αντίστοιχο Κεφάλαιο).
4.4. Βρεφική ηλικία
Λόγω απουσίας λειτουργικών κριτήριων, που να αντανακλούν την πρόσληψη ιωδίου στα βρέφη, οι συνιστώμενες προσλήψεις βασίζονται στη μέση πρόσληψη ιωδίου σε υγιή τελειόμηνα βρέφη που θήλασαν. Το Αμερικάνικο Ινστιτούτο Ιατρικής, βασίζει τις συστάσεις του στη μέση συγκέντρωση ιωδίου στο μητρικό γάλα γυναικών στις Ηνωμένες Πολιτείες στις αρχές της δεκαετίας του ’80, που είναι 146 μg/L (9). Βάσει εκτιμήσεων της μέσης ημερήσιας έκκρισης μητρικού γάλατος, η μέση ποσότητα ιωδίου που εκκρίνεται στο ανθρώπινο γάλα, εκτιμάται να είναι περίπου 115μg/ημέρα (9). Λαμβάνοντας υπόψη αυτά τα δεδομένα, η απαιτούμενη πρόσληψη σε ιώδιο για νήπια ηλικίας 0 – 6 και 6 – 12 μηνών έχει οριστεί στα 110 και στα 130 μg ημερησίως αντίστοιχα (9). Ο ΠΟΥ συστήνει για τα βρέφη μια ημερησία πρόσληψη 90 μg ιωδίου (55). Λόγω του ότι η πρόσληψη ιωδίου στον αμερικάνικο πληθυσμό τις αρχές της δεκαετίας του ’80 ήταν υπερβολική, η χρήση της μέσης συγκέντρωσης ιωδίου στο μητρικό γάλα, ήταν στα ανώτερα όρια του φάσματος 78-167 μg/L που καταγράφηκε για τις μη ιωδιοπενικές χώρες (64). Παρόλο που υψηλή πρόσληψη ιωδίου από τη μητέρα μπορεί να αυξήσει τη μέση συγκέντρωση ιωδίου στο μητρικό γάλα, πρόσληψη ιωδίου στα βρέφη μεγαλύτερη από τις απαιτήσεις τους θα απεκκριθεί στα ούρα. Έτσι οι απαιτήσεις σε ιώδιο στη γαλουχία, θα πρέπει να βασίζονται σε μελέτες ισοζυγίου σε νήπια παρά στο υπολογίσιμο αλλά ποικίλλον ποσό που εκκρίνεται στο μητρικό γάλα γυναικών σε χώρες επαρκείς σε ιώδιο. Σε μελέτες ισοζυγίου σε τελειόμηνα βρέφη, στα οποία χορηγήθηκε 20 μg/kg*ημέρα ιώδιο, βρέθηκε ότι η κατακράτηση ιωδίου ήταν 7,3 μg/kg*ημέρα (58). Εάν το βάρος αναφοράς ενός βρέφους 6 μηνών, είναι τα 7 kg, η ημερήσια κατακράτηση ιωδίου με θετικό ισοζύγιο είναι περίπου 50 μg (9).
4.5. Παιδική ηλικία
Σε μια μελέτη ισοζυγίου σε παιδιά ηλικίας 1,5 – 2,5 ετών (65), η μέση πρόσληψη ιωδίου ήταν τα 63,5 μg/ημέρα και το μέσο ισοζύγιο ιωδίου ήταν θετικό κατά 19 μg/ημέρα. Παιδιά οχτώ ετών που κατανάλωσαν περίπου 40 μg ιωδίου ημερησίως, ήταν σε αρνητικό ισοζύγιο ιωδίου (-23 έως -26 μg/ημέρα), υποδεικνύοντας ότι η μέση ελάχιστη απαίτηση σε ιώδιο είναι περίπου τα 65 μg /ημέρα (66). Δεν υπάρχουν άλλες διαθέσιμες μελέτες εκτίμησης απαιτήσεων σε ιώδιο στα παιδιά, και έτσι η εκτιμώμενη μέση απαίτηση για παιδιά ηλικίας 1 – 8 ετών, έχει οριστεί στα 65 μg/ημέρα (9). Για το υπόλοιπο της παιδικής ηλικίας και την ενηλικίωση, υπάρχουν λίγα διαθέσιμα δεδομένα για εκτίμηση της μέσης απαίτησης, και έτσι η εκτιμώμενη μέση απαίτηση ορίστηκε με τη βοήθεια δεδομένων από ενήλικες. Η συνιστώμενη ημερήσια πρόσληψη στην ενηλικίωση ορίστηκε στο 140% της εκτιμώμενης μέσης απαίτησης. Ο Παγκόσμιος Οργανισμός Υγείας, συνιστά μέση ημερήσια πρόσληψη 90 μg ιωδίου για παιδιά προσχολικής ηλικίας (0-59 μηνών) και 120 μg για παιδιά σχολικής ηλικίας 6 έως 12 ετών (55).
5. Μέθοδοι εκτίμησης της ιωδιοπενίας
Υπάρχουν τέσσερις μέθοδοι εκτίμησης της διατροφικής πρόσληψης ιωδίου στο πληθυσμό. α) η συγκέντρωση του ιωδίου στα ούρα, β) ο βαθμός της βρογχοκήλης, γ) η TSH του νεογνού και δ) η θυρεοσφαιρίνη στο πλάσμα. Αυτοί οι δείκτες είναι συμπληρωματικοί, δεδομένου ότι η συγκέντρωση του ιωδίου στα ούρα είναι ένας ευαίσθητος δείκτης της πρόσφατης πρόσληψης ιωδίου (ημέρες), η θυρεοσφαιρίνη δείκτης ενδιάμεσης ανταπόκρισης (εβδομάδες έως μήνες), ενώ οι αλλαγές της βρογχοκήλης αντανακλούν μακροχρόνια διατροφική πρόσληψη ιωδίου. (μήνες έως χρόνια).
5.1. Μέγεθος θυρεοειδούς αδένα
Υπάρχουν δύο διαθέσιμες μέθοδοι μέτρησης του μεγέθους της βρογχοκήλης: α) τραχηλική επισκόπηση και ψηλάφηση και β) υπερηχογράφημα θυρεοειδούς αδένα.
Στην ψηλάφηση, ο θυρεοειδής αδένας χαρακτηρίζεται πάσχων από βρογχοκήλη όταν ο κάθε πλευρικός λοβός έχει μέγεθος μεγαλύτερος της τελικής φάλαγγας του αντίχειρα του ατόμου που εξετάζεται. Στο σύστημα ταξινόμησης του Παγκόσμιου Οργανισμού Υγείας (55), ως βαθμού 0 βρογχοκήλη ορίζεται όταν ο θυρεοειδής αδένας δεν είναι ορατός ή ψηλαφητός, ως πρώτου βαθμού Ι, ορίζεται όταν η βρογχοκήλη είναι ψηλαφητή, αλλά όχι ορατή με τον τράχηλο στην ανατομική /φυσιολογική θέση και ως δευτέρου βαθμού ΙΙ, όταν η διόγκωση του θυρεοειδούς αδένα είναι ορατή, όταν ο τράχηλος βρίσκεται σε ανατομική θέση. Ο έλεγχος για βρογχοκήλη, διενεργείται συνήθως σε παιδιά σχολικής ηλικίας.
Η ψηλάφηση ωστόσο της βρογχοκήλης σε περιοχές ήπιας ιωδιοπενίας έχει μικρή ευαισθησία και ειδικότητα, και σε αυτές τις περιοχές είναι προτιμότερη η υπερηχογραφική μέτρηση του μεγέθους του θυρεοειδούς αδένας (67). Η υπερηχογραφία του θυρεοειδούς αδένα είναι μια μη επεμβατική, γρήγορα εκτελέσιμη (2 – 3 λεπτά/ασθενή), και εφικτή ακόμα και σε απομακρυσμένες περιοχές με τη χρήση φορητού εξοπλισμού. Ωστόσο η ερμηνεία των δεδομένων του μεγέθους του θυρεοειδούς αδένα, απαιτεί έγκυρες τιμές αναφοράς από παιδιά χωρίς ανεπάρκεια ιωδίου. Σε πρόσφατη πολυκεντρική μελέτη το μέγεθος του θυρεοειδούς αδένα μετρήθηκε σε 3529 παιδιά ηλικίας 6 έως 12 ετών που ζουν σε μη ιωδιοπενικές περιοχές, σε πέντε ηπείρους και υπολογίστηκε η 97η εκατοστιαία θέση για την ηλικία και την επιφάνεια σώματος για τα αγόρια και τα κορίτσια (68). Η βρογχοκήλη μπορεί να ταξινομηθεί σύμφωνα με αυτά τα διεθνή κριτήρια αναφοράς, ωστόσο αυτά είναι εφαρμόσιμα εάν το μέγεθος του θυρεοειδούς αδένα υπολογιστεί με τη συγκεκριμένη μέθοδο (68,69). Η υπερηχογραφική εξέταση του θυρεοειδούς αδένα είναι υποκειμενική και απαιτεί κρίση και εμπειρία. Διαφορές στη τεχνική μπορούν να προκαλέσουν σφάλματα έως και 26% στο μέγεθος του θυρεοειδούς αδένα μεταξύ των παρατηρητών/εξεταστών (70).
Σε περιοχές ενδημικής βρογχοκήλης, παρά το ότι το μέγεθος του θυρεοειδούς αδένα φυσιολογικά μειώνεται στα παιδιά σε ανταπόκριση στην αύξηση της πρόσληψης ιωδίου, ίσως να μη επιστρέφει στα φυσιολογικά όρια για μήνες ή έτη μετά από διόρθωση της ιωδοπενίας (71,72). Στη διάρκεια αυτής της μεταβατικής περιόδου το ποσοστό της βρογχοκήλης είναι δύσκολο να ερμηνευτεί λόγω του ότι αντανακλά τόσο το ιστορικό του πληθυσμού στη διατροφική πρόσληψη ιωδίο, όσο και τη παρούσα κατάσταση. Ο Aghini-Lombardi και οι συνεργάτες του (71), έδειξαν ότι η διόγκωση του θυρεοειδούς αδένα σε παιδιά με ιωδιοπενία στα πρώτα χρόνια της ζωής ίσως να μη υποστραφεί πλήρως μετά τη χορήγηση ιωδιούχου αλατιού. Εάν αυτό αληθεύει, υποδηλώνει ότι για την επίτευξη ποσοστού βρογχοκήλης κάτω από 5% σε παιδιά, ίσως απαιτείται ανάπτυξη αυτών σε περιβάλλον με επαρκές ιώδιο. Ένα πρόγραμμα διαρκούς ιωδίωσης του αλατιού θα μειώσει το ποσοστό της βρογχοκήλης σε λιγότερο από 5% σε παιδιά σχολικής ηλικίας, υποδηλώνοντας εξάλειψη της ιωδοπενίας ως σημαντικού προβλήματος της δημόσιας υγείας (55,73)
Ο ΠΟΥ συνιστά το συνολικό ποσοστό βρογχοκήλης ως δείκτη εκτίμησης της ιωδοπενίας στο πληθυσμό. Συγκεκριμένα συνολικό ποσοστό βρογχοκήλης κάτω από 5% δηλώνει επάρκεια ιωδίου, 5 – 19,9%, ήπια ιωδοπενία, 20% – 29,9% μέτρια ιωδιοπενία και συνολικό ποσοστό βρογχοκήλης πάνω από 30% σοβαρή ιωδοπενία (55).
5.2. Συγκέντρωση ιωδίου στα ούρα
Λόγω του ότι πάνω από το 90% του ιωδίου που λαμβάνεται με τη διατροφή απεκκρίνεται στα ούρα (14,54), η μέτρηση της συγκέντρωσης του ιωδίου στα ούρα αποτελεί έναν άριστο δείκτη πρόσφατης πρόσληψης ιωδίου. Η συγκέντρωση του ιωδίου στα ούρα μπορεί να εκφραστεί α) ως συγκέντρωση (μg ανά λίτρο), β) σε σχέση με την έκκριση της κρεατίνης (μg ιωδίου ανά g κρεατινίνης), ή γ) ως εικοσιτετράωρη έκκριση (μg ανά ημέρα). Στο γενικό πληθυσμό, λόγω του ότι η συλλογή ούρων εικοσιτετραώρου σε μελέτες πεδίου δεν είναι πρακτική, η συγκέντρωση ιωδίου μπορεί να μετρηθεί σε τυχαία δείγματα ούρων, σε ένα αντιπροσωπευτικό δείγμα του πληθυσμού στόχου και να εκφραστεί ως η μέση συγκέντρωση, σε μικρογραμμάρια ανά λίτρο (55).
Η μέση συγκέντρωση ιωδίου στα ούρα σε αντιπροσωπευτικό δείγμα συλλογής τυχαίου δείγματος ούρων από περίπου 1200 παιδιά, μπορεί να χρησιμοποιηθεί προκειμένου να ταξινομηθεί ένας πληθυσμός ως προς την επάρκεια του σε ιώδιο σε εθνικές μελέτες που αφορούν τη διατροφική πρόσληψη ιωδίου (55) (Πίνακας 2). Παρόλο που η μέση συγκέντρωση ιωδίου στα ούρα δεν παρέχει άμεση πληροφορία για τη λειτουργία του θυρεοειδούς αδένα, χαμηλές τιμές υποδηλώνουν ότι ο πληθυσμός βρίσκεται σε υψηλότερο κίνδυνο ανάπτυξης θυρεοειδικών δυσλειτουργιών. Ωστόσο, η μέση συγκέντρωση ιωδίου στα ούρα συχνά παρερμηνεύεται. Ατομικές προσλήψεις ιωδίου και ως εκ τούτου, οι συγκεντρώσεις ιωδίου σε τυχαία δείγματα ούρων εμφανίζουν μεγάλη ποικιλία από μέρα σε μέρα (75) και ένα κοινό σφάλμα είναι η θεώρηση ότι όλα τα άτομα με συγκέντρωση ιωδίου σε τυχαίο δείγμα ούρων μικρότερη από 100 μg/L είναι ιωδιοπενικά. Για το λόγο αυτό είναι προτιμότερη η συλλογή ούρων εικοσιτετράωρου προκειμένου να εκτιμηθεί η πρόσληψη του ιωδίου σε ατομικό επίπεδο, αυτό όμως είναι δύσκολα εφικτό. Ένας εναλλακτικός τρόπος εκτίμησης των επιπέδων του ιωδίου στους ενήλικες, είναι η χρήση του λόγου του ιωδίου προς τη κρεατινίνη, προσαρμοσμένου στην ηλικία και το φύλο αλλά αυτό έχει επίσης περιορισμούς (76). Η κρεατινίνη ίσως είναι αναξιόπιστη στην εκτίμηση της ημερήσιας έκκρισης ιωδίου από τυχαία δείγματα ούρων, ειδικά σε υποσιτιζόμενα άτομα, όπου η συγκέντρωση κρεατινίνης είναι χαμηλή. Οι εκτιμήσεις της ημερήσιας πρόσληψης ιωδίου σε πληθυσμούς μπορεί να υπολογιστούν από τις συγκεντρώσεις ιωδίου ούρων, χρησιμοποιώντας εκτιμήσεις του μέσου όγκου ούρων εικοσιτετραώρου και θεωρώντας μία μέση βιοδιαθεσιμότητα ιωδίου 92% με τη χρήση της ακόλουθης φόρμουλας:
Ιώδιο ούρων (μg/L)*0,0235*σωματικό βάρος (kg) = ημερήσια πρόσληψη ιωδίου (9)
Χρησιμοποιώντας τον ανωτέρω τύπο, μια μέση συγκέντρωση ιωδίου στα ούρα στα 100 μg/L, αντιστοιχεί περίπου σε μια μέση ημερήσια πρόσληψη των 150 μg ιωδίου.
Πίνακας 2. Επιδημιολογικά κριτήρια από τον ΠΟΥ για την εκτίμηση της πρόληψης ιωδίου διατροφής βασιζόμενη στο μέσο ή το εύρος των UI (4,56).
| Κατηγορία | UI (μg/L) | Πρόσληψη ιωδίου | Ιώδιο διατροφής |
| Παιδία που πηγαίνουν σχολείο | < 20 | Ανεπαρκής | Σοβαρή έλλειψη ιωδίου |
| 20-49 | Ανεπαρκής | Μετρίου βαθμού έλλειψη ιωδίου | |
| 50-99 | Ανεπαρκής | Βέλτιστη | |
| 100-199 | Επαρκής | Κίνδυνος ιωδοεπαγώμενου υποθυρεοειδισμού σε επιρρεπείς κατηγορίες | |
| 200-299 | Περισσότερο από επαρκής | Κίνδυνος αντιστρεπτών συνεπειών (ιωδοεπαγώμενος υποθυρεοειδισμός, αυτοάνοση θυρεοειδική νόσος) | |
| > 300 | Υπερβολική | ||
| Έγκυες | < 150 | Ανεπαρκής | |
| 150-249 | Επαρκής | ||
| 250-499 | Περισσότερο από επαρκής | ||
| > 500α | Υπερβολική | ||
| Θηλάζουσεςβ | < 100 | Ανεπαρκής | |
| ≥ 100 | Επαρκής | ||
| Παιδιά < 2 ετών | < 100 | Ανεπαρκής | |
| ≥ 100 | Επαρκής | ||
| Δεν υπάρχουν πληροφορίες για το ιώδιο διατροφής για τις εγκύους και τις θηλάζουσες γυναίκες στον πίνακα του ΠΟΥ και τα ανώτερα όρια για την μέση UI για τις θηλάζουσες και τα παιδιά < 2 ετών δεν έχουν καθοριστεί. | |||
| α Ο όρος υπερβολική σημαίνει περισσότερη ποσότητα από την απαραίτητη για να αποφευχθεί και να ελεγχθεί η ανεπάρκεια ιωδίου. | |||
β Στις θηλάζουσες μητέρες, οι αριθμοί των μέσων UI είναι μικρότερες από τις απαιτήσεις ιωδίου διότι η περίσσεια ιωδίου απεκκρίνεται στο μητρικό γάλα.
5.3. Θυρεοτρόπος ορμόνη (TSH)
Η συγκέντρωση της TSH στο πλάσμα, καθορίζεται κύρια από τα επίπεδα της κυκλοφορούσας θυρεοειδικής ορμόνης, η οποία με τη σειρά της αντανακλά τη διατροφική πρόσληψη ιωδίου και επομένως η TSH μπορεί να χρησιμοποιηθεί ως δείκτης της διατροφικής πρόσληψης ιωδίου. Ωστόσο σε παιδιά μεγαλύτερης ηλικίας και ενήλικες, παρόλο που τα επίπεδα της TSH του πλάσματος ίσως είναι ελαφρώς αυξημένα σε ιωδιοπενία, οι τιμές παραμένουν εντός των φυσιολογικών ορίων (28,32-35). Για το λόγο αυτό ο προσδιορισμός THS είναι σχετικά μη ευαίσθητος δείκτης της διατροφικής πρόσληψης ιωδίου σε ενήλικες. Σε αντίθεση αποτελεί ευαίσθητο δείκτη της επάρκειας του ιωδίου στα νεογνά (77,78).
5.4. Θυρεοσφαιρίνη (TG)
Η θυρεοσφαιρίνη συντίθεται αποκλειστικά στο θυρεοειδή αδένα, και είναι η πιο άφθονη ενδοθυροειδική πρωτεΐνη. Σε επάρκεια ιωδίου, μικρά ποσά θυρεοσφαιρίνης εκκρίνονται στη κυκλοφορία του αίματος και η συγκέντρωση της θυρεοσφαιρίνης φυσιολογικά είναι μικρότερη από 10 μg/λίτρο (79). Σε περιοχές ενδημικής βρογχοκήλης, η θυρεοσφαίρινη του πλάσματος αυξάνεται λόγω της μεγαλύτερης μάζας των θυρεοειδικών κυττάρων και της διέγερσης από την TSH (44). Η συγκέντρωση της θυρεοσφαιρίνης συσχετίζεται καλά με τη σοβαρότητα της ιωδιοπενίας, που εκτιμάται από τη συγκέντρωση του ιωδίου στα ούρα (80). Μελέτες παρέμβασης, εξετάζοντας το δυναμικό της θυρεοσφαιρίνης ως δείκτη ανταπόκρισης σε πρόσληψη ιωδιούχου ελαίου και ιωδιούχου καλίου, έδειξαν ότι τα επίπεδα της θυρεοσφαιρίνης μειώνονται γρήγορα μετά από χορήγηση συμπληρώματος ιωδίου και ότι αποτελεί περισσότερο ευαίσθητο δείκτη εκτίμησης των επιπέδων ιωδίου σε σχέση με την TSH ή τη θυροξίνη (81,82). Ωστόσο οι εμπορικά διαθέσιμες τεχνικές προσδιορισμού της θυρεοσφαιρίνης του πλάσματος, απαιτούν φλεβοκέντηση, φυγοκέντρηση και μεταφορά κατεψυγμένων δειγμάτων, τα οποία ίσως είναι δύσκολα σε απομακρυσμένες περιοχές.
Μια νέα μέθοδος προσδιορισμού της θυρεοσφαιρίνης που έχει αναπτυχθεί και αφορά σε ξηρές κηλίδες αίματος που λαμβάνονται από τρύπημα του δακτύλου, απλουστεύει τη συλλογή και μεταφορά (83,84). Σε προοπτικές μελέτες, η μέτρηση της θυρεοσφαιρίνης σε ξηρές κηλίδες αίματος, έδειξε να είναι μια ευαίσθητη μέθοδος προσδιορισμού της κατάστασης του ιωδίου και αντανακλά τη βελτίωση της θυρεοειδικής λειτουργίας, εντός μηνών, από τη χορήγηση συμπληρώματος ιωδίου (83,84). Ωστόσο αρκετά ερωτήματα χρειάζεται να απαντηθούν προτού η θυρεοσφαιρίνη μπορέσει να υιοθετηθεί ευρέως ως δείκτης εκτίμησης των επιπέδων του ιωδίου, όπως η ανάγκη για σύγχρονο προσδιορισμό των αντι-θυρεοσφαιρινικών αντισωμάτων προκειμένου να αποφευχθεί πιθανή υποεκτίμηση της θυρεοσφαιρίνης, Δεν είναι ξεκάθαρος ο επιπολασμός των αντι-θυρεοσφαιρινικών αντισωμάτων στην ιωδιοπενία όπως και το εάν αυτά κατακρημνίζονται μετά από προφυλακτική χορήγηση ιωδίου (85,86). Ένας άλλος περιορισμός είναι οι διακυμάνσεις μεταξύ των μεθόδων προσδιορισμού της θυρεοσφαιρίνης και η φτωχή επαναληψιμότητα, ακόμα και με τη χρήση τυποποιημένων μεθόδων (79).
Αυτό έχει καταστήσει δύσκολη τη καθιέρωση φυσιολογικών ορίων και /ή τιμών για τη διάκριση της βαρύτητας της ιωδοπενίας. Ωστόσο πρόσφατα έγιναν διαθέσιμα ένα διεθνούς εμβέλειας φάσμα αναφοράς καθώς και μια διεθνής σταθερά αναφοράς για τη μέτρηση της θυρεοσφαιρίνης σε ξηρές κηλίδες αίματος σε μη ιωδιοπενικά παιδιά σχολικής ηλικίας (4 – 40 μg/L) (84).
5.5. Συγκεντρώσεις θυρεοειδικών ορμονών
Οι συγκεντρώσεις των θυρεοειδικών ορμονών στο πλάσμα είναι φτωχός δείκτης εκτίμησης της επάρκειας σε ιώδιο. Σε ιωδιοπενικούς πληθυσμούς, η Τ3 του ορού, αυξάνει ή παραμένει αμετάβλητη και η Τ4 συνήθως μειώνεται (28,32). Ωστόσο αυτές οι αλλαγές είναι συχνά μέσα στα φυσιολογικά όρια και η αλληλοεπικάλυψη με αυτές σε πληθυσμούς με επάρκεια σε ιώδιο είναι αρκετά μεγάλη ώστε τα επίπεδα των θυρεοειδικών ορμονών να μην αποτελούν ευαίσθητο δείκτη εκτίμησης του διατροφικού ιωδίου (55).
5.6. Εκτίμηση της επάρκειας του ιωδίου στην εγκυμοσύνη
Η μέση συγκέντρωση του ιωδίου στα ούρα συνιστάται από τον παγκόσμιο οργανισμό υγείας και τη διεθνή επιτροπή για την αντιμετώπιση των ιωδιοπενικών διαταραχών (ICCIDD, International Council for Control of Iodine Deficiency Disorders), (55) για την εκτίμηση του διατροφικού ιωδίου σε εγκύους. Το αναμενόμενο ιώδιο ούρων σε μικρογραμμάρια μπορεί να προσδιοριστεί από τη συνιστώμενη ημερήσια πρόσληψη ιωδίου, θεωρώντας έναν μέσο όγκο ούρων εικοσιτετραώρου στα 0,9 ml/ώρα/kg (87) για κορίτσια ηλικίας 9-15 ετών και για ενήλικες γυναίκες γύρω στα 1,5 λίτρα (88) και μέση βιοδιαθεσιμότητα ιωδίου στο 92%. Έτσι η συνιστώμενη ημερήσια πρόσληψη των 220 – 250 μg ιωδίου στην εγκυμοσύνη, θα αντιστοιχούσε σε μια συγκέντρωση ιωδίου ούρων περίπου 135-150 μg/L. Περισσότερα στο οικείο κεφάλαιο.
5.7. Εκτίμηση της επάρκειας του ιωδίου στη γαλουχία
Ο μαζικός αδένας δύναται να συγκεντρώνει ιώδιο, και έτσι η χορήγηση ιωδίου στο νεογνό μέσω του μητρικού γάλατος ίσως να διατηρείται ακόμα και σε ιωδιοπενία της μητέρας (89,90). Αυτό ίσως βοηθά να εξηγηθεί, σε περιοχές με ιωδιοπενία, το γεγονός ότι οι συγκεντρώσεις ιωδίου στο μητρικό γάλα είναι συχνά υψηλότερες από τις αναμενόμενες, που εκτιμώνται από το προσδιορισμό του ιωδίου των ούρων σε μητέρες που θηλάζουν (90-92). Για παράδειγμα, πρόσφατη μελέτη σε γυναίκες που θηλάζουν στις Ηνωμένες Πολιτείες, με μέση συγκέντρωση ιωδίου στα ούρα 114 μg/L ανέφερε μέση συγκέντρωση ιωδίου στο μητρικό γάλα 155 μg/L (διακύμανση 3-1968 μg/L) (91). Περισσότερα στο οικείο κεφάλαιο.
5.8. Εκτίμηση της επάρκειας του ιωδίου στη νηπιακή ηλικία
Οι συστάσεις του Παγκόσμιου Οργανισμού Υγείας αναφέρουν ότι μέση συγκέντρωση ιωδίου ούρων τουλάχιστον 100 μg/L σε βρέφη είναι επαρκής (55). Την ίδια στιγμή, συστήνουν μια πρόσληψη 90 μg ιωδίου ημερησίως στη διάρκεια της νηπιακής ηλικίας (55) και το προτείνουν με βάσει αυτή τη μέση συγκέντρωση ιωδίου ούρων των 100 μg/L (θεωρώντας όγκο ούρων 300-500 ml). Αυτό όμως θα δημιουργούσε μια υψηλότερη τιμή τουλάχιστον στα 180 μg/L. Για να διευκρινιστεί αυτό, η συγκέντρωση ιωδίου ούρων μετρήθηκε πρόσφατα στη Σουηδία την πρώτη εβδομάδα μετά τη γέννηση, σε ένα αντιπροσωπευτικό εθνικό δείγμα υγιών, τελειόμηνων, με επαρκή επίπεδα ιωδίου, ευθυρεοειδικών βρεφών, που θήλασαν, (93). Η μέση συγκέντρωση ιωδίου ούρων ήταν 77 μg/L (95% διάστημα εμπιστοσύνης, φάσμα 76-81), δηλώνοντας ότι η ορισμένη από τον ΠΟΥ μέση συγκέντρωσης ιωδίου ούρων τιμή για επαρκή χορήγηση ιωδίου στη νηπιακή ηλικία (> 100 μg/L), ίσως είναι πολύ υψηλή για την πρώτη εβδομάδα μετά τη γέννηση. Βασιζόμενος σε αυτή τη μέση συγκέντρωση ιωδίου ούρων, και θεωρώντας όγκο ούρων 300 – 500 ml/ημέρα, προτείνει ημερήσια πρόσληψη 30 – 50 μg ιωδίου ημερησίως σε μη ιωδοπενικά βρέφη στη Σουηδία τη πρώτη εβδομάδα μετά τη γέννηση. Αυτή η εκτιμώμενη πρόσληψη ιωδίου έρχεται σε συμφωνία με δεδομένα από μελέτες ισοζυγίου σε βρέφη που έγιναν το 1989 στις Ηνωμένες Πολιτείες και οι οποίες έδειξαν ότι οι μέσες απαιτήσεις σε ιώδιο δεν υπερβαίνουν πιθανότατα τα 8-10 μg/kg*ημέρα και οι εκτιμώμενες βρεφικές απαιτήσεις σε ιώδιο τα 40 μg την ημέρα. Η συνιστώμενη ημερήσια πρόσληψη βασίζεται στις σχετικές ενεργειακές ανάγκες των ενηλίκων (93,94). Αυτά τα δεδομένα προτείνουν ότι οι τρέχουσες συστάσεις για πρόσληψη ιωδίου στα αρχικά στάδια της νηπιακής ζωής των 90 – 110 μg ημερησίως (9,55) είναι πολύ υψηλές. Απαιτούνται περισσότερα δεδομένα προκειμένου να διευκρινιστεί το ζήτημα. Η καθιέρωση σταθερών ορίων αναφοράς της συγκέντρωσης του ιωδίου των ούρων για μη ιωδοπενικά νεογνά και ενός απλού συστήματος συλλογής θα μπορούσε να διευκολύνει τη χρήση της συγκέντρωσης του ιωδίου των ούρων ως δείκτη επάρκειας ιωδίου σε αυτή την ηλικιακή ομάδα.
Ο μαζικός προσδιορισμός της TSH στα νεογνά, ίσως είναι επίσης χρήσιμη μέθοδος στην εκτίμηση της κατάστασης του ιωδίου (95-100). Ο προσδιορισμός της TSH, αποτελεί σε πολλές χώρες εξέταση ρουτίνας στα νεογνά προκειμένου να διαγνωστεί ο συγγενής υποθυρεοειδισμός. Ένας τέτοιος έλεγχος προσφέρει ταυτόχρονα έναν ευαίσθητο δείκτη εκτίμησης του διατροφικού ιωδίου (55). Ο προσδιορισμός της TSH στα νεογνά αποτελεί σημαντική εξέταση, καθώς αντανακλά την επάρκεια του ιωδίου στη διάρκεια μιας περιόδου κατά την οποία ο αναπτυσσόμενος εγκέφαλος είναι ιδιαίτερα ευαίσθητος στην ιωδοπενία. Συγκρινόμενος με αυτόν των ενηλίκων ο θυρεοειδής αδένα των νεογνών περιέχει λιγότερο ιώδιο, αλλά έχει υψηλότερους ρυθμούς μεταβολισμού του ιωδίου. Ειδικά όταν η χορήγηση ιωδίου είναι μειωμένη, η διατήρηση υψηλών μεταβολικών ρυθμών απαιτεί αυξημένη διέγερση της TSH. Για το λόγο αυτό τα επίπεδα της TSH στο πλάσμα είναι αυξημένα σε νεογνά με ιωδοπενία τις πρώτες εβδομάδες μετά τη γέννηση, κατάσταση που χαρακτηρίζεται ως παροδικός νεογνικός υποθυρεοειδισμός. Σε περιοχές ιωδιοπενίας, αύξηση του παροδικού νεογνικού υποθυρεοειδισμού, υποδεικνυόμενη από τιμές TSH πάνω από το ανώτερο όριο των 5 mU ανά λίτρο ολικού αίματος, που συλλέγεται 3 – 4 ημέρες μετά τη γέννηση, σε ποσοστό μεγαλύτερο του 3% των νεογνών υποδηλώνει την ύπαρξη ιωδοπενίας στον πληθυσμό (55).
Πρόσφατα δεδομένα από μια μεγάλη αντιπροσωπευτική σουηδική μελέτη, προτείνουν την TSH σε νεογνά, ο προσδιορισμός της οποίας γίνεται με τη χρήση ευαίσθητης μεθόδου σε δείγματα που συλλέχτηκαν 3 – 4 ημέρες μετά τη γέννηση, ως ευαίσθητο δείκτη ακόμη και οριακών επιπέδων διατροφικού ιωδίου στην εγκυμοσύνη (78). Αυτό απαιτεί επιβεβαίωση σε άλλες μη ιωδιοπενικές χώρες με προγράμματα μαζικού ελέγχου στα νεογνά.
6. Επιπτώσεις της ιωδοπενίας στον κύκλο ζωής
Η ιωδιοπενία έχει πολλαπλές δυσμενείς επιπτώσεις στην σωματική αύξηση (101) και την ανάπτυξη των ανθρώπων και των ζώων. Αυτές ορίζονται ως διαταραχές ιωδιοπενίας (Πίνακας 3) και είναι από τις πιο σημαντικές και συχνές παθήσεις στον άνθρωπο (3,4). Προκαλούνται από ανεπαρκή παραγωγή θυρεοειδικών ορμονών, λόγω έλλειψης επαρκούς ιωδίου.
Πίνακας 3. Διαταραχές έλλειψης ιωδίου ανα ηλικιακή κατηγορία (3,4).
| Ηλικιακή ομάδα | Συνέπειες της υγείας σε έλλειψη ιωδίου |
| Όλες οι ηλικίες | Βρογχοκήλη |
| Αυξημένη ευαισθησία του θυρεοειδούς στην πυρηνική ακτινοβολία | |
| Έμβρυο | Αποβολή |
| Θνησιγενές | |
| Συγγενείς ανωμαλίες | |
| Περινεογνική θνητότητα | |
| Νεογνό | Παιδική θνησιμότητα |
| Ενδημικός κρετινισμός | |
| Παιδί και έφηβος | Επηρεασμένη πνευματική λειτουργία |
| Καθυστερημένη φυσική ανάπτυξη | |
| Ενήλικας | Επηρεασμένη πνευματική λειτουργία |
| Μειωμένη εργασιακή παραγωγικότητα | |
| Τοξική οζώδης βρογχοκήλη | |
| Ιωδοεπαγώμενος υπερθυρεοειδισμός | |
| Αυξημένη εμφάνιση υποθυρεοειδισμού σε μέτρια ως σοβαρή έλλειψη ιωδίου | |
| Μειωμένη εμφάνιση υποθυρεοειδισμού σε ήπια ως μέτρια έλλειψη ιωδίου |
6.1. Εγκυμοσύνη και νηπιακή ηλικία
(Βλέπε οικείο κεφάλαιο)
6.1.1. Νευρολογική ανάπτυξη του εμβρύου
Σε περιοχές χρόνιας σοβαρής ιωδοπενίας, μητρική και εμβρυική υποθυροξιναιμία μπορεί να συμβεί τόσο στην αρχή, όσο και μετά τη κύηση (102). Οι θυρεοειδικές ορμόνες είναι απαραίτητες για τη φυσιολογική μετανάστευση των νευρώνων, και τη μυελίνωση του εγκεφάλου στη διάρκεια της εμβρυικής ζωής και στην αρχή της βρεφικής ηλικίας και επομένως υποθυροξιναιμία στη διάρκεια αυτών των κρίσιμων περιόδων προκαλεί μη αναστρέψιμες εγκεφαλικές βλάβες με αποτέλεσμα διανοητική καθυστέρηση και νευρολογικές ανωμαλίες (103). Η έκβαση εξαρτάται από τη χρονική στιγμή και τη σοβαρότητα της υποθυροξιναιμίας. Στη περιγραφή του κρετινισμού από τον McCarrison (103) στη βόρεια Ινδία, σκιαγραφήθηκαν μια νευρολογική μορφή με κύριο χαρακτηριστικό τα νευροκινητικά ελλείμματα και μια μυξοιδηματική μορφή, χαρακτηριζόμενη από αξιοσημείωτο υποθυρεοειδισμό και κοντό ανάστημα. Οι παρατηρήσεις του επεκτάθηκαν από μεταγενέστερους συγγραφείς (104,105). Τα τρία χαρακτηριστικά του νευρολογικού κρετινισμού στη πλήρως ανεπτυγμένη του μορφή είναι η διανοητική καθυστέρηση με στραβισμό, η κωφαλαλία και η κινητική σπαστικότατα. (Εικόνα 2). Η νοητική καθυστέρηση χαρακτηρίζεται από αξιοσημείωτη έκπτωση της αφαιρετικής σκέψης, ενώ λειτουργίες του αυτόνομου νευρικού συστήματος καθώς και η μνήμη διατηρούνται σχετικά καλά, εκτός σοβαρών περιπτώσεων. Η όραση δεν επηρεάζεται, ενώ η κώφωση είναι χαρακτηριστική και ίσως να είναι πλήρης στο 50% των κρετίνων, όπως επιβεβαιώθηκε από μελέτες ακουστικών προκλητών δυναμικών εγκεφαλικού στελέχους. Οι κινητικές διαταραχές δείχνουν ακαμψία των εγγύς μυών των άνω και κάτω άκρων και του κορμού και αντίστοιχη σπαστικότητα στους εγγύς μύες, με αυξημένα τα εν τω βάθει τενόντια αντανακλαστικά στα γόνατα, τους προσαγωγούς και τον δικέφαλο μυ (95). Σπαστικότητα στα πόδια και τα χέρια είναι ασυνήθης και η λειτουργία τους διατηρείται χαρακτηριστικά με αποτέλεσμα οι περισσότεροι κρετίνοι να μπορούν να περπατήσουν. Αυτό ίσως να είναι χρήσιμο στη διαφορική διάγνωση του κρετινισμού από άλλες μορφές εγκεφαλικής παράλυσης, που συνήθως συναντώνται σε ενδημικές περιοχές, όπως εγκεφαλική παράλυση από τραυματισμό στη γέννηση ή μηνιγγίτιδα.
Ο τυπικός μυξοιδηματικός κρετίνος, έχει μικρότερο βαθμό σοβαρής νοητικής καθυστέρησης από ότι στη νευρολογική μορφή, αλλά έχει όλα τα χαρακτηριστικά του σοβαρού υποθυρεοειδισμού, έκδηλα από τα πρώτα στάδια της ζωής, συμπεριλαμβανομένου της σοβαρής καθυστέρησης της ανάπτυξης, ατελή ωρίμανση χαρακτηριστικών, ατροφία των γνάθων, πρησμένα χαρακτηριστικά, μυξοιδηματικό, παχύ και ξηρό δέρμα, ξηρά και αραιά μαλλιά, καθυστερημένη σεξουαλική ανάπτυξη. Σε αντίθεση με το γενικό πληθυσμό και τον κρετινισμό νευρολογικής μορφής, η βρογχοκήλη συνήθως απουσιάζει και ο θυρεοειδής αδένας είναι ατροφικός (96). Οι συγκεντρώσεις των Τ3 και Τ4 στο πλάσμα είναι εξαιρετικά χαμηλές, συχνά μη ανιχνεύσιμες και η συγκέντρωση της TSH δραματικά υψηλή. Ίσως είναι δύσκολο να διαφοροποιηθούν αυτές οι δύο μορφές κρετινισμού και μπορεί να εκδηλωθεί ως μεικτή μορφή με χαρακτηριστικά και των δύο (95,96). Είναι αβέβαιο εάν η ήπια και η μέση ιωδιοπενία στη μητέρα προκαλεί λεπτές δυσλειτουργίες σε γνωστικές ή/και νευρολογικές λειτουργίες στον απόγονο. Δύο μελέτες ασθενών-ομάδας ελέγχου σε γυναίκες με επαρκή ιώδιο και ήπια θυρεοειδική υπολειτουργία, ανέφεραν αναπτυξιακή δυσλειτουργία στους απογόνους τους. Στις Ηνωμένες Πολιτείες (106), ο δείκτης νοημοσύνης σε παιδιά ηλικίας 7 έως 9 ετών μητέρων που εμφάνισαν υποκλινικό υποθυρεοειδισμό στη διάρκεια της εγκυμοσύνης (αυξημένη TSH στη διάρκεια του δεύτερου τριμήνου της κύησης), ήταν 7 μονάδες χαμηλότερος συγκρινόμενος με αυτόν παιδιών από μητέρες με φυσιολογική θυρεοειδική λειτουργία στη διάρκεια της εγκυμοσύνης. Στην Ολλανδία (107), η ανάπτυξη νηπίων στα 2 έτη ήταν επηρεασμένη σε παιδιά γυναικών με ελεύθερη Τ4 κάτω από τη δέκατη εκατοστιαία θέση τη δωδέκατη εβδομάδα κύησης. Αυτές οι μελέτες υποδηλώνουν ότι νοητικά ελλείμματα μπορούν να συμβούν στους απογόνους, ακόμα και εάν η μητέρα εμφανίζει ήπιο και ασυμπτωματικό υποθυρεοειδισμό. Ωστόσο, η θυρεοειδική δυσλειτουργία της μητέρας σε αυτές τις μελέτες δεν οφειλόταν πιθανά σε ιωδοπενία, αφού αυτές διεξήχθησαν σε πληθυσμούς με επαρκή πρόσληψη ιωδίου. Δεν είναι σαφές εάν η μητρική υποθυροξιναιμία και /ή ο υποκλινικός υποθυρεοειδισμός μπορούν να συμβούν σε κατά τα άλλα υγιείς εγκύους με ήπια και μέση ιωδιοπενία (βλέπε σχετικό κεφάλαιο).

Eικόνα 2. Ηλικιωμένος κρετίνος στο Κονγκό.
Ελεγχόμενες παρεμβάσεις στη σοβαρή ιωδοπενία. Σε μία μελέτη ορόσημο σε μια περιοχή με βαριά ιωδιοπενία στην Παπούα-Νέα Γουινέα (108,109), οικογένειες έλαβαν εναλλάξ ένεση φυσιολογικού ορού (ομάδα ελέγχου) ή ιωδιούχου λαδιού. Εκτιμήθηκε ο επιπολασμός του κρετινισμού στα 4 και 10 έτη παρακολούθησης, με τη χρήση περισσότερο ευαίσθητων διαγνωστικών μεθόδων στα 10 έτη παρακολούθησης. Η χορήγηση συμπληρώματος ιωδίου, συσχετίστηκε με σημαντική μείωση του επιπολασμού του ενδημικού κρετινισμού. Συγκεκριμένα στην ηλικία των τεσσάρων ετών, ο σχετικός κίνδυνος (95% διάστημα εμπιστοσύνης ), ήταν 0,27 (0,12-0,060), ενώ στην ηλικία των 10 ετών ήταν 0,17 (0,05 – 0,58). Οι συγγραφείς διεξήγαγαν μια μακροχρόνια παρακολούθηση σε ένα μικρό υπόδειγμα υγιών παιδιών στην ηλικία των 11 και 15 ετών(110) και δεν βρήκαν σημαντικές διαφορές στις κινητικές και γνωστικές λειτουργίες μεταξύ των παιδιών που γεννήθηκαν από οικογένειες που έλαβαν συμπλήρωμα ιωδίου και αυτών από τις οικογένειες της ομάδας ελέγχου που δεν έλαβαν.
Σε μια μελέτη στο Ζαΐρ, οι συμμετείχαν έγκυες γυναίκες που παρακολουθούσαν κλινικές προγεννητικού ελέγχου σε μια περιοχή σοβαρής ιωδοπενίας με 4% ποσοστό κρετινισμού (111-113). Οι έγκυες, χωρίστηκαν τυχαία σε δύο ομάδες, από της οποίες η μία έλαβε ένεση ιωδιούχου λαδιού και η άλλη ένεση βιταμινών. Οι γυναίκες βρίσκονταν στην 28η εβδομάδα κύησης όταν τους χορηγήθηκε η θεραπεία. Δείκτες ψυχοκινητικής ανάπτυξης των απογόνων μετρήθηκαν σε ηλικία περίπου 72 μηνών, αλλά υπήρξε απώλεια στη παρακολούθηση της τάξεως του 50% και στις δύο ομάδες. Οι δείκτες της ψυχοκινητικής ανάπτυξης ήταν σημαντικά υψηλότερα στην ομάδα του που έλαβε το ιώδιο και η θεραπεία είχε ως αποτέλεσμα πολύ λιγότερα παιδιά με χαμηλό ψυχοκινητικό δείκτη.
Σε μια μελέτη στη δυτική Κίνα, σε περιοχή με σοβαρή ιωδοπενία και ενδημικό κρετινισμό, οι συμμετέχοντες ήταν ομάδες παιδιών ηλικίας από τη γέννηση ως τριών ετών και γυναίκες σε κάθε τρίμηνο της κύησης (114). Παιδιά ηλικίας 1 – 3 ετών που δεν είχαν λάβει θεραπεία, αποτέλεσαν την ομάδα ελέγχου. Η παρέμβαση αφορούσε σε χορήγηση ιωδιούχου ελαίου από το στόμα και τα παιδιά καθώς και τα νεογέννητα μητέρων που έλαβαν τη θεραπεία παρακολουθήθηκαν για δύο χρόνια, Τα κύρια αποτελέσματα ήταν η νευρολογική εξέταση, η περίμετρος κεφαλής, δείκτες νοητικής και κινητικής ανάπτυξης. Μια μικρή υποομάδα παρακολουθήθηκε για περίπου εφτά χρόνια (115). Ο επιπολασμός, μέτριων ή σοβαρών νευρολογικών ανωμαλιών στα βρέφη των οποίων οι μητέρες έλαβαν ιώδιο στο πρώτο ή δεύτερο τρίμηνο της κύησης, ήταν 2%, συγκρινόμενο με το 7% που παρατηρήθηκε στα βρέφη των μητέρων που έλαβαν ιώδιο στο τρίτο τρίμηνο της κύησης ή μετά τη γέννηση. Η θεραπεία στο τρίτο τρίμηνο ή μετά τη γέννηση, δε βελτίωσε τη νευρολογική κατάσταση, ωστόσο η ανάπτυξη της κεφαλής και ο δείκτης ανάπτυξης βελτιώθηκαν ελαφρώς. Η επίπτωση της μικροκεφαλίας ήταν 27% στα παιδιά που δεν έλαβαν θεραπεία σε σύγκριση με το 11% στα παιδιά που έλαβαν και ο μέσος δείκτης ανάπτυξης στην ηλικία των δύο ετών ήταν υψηλότερος στα παιδία που έλαβαν θεραπεία σε σύγκριση με τα αυτά που δεν έλαβαν (114).
Σε μια μακροχρόνια μελέτη παρακολούθησης (115), εξετάστηκε η ανάπτυξη παιδιών (ηλικίας 4 έως 7,3 έτη), των οποίων η μητέρα έλαβε ιώδιο στη διάρκεια της εγκυμοσύνης και παιδιών που έλαβαν ιώδιο για πρώτη φόρα σε ηλικία δύο ετών. Μια δεύτερη ομάδα παιδιών ηλικίας 5,8 έως 6,9 ετών, των οποίων οι μητέρες έλαβαν ιώδιο στην εγκυμοσύνη εξετάστηκαν δύο χρόνια αργότερα. Η περίμετρος της κεφαλής βελτιώθηκε σε αυτά που έλαβαν ιώδιο στην εγκυμοσύνη, συγκριτικά με αυτά που έλαβαν ιώδιο σε ηλικία δύο ετών και σε αυτά που έλαβαν ιώδιο πριν το τέλος του δευτέρου τριμήνου συγκριτικά με αυτά που έλαβαν στη διάρκεια του τρίτου τριμήνου της κύησης. Η χορήγηση ιωδίου πριν το τρίτο τρίμηνο της κύησης είχε ως αποτέλεσμα υψηλότερα σκορ ψυχοκινητικής ανάπτυξης σε αυτά τα παιδιά σε σχέση με αυτά στα οποία το ιώδιο χορηγήθηκε αργότερα στη κύηση ή στην ηλικία των δύο ετών (115).
Σε μια τυχαιοποιημένη μελέτη (116,117), μελετήθηκαν γυναίκες σε ηλικία τεκνοποίησης από τρία χωριά των Άνδεων, περιοχή σοβαρής ιωδιοπενίας με 1-3% ποσοστό κρετινισμού. Στη πρώτη ομάδα χορηγήθηκε ένεση ιωδιούχου λαδιού πριν τη σύλληψη ή στη διάρκεια της εγκυμοσύνης, ενώ στην ομάδα ελέγχου δεν χορηγήθηκε κάποια θεραπεία. Σε μια υποομάδα των παιδιών ηλικίας ενός και τεσσάρων ετών εκτιμήθηκαν δείκτες νοητικής ανάπτυξης. Στα αρχικά αποτελέσματα, δε βρέθηκε στατιστικά σημαντική διαφορά όσον αφορούσε τη γνωστική ανάπτυξη (116). Μια ακόλουθη εκ νέου ανάλυση μελέτησε εκ νέου τα παιδιά χωρίζοντας τα σε δύο ομάδας, ιώδιο-επαρκή και ιωδιοπενικά τη χρονική στιγμή που διεξήχθησαν οι γνωστικές δοκιμασίες, βασιζόμενοι στη συγκέντρωση του ιωδίου στα ούρα και στη συγκέντρωση της Τ4 στο πλάσμα. Αυτή η ανάλυση βρήκε ένα σημαντικά υψηλότερο δείκτη νοημοσύνης στην ομάδα των παιδιών με επάρκεια ιωδίου συγκριτικά με την ιωδιοπενική ομάδα (117).
Σε δύο χωριά στο Εκουαδόρ με σοβαρή ιωδοπενία και ποσοστό κρετινισμού πάνω από 8%, χορηγήθηκε θεραπεία ιωδίου στους κατοίκους του πρώτου χωριού, ενώ το δεύτερο δεν έλαβε κάποια θεραπεία και αποτέλεσε την ιωδιοπενική ομάδα ελέγχου (118). Οι συμμετέχοντες ήταν γυναίκες αναπαραγωγικής ηλικίας, έγκυες καθώς και παιδιά και η κάλυψη με ιώδιο εκτιμήθηκε να είναι περίπου 90%. Στην ομάδα του πρώτου χωριού χορηγήθηκε ένεση ιωδιούχου λαδιού και παρακολουθήθηκε ανά τετραετία για συνολικά είκοσι περίπου έτη. Μια σειρά μελετών παρακολούθησης, διεξήχθησαν μετά προκειμένου να εξεταστούν τα αποτελέσματα στους απογόνους (118,119). Στην ομάδα που έλαβε θεραπεία δεν γεννήθηκε πλέον παιδί με κρετινισμό. Δύο χρόνια μετά την έναρξη της θεραπείας, ο μέσος δείκτης ανάπτυξης στα βρέφη, δε διέφερε σημαντικά ανάμεσα στα δύο χωριά. Ωστόσο, ο μέσος δείκτης νοημοσύνης, που μετρήθηκε σε παιδιά πρώτης και δευτέρας δημοτικού, ήταν κατά 10 μονάδες υψηλότερος στο χωρίο που έλαβε τη θεραπεία σε σύγκριση με το χωριό-ελέγχου. Πέντε χρόνια μετά την έναρξη της θεραπείας, το χωριό που έλαβε θεραπεία χωρίστηκε σε τρείς υποομάδες. α) παιδιά που γεννήθηκαν μετά την έναρξη της θεραπείας, β) παιδιά των οποίων οι μητέρες έλαβαν ιώδιο στη διάρκεια της εγκυμοσύνης και γ) παιδιά, οι μητέρες των οποίων έλαβαν ιώδιο πριν τη σύλληψη. Η τελευταία ομάδα εμφάνισε σημαντικά υψηλότερο δείκτη νοημοσύνης από ότι οι δύο πρώτες ομάδες. Μελέτες που διεξήχθησαν αρκετά χρόνια αργότερα σε αυτά, επίσης έδειξαν ότι η θεραπεία ιωδίου στο τέλος της εγκυμοσύνη ή μετά τη γέννηση δεν είχε όφελος στο δείκτη νοημοσύνης σε παιδιά ηλικίας 3-5 ετών, αλλά η θεραπεία στην αρχή της εγκυμοσύνης ή προ της σύλληψης βελτίωσε το δείκτη νοημοσύνης (119).
Αυτές οι πέντε μελέτες παρέμβασης (108-119), ήταν πρωτοποριακές μελέτες που έγιναν κάτω από δύσκολες συνθήκες σε απομακρυσμένες περιοχές. Η μελέτη στη Παπούα- Νέας Γουινέας, είχε τον ισχυρότερο σχεδιασμό και καταδεικνύει σαφώς, ότι η θεραπεία με ιωδίου σε έναν πληθυσμό με υψηλά επίπεδα κρετινισμού, μειώνει ή εξαλείφει την επίπτωση του κρετινισμού. Οι μελέτες στο Ζαΐρ και την Κίνα αναφέρουν ότι οι δείκτες ανάπτυξης ήταν 10-20% υψηλότερα σε παιδιά που γεννήθηκαν από μητέρες που έλαβαν θεραπεία με ιώδιο πριν ή στη διάρκεια της εγκυμοσύνης. Οι μελέτες στο Περού και το Εκουαδόρ, ήταν λιγότερο καλά ελεγχόμενες, αλλά επίσης προτείνουν μέτρια γνωστικά οφέλη σε βρέφη και παιδιά οι μητέρες των οποίων έλαβαν θεραπεία με ιώδιο. Παρόλο που τα δεδομένα από τη μελέτη στο Ζαΐρ, υποδεικνύουν ότι η διόρθωση της ιωδοπενίας, ακόμα και στη μέση ή το τέλος της κύησης βελτιώνει τη γνωστική ανάπτυξη των βρεφών, δεδομένα από την άλλη μελέτη έδειξαν ότι νευρολογικά ελλείμματα μπορούν μόνο να προληφθούν όταν η θεραπεία ιωδίου δοθεί πριν ή νωρίς στην εγκυμοσύνη.
Σε δική μας μελέτη μετά από χορήγηση caps ιωδιωμένου λαδιού (190 mg iodine/caps) σε 3 εξαμηνιαίες δόσεις σε πληθυσμό 190.000 παδιών ηλικίας 6 – 15 ετών που έπασχαν από βαρειά ιωδιοπενία στον ορεινό όγκο του Καυκάσου στο Αζερμπαϊτζάν διαπιστώθηκε μετά από 3 χρόνια δραματική μείωση της βρογχοκήλης και αύξηση της απέκκρισης ιωδίου στα ούρα (120).
Ελεγχόμενες παρεμβάσεις σε καταστάσεις ήπιας και μέτριας ιωδοπενίας. Τα γνωστικά ελλείμματα που συνδέονται με ιωδοπενία, ίσως να μην περιορίζονται μόνο σε απομακρυσμένες περιοχές με σοβαρή ιωδοπενία. Αρκετοί συγγραφείς έχουν συμφωνήσει ότι ακόμα και η ήπια έως μέτρια ιωδοπενία στην εγκυμοσύνη, η οποία είναι ακόμα παρούσα σε αρκετές χώρες στην Ευρώπη, ίσως επηρεάζει τις γνωστικές λειτουργίες στους απογόνους (60-62,121-123). Οι ελεγχόμενες μελέτες θεραπείας με ιώδιο, σε εγκύους με ήπια έως μέτρια ιωδιοπενία, που συζητούνται στις επόμενες παραγράφους, δεν αναφέρουν δεδομένα όσον αφορά την ανάπτυξη βρεφών ή παιδιών. Ωστόσο, αρκετές καταγεγραμμένες μετρήσεις ίσως είναι δείκτες της μελλοντικής ανάπτυξης των βρεφών, συμπεριλαμβανομένου της θυρεοειδικής λειτουργίας της μητέρας και του νεογνού (βλέπε σχετικό κεφάλαιο).
6.1.2. Βρεφική θνησιμότητα
Η βρεφική επιβίωση είναι βελτιωμένη σε νεογέννητα μητέρων στις οποίες η ιωδιοπενία διορθώθηκε πριν ή κατά τη διάρκεια της εγκυμοσύνης. Σε περιοχές σοβαρής ιωδοπενίας, υπάρχει αντίστροφη συσχέτιση μεταξύ των επιπέδων της Τ4 της μητέρας στη διάρκεια της εγκυμοσύνης και τα ποσοστά θανάτου των απογόνων (125). Ο DeLong και οι συνεργάτες του (126), πρόσθεσαν ιωδιούχο κάλιο στο νερό άρδευσης για μια περίοδο 2 έως 4 εβδομάδων σε τρείς περιοχές με σοβαρή ιωδοπενία στην Κίνα και βρήκαν μεγάλη μείωση στη νεογνική και βρεφική θνησιμότητα στα επόμενα 2 – 3 χρόνια σε σύγκριση με τις περιοχές οι οποίες δεν έλαβαν ιώδιο. Η μέση συγκέντρωση ιωδίου στα ούρα αυξήθηκε σε γυναίκες αναπαραγωγικής ηλικίας από λιγότερο από 10 στα 55 μg/L, ενώ ο δείκτης βρεφικής θνησιμότητας μειώθηκε στις τρείς περιοχές που έλαβαν ιώδιο από 58,2 στα 28,7 ανά 1000 γεννήσεις, από 47,4 στα 19,1 ανά 1000 γεννήσεις και από 106,2 στα 57,3 ανά 1000 γεννήσεις. Παρόμοια αποτελέσματα παρατηρήθηκαν επίσης για τη νεογνική θνησιμότητα. Η πιθανότητα νεογνικού θανάτου μειώθηκε περίπου κατά 65% στο πληθυσμό, πού έλαβε θεραπεία με ιώδιο.
Ιωδιούχο λάδι το οποίο χορηγήθηκε ενδομυϊκά σε ιωδιοπενικές εγκύους στο Ζαΐρ στην 28η περίπου εβδομάδα κύησης, μείωσε τη βρεφική θνητότητα (127). Σε γυναίκες με βαριά ιωδιοπενία, ο δείκτης βρεφικής θνησιμότητας σε βρέφη μητέρων που έλαβαν θεραπεία και βρέφη μητέρων χωρίς θεραπεία, ήταν 113 και 243 ανά 1000 γεννήσεις αντίστοιχα και σε μητέρες με ήπια έως μέτρια ιωδοπενία, ο δείκτης βρεφικής θνησιμότητας με και χωρίς θεραπεία ήταν 146 και 204 ανά 1000 γεννήσεις αντίστοιχα. Στην Αλγερία τα ποσοστά αποβολής, θνησιγένειας και πρωιμότητας ήταν σημαντικά χαμηλότερα ανάμεσα στις γυναίκες που έλαβαν ιωδιούχο λάδι 1 έως 3 μήνες πριν τη σύλληψη ή στη διάρκεια της εγκυμοσύνης σε σχέση με τις γυναίκες που δεν έλαβαν (128).
Η βρεφική επιβίωση, ίσως να βελτιώνεται με τη χορήγηση συμπληρώματος ιωδίου στη νεογνική περίοδο. Μια τυχαιοποιημένη, εικονικού φαρμάκου-ελεγχόμενη μελέτη χορήγησης 100μg ιωδίου με τη μορφή ιωδιούχου λαδιού από το στόμα, διεξήχθη σε περιοχή υποτιθέμενης ιωδοπενίας στην Ινδονησία προκειμένου να εκτιμηθεί η επίδραση της στη θνησιμότητα (129). Το ιώδιο ή το εικονικό φάρμακο χορηγήθηκαν σε συνδυασμό με το εμβόλιο της πολιομυελίτιδας από το στόμα. 617 βρέφη έλαβαν θεραπεία στην ηλικία περίπου των έξι εβδομάδων και παρακολουθήθηκαν μέχρι τον έκτο μήνα της ζωής. Υπήρξε μια σημαντική μείωση της τάξεως του 72% στο κίνδυνο βρεφικού θανάτου στη διάρκεια των πρώτων δύο μηνών της παρακολούθησης. Σε μια μεγάλη μελέτη χρονικής στιγμής στην Ινδονησία, η χρήση επαρκώς ιωδιωμένου αλατιού, συνδέθηκε με σημαντικά χαμηλότερο επιπολασμό υποσιτισμού στα παιδιά και θνησιμότητας στα νεογνά, βρέφη και παιδιά ηλικίας κάτω των 5 ετών (130). Συνοψίζοντας τα αποτελέσματα, προτείνεται ότι η αναπλήρωση του ιωδίου σε εγκύους με βαριά ιωδιοπενία ή σε βρέφη ίσως μειώνει το δείκτη βρεφικής θνησιμότητας τουλάχιστον κατά 50%.
6.2. Παιδική ηλικία
6.2.1. Νόηση
Υπήρξαν πολλές μελέτες, που σύγκριναν τη νοητική ή/και τη κινητική λειτουργία σε παιδιά από περιοχές με χρόνια ιωδοπενία και περιοχές επαρκείς σε ιώδιο, συμπεριλαμβανομένου παιδιών από την Ασία και την Ευρώπη (131-146). Αυτές οι μελέτες, με λίγες εξαιρέσεις, ανέφεραν μειωμένη διανοητική λειτουργία και κινητικές δεξιότητες στα παιδιά που προέρχονταν από ιωδιοπενικές περιοχές. Ωστόσο, μελέτες παρατήρησης, περιπλέκονται συχνά από άλλους παράγοντες που συνεπιδρούν, οι οποίοι επηρεάζουν την ανάπτυξη του παιδιού (147). Επίσης, αυτές οι μελέτες δεν θα μπορούσαν να διακρίνουν ανάμεσα στην επίδραση της επίμονης ιωδοπενίας στη διάρκεια της εμβρυικής ζωής και στην επίδραση της τρέχουσας κατάστασης του ιωδίου. Δύο μετά-αναλύσεις έχουν αναφερθεί σε αυτό το θέμα (148,149). Η πρώτη πραγματοποιήθηκε για 21 πειραματικές μελέτες και μελέτες παρατήρησης, συμπεριλαμβάνοντας μια ομάδα ελέγχου της επίδρασης της ιωδοπενίας στη νοητική ανάπτυξη (148). Από αυτές, 16 μελέτες αφορούσαν παιδιά, 4 συμπεριλάμβαναν ενήλικες και δύο συμπεριλάμβαναν βρέφη, τα όρια ηλικίας ήταν 2 έως 45 έτη. Η τελική μετα-ανάλυση, περιλάμβανε 2214 συμμετέχοντες, κυρίως παιδιά, και ο δείκτης νοημοσύνης χρησιμοποιήθηκε ως η κύρια μέτρηση έκβασης. Όλες οι μελέτες διεξήχθησαν σε περιοχές μέτριας έως σοβαρής ιωδοπενίας. Ο δείκτης νοημοσύνης των ομάδων χωρίς ιωδοπενία ήταν κατά μέσο όρο 13,5 μονάδες υψηλότερος από αυτόν στις ομάδες με ιωδοπενία. Ωστόσο οι μελέτες που περιελήφθησαν σε αυτήν την ανάλυση ήταν ποικίλης ποιότητας, τα περισσότερα δεδομένα προήλθαν από μελέτες παρατήρησης και μόνο έξι από τα υποδεικνυόμενα άρθρα είχα δημοσιευτεί σε έγκριτα περιοδικά. Τα κριτήρια επιλογής για τη δεύτερη μετά ανάλυση (149), περιελάμβαναν όλες τις μελέτες που διεξήχθησαν στην Κίνα, συνέκριναν τα παιδιά κάτω των 16 ετών, πού ζούσαν σε φυσικά ιώδιο-επαρκείς περιοχές με αυτά σε 1. Περιοχές σοβαρής ιωδοπενίας 2. Παιδιά που ζούσαν σε ιωδιοπενικές περιοχές, που γεννήθηκαν πριν την εισαγωγή της προφυλακτικής χορήγησης ιωδίου, 3. Παιδιά ιωδιοπενικών περιοχών, που γεννήθηκαν μετά την εισαγωγή της προφυλακτική χορήγησης ιωδίου. Ο δείκτης νοημοσύνης μετρήθηκε χρησιμοποιώντας τις κλίμακες ευφυΐας Binet ή Raven. Το μέγεθος της επίδρασης ήταν μια αύξηση των 12,45 , 12,3 και 4,8 μονάδων, αντίστοιχα, για την ομάδα με επάρκεια ιωδίου και τα τελευταίες δύο ομάδες συγκρινόμενοι με αυτών στις ιωδιοπενικές περιοχές. Συγκρινόμενα με παιδιά με σοβαρή ιωδοπενία, υπήρξε μια αύξηση περίπου των 12 μονάδων στη κλίμακα του δείκτη νοημοσύνης για τα παιδιά που γεννήθηκαν τουλάχιστον τρία χρονιά μετά την εισαγωγή της προφύλαξης ιωδίου. Παρόλο που έχει δηλωθεί, ότι οι ομάδες ελέγχου ήταν συγκρίσιμες κοινωνικά, οικονομικά και μορφωτικά, είναι δύσκολο να κριθεί η συνολική ποιότητα των μελετών που αναφέρθησαν στους κινέζους και συμπεριλήφθησαν σε αυτή τη μετα-ανάλυση. Πάρα τους σαφείς περιορισμούς των κύριων δεδομένων χρονικής στιγμής που συμπεριλαμβάνονται σε αυτές τις δύο μετα-αναλύσεις (148,149), τα συνολικά συμπεράσματα είναι παρόμοια. Εκτιμούν ότι πληθυσμοί και ιδιαίτερα παιδιά με χρόνια σοβαρή ιωδοπενία εμφανίζουν μια μέση μείωση στο δείκτη νοημοσύνης των 12-13,5 μονάδων.
Ωφελεί η θεραπεία με ιώδιο στη σχολική ηλικία σε ένα παιδί το οποίο έχει γεννηθεί και μεγαλώσει σε καταστάσεις ιωδιοπενίας; Αρκετές, τυχαιοποιημένες ελεγχόμενες μελέτες σε παιδιά σχολικής ηλικίας προσπάθησαν να εκτιμήσουν την επίδραση του ιωδιούχου λαδιού στη νόηση (150-153). Τρεις από τις μελέτες (150,152,153) δε βρήκαν επίδραση, ενώ μια έδειξε ότι η νόηση βελτιώθηκε με τη θεραπεία (151). Ωστόσο προβλήματα μεθοδολογίας περιορίζουν την ερμηνεία λόγω του ότι σε δύο από τις μελέτες συνεπέδρασε η σημαντική βελτίωση στα επίπεδα του ιωδίου στην ομάδα ελέγχου (150,153), ενώ σε δύο, η ομάδα που έλαβε θεραπεία παρέμεινε ιωδιοπενική στον επανέλεγχο (151,152). Σε μια πρόσφατη εικονικού φαρμάκου –ελεγχόμενη διπλή τυφλή μελέτη παρέμβασης διάρκειας 6 μηνών, 310 παιδιά ηλικίας 10 έως 12 ετών, με μέτρια ιωδοπενία στην Αλβανία έλαβαν είτε 400 μg ιωδίου σε μορφή ιωδιούχου λαδιού από το στόμα ή εικονικό φάρμακο. Τα παιδιά επεβλήθησαν σε νοητικές και κινητικές δοκιμασιών οι οποίες περιελάμβαναν μετρήσεις επεξεργασίας πληροφοριών, εργασιακή μνήμη, επίλυση οπτικών προβλημάτων, οπτική αναζήτηση, λεπτές κινητικές δεξιότητες. Η θεραπεία με ιώδιο βελτίωσε αξιοσημείωτα τα επίπεδα του ιωδίου και τη λειτουργία του θυρεοειδούς αδένα. Στις 24 εβδομάδες, η μέση συγκέντρωση του ιωδίου στα ούρα στην ομάδα που έλαβε θεραπεία ήταν 172 μg/L, και η μέση συγκέντρωση της Τ4 αυξήθηκε κατά περίπου 40%. Συγκρινόμενα με την ομάδα που έλαβε το εικονικό φάρμακο, η θεραπεία με ιώδιο, βελτίωσε σημαντικά την απόδοση στις δεξιότητες της επεξεργασίας πληροφοριών, λεπτές κινήσεις, και την επίλυση οπτικών προβλημάτων. Αυτά τα ευρήματα χρειάζεται να επιβεβαιωθούν και σε άλλους πληθυσμούς, αλλά φαίνεται ότι σε παιδιά που γεννήθηκαν και μεγάλωσαν σε ιωδιοπενικές περιοχές, η νοητική δυσλειτουργία είναι τουλάχιστον εν μέρει αναστρέψιμη με αναπλήρωση του ιωδίου (154).
6.2.2. Σωματική ανάπτυξη
Σοβαρή ιωδοπενία στη διάρκεια της εμβρυικής ζωής, προκαλεί κρετινισμό και νανισμό και το ιωδιούχο λάδι που χορηγείται στη διάρκεια της εγκυμοσύνης σε περιοχές μέτριας ιωδοπενίας αυξάνει το βάρος γέννησης του νεογνού κατά 100 – 200 g (126-155). Λιγότερο σαφής είναι η σχέση μεταξύ ιωδοπενίας και σωμάτικής ανάπτυξης μετά τη γέννηση. Δεδομένα από μελέτες χρονικής στιγμής όσο αφορά τη πρόσληψη ιωδίου και ανάπτυξη του παιδιού είναι μικτά (156-159), με τις περισσότερες μελέτες να βρίσκουν μέτριες θετικές συσχετίσεις. Σε πέντε χώρες της Ασίας η πρόσβαση των νοικοκυριών στο ιωδιούχο αλάτι συσχετίστηκε με αυξημένο για την ηλικία βάρος νεογνού και αυξημένη περίμετρο του μέσου άνω βραχίονα στα βρέφη(160). Ωστόσο, ελεγχόμενες μελέτες παρέμβασης με ιωδιούχο λάδι (150,151) ή ιώδιο που χορηγήθηκε μαζί με άλλα μικροστοιχεία (161-163) δεν έδειξαν γενικά να επηρεάζεται η ανάπτυξη του παιδιού.
Τα επίπεδα του ιωδίου, ίσως επηρεάζουν την σωματική ανάπτυξη, μέσω δράσης στο θυρεοειδικό άξονα. Η χορήγηση θυροξίνης σε υποθυρεοειδικά παιδιά αυξάνει την σωματική τους ανάπτυξη (164). Οι θυρεοειδικές ορμόνες διεγείρουν την έκκριση της αυξητικής ορμόνης και ρυθμίζουν την δράση της αυξητικής ορμόνης στους υποδοχείς της (165-167). Ο IGF-I και η IGFσυνδετική πρωτεΐνη IGFBP-3, εξαρτώνται επίσης από την κατάσταση του θυρεοειδούς αδένα (168,169). Συγκεκριμένα, ο υποθυρεοειδισμός μειώνει τα επίπεδα των IGF-I και IGFBP-3 που κυκλοφορούν στο αίμα και η χορήγηση θυροξίνης τα αυξάνει (170,171). Σε παιδιά με ιωδοπενία, η επηρεασμένη θυρεοειδική λειτουργία και η βρογχοκήλη συσχετίζονται αντιστρόφως με τις συγκεντρώσεις των IGF-I και IGFBP-3 στο αίμα (172-174). Ωστόσο, σε μία μη ελεγχόμενη μελέτη, η χορήγηση από του στόματος ιωδιούχου λαδιού, παραδόξως μείωσε τις συγκεντρώσεις των IGF-I και IGFBP-3 στο αίμα σε παιδία από τη Τουρκία (175).
Ο σκοπός μιας πρόσφατης μελέτης (176), ήταν να προσδιοριστεί εάν η αναπλήρωση ιωδίου βελτιώνει τη σωματική ανάπτυξη σε παιδιά σχολικής ηλικίας και να διερευνήσει το ρόλο των IGF-I και IGFBP-3 σε αυτό το αποτέλεσμα. Τρεις προοπτικές διπλές –τυφλές μελέτες παρέμβασης, διεξήχθησαν σε περιοχές ποικίλης ιωδοπενίας και συγκεκριμένα σε παιδιά με βαριά ιωδοπενία από το Μαρόκο, σε παιδιά από την Αλβανία με μέτρια ιωδοπενία, και σε παιδιά της νοτίου Αφρικής με ήπια ιωδοπενία. Σε όλες τις μελέτες, η θεραπεία με ιώδιο αύξησε τη μέση συγκέντρωση ιωδίου στα ούρα σε πάνω από 100 μg/L, ενώ η μέση συγκέντρωση ιωδίου ούρων στις ομάδες ελέγχου, παρέμεινε αμετάβλητη. Στη νότια Αφρική, η αναπλήρωση ιωδίου αύξησε μετρίως τον IGF-I, αλλά δεν επέφερε μεταβολή στα επίπεδα της IGFBP-3, ολικής Τ4 και τη σωματική ανάπτυξη. Στην Αλβανία, και το Μαρόκο η αναπλήρωση ιωδίου, αύξησε τη συνολική Τ4, IGF-I και IGFBP-3, τα Ζ- σκορ βάρος/ηλικία και ύψος/ηλικία.
Δική μας μελέτη στον προαναφερθέντα πληθυσμό των παιδιών στο Αζερμπαϊτζάν έδειξε 5 χρόνια μετά την χορήγηση του ιωδίου σημαντική αύξηση της SD του ύψους στα παιδιά αυτά (101). Αυτές οι ελεγχόμενες μελέτες, δηλώνουν σαφώς ότι η αναπλήρωση ιωδίου σε παιδιά σχολικής ηλικίας, αυξάνει τις συγκεντρώσεις των IGF-I και IGFBP-3 και βελτιώνει τη σωματική ανάπτυξη (176).
6.2.3. Υποκλινικός υποθυρεοειδισμός λόγω ιωδιοπενίας
Η χρόνια ιωδιοπενία, αυξάνει τη συγκέντρωση της TSH και παράγει θυρεοειδικές ορμόνες, όπως στον υποκλινικό υποθυρεοειδισμό (46), ο οποίος με τη σειρά του ίσως αποτελεί παράγοντα κίνδυνου για καρδιαγγειακή νόσο (177). Ο υποκλινικός υποθυρεοειδισμός στα παιδιά ίσως συνδέεται με ένα πιο αθηρογόνο λιπιδαιμικό προφίλ. (178). Το ιωδιούχο λάδι, επαναφέρει γρήγορα σε φυσιολογικά επίπεδα, τις αυξημένες συγκεντρώσεις της θυρεοτρόπου ορμόνης που παρατηρήθηκαν σε άτομα με ιωδοπενία (179) διορθώνοντας έτσι τον υποκλινικό υποθυρεοειδισμό. Σε μια μη ελεγχόμενη μελέτη η θεραπεία της βρογχοκήλης με ιώδιο σε έφηβους γερμανούς, μείωσε τα επίπεδα των συγκεντρώσεων της χοληστερίνης στο πλάσμα (180). Σε μια άλλη πρόσφατη ελεγχόμενη μελέτη, η θεραπεία με ιώδιο σε παιδιά με μέτρια ιωδοπενία και αυξημένα επίπεδα TSH, βελτίωσε το λιπιδαιμικό προφίλ και μείωσε τα επίπεδα ινσουλίνης σε σύγκριση με τα αντίστοιχα της ομάδας ελέγχου (181). Εάν αυτά τα ευρήματα, επιβεβαιωθούν και σε άλλους πληθυσμούς, τα μέχρι τώρα αναγνωρισμένα οφέλη της προφυλακτικής χορήγησης ιωδίου, ίσως είναι σημαντικά καθώς η ιωδιοπενία παραμένει συνήθης σε πολλές γρήγορα αναπτυσσόμενες χώρες με αυξανόμενα ποσοστά παχυσαρκίας και καρδιαγγειακής νόσου.
6.3. Ενηλικίωση
Σε ενήλικες, η ήπια έως μέτρια ιωδοπενία φαίνεται να συσχετίζεται με υψηλότερα ποσοστά περισσότερου επιθετικών τύπων καρκίνου του θυρεοειδούς αδένα, αυξημένο κίνδυνο ανάπτυξης διάχυτης βρογχοκήλης και αυξημένο κίνδυνο εμφάνισης μη τοξικής και τοξικής οζώδους βρογχοκήλης καθώς και υπερθυρεοειδισμού (4,31). Μελέτες παρατήρησης επίσης υποδηλώνουν δευτερογενείς αρνητικές επιπτώσεις του υποθυρεοειδισμού σε ενήλικες, όπως επηρεασμένη νοητική λειτουργία με μειωμένη ικανότητα μάθησης, απάθεια και χαμηλή εργασιακή παραγωγικότητα (3).
7. Επιδημιολογία
Μόνο λίγες χώρες –η Ελβετία, μερικές σκανδιναβικές χώρες, η Αυστραλία, οι Ηνωμένες πολιτείες και ο Καναδάς –είχαν επάρκεια ιωδίου πριν το 1990. Έκτοτε, ο αριθμός των νοικοκυριών που χρησιμοποιούσαν ιωδιούχο αλάτι παγκοσμίως, αυξήθηκε δραματικά από ποσοστό λιγότερο από 20% σε ποσοστό περισσότερο από 70%, μειώνοντας την ιωδιοπενία (182). Αυτή η προσπάθεια ωθήθηκε από το συνασπισμό/συνεργασία διεθνών οργανισμών συμπεριλαμβανομένου των ICCIDD, WHO, UNICEF και την Micronutrient Initiative. Αυτή η ανεπίσημη συνεργασία καθιερώθηκε το 1990 μετά την παγκόσμια διάσκεψη κορυφής για τα παιδιά και χρηματοδοτήθηκε από τον παγκόσμιο οργανισμό Κiwanis, το ίδρυμα Gates, και προγράμματα ενίσχυσης των χωρών. Πρόσφατα, ο παγκόσμιος οργανισμός υγείας εκτίμησε ότι σχεδόν 2 δισεκατομμύρια άτομα έχουν ανεπαρκή πρόσληψη ιωδίου, με το ένα τρίτο αυτών να αφορά σε παιδιά σχολικής ηλικίας (183). Ο χαμηλότερος επιπολασμός της ιωδοπενίας παρατηρείται στην Αμερική (10,6%), όπου το ποσοστό των νοικοκυριών που καταναλώνουν ιωδιούχο αλάτι είναι το υψηλότερο παγκοσμίως (90%). Ο μεγαλύτερος επιπολασμός ιωδιοπενίας αντίθετα σημειώνεται στην Ευρώπη (52%), όπου η κάλυψη των νοικοκυριών με ιωδιούχο αλάτι είναι η χαμηλότερη (περίπου 25%) και πολλές χώρες έχουν αδύναμα έως καθόλου προγράμματα αντιμετώπισης των ιωδιοπενικών διαταραχών. Ο αριθμός των χωρών, στις οποίες η ιωδοπενία παραμένει ένα δημόσιο πρόβλημα υγείας ανέρχεται στο 47. Ωστόσο, έχει σημειωθεί πρόοδος από το 2003. Δώδεκα χώρες, σημείωσαν σημαντική πρόοδο στην αντιμετώπιση της ιωδιοπενίας και το ποσοστό των παιδιών σχολικής ηλικίας με κίνδυνο ιωδοπενίας μειώθηκε κατά 5%. Στην Αυστραλία και τις Ηνωμένες Πολιτείες, δύο χώρες που παλαιότερα είχαν επάρκεια σε ιώδιο, η πρόσληψη του ιωδίου μειώθηκε (183). Η Αυστραλία εμφανίζει πλέον ήπια ιωδιοπενία (184), και στις Ηνωμένες πολιτείες η μέση συγκέντρωση ιωδίου στα ούρα είναι στα 160 μg/L (95% διάστημα εμπιστοσύνης, 136 – 162), ακόμα επαρκής, αλλά ωστόσο υποδιπλάσια της μέσης συγκέντρωσης ιωδίου στα ούρα των 321 μg/L που είχε βρεθεί τη δεκαετία του 70 (185). Από την άλλη μεριά, η πρόσληψη ιωδίου είναι περισσότερο από επαρκής, ή ακόμα και υπερβολική σε 34 χώρες, σε σχέση με 27 χώρες το 2003. Αυτές οι αλλαγές τονίζουν τη σημαντικότητα της τακτικής επιτήρησης των επιπέδων του ιωδίου στις χώρες, προκειμένου να ανιχνευτούν τόσο η χαμηλή όσο και η υπερβολική κατανάλωση ιωδίου.
Υπάρχουν αρκετοί περιορισμοί στα δεδομένα αυτά από την Παγκόσμιο Οργάνωση Υγείας. Αρχικά, η δυνατότητα με τη βοήθεια ενός δείκτη πληθυσμού (μέση συγκέντρωση ιωδίου ούρων) να εκτιμηθεί ο αριθμός των ατόμων που επηρεάστηκαν, είναι προβληματική. Για παράδειγμα, μια χώρα στην οποία τα παιδία έχουν μια μέση συγκέντρωση ούρων των 100 μg/L, θα μπορούσε να ταξινομηθεί ως χώρα που αποκτά επάρκεια σε ιώδιο, ωστόσο την ίδια στιγμή το 50% των παιδιών θα ταξινομούνταν ως έχοντες ανεπαρκή πρόσληψη ιωδίου. Κατά δεύτερον, εθνικές αντιπροσωπευτικές έρευνες αντιπροσωπεύουν μόνο το 60% του παγκόσμιου πληθυσμού, που περιλαμβάνεται στα δεδομένα του Παγκοσμίου Οργανισμού Υγείας, και υποεθνικά δεδομένα ίσως υποεκτιμούν ή υπερεκτιμούν την έκταση της ιωδιοπενίας (183). Τέλος, υπάρχουν ανεπαρκή δεδομένα από σχεδόν όλες τις χώρες για την εκτίμηση της ιωδιοπενίας στις εγκύους.
Η κάλυψη των νοικοκυριών με ιωδιούχο αλάτι στη νότια Ασία, είναι μόνο 49%. Πάνω από 17 εκατομμύρια νεογέννητα σε αυτή τη περιοχή, έρχονται στη ζωή ετησίως με κίνδυνο εμφάνισης εγκεφαλικής βλάβης, λόγω ιωδοπενίας. Αυτό αποτελεί το 40% όλων των επικίνδυνων τοκετών παγκοσμίως (186). Υπάρχουν μεγάλες προκλήσεις προκειμένου να αυξηθεί η κάλυψη αυτής της περιοχής με ιωδιούχο αλάτι, συμπεριλαμβανομένου τη παρουσία μεγάλου αριθμού τοπικών μικροπαραγωγών αλατιού, ανεπαρκή έλεγχο και/ή έλλειψη πολιτικής δέσμευσης. Στην Ινδία, πάρα τις εντατικές προσπάθειες προώθησης του ιωδιούχου αλατιού, σχεδόν μόνο το μισό του πληθυσμού είναι καλυμμένο και η κάλυψη είναι ιδιαίτερα φτωχή σε πληθυσμούς με χαμηλό κοινωνικοοικονομικό επίπεδο (187,188). Το ιωδιούχο αλάτι δεν είναι διαθέσιμο σε αρκετές αγροτικές αγορές και /ή το αλάτι είναι φτωχά ή ανεπαρκώς ιωδιωμένο. Το 1997, σε μια κίνηση βελτίωσης της αύξησης της κατανάλωσης του ιωδιούχου αλατιού, η κυβέρνηση της Ινδίας απαγόρευσε τη πώληση μη ιωδιωμένου αλατιού για κατανάλωση από τον άνθρωπο. Ωστόσο το Σεπτέμβριο του 2000, η κυβέρνηση της Ινδίας, αναίρεσε την απαγόρευση, δηλώνοντας ότι ‘Σχετικά με το σημείο αρχής, συμπεράσματα στο θέμα προσωπικής επιλογής είναι ανεπιθύμητα’. Αυτό είχε ως αποτέλεσμα μια μείωση 12% στη κάλυψη του έθνους με ιωδιούχο αλάτι (188). Μόνο μετά από εντατική υπεράσπιση από διεθνείς και εθνικούς εταίρους, η κυβέρνηση της Ινδίας επανέφερε την απαγόρευση το Μάιο του 2006.
Το 67% των νοικοκυριών στην Υποσαχάρια Αφρική χρησιμοποιούν ιωδιωμένο αλάτι, αλλά η κάλυψη ποικίλει ευρέως από χώρα σε χώρα (189). Σε χώρες όπως το Σουδάν, Μαυριτανία, Γουινέα, Γκάμπια, η κάλυψη είναι λιγότερο από 10%, ενώ στη Μπουρούντι, Κένυα, Νιγηρία, Τυνησία, Ουγκάντα και Ζιμπάμπουε είναι πάνω από 90%.
Σε αρκετές χώρες, η νομοθεσία όσον αφορά στην ιωδίωση του αλατιού απουσιάζει ή είναι αδύναμη και σε αυτές που υπάρχει νομοθεσία, το ιώδιο που ορίζεται για το αλάτι ποικίλει από 20 έως 100 ppm. Σα συνέπεια η επάρκεια του ιωδίου στην Υποσαχάρια Αφρική ποικίλει από καθαρή ιωδοπενία σε χώρες όπως η Αιθιοπία η Σιέρρα Λεόνε και Αγκόλα έως υπερβολική πρόσληψη ιωδίου στην Ουγκάντα και την Κένυα. Ένας αριθμός των χωρών της Υποσαχάριας Αφρικής έχουν εξαιρετικά προγράμματα, συμπεριλαμβανομένης της Νιγηρίας, η οποία πρόσφατα αναγνωρίστηκε ως η πρώτη αφρικανική χώρα πού κατάφερε να εξαλείψει την ιωδοπενία (190).
Υπάρχουν αρκετές προκλήσεις στον έλεγχο των ιωδιοπενικών διαταραχών στην Υποσαχάρια Αφρική. Σε πολλές χώρες προσπάθειες για αποτελεσματικά προγράμματα χορήγησης ιωδιωμένου αλατιού δεν έχουν αποδώσει εξαιτίας διαμαχών, λιμού και πολιτικής αστάθειας. Οφείλει να δοθεί έμφαση στην επιμόρφωση των κυβερνητικών ηγετών και του πληθυσμού, το σχηματισμό εθνικών συνασπισμών αντιμετώπισης διαταραχών ιωδοπενίας κτλ. Οι χώρες με υπάρχουσα νομοθεσία, που αφορά σε προσθήκη 80-100ppm ιωδίου στο αλάτι οφείλουν να μειώσουν αυτά τα επίπεδα στο 20-40ppm και να βελτιώσουν την επιτήρηση των επιπέδων του ιωδίου (191).
Τέλος, όσον αφορά την Ελλάδα, παρά το γεγονός ότι δεν υπήρξε ποτέ από την Πολιτεία στοχευμένη πρωτοβουλία για την αντιμετώπιση της ιωδιοπενίας η βελτίωση των κοινωνικοοικονομικών συνθηκών και οι αλλαγές στις διατροφικές συνήθειες οδήγησαν σε εξάλειψη του προβλήματος (192).
Η Διεθνής Ομάδα Καθοδήγησης της Ανάπτυξης του Παιδιού (The International Child Development Steering Group), αναγνώρισε την ιωδοπενία ως έναν από τους τέσσερις παγκόσμιους παράγοντες κινδύνους κλειδιά στη διατάραξη της ανάπτυξης του παιδιού , όπου η ανάγκη για παρέμβαση είναι επείγουσα (193). H αντιμετώπιση των ιωδιοπενικών διαταραχών στο υπόλοιπο ένα τρίτο του παγκόσμιου πληθυσμού, που βρίσκεται σε κίνδυνο, δεν θα είναι εύκολη. Παρόλο που οι βασικοί συντελεστές στα επιτυχημένα εθνικά προγράμματα έχουν ταυτοποιηθεί, η πρόσβαση σε οικονομικά μειονεκτικές ομάδες που ζουν σε απομακρυσμένες περιοχές και η ιωδίωση του παραγόμενου αλατιού από τους τοπικούς μικροπαραγωγούς αλατιού αποτελούν προκλήσεις (194). Μια σημαντική στρατηγική θα είναι η ενίσχυση των εθνικών συνασπισμών οι οποίοι περιλαμβάνουν κυβερνητικούς εταίρους, εθνικές και διεθνείς υπηρεσίες, το φορέα εθνικής υγείας και τους παραγωγούς αλατιού. Στις χώρες τις οποίες εφαρμόζονται προγράμματα ιωδίωσης του άλατος, η επιτήρηση και συνέχισή τους αποτελούν σημεία εστίασης. Τα προγράμματα είναι εύθραυστα και απαιτούν μακροπρόθεσμη δέσμευση από τις κυβερνήσεις. Σε αρκετές χώρες όπου η ιωδοπενία είχε εξαλειφθεί, τα προγράμματα ιωδίωσης του αλατιού κατέρρευσαν και η ιωδοπενία επανεμφανίστηκε (195). Τα παιδιά σε ιωδιοπενικές περιοχές είναι ευάλωτα ακόμα και σε σύντομης διάρκειας διαταραχές στα προγράμματα ιωδίωσης του αλατιού (196). Οι χώρες οφείλουν να επιτηρούν τα επίπεδα του διατροφικού ιωδίου κάθε τρία έτη και να αναφέρουν την πρόοδό τους στη συνέλευση της ΠΟΥ (World Health Assembly) (197) .
8. Θεραπεία και πρόληψη της ιωδιοπενίας
8.1. Ιωδίωση του αλατιού
Σε όλες σχεδόν τις περιοχές που έχουν επηρεαστεί από την ιωδοπενία, ο πιο αποτελεσματικός τρόπος να αντιμετωπιστεί η ιωδιοπενία είναι μέσω ιωδίωσης του αλατιού (55). Καθολική ιωδίωση του αλατιού είναι ένας όρος που χρησιμοποιείται για να περιγράψει την ιωδίωση όλων των αλατιών για χρήση από τον άνθρωπο (βιομηχανικά τρόφιμα, νοικοκυριό) και κατανάλωση από τα ζώα. Παρόλο που είναι το ιδανικό ακόμα και σε χώρες με επιτυχημένα προγράμματα ιωδίωσης του αλατιού, η καθολική ιωδίωση άλατος επιτυγχάνεται σπάνια, λόγω του ότι οι βιομηχανίες τροφίμων είναι συνήθως απρόθυμες στη χρήση ιωδιούχου αλατιού και πολλές χώρες δεν ιωδιώνουν τα αλάτι που προστίθεται στις ζωοτροφές. Η ιωδίωση αλατιού αποτελεί τη συνιστώμενη στρατηγική αντιμετώπισης των ιωδιοπενικών διαταραχών, λόγω του ότι:
- Το αλάτι είναι ένα από τα συστατικά φαγητών, τα οποία καταναλώνονται από τον καθένα
- Η πρόσληψη του αλατιού παραμένει αρκετά σταθερή στη διάρκεια του χρόνου
- Σε πολλές χώρες, η παραγωγή/εισαγωγή άλατος είναι περιορισμένη σε λίγες πηγές
- Η τεχνολογία της ιωδίωσης είναι απλή και σχετικά μη ακριβή στην εφαρμογή
- Η πρόσθεση ιωδίου στο αλάτι δεν επηρεάζει το χρώμα ή τη γεύση του
- Η ποσότητα του ιωδίου στο αλάτι μπορεί να επιτηρηθεί σε επίπεδο παραγωγής, λιανικής πώλησης, και νοικοκυριού
H Παγκόσμια Οργάνωση Υγείας (WHO), το Ταμείο Παιδιών του Οργανισμού Ηνωμένων Εθνών (UNICEF) και η Διεθνής Επιτροπή για την Αντιμετώπιση των Ιωδιοπενικών Διαταραχών (ICCIDD), συνιστούν τη προσθήκη 20-40 mg ιωδίου ανά κιλό αλατιού, ανάλογα με την τοπική πρόσληψη σε ιώδιο (55). Το ιώδιο μπορεί να προστεθεί στο αλάτι με μορφή ιωδιούχου καλίου (ΚΙ) είτε ως ιωδικό κάλιο (KIO3). Λόγω του ότι το KIO3, έχει μεγαλύτερη σταθερότητα από το ΚΙ σε παρουσία υγρασίας, ακαθαρσίες αλατιού και πορώδη συσκευασία (198,199), αποτελεί τη συνιστώμενη μορφή σε τροπικές χώρες και σε χώρες με χαμηλής ποιότητας αλάτι. Το ιώδιο προστίθεται μετά την ξήρανση του άλατος με τη χρήση δύο τεχνικών. Η πρώτη είναι η υγρή μέθοδος, όπου διάλυμα ΚΙΟ3 ψεκάζεται σε κανονικούς ρυθμούς στο αλάτι καθώς αυτό κινείται πάνω σε ιμάντα μεταφοράς. Η δεύτερη μέθοδος είναι η ξηρά μέθοδος, όπου ΚΙ ή ΚΙΟ3 σε σκόνη ψεκάζεται πάνω σε ξηραμένο αλάτι. Η συσκευασία του ιωδιωμένου αλατιού, οφείλει να γίνεται σε περιέκτες με χαμηλή πυκνότητα σε πολυαιθυλένιο. Σε μια πολυεθνική μελέτη, η υψηλή υγρασία σε συνδυασμό με τη πορώδη συσκευασία είχαν ως αποτέλεσμα απώλεια ιωδίου πάνω από 90% σε αποθήκευση διάρκειας ενός έτους, λόγω εξάχνωσης του ιωδίου σε περιέκτες υψηλής πυκνότητας σε πολυαιθυλένιο, σε σύγκριση με απώλειες 10-15% που παρατηρήθηκαν σε περιέκτες χαμηλής πυκνότητας σε πολυαιθυλένιο (199).
Η ιωδίωση του αλατιού, παραμένει ο περισσότερο αποδοτικός τρόπος χορήγησης ιωδίου και βελτίωσης της γνωστικής λειτουργίας σε ιωδιοπενικούς πληθυσμούς (200). Για παράδειγμα στη Σιέρρα Λεόνε έχει υπολογισθεί ότι, εάν τα επίπεδα ιωδοπενίας παραμείνουν αμετάβλητα για τα επόμενα πέντε χρόνια, η παρούσα αξία απωλειών μελλοντικής παραγωγικότητας λόγω της διανοητικής διαταραχής από ιωδιοπενία στην εμβρυική ζωή, θα υπερβεί τα 42,5 εκατομμύρια δολάρια (201). Παγκοσμίως, το ετήσιο κόστος για την ιωδίωση του αλατιού, εκτιμάται στα 0,02 – 0,05 δολάρια ανά παιδί που καλύπτεται. Το κόστος ανά θάνατο παιδιού που απέτρεψε στα 1000 δολάρια και ανά αναπηρία προσαρμοσμένη το έτος ζωής που απέτρεψε στα 34-36 δολάρια (202). Από άλλη οπτική σκοπιά, προ της ευρείας ιωδίωσης του αλατιού, οι ετήσιες δυνητικές απώλειες που αποδίδονταν σε ιωδοπενία στον αναπτυσσόμενο κόσμο εκτιμήθηκαν ότι ήταν 35,7 δισεκατομμύρια συγκρινόμενες με το εκτιμώμενο ετήσιο κόστος των 0,5 δισεκατομμυρίων για την ιωδίωση του αλατιού, αναλογία δηλαδή όφελος/κόστος, 70/1 (203). Ωστόσο η καθολική ιωδίωση του αλατιού πρέπει να είναι διαρκής, προκειμένου να είναι αποτελεσματική και αυτό αποτελεί μέγιστη πρόκληση.
8.2. Άλλα μέσα χορήγησης ιωδίου
Το ψωμί, μπορεί να είναι ένα αποτελεσματικό μέσο χορήγησης ιωδίου μέσω εμπλουτισμού του αλατιού που χρησιμοποιείται κατά τη παρασκευή του με ιώδιο (204). Παρόλο που η ιωδίωση του πόσιμου νερού ή του νερού άρδευσης, μπορεί να είναι επίσης αποτελεσματική (205,206), το υψηλό κόστος και η πολυπλοκότητα στην επιτήρηση αποτελούν μειονεκτήματα. Γάλα εμπλουτισμένο με ιώδιο είναι μια μεγάλη τυχαία πηγή σε χώρες όπως η Ελβετία και ο Ηνωμένες Πολιτείες (8,10), λόγω της χρήσης ιωδιοφόρων στη παραγωγή γαλακτοκομικών προϊόντων και όχι λόγω σκόπιμης προσθήκης ιωδίου. Στη Φιλανδία, ο εμπλουτισμός των ζωοτροφών με ιώδιο, αύξησε το περιεχόμενο ιώδιο στα τρόφιμα ζωικής προέλευσης. Σε χώρες που είναι επηρεασμένες από ιωδιοπενικές διαταραχές, το ιώδιο οφείλει να προστίθεται στις συμπληρωματικές τροφές που χρησιμοποιούνται για απογαλακτισμό του βρέφους, προκειμένου η πρόσληψη ιωδίου σε αυτά να είναι περίπου 90μg ιωδίου ημερησίως (207) .
8.3. Χορήγηση συμπληρώματος ιωδίου
Σε κάποιες περιοχές, η ιωδίωση του αλατιού ίσως να μην είναι πρακτική στην αντιμετώπιση της ιωδιοπενίας, τουλάχιστον βραχυπρόθεσμα. Αυτό ίσως συμβεί σε απομακρυσμένες περιοχές, όπου η επικοινωνία είναι φτωχή ή όπου υπάρχουν πολυάριθμοι μικροπαραγωγοί αλατιού. Σε αυτές τις περιοχές μπορούν να χρησιμοποιηθούν συμπληρώματα ιωδιούχου λαδιού (55). Το ιωδιούχο λάδι, παρασκευάζεται από εστεροποίηση των μη κορεσμένων λιπαρών οξέων σε σπόρους ή φυτικά έλαια και προσθήκη ιωδίου στους διπλούς δεσμούς (208). Μπορεί να χορηγηθεί από το στόμα ή ως ενδομυϊκή ένεση (81). Η ενδομυϊκή οδός, έχει μεγαλύτερη διάρκεια δράσης, αλλά η από του στόματος χορήγηση είναι περισσότερο συνήθης, λόγω του ότι είναι πιο απλή. Οι συνήθεις δόσεις είναι 200-400mg ιωδίου ετησίως (55), και συχνά προτιμάται η χορήγησή του σε εγκύους (210), παιδιά και γυναίκες αναπαραγωγικής ηλικίας. Τα μειονεκτήματά του είναι τα άνισα επίπεδα ιωδίου στη κυκλοφορία με το χρόνο, η ανάγκη για άμεση επαφή με τα άτομα και το κόστος.
Το ιώδιο μπορεί επίσης να χορηγηθεί ως ΚΙ ή ΚΙΟ3 σε σταγόνες ή ταμπλέτες. Μονές δόσεις από τα στόμα 30 mg ΚΙ μηνιαίως ή κάθε δύο εβδομάδες, μπορούν να παρέχουν επαρκές ιώδιο σε παιδιά σχολικής ηλικίας (211). Το διάλυμα Lugol περιέχει περίπου 6 mg ιωδίου ανά σταγόνα και παρόμοια σκευάσματα είναι συχνά διαθέσιμα ως αντισηπτικά σε αγροτικά ιατρεία αναπτυσσόμενων χωρών και προσφέρουν έναν άλλο απλό τρόπο τοπικής χορήγησης ιωδίου.
8.4. Στρατηγικές πρόληψης ή διόρθωσης ιωδιοπενίας στη διάρκεια της εγκυμοσύνης και στη γαλουχία
Για σχεδόν όλες τις χώρες, η κύρια στρατηγική για διαρκή εξάλειψη της ιωδιοπενίας στην εγκυμοσύνη παραμένει η καθολική ιωδίωση του αλατιού (212). Σε χώρες ή περιοχές, όπου τα προγράμματα ιωδίωσης του αλατιού καλύπτουν τουλάχιστον το 90% των νοικοκυριών, έχουν εφαρμοστεί για τουλάχιστον δύο χρόνια και η μέση συγκέντρωση ιωδίου ούρων υποδεικνύει επαρκή πρόσληψη ιωδίου (Πίνακας 2), δε χρειάζεται να χορηγηθεί συμπλήρωμα ιωδίου στις έγκυες και στις μητέρες που θηλάζουν (βλέπε σχετικό κεφάλαιο).
9. Εντερική και παρεντερική διατροφή
9.1. Νηπιακή ηλικία
Μελέτες ισοζυγίου σε υγιή πρόωρα έδειξαν ότι για να διατηρηθεί θετικό ισοζύγιο ιωδίου απαιτείται μια ημερήσια πρόσληψη τουλάχιστον 30μg ιωδίου ανά κιλό σωματικού βάρους και οι ειδικοί γενικά συνιστούν πρόσληψη ιωδίου από 30 έως 60 μg/kg ημερησίως για αυτήν την ομάδα (213-215). Τα γάλατα φόρμουλες για πρόωρα περιέχουν 20 έως 170 μg ιωδίου ανά λίτρο και το μητρικό γάλα γενικώς περιέχει 50 έως 150 μg ιωδίου ανά λίτρο ανάλογα με τη διατροφική πρόσληψη της μητέρας σε ιώδιο, (92,216,217). Έτσι, ειδικά στη διάρκεια των πρώτων εβδομάδων μετά τον τοκετό , που ο όγκος τροφής είναι συχνά μικρός, πρόωρα νεογνά που σιτίζονται εντερικά ίσως να μη φτάνουν τη συνιστώμενη πρόσληψη ιωδίου (214,217).
Η από του στόματος απορρόφηση ιωδίου είναι αποτελεσματική και η βιοδιαθεσιμότητά του υπολογίζεται στο 90-95% (13,14). Αυτό σημαίνει ότι οι δόσεις του ιωδίου μέσω εντερικής ή παρεντερικής οδού οφείλουν να είναι ισοδύναμες. Ωστόσο, τα εμπορικά διαθέσιμα διαλύματα παρεντερικής διατροφής περιέχουν πολύ λιγότερο ιώδιο από ότι το μητρικό γάλα ή τα γάλατα φόρμουλες για νεογνά (217). Η αμερικάνικη και η ευρωπαϊκή κοινότητα κλινικής διατροφής, συνιστούν πρόσληψη ιωδίου 1 μg ανά κιλό σωματικού βάρους την ημέρα (218,219), πολύ χαμηλότερη από το ρυθμό εμβρυικής ανάπτυξης (214,215). Η συντηρητική αυτή σύσταση θεωρεί ότι τα πρόωρα νεογνά που σιτίζονται παρεντερικά θα απορροφήσουν ιώδιο από τα τοπικά χρησιμοποιούμενα ιωδιούχα αντισηπτικά μέσω του δέρματος και επίσης θα λάβουν μικρές ποσότητες τυχαίου ιωδίου από άλλες εγχύσεις. Αυτή η άποψη υποστηρίζεται από τη μελέτη του Moukarzel και των συνεργατών του (220), οι οποίοι βρήκαν σε 18 νεογνά που ελάμβαναν μακροχρόνια πλήρη παρεντερική διατροφή χωρίς συμπληρωματικό ιώδιο, ότι οι δοκιμασίες λειτουργίας του θυρεοειδούς ήταν φυσιολογικά και οι συγκεντρώσεις του ιωδίου στα πλάσμα ήταν σημαντικά υψηλότερες από την ομάδα ελέγχου. Οι συγγραφείς εκτίμησαν ότι το τυχαίο ιώδιο σε διαλύματα πλήρους παρεντερικής διατροφής και γαλακτώματα λίπους, ευθύνονταν για το 50% του προσλαμβανομένου ιωδίου και υπέθεσαν ότι η υπόλοιπο προσληφθέν ιώδιο προήλθε από τη διαδερμική απορρόφηση του ιωδίου από τη χρήση τοπικών ιωδιούχων αντισηπτικών. Κατέληξαν έτσι στο συμπέρασμα ότι δεν χρειαζόταν να χορηγηθεί συμπλήρωμα ιωδίου ακόμα και στα παιδιά που λάμβαναν μακροχρόνια πλήρη παρεντερική διατροφή. Επιπλέον, η συχνή χρήση ιωδιούχων αντισηπτικών σε νεογνά μπορεί να επιφέρει διαδερμική απορρόφηση τουλάχιστον 100μg ιωδίου ημερησίως, υπερβολική πρόσληψη ιωδίου και να προκαλέσει νεογνικό υποθυρεοειδισμό (220).
Εξαιτίας ανησυχιών για ενδεχόμενη υπερβολική πρόσληψη ιωδίου και λόγω πλεονεκτημάτων των αντισηπτικών που βασίζονται σε χλωρεξιδίνη (222), η χρήση των ιωδιούχων αντισηπτικών στα νεογνά, ίσως μειώνεται, θέτοντας αυτά σε κίνδυνο ιωδοπενίας. Εάν τα πρόωρα νεογνά που σιτίζονται παρεντερικά δεν εκτεθούν στις τυχαίες πηγές ιωδίου, ίσως λαμβάνουν μόνο 1 – 3 μg ιωδίου ανά κιλό βάρος σώματος ημερησίως και βρεθούν σε αρνητικό ισοζύγιο ιωδίου στη διάρκεια των πρώτων εβδομάδων μετά τον τοκετό (214,215). Ο Ibrahim και οι συνάδελφοί του (215), μελέτησαν 13 πρόωρα τα οποία είχαν μια μέση πρόσληψη ιωδίου 3μg ανά κιλό σωματικού βάρους ημερησίως και ημερήσιο ρυθμό χορήγησης παρεντερικής διατροφής 150 ml/kg σωματικού βάρους. Όλα τα νεογνά εμφάνισαν αρνητικό ισοζύγιο ιωδίου την 1η ημέρα, 12 από αυτά παρέμειναν σε αρνητικό ισοζύγιο μέχρι την 6η ημέρα, ενώ 3 παρέμειναν σε αρνητικό ισοζύγιο έως την 28η ημέρα.
Αρκετοί συγγραφείς έχουν υποστηρίξει ότι η ιωδοπενία οφείλει να αποφεύγεται στη διάρκεια αυτής της περιόδου, γιατί πιθανόν να μειώνει παροδικά τα επίπεδα των θυρεοειδικών ορμονών τις πρώτες εβδομάδες μετά τον τοκετό (223-225). Παροδική υποθυροξιναιμία σε πρόωρα νεογνά έχει συνδεθεί με επηρεασμένη νευροανάπτυξη, αλλά ο πιθανός ρόλος του ιωδίου σε αυτό, έχει διερευνηθεί σε μια μόνο τυχαιοποιημένη ελεγχόμενη μελέτη (226). Στη μελέτη αυτή, νεογνά, τα οποία γεννήθηκαν πριν από την 33η εβδομάδα κύησης έλαβαν τυχαία είτε γάλα φόρμουλας ενισχυμένο με 272 μg/L ιωδίου ή φόρμουλα χωρίς συμπληρωτικό ιώδιο (68 μg/L) μέχρι την 40η εβδομάδα μετά την σύλληψη. Τα γάλατα αυτά παρείχαν μια ημερήσια πρόσληψη ιωδίου περίπου 40 έως 50 και 12 έως 16 μg/kg σωματικού βάρους στην ομάδα που έλαβε θεραπεία και την ομάδα ελέγχου αντίστοιχα. Δεν υπήρξε στατιστικά σημαντική επίδραση στη λειτουργία του θυρεοειδούς αδένα ή στην επίπτωση της χρόνιας πνευμονοπάθειας, ωστόσο, η μελέτη είχε αρκετούς περιορισμούς. Παρόλο που η παροδική υποθυροξιναιμία είναι πιο στενά συνδεδεμένη με αρνητικές επιπτώσεις σε εξαιρετικά πρόωρα νεογνά, μόνο το 14% αυτών είχαν βάρος γέννησης κάτω από ένα κιλό. Επιπλέον, η παρέμβαση ξεκίνησε μετά την έναρξη λήψης εντερικής διατροφής, συνήθως δύο εβδομάδες μετά τη γέννηση, αλλά σε πρόωρα βρέφη το ισοζύγιο του ιωδίου είναι συχνά αρνητικό και παροδική υποθυροξιναιμία εγκαθίσταται τις πρώτες 1-2 εβδομάδες μετά τη γέννηση. Τέλος, η μελέτη δε μπόρεσε να εκτιμήσει πιθανή επίδραση στη νευροανάπτυξη. Μια πρόσφατη ανασκόπηση κατέληξε στο ότι τα διαθέσιμα δεδομένα είναι ανεπαρκή να υποστηρίξουν τη συμπληρωματική χορήγηση ιωδίου σε πρόωρα βρέφη (227). Επιπλέον, παρόλο που οι αναλύσεις υποομάδας σε μονή ελεγχόμενη μελέτη έδειξαν ότι υποκατάσταση με Τ4 ίσως προλαμβάνει την νευροαναπτυξιακή θνησιμότητα σε εξαιρετικά πρόωρα νεογνά (228), τα καθολικά δεδομένα είναι ανεπαρκή να συνιστούν χορήγηση θυρεοειδικών ορμονών ως θεραπεία προφύλαξης (229).
9.2. Παιδική ηλικία
Για παιδιά που λαμβάνουν παρεντερική διατροφή συνιστάται επίσης ημερήσια δόση 1 μg ιωδίου ανά κιλό σωματικού βάρους (218,219). Μια πρόσφατη μελέτη εκτίμησε το ιώδιο και τη κατάσταση του θυρεοειδούς αδένα σε 15 παιδιά ηλικίας 1 έως 17 ετών (μέση ηλικία 76 μήνες) με μακροχρόνια λήψη παρεντερικής διατροφής (230). Εννέα από αυτά τα παιδιά έπασχαν από σύνδρομο βραχέος εντέρου και έξι από άλλη εντερική νόσο. Δέκα παιδιά έλαβαν πλήρη παρεντερική διατροφή και πέντε μερική παρεντερική διατροφή για 14 έως 84 εβδομάδες. Παρατηρήθηκε, ότι υπήρξε μια σημαντική αντίστροφη συσχέτιση της διάρκειας της παρεντερικής διατροφής με τη συγκέντρωση ιωδίου στα ούρα και ότι μετά από δώδεκα εβδομάδες όλα τα παιδιά είχαν συγκέντρωση ιωδίου στα ούρα μικρότερη από 100 μg/L, οκτώ εκ των οποίων μικρότερη από 50 μg/L (μέτρια ιωδοπενία) και εφτά μικρότερη από 20 μg/L (σοβαρή ιωδοπενία). Ωστόσο, παρά την φανερά χαμηλή πρόσληψη ιωδίου, δεν παρατηρήθηκε αύξηση στο μέγεθος του θυρεοειδούς αδένα ή σημεία θυρεοειδικής δυσλειτουργίας στα παιδιά.
Εφόσον κριθεί αναγκαίο, μπορεί να χορηγηθούν παρεντερικά συμπληρώματα ιχνοστοιχείων που περιείχαν ιώδιο, τα οποία είναι διαθέσιμα για παιδιατρική χρήση. H συνιστώμενη δοσολογία για βρέφη ή παιδιά βάρους μέχρι 15κιλά και ηλικίας τουλάχιστον δύο ημερών είναι 1 ml/kg σωματικού βάρους ημερησίως, ενώ η συνιστώμενη ημερήσια δόση για παιδιά με βάρος άνω των 15 κιλών είναι 15ml (231).
9.3. Ενηλικίωση
Τα εμπορικά διαθέσιμα προϊόντα εντερικής διατροφής γενικά παρέχουν 75 – 110 μg ιωδίου (232). Οι ημερήσιες απαιτήσεις ιωδίου σε ενήλικες που λαμβάνουν εντερική ή πλήρη παρεντερική διατροφή εκτιμάται να είναι 70 – 150 μg (233). Μια πρόσφατη τεχνική ανασκόπηση της παρεντερικής διατροφής από την αμερικάνικη γαστρεντερολογική εταιρεία συνέστησε πρόσληψη 70 – 140 μg ιωδίου ημερησίως (234). Παρόλο που τα περισσότερα σχήματα παρεντερικής διατροφής δεν περιέχουν ιώδιο, δεν είναι πιθανό να προκληθεί ιωδοπενία, λόγω της διαδερμικής απορρόφησης του ιωδίου που προέρχεται στα ιωδιούχα αντισηπτικά και άλλες τυχαίες πηγές. Δεν έχουν αναφερθεί συμπτώματα ιωδοπενίας σε ενδονοσοκομειακή ενδοφλέβια υποστήριξη της θρέψης (235). Οι θυρεοειδικές αποθήκες ιωδίου ίσως επαρκούν να καλύψουν τις ανάγκες των ασθενών που απαιτούν πλήρη παρεντερική διατροφή για διάστημα έως και τρεις μήνες (233). Σε ενήλικες με επάρκεια ιωδίου, το περιεχόμενο στο θυρεοειδή αδένα ιώδιο είναι 15 – 20 mg (19). Σε μια μελέτη στη Βραζιλία, ενήλικες με εντερική δυσαπορρόφηση λόγω συνδρόμου βραχέος εντέρου, στους οποίους χορηγήθηκε μακροχρόνια πλήρης παρεντερική διατροφή χωρίς ιώδιο είχαν φυσιολογικά επίπεδα του ιωδίου και των θυρεοειδικών ορμονών (238). Για τους λόγους αυτούς πολλοί ειδικοί δε συστήνουν ως ρουτίνα τη χορήγηση συμπληρωματικού ιωδίου σε ασθενείς που λαμβάνουν πλήρη παρεντερική διατροφή (236,237). Ωστόσο, στο εμπόριο υπάρχουν διαθέσιμα ενδοφλέβια διαλύματα ιωδιούχου νατρίου, όπως για παράδειγμα, το διάλυμα Iodopen το οποίο περιέχει 100 μg ιωδίου/ml. Η συνήθης δόση προφύλαξης ή θεραπείας της ιωδοπενίας είναι 1 – 2 μg ιωδίου/kg σωματικού βάρους ημερησίως. Για παιδιά, εγκύους και γυναίκες που θηλάζουν, η συνιστώμενη ημερήσια δόση είναι 2 – 3 μg ιωδίου/kg βάρους (239).
10. Αυξημένη πρόσληψη ιωδίου στο πληθυσμό και υπερβολική πρόσληψη ιωδίου
Περισσότερο από τα 2/3 των 5 δισεκατομμυρίων ανθρώπων που ζουν σε χώρες επηρεασμένες από την ιωδοπενία, έχουν πρόσβαση στο ιωδιούχο αλάτι (4). Η υπερβολική πρόσληψη ιωδίου, συμβαίνει περισσότερο συχνά όταν επίπεδα ιωδιούχου άλατος είναι πολύ υψηλά και υπάρχει φτωχή/ελλιπής επιτήρηση. Για παράδειγμα, στη Βραζιλία, Αρμενία και την Ουγκάντα, η μέση συγκέντρωση ιωδίου στα ούρα, είναι πάνω από 300 μg/L, ενώ στη Χιλή πάνω από 500 μg/L (183). Υψηλό διατροφικό ιώδιο μπορεί επίσης σπάνια να προέρχεται από φυσικές πηγές, όπως τα φύκια στην παράκτια Ιαπωνία (240,341), το πόσιμο νερό το οποίο είναι εμπλουτισμένο με ιώδιο στην Κίνα (242,243) και το γάλα και το κρέας που είναι εμπλουτισμένα με ιώδιο στην Ισλανδία (244), λόγω χρήσης προϊόντων ψαριών στην κτηνοτροφία. Η μέση συγκέντρωση ιωδίου στα ούρα σε παιδιά πρωτοβάθμιας σχολικής ηλικίας στις Ηνωμένες Πολιτείες είναι 229 μg/L (185), ως αποτέλεσμα χρήσης ουσιών που περιέχουν ιώδιο στην παραγωγή γαλακτοκομικών προϊόντων και τη παρασκευή τροφίμων (10,245), καθώς και του ιωδίου που προέρχεται από την ιωδίωση του αλατιού. Ευρωπαϊκές (246) και αμερικάνικες (9) επιτροπές εμπειρογνωμόνων, έχουν ορίσει τα ανώτερα ανεκτά επίπεδα πρόσληψης ιωδίου (Πίνακας 4), αλλά εφιστούν την προσοχή λόγω του ότι άτομα με χρόνια ιωδοπενία, ίσως ανταποκριθούν διαφορετικά σε προσλήψεις ιωδίου χαμηλότερες από αυτά. Οξεία δηλητηρίαση μετά από λήψη αρκετών γραμμαρίων ιωδίου, εκδηλώνεται με συμπτώματα, όπως γαστρεντερικό ερεθισμό, κοιλιακό άλγος, ναυτία, έμετο και διάρροια καθώς επίσης και καρδιαγγειακά συμπτώματα, κώμα και κυάνωση (247). Η υπερβολική πρόσληψη ιωδίου, πολύ σπάνια ίσως προκαλέσει ιωδοδερμία, μια δερματική διαταραχή που χαρακτηρίζεται από ακμοειδή εξανθήματα, κνησμώδες εξάνθημα και κνίδωση (248).
Πίνακας 4. Τα ανώτερα ανεκτά επίπεδα πρόσληψης ιωδίου (μg/ημέρα).
| Ηλικιακή ομάδα | Ευρωπαϊκή Επιτροπή/ Επιστημονική Επιτροπή διατροφής (246) | ΙΟΜ (9) |
| 1-3 | 200 | 200 |
| 4-6 | 250 | 300 |
| 7-10 | 300 | 300 |
| 11-14 | 450 | 300 |
| 15-17 | 500 | 900 |
| Ενήλικες | 600 | 1100 |
| Έγκυες | 600 | 1100 |
Σε περιοχές με επάρκεια σε ιώδιο, οι περισσότεροι υγιείς ενήλικες είναι αξιοσημείωτα ανεκτικοί σε πρόσληψη ιωδίου πάνω από 1mg ημερησίως, λόγω του ότι ο υγιής θυρεοειδής αδένας είναι ικανός να προσαρμόζεται σε ένα μεγάλο εύρος προσλήψεων και να ρυθμίζει τη σύνθεση και έκκριση των θυρεοειδικών ορμονών (249). Μεγάλα ποσά ιωδίου που χορηγήθηκαν για ημέρες έως μήνες σε μικρές ομάδες υγιών ατόμων έδειξαν λίγες παρενέργειες (250). Ωστόσο, αύξηση της δόσης σε όρια μικρογραμμαρίων, ίσως προκαλέσει υπέρ- ή υποθυρεοειδισμό σε άτομα με προϋπάρχουσα θυρεοειδική δυσλειτουργία. Αυτό συμβαίνει εξαιτίας της πιθανής απουσίας του φυσιολογικού κατασταλτικού μηχανισμού μεταφοράς ιωδίου εντός του θυρεοειδούς αδένα, σε περίπτωση δυσλειτουργίας (251).
Έτσι, αλλαγές της πρόσληψης ιωδίου στο πληθυσμό, ίσως είναι ένας σημαντικός καθοριστικός παράγοντας για το μοτίβο της θυρεοειδικής νόσου. Αυτό έχει αποδειχτεί σε επιδημιολογικές μελέτες, οι οποίες εξέτασαν τη σχέση ανάμεσα στη πρόσληψη ιωδίου και στην επίπτωση καθώς και στον επιπολασμό των θυρεοειδικών νόσων.
10.1. Η επιδημιολογία των θυρεοειδικών διαταραχών σε περιοχές χαμηλής και υψηλής πρόσληψης ιωδίου
Δανοί ερευνητές, συνέκριναν την επίπτωση και τον επιπολασμό του υπέρ- και του υποθυρεοειδισμού στη Γιουτλάνδη της Δανίας, μια περιοχή με χαμηλή πρόσληψη ιωδίου (περίπου 40-70μg/ημέρα) και στην Ισλανδία, μια περιοχή με υψηλή πρόσληψη ιωδίου (περίπου 400-450μg/ημέρα, βάσει έκκρισης ιωδίου ούρων της τάξης των 300μg/ 24 ώρες σε νέα άτομα) (252). Στις δύο περιοχές, παρατηρήθηκε διαφορετικό μοτίβο θυρεοειδικής δυσλειτουργίας. Συγκεκριμένα, παρατηρήθηκε μεγαλύτερος επιπολασμός του υπερθυρεοειδισμού και χαμηλότερος επιπολασμός του υποθυρεοειδισμού στη Γιουτλάνδη, σε σχέση με την Ισλανδία και ο κίνδυνος ανάπτυξης υπερθυρεοειδισμού ήταν 2,3 φορές μεγαλύτερος στη Γιουτλάνδη από ότι στην Ισλανδία. Η πολυοζώδης τοξική βρογχοκήλη ήταν το συχνότερο αίτιο υπερθυρεοειδισμού στην Γιουτλάνδη, αλλά σχετικά σπάνιο στην Ισλανδία, όπου σχεδόν όλες οι περιπτώσεις υπερθυρεοειδισμού αφορούσαν σε νόσο Graves σε νέα άτομα και άτομα μέσης ηλικίας (252). Άλλοι πληθυσμοί με μακροχρόνια ήπια έως μέτρια ιωδοπενίας εκδήλωσαν επίσης υψηλό επιπολασμό θυρεοειδικής υπερλειτουργίας με χαμηλή TSH ορού, αλλά χαμηλό επιπολασμό θυρεοειδικής υπολειτουργίας, ενώ πληθυσμοί σε περιοχές με υψηλή πρόσληψη ιωδίου εμφάνισαν το αντίθετο μοτίβο (253-262).
Σε περιοχές ήπιας ιωδοπενίας, παρατηρείται αύξηση στην ανάπτυξη πολλαπλών όζων στο θυρεοειδή αδένα σε γυναίκες με προχωρημένη ηλικία, που συνδέεται με μείωση της TSH στο πλάσμα (263,264). Αυτά τα δεδομένα υποδηλώνουν ότι τα υψηλότερα ποσοστά εμφάνισης υπερθυρεοειδισμού σε πληθυσμούς με ήπια ιωδοπενία οφείλονται πιθανόν στο υψηλότερο ποσοστό τοξικής πολυοζώδους βρογχοκήλης. Επομένως, όπως η διάχυτη βρογχοκήλη, έτσι και η υπερλειτουργία του θυρεοειδούς αδένα οφείλει να ανήκει στο φάσμα των διαταραχών που προκαλούνται από ήπια έως μέτρια ιωδοπενία.
Για την αύξηση του υποθυρεοειδισμού σε έναν πληθυσμό με χρονιά υψηλή πρόσληψη ιωδίου, υπάρχουν δύο μηχανισμοί που ίσως ευθύνονται. Ένας μηχανισμός είναι το ανασταλτικό φαινόμενο του ιωδίου στη σύνθεση και έκκριση των θυρεοειδικών ορμονών. Αυτός ο μηχανισμός αυτορρύθμισης, παρέχει προστασία από την υπερέκκριση θυρεοειδικών ορμονών εν όψει υψηλής πρόσληψης ιωδίου. Ωστόσο, αυτός ο μηχανισμός αυτορρύθμισης δεν είναι τέλειος και συνήθως προκαλείται κάποιος βαθμός θυρεοειδικής υπολειτουργίας. Στην Ιαπωνία για παράδειγμα, ενήλικες με χρόνια υπερβολική πρόσληψη ιωδίου, πολλοί εκ των οποίων εμφανίζουν κλινικό υποθυρεοειδισμό, θα γίνουν ευθυρεοειδικοί όταν η πρόσληψη ιωδίου επιστρέψει σε φυσιολογικά επίπεδα (265,266). Ο δεύτερος πιθανά εμπλεκόμενος μηχανισμός, είναι η θυρεοειδική υπολειτουργία λόγω της αυτοάνοσης θυρεοειδίτιδας που προκαλείται από το ιώδιο (267). Δεν υπάρχει συμφωνία ωστόσο όλων των μελετών. Έχει παρατηρηθεί ότι η συχνότητα της ιστολογικής διάγνωσης θυρεοειδίτιδας σε χειρουργικές τομές θυρεοειδούς αδένα είναι αυξημένη σε περιοχή ενδημικής βρογχοκήλης μετά από προφυλακτική χορήγηση ιωδίου (268).
Η καθολική επίπτωση του καρκίνου του θυρεοειδούς αδένα στο πληθυσμό, δε φαίνεται να επηρεάζεται από την πρόσληψη ιωδίου. Μία μελέτη στη Δανία, έδειξε ότι μέτριες διαφορές στη πρόσληψη ιωδίου ανάμεσα σε περιοχές δεν επηρέασαν την επίπτωση του καρκίνου του θυρεοειδούς αδένα, ούτε τη κατανομή των διαφόρων ιστολογικών τύπων του (269). Ωστόσο, σε άλλες μελέτες φάνηκε ότι η κατανομή των διαφόρων ιστολογικών τύπων του καρκίνου του θυρεοειδούς σχετίζεται με τη πρόσληψη ιωδίου. Σε περιοχές με υψηλότερη πρόσληψη ιωδίου, παρατηρούνται λιγότερα θυλακιώδη και αναπλαστικά καρκινώματα, και περισσότερα θηλώδη καρκινώματα (268,270). Η μείωση εμφάνισης των περισσότερο κακοήθων ιστολογικών τύπων του καρκίνου του θυρεοειδούς αδένα, καθώς και η χαμηλότερη δόση ραδιενεργού ιωδίου στο θυρεοειδή αδένα σε περίπτωση πυρηνικού ατυχήματος, που παρατηρούνται μετά από προφυλακτική χορήγηση ιωδίου, είναι οφέλη που προκύπτουν από την αντιμέτωπη της ήπιας έως μέτριας ιωδοπενίας.
Σε παιδιά, η υπερβολική διατροφική πρόσληψη ιωδίου έχει συσχετιστεί με την εμφάνιση βρογχοκήλης και θυρεοειδικής δυσλειτουργίας. Σε αναφορές ‘ενδημικής βρογχοκήλης ακτής’ στο Χοκάιντο της Ιαπωνίας (240), ‘όπου η παραδοσιακή τοπική κουζίνα είναι πλούσια σε φύκια με υψηλό περιεχόμενο ιώδιο, η μέση συγκέντρωση ιωδίου στα ούρα στα παιδιά που κατανάλωναν φαγητά της τοπικής κουζίνα, ήταν περίπου 23 μg /ημέρα. Ο συνολικός επιπολασμός ορατής βρογχοκήλης στα παιδιά ήταν 3-9%, αλλά σε αρκετά χωριά έφτανε το 25%. Οι περισσότερες βρογχοκήλες ανταποκρίθηκαν στη χορήγηση θυρεοειδικών ορμονών ή/και στο περιορισμό της διατροφικής πρόσληψης ιωδίου. Δεν αναφέρθηκε ωστόσο καμία περίπτωση κλινικού υπό- ή υπερθυρεοειδισμού.
Πρόσληψη ιωδίου αρκετά κάτω από αυτή στις μελέτες από το Χοκάιντο, μπορεί επίσης να οδηγήσει σε ανάπτυξη βρογχοκήλης σε παιδιά (240). Σε 171 παιδιά από δύο χωριά στην Κίνα, όπου οι συγκεντρώσεις ιωδίου στο πόσιμο νερό ήταν 462 και 54μg/L, οι μέσες συγκεντρώσεις ιωδίου στα ούρα, 1235 και 428 μg/g κρεατινίνης αντίστοιχα, η μέση συγκέντρωση της TSH ήταν 7,8 και 3,9 mU/L και το ποσοστό βρογχοκήλης ήταν πάνω από 60% και 15-20% αντίστοιχα (243). Σε άλλες αναφορές που προέρχονται από την Κίνα , λήψη πόσιμου νερού με συγκεντρώσεις ιωδίου πάνω από 300 μg/L, είχε ως αποτέλεσμα συγκεντρώσεις ιωδίου στα ούρα πάνω από 900 μg/L και ποσοστό βρογχοκήλης πάνω από 10%. Αυτές οι μελέτες, υποδηλώνουν ότι βρογχοκήλη και θυρεοειδική δυσλειτουργία είναι δυνατόν να εμφανιστεί στα παιδιά σε προσλήψεις ιωδίου στη περιοχή από 400 έως 1300 μg/ημέρα. Αυτός ο ισχυρισμός υποστηρίζεται από μια μεγάλη διεθνή μελέτη κοορτής σε παιδιά ηλικίας έξι έως δώδεκα ετών, όπου η χρόνια λήψη τουλάχιστον 500 μg ιωδίου ημερησίως, συσχετίστηκε με αύξηση του μεγέθους του θυρεοειδούς αδένα όπως αυτό καθορίστηκε στον υπέρηχο (271). Παρόλο που αυτά τα ευρήματα υποδηλώνουν ότι μετρίως υψηλές διατροφικές προσλήψεις σε ιώδιο μεταξύ 300 έως 400 μg ημερησίως, είναι καλά ανεκτικές από υγιή παιδιά, ωστόσο δεν έχουν κάποιο όφελος και ίσως έχουν παρενέργειες οι οποίες δεν ανακαλύφθηκαν στις μελέτες αυτές
10.2. Τα αποτελέσματα της αυξημένης πρόσληψης ιωδίου στη θυρεοειδική λειτουργία
Η αύξηση της πρόσληψης ιωδίου σε ιωδιοπενικούς πληθυσμούς, συνοδεύεται τυπικά από μια καθαρή αύξηση στην επίπτωση του υπερθυρεοειδισμού. Το μέγεθος αύξησης της πρόσληψης, εξαρτάται από το ιώδιο που χορηγήθηκε και από τη σοβαρότητα της προϋπάρχουσας ιωδιοπενίας. Άτομα με υψηλό κίνδυνο εμφάνισης υπερθυρεοειδισμού από ιώδιο, έχουν προϋπάρχουσα πολυοζώδη θυρεοειδική νόσο, και παρόλο που τα περισσότερα είναι ευθυρεοειδικά, έχουν χαμηλή τιμή TSH στο πλάσμα, η οποία δεν ανταποκρίνεται στην TRH. Τα θυρεοειδικά κύτταρα σε αυτούς τους όζους ίσως να μην είναι ευαίσθητα στη δράση της TSH και εάν η παροχή ιωδίου αυξηθεί ξαφνικά, ίσως να υπερεκκρίνουν θυρεοειδικές ορμόνες (251).
Στο Σουδάν, μετά από λήψη ιωδιούχου λαδιού, 3% των ιωδιοπενικών ενηλίκων με βρογχοκήλη, ανέπτυξε κλινικό υπερθυρεοειδισμό, και οι συγκεντρώσεις της TSH στο πλάσμα ήταν λιγότερο από 0,1 mU/L στο 6-17% των ατόμων δώδεκα μήνες μετά από τη θεραπεία με ιώδιο (179). Στο Ζαΐρ, η χορήγηση ιωδιούχου αλατιού είχε ως συνέπεια το 7,4% των ενήλικων με προϋπάρχουσα οζώδη βρογχοκήλη να αναπτύξει βαριά θυρεοτοξίκωση και σε πολλούς η διαταραχή παρέμεινε για πάνω ένα χρόνο (274). Παρόμοια στη Ζιμπάμπουε, η εισαγωγή ιωδιούχου αλατιού προκάλεσε τριπλάσια αύξηση του υπερθυρεοειδισμού από ιώδιο (275). Η αύξηση στην επίπτωση του υπερθυρεοειδισμού από ιώδιο, μετά από σωστά επιτηρούμενη χορήγηση του ιωδίου είναι παροδική, πιθανόν λόγω του ότι η προκαλούμενη ιωδοπενία στο πληθυσμό μειώνει το μελλοντικό κίνδυνο ανάπτυξης αυτόνομων θυρεοειδικών όζων (276). Στην Ελβετία το 1980, η αύξηση του περιεχόμενου στο αλάτι ιωδίου από περίπου 7,5 σε 15 ppm, οδήγησε σε αύξηση της συγκέντρωσης ιωδίου στα ούρα από περίπου 80 στα 150 μg/g κρεατινίνης. Τα δύο πρώτα χρόνια μετά την αύξηση, η επίπτωση της τοξικής οζώδους βρογχοκήλης αυξήθηκε κατά 12%, αλλά σταδιακά παλινδρόμησε σε ένα σταθερό επίπεδο του 25% της αρχικής επίπτωσης (277) .
Στην Κίνα, με σκοπό να διερευνηθεί η επίδραση της πρόσληψης ιωδίου στη θυρεοειδική δυσλειτουργία (48,74,278), διεξήχθη μία πενταετής προοπτική βασισμένη στη κοινότητα έρευνα σε τρεις αγροτικές παροικίες της Κίνας με α) ηπίως ανεπαρκή πρόσληψη ιωδίου, β) περισσότερη από επαρκή πρόσληψη ιωδίου (αρχικά ήπια ιωδιοπενία που διορθώθηκε με ιωδιούχο αλάτι), και γ) υπερβολική πρόσληψη ιωδίου από περιβαλλοντικές πηγές. Η μέση συγκέντρωση ιωδίου στα ούρα ήταν 88, 214 και 634 μg/L, αντίστοιχα. Στις τρεις κοινότητες, η αθροιστική επίπτωση του υπερθυρεοειδισμού ήταν 1,4, 0,9 και 0,8%, του κλινικού υποθυρεοειδισμού 0,2, 2,6, 2,9% και της αυτοάνοσης θυρεοειδίτιδας 0,2, 1, και 1,3%, αντίστοιχα. Στα περισσότερα άτομα ο υποκλινικός υποθυρεοειδισμός και η αυτοάνοση θυρεοειδίτιδα ήταν παροδικά. Μεταξύ των ατόμων που ήταν ευθυρεοειδικά και είχαν αντιθυρεοειδικά αντισώματα κατά την έναρξη, η πενταετής επίπτωση των αυξημένων επιπέδων TSH στο πλάσμα ήταν μεγαλύτερη στα άτομα με υπερβολική πρόσληψη ιωδίου η με περισσότερο από επαρκή πρόσληψη ιωδίου, από ότι στα άτομα με ηπίως ανεπαρκή πρόσληψη ιωδίου. Σε όλες τις παροικίες, ανεξάρτητα από την πρόσληψη του ιωδίου, τα θετικά αντισώματα κατά της θυρεοειδικής υπεροξειδάσης, ή η παρουσία βρογχοκήλης σε υγιείς συμμετέχοντες συνδέθηκαν με την εμφάνιση υπερθυρεοειδισμού. Στις τρεις αυτές παροικίες, η αθροιστική επίπτωση της διάχυτης και οζώδους βρογχοκήλης ήταν 7,1, 4,4 και 6,9% και 5, 2,4, 0,8% αντίστοιχα, υποδηλώνοντας ότι η σχέση μεταξύ ιωδίου και κινδύνου εμφάνισης διάχυτης βρογχοκήλης, σχηματίζει μια καμπύλη σχήματος U, ενώ οι οζώδεις βρογχοκήλες είναι περισσότερο επικρατούσες σε ιωδιοπενικές περιοχές.
Σε δύο περιοχές της Δανίας (Άλμποργκ και Κοπεγχάγη), με μέτρια και ήπια ιωδιοπενία αντίστοιχα, καταγράφηκαν νέες περιπτώσεις θυρεοειδικής νόσου, μετά από προσεκτική εφαρμογή προγράμματος ιωδίωσης αλατιού (124, 208). Συγκεκριμένα, το καθολικό ποσοστό επίπτωσης του υποθυρεοειδισμού, αυξήθηκε μετρίως στη διάρκεια μια προοπτικής μελέτης επταετούς παρακολούθησης, από 38,3/100/έτος αρχικά σε 47,2/100 ανά έτος, εφτά χρόνια μετά την εφαρμογή της ιωδίωση του άλατος. Υπήρξε ωστόσο διαφορετική γεωγραφική κατανομή, καθώς ο υποθυρεοειδισμός αυξήθηκε μόνο στην περιοχή με προηγουμένως μέτρια ιωδοπενία και αφορούσε σε νέους και μέσης ηλικίας ενήλικες (124). Αντίστοιχα, σε μελέτη εξαετούς παρακολούθησης, υπήρξε αύξηση στο καθολικό ποσοστό επίπτωσης του υπερθυρεοειδισμού (από 102/100/έτος αρχικά σε 138,7/100/έτος μετά την ιωδίωση του αλατιού), που αφορούσε σε όλες τις ηλικιακές ομάδες και στα δύο φύλα. Αντίθετα όμως με την πολυοζώδη τοξική βρογχοκήλη, όπου οι περισσότερες περιπτώσεις αφορούν σε ηλικιωμένα άτομα, πολλές από τις νέες αυτές περιπτώσεις υπερθυρεοειδισμού, παρατηρήθηκαν σε νέα άτομα- η αύξηση ήταν μεγαλύτερη σε ενήλικες από 20 έως 39 ετών- και ήταν πιθανώς αυτοάνοσης αρχής. Σύμφωνα με τους συγγραφείς, περαιτέρω παρακολούθηση αναμένεται να δείξει μείωση στο αριθμό των ηλικιωμένων που νοσούν από οζώδη υπερθυρεοειδισμό (208).
11. Συμπεράσματα
Επιφυλάξεις για πιθανή αύξηση των θυρεοειδικών νόσων που προκαλούνται / επάγονται από το ιώδιο εξακολουθούν να καθυστερούν ή να περιορίζουν την εφαρμογή προφυλακτικής χορήγησης ιωδίου σε ιωδιοπενικούς πληθυσμούς. Το ερώτημα είναι εάν αυτές οι ανησυχίες είναι δικαιολογημένες Εξετάζοντας τα οφέλη και τους κινδύνους, είναι σαφές ότι η βαριά ιωδιοπενία στην εγκυμοσύνη μπορεί να προκαλέσει υποθυρεοειδισμό, αρνητική έκβαση της κύησης, κρετινισμό και μη αναστρέψιμη νοητική καθυστέρηση. Ήπια έως μέτρια ιωδοπενία κατά την εμβρυική και παιδική ηλικία έχει ως αποτέλεσμα μαθησιακή ανικανότητα, φτωχή σωματική ανάπτυξη και εμφάνιση διάχυτης βρογχοκήλης. Σε ενήλικες, η μέση έως μέτρια ιωδοπενία φαίνεται να συσχετίζεται με υψηλότερα ποσοστά εμφάνισης των περισσότερο επιθετικών ιστολογικών τύπων του καρκίνου του θυρεοειδούς αδένα και να αυξάνει τον κίνδυνο μη τοξικής και τοξικής οζώδους βρογχοκήλης καθώς και του υπερθυρεοειδισμού
Ωστόσο, η αύξηση της πρόσληψης του ιωδίου σε ιωδιοπενικούς πληθυσμούς δεν είναι ακίνδυνη. Η ήπια ιωδιοπενία ίσως συνδέεται με μειωμένο κίνδυνο εμφάνισης κλινικού και υποκλινικού υποθυρεοειδισμού καθώς και αυτοάνοσης θυρεοειδίτιδας. Στην Κίνα η χρόνια υπερβολική πρόσληψη ιωδίου συνδέεται με μικρή αύξηση του υποκλινικού υποθυρεοειδισμού και αυτοάνοσης θυρεοειδίτιδας αλλά όχι του κλινικού υποθυρεοειδισμού ή κλινικού υπερθυρεοειδισμού. Αντιθέτως, στη Δανία, η διόρθωση της ήπιας έως μέτριας ιωδοπενίας αύξησε συγκρατημένα τα ποσοστά του υπό-και υπερθυρεοειδισμού. Τα διαφορετικά αποτελέσματα της ποικίλης πρόσληψης ιωδίου στις μελέτες αυτές ίσως οφείλονται σε διαφορές στην υποκείμενη θυρεοειδική αυτονομία, γενετική επιδεκτικότητα ή άλλους περιβαλλοντικούς παράγοντες.
Περισσότερα προοπτικά δεδομένα στην επιδημιολογία των θυρεοειδικών διαταραχών που προκαλούνται από αλλαγές στη πρόσληψη ιωδίου σε άλλες χώρες θα ήταν πολύτιμα. Ωστόσο, φαίνεται ότι η επίτευξη της ιδανικής πρόσληψης ιωδίου (στη περιοχή των 150-250 μg ιώδιο ημερησίως στους ενήλικες), μπορεί να ελαχιστοποιήσει το ποσό των θυρεοειδικών δυσλειτουργιών στο πληθυσμό (273). Η προφυλακτική χορήγηση ιωδίου με περιοδική επιτήρηση, είναι μια εξαιρετικά αποδοτική προσέγγιση για την αντιμετώπιση των θυρεοειδικών δυσλειτουργιών, σε σχέση με τη κλινική διάγνωση και τη θεραπεία. Εάν υπάρξει προσεκτική επιτήρηση των προγραμμάτων προφυλακτικής χορήγησης ιωδίου, τόσο για ιωδοπενία όσο και υπερβολική πρόσληψη ιωδίου, ο κίνδυνος υπερβολικής πρόσληψης ιωδίου είναι πολύ μικρότερος από τους ουσιαστικούς κίνδυνους ιωδιοπενίας όπως απώλεια του κυήματος, ανάπτυξη βρογχοκήλης και νοητική καθυστέρηση, που εξακολουθεί να αφορά σε πάνω από το ένα τρίτο του παγκόσμιου πληθυσμού (183).
12. Επιγραμματικά
- Οικολογία και διατροφικές πηγές ιωδίου: H χρήση ιωδιωμένου άλατος αποτελεί την αποτελεσματικότερη μέθοδο αντιμετώπισης της ιωδιοπενίας.
- Απορρόφηση και μεταβολισμός ιωδίου: o θυρεοειδής προσαρμόζει την λειτουργία του ανάλογα με το ποσόν του προσλαμβανόμενου διαιτητικά ιωδίου.
- Οι απαιτήσεις σε ιώδιο στην εγκυμοσύνη και τη γαλουχία αυξάνονται.
- Μέθοδοι εκτίμησης της ιωδιοπενίας: μέγεθος θυρεοειδή, συγκέντρωση ιωδίου ούρων, θυρεοειδοτρόπος ορμόνη και θυρεοσφαιρίνη.
- Επί υπερβολικής πρόσληψης ιωδίου, αναπτύσσονται επίσης προσαρμοστικές αλλαγές στη λειτουργία του θυρεοειδή.
Βιβλιογραφία
1. Baumann F et al. Ueber das normale Vorkommen von Jod im Thierkörper. Z Physiol Chem 1896; 21:319–330.
2. Marine D, Kimball OP et al. The prevention of simple goiter in man. J Lab Clin Med 1917; 3:40–48.
3. Hetzel BS et al. Iodine deficiency disorders (IDD) and their eradication. Lancet1983; 2:1126–1129.
4. Zimmermann MB, Jooste PL et al. The iodine deficiency disorders. Lancet 2008; 372:1251–1262.
5. Goldschmidt VW et al. Geochemistry. Oxford, UK: Oxford University Press 1954.
6. Johnson, C C. Database of the iodine content of soils populated with data from published literature. British Geological Survey, 2003; CR/03/004N.
7. Pennington JAT, Schoen SA et al. eComposition of core foods in the U.S. food supply, 1982–1991. J Food Comp Anal 8:171–217.
8. Haldimann M, Alt A et al. Iodine content of food groups. J Food Comp Anal 2005; 18:461–471 .
9. Institute of Medicine, Academy of Sciences. Dietary reference intakes for vitamin A, Vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Washington, DC: National Academy Press 2001.
10. Pearce EN, Pino S et al. Sources of dietary iodine: bread, cows’ milk, and infant formula in the Boston area. J Clin Endocrinol Metab 2004; 89:3421–3424.
11. Chavasit V et al. Study on stability of iodine in iodated salt by use of different cooking model conditions. J Food Comp Anal 2002; 15:265–276.
12. Michalaki M. et al. The gastrointestinal absorption of iodine is not reduced after malabsorptive bariatric procedures In press.
13. Alexander WD, Harden RM et al. Some aspects of the absorption and concentration of iodide by the alimentary tract in man. Proc Nutr Soc 2002; 26:62–66.
14. Nicola JP, Basquin C et al. The Na+/I-symporter mediates active iodide uptake in the intestine. Am J Physiol Cell Physiol 2009; 296:C654–C662
15. DeGroot LJ et al. Kinetic analysis of iodine metabolism. J Clin Endocrinol Metab 1966; 26:149–173.
16. Stanbury JB, Brownell GL et al. Endemic goiter. In: Stanbury JB, ed. The adaptation of man to iodine deficiency. Cambridge, MA: Harvard University Press 1966; 1–209.
17. Wayne EJ et al. Clinical aspects of iodine metabolism. Oxford, UK: Blackwell Scientific 1964.
18. Weaver JC et al. Excretion of radioiodine in human milk. J Am Med Assoc 1960; 173:872–875.
19. Fisher DA et al. Thyroid iodine content and turnover in euthyroid subjects: validity of estimation of thyroid iodine accumulation from short-term clearance studies. J Clin Endocrinol Metab 1969; 29:721–727.
20. Eskandari S, Loo DD et al. Thyroid Na+/I− symporter. Mechanism, stoichiometry, and specificity. J Biol Chem 1997; 272:27230–27238.
21. Smanik PA, Ryu KY et al. Expression, exon-intron organization, and chromosome mapping of the human sodium iodide symporter. Endocrinology 1997; 138:3555–3558.
22. Eng PH et al. Escape from the acute Wolff-Chaikoff effect is associated with a decrease in thyroid sodium/iodide symporter messenger ribonucleic acid and protein. Endocrinology 1999; 140:3404–3410.
23. Dunn JT et al. Thyroglobulin, hormone synthesis and thyroid disease. Eur J Endocrinol 1995; 132:603–604.
24. Dunn JT et al. Update on intrathyroidal iodine metabolism. Thyroid 2001; 11:407–414.
25. Oppenheimer JH et al. Determination of common parameters of iodothyronine metabolism and distribution in man by noncompartmental analysis. J Clin Endocrinol Metab 1975; 41:319–324.
26. Taki K, Kogai T et al. thyroid-specific far-upstream enhancer in the human sodium/iodide symporter gene requires Pax-8 binding and cyclic adenosine 3′,5′-monophosphate response element-like sequence binding proteins for full activity and is differentially regulated in normal and thyroid cancer cells. Mol Endocrinol 2002; 16:2266–2282.
27. Abrams GM, Larsen PR et al. Triiodothyronine and thyroxine in the serum and thyroid glands of iodine-deficient rats. J Clin Invest 1973; 52:2522–2531.
28. Delange F et al. Iodine deficiency. In: Braverman LE, Utiger RD, eds. Werner and Ingbar’s the thyroid: a fundamental and clinical text. 8th ed. Philadelphia: JD Lippincott; 2000; 295–316.
29. Dumont JE, Ermans AM, et al. Large goitre as a maladaptation to iodine deficiency. Clin Endocrinol (Oxf) 1995; 43:1–10.
30. Kopp P, Kimura ET, et al. Polyclonal and monoclonal thyroid nodules coexist within human multinodular goiters. J Clin Endocrinol Metab 1994; 79:134–139
31. Laurberg P, Bülow Pedersen I et al. Environmental iodine intake affects the type of nonmalignant thyroid disease. Thyroid 2001; 11:457–469.
32. Delange F, Camus M, Ermans AM. Circulating thyroid hormones in endemic goiter. J Clin Endocrinol Metab 1972; 34:891–895.
33. Van Herle AJ, Hershman JM, et al. Serum thyroglobulin in inhabitants of an endemic goiter region of New Guinea. J Clin Endocrinol Metab 1976; 43:512–516.
34. Dumont JE, Ermans AM et al. Thyroid function in a goiter endemic. V. Mechanism of thyroid failure in the Uele endemic cretins. J Clin Endocrinol Metab 1963; 23:847–860.
35. Morreale de Escobar G et al. Role of thyroid hormone during early brain development. Eur J Endocrinol 2004; 151(Suppl 3):U25–U37.
36. Gaitan E 1989 Environmental goitrogenesis. Boca Raton, FL: CRC Press
37. Ermans AM, Delange F, et al. Possible role of cyanide and thiocyanate in the etiology of endemic cretinism. Adv Exp Med Biol 1972; 30:455–486.
38. Laurberg P, Nøhr SB, et al. Iodine nutrition in breast-fed infants is impaired by maternal smoking. J Clin Endocrinol Metab 2004; 89:181–187.
39. Messina M, Redmond G. Effects of soy protein and soybean isoflavones on thyroid function in healthy adults and hypothyroid patients: a review of the relevant literature. Thyroid 2006; 16:249–258.
40. Blount BC, Pirkle JL, et al. Urinary perchlorate and thyroid hormone levels in adolescent and adult men and women living in the United States. Environ Health Perspect 2006; 114:1865–1871.
41. Braverman LE, Pearce EN, et al. Effects of six months of daily low-dose perchlorate exposure on thyroid function in healthy volunteers. J Clin Endocrinol Metab 2006; 91:2721–2724.
42. Zimmermann MB, Köhrle J. The impact of iron and selenium deficiencies on iodine and thyroid metabolism: biochemistry and relevance to public health. Thyroid 2002; 12:867–878.
43. Zimmermann MB et al. The influence of iron status on iodine utilization and thyroid function. Ann Rev Nutr 2006; 26:367–389.
44. Zimmermann MB et al. Iron deficiency predicts poor maternal thyroid status during pregnancy. J Clin Endocrinol Metab 2007; 92:3436–3440.
45. Zimmermann MB et al. The effects of vitamin A deficiency and vitamin A supplementation on thyroid function in goitrous children. J Clin Endocrinol Metab . 2004; 89:5441–5447.
46. Zimmermann MB, Jooste PL et al. Vitamin A supplementation in iodine-deficient African children decreases TSH stimulation of the thyroid and reduces the goiter rate. Am J Clin Nutr 2007; 86:1040–1044.
47. Fisher DA, Oddie TH et al. Thyroidal radioiodine clearance and thyroid iodine accumulation: contrast between random daily variation and population data. J Clin Endocrinol Metab 1969; 29:111–115.
48. Teng W, Shan Z, et al. Effect of iodine intake on thyroid diseases in China. N Engl J Med 2006; 354:2783–2793.
49. Oddie TH, Fisher DA, et al. Factors affecting the estimation of iodine entering the normal thyroid gland using short-term clearance studies. J Clin Endocrinol Metab 1964; 24:924–933.
50. Dworkin HJ, Jacquez JA, et al. Relationship of iodine ingestion to iodine excretion in pregnancy. J Clin Endocrinol Metab 1966; 26:1329–1342.
51. Harrison MT Iodine balance in man. Postgrad Med J 1968; 44:69–71.
52. Harrison MT, Harden R, et al. Iodine balance studies in patients with normal and abnormal thyroid function. J Clin Endocrinol Metab 1965; 25:1077–1084
53. Malamos B, Koutras DA, et al. Endemic goiter in Greece: an iodine balance study in the field. J Clin Endocrinol Metab 1967; 27:1372–1380.
54. Vought RL, London WT et al. Iodine intake, excretion and thyroidal accumulation in healthy subjects. J Clin Endocrinol Metab 1967; 27:913–919
55. World Health Organization, United Nations Children’s Fund, International Council for the Control of Iodine Deficiency Disorders .Assessment of iodine deficiency disorders and monitoring their elimination. 3rd ed. Geneva: 2007 WHO.
56. Glinoer D et al. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev 1997; 18:404–433.
57. Koukkou Eftychia, Kravaritis Stavros et al. No difference in Urinary Iodine Excretion between pregnant women and their spouses: An indication of no increase in renal iodine excretion during pregnancy. In press
58. Delange F et al. Iodine nutrition and congenital hypothyroidism. In: Delange F, Fisher DA, Glinoer D, eds. Research in congenital hypothyroidism. NewYork: Plenum Press; 1989; 157–161.
59. Delange F, Bourdoux P, et al. Negative iodine balance in preterm infants. Ann Endocrinol 1984; 45:77.
60. Romano R, Jannini EA, et al. The effects of iodoprophylaxis on thyroid size during pregnancy. Am J Obstet Gynecol 1991; 164:482–485.
61. Pedersen KM, Laurberg P, et al. Amelioration of some pregnancy-associated variations in thyroid function by iodine supplementation. J Clin Endocrinol Metab 1993; 77:1078–1083.
62. Glinoer D, De Nayer P et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects. J Clin Endocrinol Metab 1995; 80:258–269.
63. Hollowell JG, Staehling NW, et al. Iodine nutrition in the United States. Trends and public health implications: iodine excretion data from National Health and Nutrition Examination Surveys I and III (1971–1974 and 1988–1994). J Clin Endocrinol Metab 1998; 83:3401–3408.
64. Zimmermann MB et al. The impact of iodized salt or iodine supplements on iodine status during pregnancy, lactation and infancy. Public Health Nutr 2007; 10:1584–1595.
65. Ingenbleek Y, Malvaux P et al. Iodine balance studies in protein-calorie malnutrition. Arch Dis Child 1974; 49:305–309.
66. Malvaux P, Beckers C, et al. Iodine balance studies in nongoitrous children and in adolescents on low iodine intake. J Clin Endocrinol Metab 1969; 29:79–84.
67. Zimmermann M, Saad A et al. Thyroid ultrasound compared with World Health Organization 1960 and 1994 palpation criteria for determination of goiter prevalence in regions of mild and severe iodine deficiency. Eur J Endocrinol 2000; 143:727–731.
68. Zimmermann MB, Hess SY et al. New reference values for thyroid volume by ultrasound in iodine-sufficient schoolchildren: a World Health Organization/Nutrition for Health and Development Iodine Deficiency Study Group Report. Am J Clin Nutr 2004; 79:231–237.
69. Brunn J, Block U et al. Volumetrie der Schilddrüsenlappen mittels Real-time-Sonographie. Dtsch Med Wochenschr 1981; 106:1338–1340.
70. Zimmermann MB et al. Toward a consensus on reference values for thyroid volume in iodine-replete schoolchildren: results of a workshop on inter-observer and inter-equipment variation in sonographic measurement of thyroid volume. Eur J Endocrinol 2001; 144:213–220.
71. Aghini-Lombardi F, Antonangeli L et al. Effect of iodized salt on thyroid volume of children living in an area previously characterized by moderate iodine deficiency. J Clin Endocrinol Metab 1997; 82:1136–1139.
72. Zimmermann MB, Hess SY et al. Thyroid size and goiter prevalence after introduction of iodized salt: a 5-y prospective study in schoolchildren in Cote d’Ivoire. Am J Clin Nutr 2003; 77:663–667.
73. Kostas B. Markou, Neoklis A. Georgopoulos et al. Iodine Deficiency in Azerbaijan After the Discontinuation of an Iodine Prophylaxis Program: Reassessment of Iodine Intake and Goiter Prevalence in Schoolchildren Thyroid; 2001; 11(12): 1141-1146.
74. Yu X, Fan C, Shan Z et al. A five-year follow-up study of goiter and thyroid nodules in three regions with different iodine intakes in China. J Endocrinol Invest 2008; 31:243–250.
75. Andersen S, Karmisholt J et al. Reliability of studies of iodine intake and recommendations for number of samples in groups and in individuals. Br J Nutr 2008; 99:813–818.
76. Knudsen N, Christiansen E et al. Age- and sex-adjusted iodine/creatinine ratio. A new standard in epidemiological surveys? Evaluation of three different estimates of iodine excretion based on casual urine samples and comparison to 24h values. Eur J Clin Nutr 2000; 54:361–363.
77. Delange F et al. Neonatal screening for congenital hypothyroidism: results and perspectives. Horm Res 1997; 48:51–61.
78. Zimmermann MB, Aeberli I et al. Increasing the iodine concentration in the Swiss iodized salt program markedly improved iodine status in pregnant women and children: a 5-y prospective national study. Am J Clin Nutr 2005; 82:388–392.
79. Spencer CA, Wang CC et al. Thyroglobulin measurement. Techniques, clinical benefits, and pitfalls. Endocrinol Metab Clin North Am1995; 24:841–863.
80. Knudsen N, Bülow I et al. Serum Tg: a sensitive marker of thyroid abnormalities and iodine deficiency in epidemiological studies. J Clin Endocrinol Metab 2001; 86:3599–3603.
81. Benmiloud M, Chaouki ML et al. Oral iodized oil for correcting iodine deficiency: optimal dosing and outcome indicator selection. J Clin Endocrinol Metab 1994; 79:20–24.
82. Missler U, Gutekunst R et al. Thyroglobulin is a more sensitive indicator of iodine deficiency than thyrotropin: development and evaluation of dry blood spot assays for thyrotropin and thyroglobulin in iodine-deficient geographical areas. Eur J Clin Chem Clin Biochem 1994; 32:137–143.
83. Zimmermann MB et al. Development of a dried whole-blood spot thyroglobulin assay and its evaluation as an indicator of thyroid status in goitrous children receiving iodized salt. Am J Clin Nutr 2003; 77:1453–1458.
84. Zimmermann MB, de Benoist B et al. Assessment of iodine status using dried blood spot thyroglobulin: development of reference material and establishment of an international reference range in iodine-sufficient children. J Clin Endocrinol Metab 2006; 91:4881–4887.
85. Zimmermann MB, Moretti D et al. Introduction of iodized salt to severely iodine-deficient children does not provoke thyroid autoimmunity: a one-year prospective trial in northern Morocco. Thyroid 2003; 13:199–203.
86. Loviselli A, Velluzzi F et al. The Sardinian autoimmunity study: 3. Studies on circulating antithyroid antibodies in Sardinian schoolchildren: relationship to goiter prevalence and thyroid function. Thyroid 2001; 11:849–857.
87. Mattsson S, Lindström S et al. Diuresis and voiding pattern in healthy schoolchildren. Brit J Urol 1995; 76:783–789.
88. Larsson G, Victor A et al. Micturition patterns in a healthy female population, studied with a frequency/volume chart. Scand J Urol Nephrol Suppl 1988; 114:53–57.
89. Vermiglio F, Lo Presti VP et al. Enhanced iodine concentration capacity by the mammary gland in iodine deficient lactating women of an endemic goiter region in Sicily. J Endocrinol Invest 1992; 15:137–142.
90. Dorea JG et al. Iodine nutrition and breast feeding. J Trace Elem Med Biol 2002; 16:207–220.
91. Pearce EN, Leung AM et al. Breast milk iodine and perchlorate concentrations in lactating Boston-area women. J Clin Endocrinol Metab 2007; 92:1673–1677.
92. Semba RD, Delange F et al. Iodine in human milk: perspectives for human health. Nutr Rev 2001; 59:269–278.
93. Dorey CM, Zimmermann MB et al. Reference values for spot urinary iodine concentrations in iodine-sufficient newborns using a new pad collection method. Thyroid 2008; 18:347–352.
94. National Research Council. Recommended dietary allowances. 10th rev. ed. Washington, DC: National Academy Press; 1989; 215.
95. Delange F, Heidemann P et al. Regional variations of iodine nutrition and thyroid function during the neonatal period in Europe. Biol Neonate 1986; 49:322–330.
96. Nordenberg D, Sullivan K et al. Congenital hypothyroid screening programs and the sensitive thyrotropin assay: strategies for the surveillance of iodine deficiency disorders In: Delange F, Dunn J, Glinoer D, eds. Iodine deficiency in Europe: a continuing concern. New York: Plenum Publishing; 1993; 211–217.
97. Carta Sorcini M, Diodato A et al. Influence of environmental iodine deficiency on neonatal thyroid screening results. J Endocrinol Invest 1988; 11:309–312.
98. Sullivan KM, May W et al. Use of thyroid stimulating hormone testing in newborns to identify iodine deficiency. J Nutr 1997; 127:55–58.
99. Copeland DL, Sullivan KM et al. Comparison of neonatal thyroid-stimulating hormone levels and indicators of iodine deficiency in school children. Public Health Nutr 2002; 5:81–87.
100. Glinoer D et al. The regulation of thyroid function during normal pregnancy: importance of the iodine nutrition status. Best Practice Res Clin Endocrinol Metab 2004; 18:133–152.
101. Markou KB, Tsekouras A. et al. Treating Iodine Deficiency: Long-Term Effects of Iodine Repletion on Growth and Pubertal Development in School-Age Children Thyroid 2008;18(4): 449-454.
102. Morreale de Escobar G et al. Role of thyroid hormone during early brain development. Eur J Endocrinol 2004; 151(Suppl 3):U25–U37.
103. McCarrison R et al. Observations on endemic cretinism in the Chitral and Gilgit Valleys. Lancet 1908; 2:1275–1280.
104. Halpern JP, Boyages SC et al. The neurology of endemic cretinism. Brain 1991; 114:825–841.
105. Delange F et al. Endemic goitre and thyroid function in Central Africa. Monographs in pediatrics. Basel, Switzerland: S. Karger; 1974; 1–171.
106. Haddow JE, Palomaki GE et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999; 341:549–555 .
107. Pop VJ, Kuijpens JL et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin Endocrinol (Oxf) 1999; 50:149–155.
108. Pharoah POD, Buttfield IH et al. Neurological damage to the fetus resulting from severe iodine deficiency during pregnancy. Lancet 1971; 1:308–310.
109. Pharoah PO, Connolly KJ et al. A controlled trial of iodinated oil for the prevention of endemic cretinism: a long term follow up. Int J Epidemiol 1987; 16:68–73.
110. Pharoah PO, Connolly KJ et al. Effects of maternal iodine supplementation during pregnancy. Arch Dis Child 1991; 66:145–147.
111. Thilly CH, Delange F et al. Fetal hypothyroidism and maternal thyroid status in severe endemic goiter. J Clin Endocrinol Metab 1978; 47:354–360.
112. Thilly C, Lagasse R. Impaired fetal and postnatal development and high perinatal death rate in a severe iodine deficient area. Thyroid Research VIII. Proc 8th International Thyroid Congress, Australian Academy of Research, Sydney, Australia, 1980, pp 20–23.
113. Thilly CH, Swennen B et al. Maternal, fetal and juvenile hypothyroidism, birthweight and infant mortality in the etiopathogenesis of the IDD spectrum in Zaire and Malawi. In: Stanbury JB, ed. The damaged brain of iodine deficiency. New York: Cognizant Communication; 1994; 241–250.
114. Cao XY, Jiang XM et al. Timing of vulnerability of the brain to iodine deficiency in endemic cretinism. N Engl J Med 1994; 331:1739–1744.
115. O’Donnell KJ, Rakeman MA et al. Effects of iodine supplementation during pregnancy on child growth and development at school age. Dev Med Child Neurol 2002; 44:76–81.
116. Pretell EA, Palacios P et al. Iodine deficiency and the maternal/fetal relationship. In: Dunn JG, Medeiros-Neto GA, eds. Endemic goiter and cretinism. Continuing threats to world health. Pan American Health Organization Science Publication 292. Washington, DC: WHO; 1974; 143–155.
117. Pretell EA, Caceres A et al. Impairment of mental development by iodine deficiency and its correction. A retrospective view of studies in Peru. In: Stanbury JB, ed. The damaged brain of iodine deficiency. New York: Cognizant Communication; 1994; 187–191.
118. Fierro-Benitez R, Cazar R et al. Effects on schoolchildren of prophylaxis of mothers with iodized oil in an area of iodine deficiency. J Endocrinol Invest 1988; 11:327–335.
119. Greene LS et al. A retrospective view of iodine deficiency, brain development and behavior from studies in Ecuador. In: Stanbury JB, ed. The damaged brain of iodine deficiency. New York: Cognizant Communication; 1994; 173–185.
120. Markou KB, Georgopoulos NA et al. Improvement of iodine deficiency after iodine supplementation in schoolchildren of Azerbaijan was accompanied by hypo and hyperthyrotropinemia and increased title of thyroid autoantibodies. J Endocrinol Invest 2003; 26: 43-48.
121. Liesenkötter KP, Göpel W et al. Earliest prevention of endemic goiter by iodine supplementation during pregnancy. Eur J Endocrinol 1996; 134: 443–448.
122. Nøhr SB, Jørgensen A. Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-positive women living in an area with mild to moderate iodine deficiency: is iodine supplementation safe? J Clin Endocrinol Metab 2000; 85:3191–3198.
123. Antonangeli L, Maccherini D et al. Comparison of two different doses of iodide in the prevention of gestational goiter in marginal iodine deficiency: a longitudinal study. Eur J Endocrinol 2002; 147:29–34.
124. Pedersen IB, Laurberg P et al. An increased incidence of overt hypothyroidism after iodine fortification of salt in Denmark: a prospective population study. J Clin Endocrinol Metab 2007; 92:3122–3127.
125. Pharoah PO, Ellis SM et al. Maternal thyroid function, iodine deficiency and fetal development. Clin Endocrinol (Oxf) 1976; 5:159–166.
126. DeLong GR, Leslie PW et al. Effect on infant mortality of iodination of irrigation water in a severely iodine-deficient area of China. Lancet 1997; 350:771–773.
127. Thilly CH, Swennen B et al. Maternal, fetal and juvenile hypothyroidism, birth weight and infant mortality in the etiopathogenesis of the IDD spectra in Zaire and Malawi. In: JB Stanbury, ed. The damaged brain of iodine deficiency. New York: Cognizant Communication; 1994; 241–250.
128. Chaouki ML, Benmiloud M et al. Prevention of iodine deficiency disorders by oral administration of lipiodol during pregnancy. Eur J Endocrinol 1994; 130:547–551.
129. Semba RD, de Pee S et al. Child malnutrition and mortality among families not utilizing adequately iodized salt in Indonesia. Am J Clin Nutr 2008; 87:438–444.
130. Cobra C, Muhilal, Rusmil K et al. Infant survival is improved by oral iodine supplementation. J Nutr 1997; 127:574–578.
131. Boyages SC, Collins JK et al. Iodine deficiency impairs intellectual and neuromotor development in apparently-normal persons. A study of rural inhabitants of north-central China. Med J Aust 1989; 150:676–682.
132. Choudhury N, Gorman KS et al. Subclinical prenatal iodine deficiency negatively affects infant development in Northern China. J Nutr 2003; 133:3162–3165.
133. Gao TS, Teng WP et al. Effect of different iodine intake on schoolchildren’s thyroid diseases and intelligence in rural areas. Chin Med J 2004; 117:1518–1522.
134. Amarra MS, Bongga DC et al. Effect of iodine status and other nutritional factors on psychomotor and cognitive performance of Filipino schoolchildren. Food Nutr Bull 2007; 28:47–54.
135. Vermiglio F, Sidoti M et al. Defective neuromotor and cognitive ability in iodine-deficient schoolchildren of an endemic goiter region in Sicily. J Clin Endocrinol Metab 1990; 70:379–384.
136. Fenzi GF, Giusti LF et al. Neuropsychological assessment in schoolchildren from an area of moderate iodine deficiency. J Endocrinol Invest 1990; 13:427–431
137. Vitti P, Aghini Lombardi F et al. Mild iodine deficiency in fetal/neonatal life and neuropsychological performances. Acta Med Austriaca 1992; 19(Suppl 1):57–59.
138. Aghini Lombardi FA, Pinchera A et al. Mild iodine deficiency during fetal/neonatal life and neuropsychological impairment in Tuscany. J Endocrinol Invest 1995; 18:57–62.
139. Vermiglio F, Lo Presti VP et al. Attention deficit and hyperactivity disorders in the offspring of mothers exposed to mild-moderate iodine deficiency: a possible novel iodine deficiency disorder in developed countries. J Clin Endocrinol Metab 2004; 89:6054–6060
140. Santiago-Fernandez P, Torres-Barahona R et al. Intelligence quotient and iodine intake: a cross-sectional study in children. J Clin Endocrinol Metab 2004; 89:3851–3857.
141. Azizi F, Sarshar A et al. Impairment of neuromotor and cognitive development in iodine-deficient schoolchildren with normal physical growth. Acta Endocrinol (Copenh) 1993; 129:501–504.
142. Azizi F, Kalani H et al. Physical, neuromotor and intellectual impairment in non-cretinous schoolchildren with iodine deficiency. Int J Vitam Nutr Res 1995; 65:199–205.
143. Salarkin N, Mirmiran P et al. Timing of the effect of iodine supplementation on intelligence quotient of schoolchildren. Int J Endocrinol Metab 2004; 2:95–102.
144. Tiwari BD, Godbole MM et al. Learning disabilities and poor motivation to achieve due to prolonged iodine deficiency. Am J Clin Nutr 1996; 63:782–786.
145. Huda SN, Grantham-McGregor SM et al. Biochemical hypothyroidism secondary to iodine deficiency is associated with poor school achievement and cognition in Bangladeshi children. J Nutr 1999; 129:980–987.
146. Ojule AC, Osotimehin BO et al. The influence of iodine deficiency on the cognitive performance of school children in Saki, south-west Nigeria. Afr J Med Sci 1998; 27:95–99.
147. Sameroff AJ, Seifer R et al. Stability and intelligence from preschool to adolescence: the influence of social and family risk factors. Child Dev 1993; 64:80–97.
148. Bleichrodt N, Born MP et al. A metaanalysis of research on iodine and its relationship to cognitive development. In: Stanbury JB, ed. The damaged brain of iodine deficiency. New York: Cognizant Communications; 1994; 195–200.
149. Qian M, Wang D et al.The effects of iodine on intelligence in children: a meta-analysis of studies conducted in China. Asia Pacific J Clin Nutr 2005; 14:32–42.
150. Bautista A, Barker PA et al. The effects of oral iodized oil on intelligence, thyroid status, and somatic growth in school-age children from an area of endemic goiter. Am J Clin Nutr 1982; 35:127–134.
151. Shrestha RM. Effect of iodine and iron supplementation on physical, psychomotor and mental development in primary school children in Malawi. Doctoral thesis, Wageningen Agricultural University, Wageningen, The Netherlands 1994.
152. Huda SN, Grantham-McGregor SM et al. Cognitive and motor functions of iodine deficient but euthyroid children in Bangladesh do not benefit from iodized poppy seed oil (Lipiodol). J Nutr 2001; 131:72–77.
153. Isa ZM, Alias IZ, Kadir KA et al. Effect of iodized oil supplementation on thyroid hormone levels and mental performance among Orang Asli schoolchildren and pregnant mothers in an endemic goitre area in Peninsular Malaysia. Asia Pac J Clin Nutr 2000; 9:274–281.
154. Zimmermann MB, Connolly K et al. Iodine supplementation improves cognition in iodine-deficient schoolchildren in Albania: a randomized, controlled, double-blind study. Am J Clin Nutr 2006; 83:108–114.
155. Koutras DA, Christakis G et al. Endemic goiter in Greece: nutritional status, growth, and skeletal development of goitrous and nongoitrous populations. Am J Clin Nutr 1973; 26:1360–1368.
156. Bautista A, Barker PA et al. Lack of correlation between thyroid size and body growth in an area of endemic goiter. Am J Clin Nutr 1977; 30:275–279.
157. Ali O, Tan TT et al. Thyroid function and pubertal development in malnutrition. Ann Acad Med Singapore 1994; 23:852–855.
158. Neumann CG, Harrison GG et al. Onset and evolution of stunting in infants and children. Examples from the Human Nutrition Collaborative Research Support Program. Kenya and Egypt studies. Eur J Clin Nutr 1994; 48(Suppl 1):S90–S102.
159. Lal RB, Srivastava VK et al. A study of the spectrum of iodine deficiency disorders in rural area of Uttar Pradesh. Indian J Public Health 1996; 40:10–12.
160. Mason JB, Deitchler M et al.Iodine fortification is related to increased weight-for-age and birthweight in children in Asia. Food Nutr Bull 2002 ; 23:292–308.
161. van Stuijvenberg ME, Kvalsvig JD et al. Effect of iron-, iodine-, and beta-carotene-fortified biscuits on the micronutrient status of primary school children: a randomized controlled trial. Am J Clin Nutr 1999; 69:497–503.
162. Rivera JA, González-Cossío T et al. Multiple micronutrient supplementation increases the growth of Mexican infants. Am J Clin Nutr 2001; 74:657–663.
163. Moreno-Reyes R, Mathieu F et al. Selenium and iodine supplementation of rural Tibetan children affected by Kashin-Beck osteoarthropathy. Am J Clin Nutr 2003; 78:137–144.
164. Hernández-Cassis C, Cure-Cure C et al. Effect of thyroid replacement therapy on the stature of Colombian children with minimal thyroid dysfunction. Eur J Clin Invest 1995; 25:454–456.
165. Crew MD, Spindler SR et al. Thyroid hormone regulation of the transvected rat growth hormone promoter. J Biol Chem 1986; 261:5018–5022.
166. Samuels MH, Wierman ME et al.The effect of altered thyroid status on pituitary hormone messenger ribonucleic acid concentration in the rat. Endocrinology 1989; 124:2277–2282.
167. Hochberg Z, Bick T et al. Alterations of human growth hormone binding by rat liver membranes during hypo-and hyperthyroidism. Endocrinology 1990; 126:325–329.
168. Burstein PJ, Draznin B et al. The effect of hypothyroidism on growth, serum growth hormone, the growth hormone-dependent somatomedin, insulin-like growth factor, and its carrier protein in rats. Endocrinology 1979; 104:1107–1111.
169. Näntö-Salonen K, Muller HL et al. Mechanisms of thyroid hormone action on the insulin-like growth factor system: all thyroid hormone effects are not growth hormone mediated. Endocrinology 1993; 132:781–788.
170. Miell JP, Zini M et al. Reversible effects of cessation and recommencement of thyroxine treatment on insulin-like growth factors (IGFs) and IGF-binding proteins in patients with total thyroidectomy. J Clin Endocrinol Metab 1994; 79:1507–1512.
171. Iglesias P, Bayón C et al. Serum insulin-like growth factor type 1, insulin-like growth factor-binding protein-1, and insulin-like growth factor-binding protein-3 concentrations in patients with thyroid dysfunction. Thyroid 2001; 11:1043–1048.
172. Wan Nazaimoon WM, Osman A et al. Effects of iodine deficiency on insulin-like growth factor-I, insulin-like growth factor-binding protein-3 levels and height attainment in malnourished children. Clin Endocrinol (Oxf) 1996; 45:79–83.
173. Aydin K, Bideci A et al. Insulin-like growth factor-I and insulin-like growth factor binding protein-3 levels of children living in an iodine- and selenium-deficient endemic goiter area. Biol Trace Elem Res 2002; 90:25–30.
174. Alikaþifođlu A, Ozön A et al. Serum insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 levels in severe iodine deficiency. Turk J Pediatr 2002; 44:215–218.
175. Ozön A, Alikaþifođlu A et al. Influence of iodine supplementation on serum insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 (IGFBP-3) levels in severe iodine deficiency. Turk J Pediatr 2004; 46:303–308.
176. Zimmermann MB, Jooste PL et al. Treatment of iodine deficiency in school-age children increases IGF-1 and IGFBP-3 concentrations and improves somatic growth. J Clin Endocrinol Metab 2007; 92:437–442.
177. Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008; 29:76–13.
178. Paoli-Valeri M, Guzman M et al. Atherogenic lipid profile in children with subclinical hypothyroidism. An Pediatr (Barc) 2005; 62:128–134.
179. Elnagar B, Eltom M et al. The effects of different doses of oral iodized oil on goiter size, urinary iodine, and thyroid-related hormones. J Clin Endocrinol Metab 1995; 80:891–897.
180. Rönnefarth G, Kauf E et al. Therapy of iodine deficiency goiter in adolescents with iodine or a combination of iodine and levothyroxine with special reference to lipid parameters. Klin Padiatr 1996; 208:123–128.
181. Zimmermann MB, Aeberli I et al. Iodine treatment in children with subclinical hypothyroidism due to chronic iodine deficiency decreases TSH and C-peptide concentrations and improves the lipid profile. Thyroid 2009;19: 1099-1104.
182. Delange F, Bürgi H et al. World status of monitoring iodine deficiency disorders control programs. Thyroid 2002; 12:915–924.
183. de Benoist B, McLean E et al. Iodine deficiency in 2007: global progress since 2003. Food Nutr Bull 2008; 29:195–202.
184. Li M, Eastman CJ, Waite KV et al. Are Australian children iodine deficient? Results of the Australian National Iodine Nutrition Study. Med J Aust 2006; 184:165–169.
185. Caldwell KL, Miller GA et al. Iodine status of the U.S. population, National Health and Nutrition Examination Survey 2003–2004. Thyroid 2008; 18:1207–1214
186. UNICEF 2002 Fact sheet. IDD: achievements and challenges. Available at: http://www.unicef.org/media/14946.html
187. Ministry of Health and Family Welfare, Government of India 2007 2005–06 National Family Health Survey (NFHS-3). New Delhi: Government of India
188. Sankar R, Pandav CS et al. Ban on sale of non-iodized salt for human consumption: A step in the right direction. Natl Med J India 2005; 18:169–171.
189. UNICEF. The State of the world’s children 2007. Available at: www.unicef.org/SOWC/
190. Egbuta J, Onyezili F et al. Impact evaluation of efforts to eliminate iodine deficiency disorders in Nigeria. Public Health Nutr 2003; 6:169–173.
191. Okosieme OE et al. Impact of iodination on thyroid pathology in Africa. J R Soc Med 2006; 99:396–401.
192. Markou BK and Koukkou GE. The Greek Population Is Iodine-Sufficient, and Not at Risk of Iodine-Induced Hyperthyroidism, J. Nutr. 2012; 142: 1611.
193. Walker SP, Wachs TD et al. International Child Development Steering Group 2007 Child development: risk factors for adverse outcomes in developing countries. Lancet 2007; 369:145–157.
194. UNICEF Nutrition Section, Eastern and Southern Africa Regional Office 2007 Protecting children’s brain development: a strategic review on sustained universal salt iodization in Eastern and Southern Africa. Nairobi: UNICEF; 2007; 1–40
195. Dunn JT et al. Complacency: the most dangerous enemy in the war against iodine deficiency. Thyroid 2000; 10:681–683.
196. Zimmermann MB, Wegmüller R et al. Rapid relapse of thyroid dysfunction and goiter in school-age children after discontinuation of salt iodization. Am J Clin Nutr 2004; 79:642–645.
197. WHO. The 58th World Health Assembly WHA58.24: Sustaining the elimination of iodine deficiency disorders. 2005; Available at: http://www.who.int/gb/ebwha/pdf_files/WHA58/ WHA58_24-en.pdf.
198. Diosady LL, Alberti JO et al. Stability of iodine in iodized salt used for correction of iodine-deficiency disorders, I. Food Nutr Bull 1997; 18:388–396
199. Diosady LL, Alberti JO et al. Stability of iodine in iodized salt used for correction of iodine-deficiency disorders, II. Food Nutr Bull 1998; 19:240–250.
200. Engle PL, Black MM et al. International Child Development Steering Group 2007 Strategies to avoid the loss of developmental potential in more than 200 million children in the developing world. Lancet 2007; 369:229–242.
201. Aguayo VM, Scott S et al. PROFILES Study Group 2003 Sierra Leone–investing in nutrition to reduce poverty: a call for action. Public Health Nutr 2003; 6:653–657.
202. Caulfield LE, Richard SA et al. Stunting, wasting, and micronutrient deficiency disorders 2006. In: Dean T, Jamison DT, Breman JG, Measham AR, Alleyne G, Claeson M, Evans DB, Jha P, Mills A, Musgrove P, eds. Disease control priorities in developing countries. 2nd ed. New York: Oxford University Press; 2006; 551–568.
203. Horton S et al. The economics of food fortification. J Nutr 2006; 136:1068–1071.
204. Seal JA, Doyle Z et al. Iodine status of Tasmanians following voluntary fortification of bread with iodine. Med J Aust 2007; 186:69–71.
205. Cao XY, Jiang XM et al. Iodination of irrigation water as a method of supplying iodine to a severely iodine-deficient population in Xinjiang, China. Lancet 1994; 344:107–110.
206. Squatrito S, Vigneri R et al. Prevention and treatment of endemic iodine-deficiency goiter by iodination of a municipal water supply. J Clin Endocrinol Metab 1986; 63:368–375.
207. Dunn JT et al. Iodine should be routinely added to complementary foods. J Nutr 2003; 133:3008S–3010S.
208. Untoro J, Schultink W et al. Efficacy of oral iodized peanut oil is greater than that of iodized poppy seed oil among Indonesian schoolchildren. Am J Clin Nutr 2006; 84:1208–1214.
209. Bülow Pedersen I, Laurberg P et al. Increase in incidence of hyperthyroidism predominantly occurs in young people after iodine fortification of salt in Denmark. J Clin Endocrinol Metab 2006; 91:3830–3834.
210. Delange F et al. Administration of iodized oil during pregnancy: a summary of the published evidence. Bull World Health Organ 1996; 74:101–108.
211. Todd CH, Dunn JT et al. Intermittent oral administration of potassium iodide solution for the correction of iodine deficiency. Am J Clin Nutr 1998; 67:1279–1283.
212. WHO Secretariat, Andersson M et al. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2-years-old: conclusions and recommendations of the technical consultation. Public Health Nutr 2007;10:1606–1611.
213. Delange F, Bourdoux P et al. Physiology of iodine nutrition during pregnancy, lactation, and early postnatal life. In: Berger H, ed. Vitamins and minerals in pregnancy and lactation: Nestle nutrition workshop series. New York: Vevey/Raven Press; 1988; 16:205–214.
214. Ares S, Escobar-Morreale HF et al. Neonatal hypothyroxinemia: effects of iodine intake and premature birth. J Clin Endocrinol Metab 1997; 82:1704–1712.
215. Ibrahim M, de Escobar GM et al. Iodine deficiency associated with parenteral nutrition in extreme preterm infants. Arch Dis Child Fetal Neonatal 2003; Ed 88:F56–F57.
216. Seibold-Weiger K, Wollmann H et al. Iodine concentration in the breast milk of mothers of premature infants. Z Geburtshilfe Neonatol 1999; 203:81–85.
217. Ares S, Quero J et al. Iodine content of infant formulas and iodine intake of premature babies: high risk of iodine deficiency. Arch Dis Child Fetal Neonatal 1994; Ed 71:F184–F191.
218. Greene HL, Hambidge KM et al. Guidelines for the use of vitamins, trace elements, calcium, magnesium, and phosphorus in infants and children receiving total parenteral nutrition: report of the Subcommittee on Pediatric Parenteral Nutrient Requirements from the Committee on Clinical Practice Issues of the American Society for Clinical Nutrition. Am J Clin Nutr 1988; 48:1324–1342.
219. Koletzko B et al. Parenteral Nutrition Guidelines Working Group; European Society for Clinical Nutrition and Metabolism; European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN); European Society of Paediatric Research (ESPR) 2005 Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr 2005; 41(Suppl 2):S1–S87.
220. Moukarzel AA, Buchman AL et al. Iodine supplementation in children receiving long-term parenteral nutrition. J Pediatr 1992; 121:252–254.
221. Smerdely P, Lim A et al. Topical iodine containing antiseptics and neonatal hypothyroidism in very-low-birthweight infants. Lancet 1989; 2:661–664.
222. Mimoz O, Villeminey S et al. Chlorhexidine-based antiseptic solution vs alcohol-based povidone- iodine for central venous catheter care. Arch Intern Med 2007; 167:2066–2072.
223. Reuss ML, Leviton A et al. Thyroxine values from newborn screening of 919 infants born before 29 weeks’ gestation. Am J Public Health 1997; 87:1693–1697.
224. Lucas A, Morley R et al. Low triiodothyronine concentration in preterm infants and subsequent intelligence quotient (IQ) at 8 year follow up. BMJ 1996; 312:1132–1133.
225. Reuss ML, Paneth N et al. The relation of transient hypothyroxinemia in preterm infants to neurologic development at two years of age. N Engl J Med 1996; 334:821–827.
226. Rogahn J, Ryan S et al. Randomised trial of iodine intake and thyroid status in preterm infants. Arch Dis Child Fetal Neonatal 2000; Ed 83:F86–F90.
227. Ibrahim M, Sinn J et al. Iodine supplementation for the prevention of mortality and adverse neurodevelopmental outcomes in preterm infants. Cochrane Database of Syst Rev 2006; 2:CD005253.
228. van Wassenaer AG, Kok JH et al. Effects of thyroxine supplementation on neurologic development in infants born at less than 30 weeks’ gestation. N Engl J Med 1997; 336:21–26.
229. Osborn DA, Hunt RW. Prophylactic postnatal thyroid hormones for prevention of morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2007; 24;(1):CD005948.
230. Cicalese MP, Assante L et al. Asking for iodine supplementation in children on parenteral nutrition. Dig Liver Dis 2008; 40:A115.
231. Fresenius Kabi AG. Peditrace: Bad Homburg, Germany. 2009; http://www.fresenius-kabi.com/internet/kabi/corp/ fkintpbn.nsf
232. Hopkins B. Enteral nutrition products. In: Zaloga GP, ed. Nutrition in critical care. St. Louis, MO: Mosby; 1994; 439–468.
233. Atkinson M, Worthley LI. Nutrition in the critically ill patient: part II. Parenteral nutrition. Crit Care Resusc 2003; 5:121–136.
234. Koretz RL, Lipman TO et al. American Gastroenterological Association Technical review on parenteral nutrition. Gastroenterology 2001; 121:970–1001.
235. Grant JP et al. Handbook of total parenteral nutrition. Philadelphia: W.B. Saunders Company; 1992; 280.
236. Gough DC, Laing I et al. Thyroid function on short-term total parenteral nutrition without iodine supplements. JPEN J Parenter Enteral Nutr 1982; 6:439–440.
237. Leung FY et al. Trace elements in parenteral micronutrition. Clin Biochem 1995; 28:561–566.
238. Navarro AM, Suen VM et al. Patients with severe bowel malabsorption do not have changes in iodine status. Nutrition 2005; 21:895–900.
239. Iodopen (Sodium Iodide Injection) 2008 APP Pharmaceuticals, Schaumburg, IL.http://www.apppharma.com/ProductDetail.aspx?Id=63&name=Iodopen_Sodium_ Iodide_Injection
240. Suzuki H, Higuchi T et al. “Endemic coast goitre” in Hokkaido, Japan. Acta Endocrinol (Copenh) 1965; 50:161–176.
241. Nagataki S et al. The average of dietary iodine intake due to the ingestion of seaweeds is 1.2 mg/day in Japan. Thyroid 2008; 18:667–668.
242. Li M, Liu DR et al. Endemic goitre in central China caused by excessive iodine intake. Lancet 1987; 2:257–259.
243. Zhao J et al. Iodine-rich drinking water of natural origin in China. Lancet 1998; 352:2024.
244. Sigurdsson G et al. Urine excretion of iodine in an Icelandic population. Icelandic Med J 1988; 74:179–181.
245. London WT et al. Bread— dietary source of large quantities of iodine. N Engl J Med 1966; 223:338.
246. Scientific Committee on Food, Health and Consumer Protection Directorate-General 2002 Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Iodine. Brussels: European Commission
247. Pennington JA et al. A review of iodine toxicity reports. J Am Diet Assoc 1990; 90:1571–1581.
248. Parsad D et al. Acneform eruption with iodized salt. Int J Dermatol 1998 ; 37:478.
249. Chow CC, Phillips DI et al. Effect of low dose iodide supplementation on thyroid function in potentially susceptible subjects: are dietary iodide levels in Britain acceptable? Clin Endocrinol (Oxf) 1991; 34:413–416.
250. Gardner DF et al. Effects of low dose oral iodide supplementation on thyroid function in normal men. Clin Endocrinol (Oxf) 1988; 28:283–288.
251. Marina Michalaki et al. The Odyssey of Nontoxic Nodular Goiter (NTNG) in Greece under Suppression Therapy, and after Improvement of Iodine Deficiency Thyroid; 2008; 18(6): 641-645.
252. Laurberg P, Pedersen KM et al. High incidence of multinodular toxic goitre in the elderly population in a low iodine intake area vs. high incidence of Graves’ disease in the young in a high iodine intake area: comparative surveys of thyrotoxicosis epidemiology in East-Jutland Denmark and Iceland. J Intern Med 1991; 229:415–420.
253. Aghini-Lombardi F, Antonangeli L et al. The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. J Clin Endocrinol Metab 1999; 84:561–566.
254. Laurberg P, Pedersen KM et al. Iodine intake and the pattern of thyroid disorders: a comparative epidemiological study of thyroid abnormalities in the elderly in Iceland and in Jutland, Denmark. J Clin Endocrinol Metab 1998; 83:765–769.
255. Seck T, Scheidt-Nave C et al. Prevalence of thyroid gland dysfunctions in 50- to 80-year-old patients. An epidemiologic cross-sectional study in a southwestern community. Med Klin (Munich) 1997; 92: 642–646.
256. Hintze G, Burghardt U et al. Prevalence of thyroid dysfunction in elderly subjects from the general population in an iodine deficiency area. Aging (Milano) 1991; 3:325–331.
257. Szabolcs I, Podoba J et al. Comparative screening for thyroid disorders in old age in areas of iodine deficiency, long-term iodine prophylaxis and abundant iodine intake. Clin Endocrinol (Oxf) 1997; 47:87–92.
258. Konno N, Makita H et al. Association between dietary iodine intake and prevalence of subclinical hypothyroidism in the coastal regions of Japan. J Clin Endocrinol Metab 1994; 78:393–397.
259. Roti E, Gardini E et al. Prevalence of anti-thyroid peroxidase antibodies in serum in the elderly: comparison with other tests for anti-thyroid antibodies. Clin Chem 1992; 38:88–92.
260. Ozbakir O et al. The prevalence of thyroid dysfunction among elderly subjects in an endemic goiter area of Central Anatolia. Endocr J 1995; 42:713–716.
261. Nygaard B, Gideon P et al. Thyroid volume and morphology and urinary iodine excretion in a Danish municipality. Acta Endocrinol (Copenh) 1993; 129:505–510.
262. Knudsen N, Jorgensen T et al. The prevalence of thyroid dysfunction in a population with borderline iodine deficiency. Clin Endocrinol (Oxf) 1999; 51:361–367.
263. Knudsen N, Bülow I et al. Comparative study of thyroid function and types of thyroid dysfunction in two areas in Denmark with slightly different iodine status. Eur J Endocrinol 2000; 143:485–491.
264. Knudsen N, Bulow I et al. Goitre prevalence and thyroid abnormalities at ultrasonography: a comparative epidemiological study in two regions with slightly different iodine status. Clin Endocrinol (Oxf) 2000; 53:479–485.
265. Tajiri J, Higashi K et al. Studies of hypothyroidism in patients with high iodine intake. J Clin Endocrinol Metab 1986; 63:412–417.
266. Sato K, Okamura K et al. Immunological and chemical types of reversible hypothyroidism; clinical characteristics and long-term prognosis. Clin Endocrinol (Oxf) 1996; 45:519–528.
267. Safran M, Paul TL et al. Environmental factors affecting autoimmune thyroid disease. Endocrinol Metab Clin North Am 1987; 16:327–342.
268. Harach HR, Escalante DA et al. Thyroid carcinoma and thyroiditis in an endemic goitre region before and after iodine prophylaxis. Acta Endocrinol (Copenh) 1985; 108:55–60.
269. Sehestedt T, Knudsen N et al. Iodine intake and incidence of thyroid cancer in Denmark. Clin Endocrinol (Oxf) 2006; 65:229–233.
270. Feldt-Rasmussen U. Iodine and cancer. Thyroid 2001; 11:483–486.
271. Zimmermann MB, Ito Y et al. High thyroid volume in children with excess dietary iodine intakes. Am J Clin Nutr 2005; 81:840–844.
272. Roti E, Uberti ED. Iodine excess and hyperthyroidism. Thyroid 2001; 11(5):493–500.
273. Zimmermann MB. Iodine requirements and the risks and benefits of correcting iodine deficiency in populations. J Trace Elem Med Biol 2008; 22:81–92.
274. Bourdoux PP, Ermans AM et al. Iodine-induced thyrotoxicosis in Kivu, Zaire. Lancet 1996; 347:552–553.
275. Todd CH, Allain T et al. Increase in thyrotoxicosis associated with iodine supplements in Zimbabwe. Lancet 1995; 346: 1563–1564.
276. Delange F et al. Risks of iodine-induced hyperthyroidism after correction of iodine deficiency by iodized salt. Thyroid 1999; 9:545–556.
277. Bürgi H et al. Thyrotoxicosis incidence in Switzerland and benefit of improved iodine supply. Lancet 1998; 352:1034.
278. Yang F, Shan Z et al. Chronic iodine excess does not increase the incidence of hyperthyroidism: a prospective community-based epidemiological survey in China. Eur J Endocrinol 2007; 156:403–408.
Created: October 27, 2014
Last update: October 27, 2014

