Μ. Μιχαλάκη
Επιμελήτρια Α’, Ενδοκρινολογικό Τμήμα, Πανεπιστημιακή Παθολογική Κλινική,
Πανεπιστημιακό Γενικό Νοσοκομείο Πατρών
Α.Γ. Βαγενάκης
Ομότιμος Καθηγητής Ενδοκρινολογίας-Παθολογίας, Πανεπιστήμιο Πατρών
1. Ορισμός – Καταστάσεις στις οποίες παρατηρείται
Το σύνδρομο της μη θυρεοειδικής νόσου (ΜΘΝ) περιεγράφει για πρώτη φορά το 1963 από τον Oppenheimer (1) και αφορά τις παροδικές αλλαγές των παραμέτρων της θυρεοειδικής λειτουργίας οι οποίες παρατηρούνται σε ασθενείς που νοσούν απο μη θυρεοειδικό νόσημα. Επίσης αναφέρεται στη βιβλιογραφία ως σύνδρομο της χαμηλής Τ3 (low T3 syndrome) καθώς και ως σύνδρομο του νοσούντος ευθυρεοειδικού (euthyroid sick syndrome) (2). Ο τελευταίος όρος δεν θεωρείται πλέον δόκιμος αφού προϋποθέτει ότι ο ασθενής είναι ευθυρεοειδικός, κατι όμως που όπως φαίνεται από πρόσφατες μελέτες, μάλλον δεν ισχύει. Αποτελεί βιοχημικό ορισμό και δεν περιλαμβάνει κλινικά σημεία και συμπτώματα. Ουσιαστικά παρατηρείται κάθε φορά που ο οργανισμός υφίσταται κάποιο οργανικό στρες και από πολλούς ερευνητές θεωρείται φυσιολογική προσαρμογή σε αυτό. Πιο συγκεκριμένα, κάθε φορά που η ομοιόσταση του οργανισμού απειλείται ο οργανισμός απαντά με μια «ολιστική» νευροενδοκρινική απάντηση προκειμένου να αντιμετωπίσει τον κίνδυνο. Καταστέλλει αφ’ ενός την παραγωγή της βιολογικά ενεργούς θυρεοειδικής ορμόνης T3, την γοναδική λειτουργία και έτσι παρατηρούνται μειωμένα επίπεδα τεστοστερόνης στους άνδρες και οιστραδιόλης στις γυναίκες καθώς επίσης και τον αυξητικό παράγοντα IGF-I προκειμένου να εξοικονομήσει ενέργεια και αφ’ ετέρου διεγείρεται η έκκριση της αδρεναλίνης και κορτιζόλης, ορμονών που θεωρούνται απαραίτητες για την μάχη της επιβίωσης. Το σύνδρομο έχει παρατηρηθεί σε νηστεία και κυρίως σε στέρηση υδατανθράκων, στην σήψη-σηπτικό shock, σε βαρέως πάσχοντες, οξέα εμφράγματα του μυοκαρδίου, χειρουργεία, τραύματα, διαβητική κετοξέωση, νεφρική ανεπάρκεια, ηπατική ανεπάρκεια, εγκαύματα, ψυχωσικές διαταραχές, λοίμωξη από τον ιό του AIDS και τελευταία και σε μαραθωνοδρόμους (3-6).
2. Αλλαγές των θυρεοειδικών παραμέτρων
Η πτώση της Τ3 και η αύξηση της ανάστροφης Τ3 αποτελούν τις χαρακτηριστικές αλλαγές των θυρεοειδικών παραμέτρων εξ’ ου και ο όρος «σύνδρομο της χαμηλής Τ3». Όσο αυξάνει η βαρύτητα των νοσημάτων τόσο επιτείνεται η πτώση της Τ3 και αρχίζουν να μειώνονται και τα επίπεδα των Τ4 και TSH τα οποία σε ήπια νοσήματα παραμένουν εντός φυσιολογικών ορίων και ίσως και λίγο αυξημένα (Εικόνα 1). Το 1998 σε δημοσίευση της ομάδας της Van den Berghe (7) διατυπώθηκε μια νέα θεωρία σχετικά με τον τύπο των αλλαγών των θυρεοειδικών παραμέτρων που παρατηρούνται ανάλογα με το εάν η νόσος είναι οξεία ή παρατεταμένη. Πιο συγκεκριμένα σύμφωνα με τους ερευνητές υποστηρίζεται ότι τις πρώτες ώρες από την εγκατάσταση κάποιου βλαπτικού παράγοντα οι ορμόνες του προσθίου λοβού της υποφύσεως διεγείρονται ενώ οι ορμόνες των οργάνων στόχων καταστέλλονται δίνοντας μια εικόνα αντίστασης στην δράση των πρώτων. Αντίθετα, αν ο οργανισμός καταφέρει να επιβιώσει της οξείας φάσης λόγω της παροχής εντατικής ιατρικής φροντίδας όπως κατά κύριο λόγο συμβαίνει στους ασθενείς που νοσηλεύονται σε μονάδες εντατικής θεραπείας, τότε καταστέλλονται και οι ορμόνες της υποφύσεως και οι ορμόνες των οργάνων στόχων δίνοντας την εικόνα υποφυσιακής ανεπάρκειας με εξαίρεση τα επίπεδα της κορτιζόλης τα οποία αυξάνονται. Πιθανά η χρόνια φάση προϋποθέτει και αυξημένη βαρύτητα αλλιώς οι ασθενείς θα είχαν ανανήψει μετά τα πρώτα 24ωρα, επομένως μάλλον πρόκειται για ταυτόσημες έννοιες. Ένα ερώτημα που παραμένει είναι πόσο διαρκεί η οξεία φάση και πότε εισέρχεται ο ασθενής στη χρόνια φάση. Δεν υπάρχουν συγκεκριμένες αναφορές, όμως από ότι θα αναφερθεί στη συνέχεια, η οξεία φάση προσδιορίζεται στις πρώτες ώρες από την έναρξη του νοσήματος.
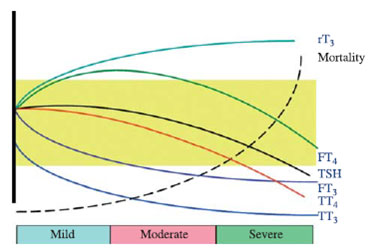
Εικόνα 1. Μεταβολές των θυρεοειδικών ορμονών ανάλογα με τη βαρύτητα του νοσήματος (4).
Τριϊωδοθυρονίνη (Τ3). Η πτώση της Τ3 αποτελεί την χαρακτηριστική μεταβολή των θυρεοειδικών παραμέτρων και η οποία παρατηρείται σε όλες τις καταστάσεις στις οποίες έχει περιγραφεί το σύνδρομο. Η πτώση της Τ3 είναι τόσο μεγαλύτερη όσο βαρύτερο είναι το νόσημα (Εικόνα 1) και συνοδεύεται από παράλληλη πτώση και της ελεύθερης Τ3 (FT3) (4) (2).
Θυροξίνη (Τ4). Η Τ4 μπορεί να βρεθεί φυσιολογική σε ελαφρά νόσο ή ακόμη και αυξημένη στις πρώτες ώρες από την έναρξη της νόσου. Όταν το νόσημα είναι σοβαρότερο τότε παρατηρείται και πτώση των επιπέδων της Τ4 του ορού. Όπως συμβαίνει και με την Τ3 ορού, όσο η βαρύτητα του νοσήματος αυξάνει τόσο χαμηλότερες είναι οι συγκεντρώσεις της Τ4 (Εικόνα 1) (8). Επιπλέον έχει βρεθεί ότι τα επίπεδα της Τ4 έχουν προγνωστική αξία. Τιμές χαμηλότερες από 4 μg/dl συνοδεύονται από θνητότητα 50%, ενώ τιμές χαμηλότερες από 2 μg/dl συνοδεύονται από θνητότητα 80% (8).
Θυρεοτρόπος ορμόνη TSH. Σε ήπια νόσο τα επίπεδα της TSH ορού είναι εντός φυσιολογικών ορίων παρά τα χαμηλά επίπεδα της Τ3 ενώ όσο αυξάνει η βαρύτητα του νοσήματος τόσο αρχίζουν και μειώνονται τα επίπεδα της (Εικόνα 2). Σε τακτικά χειρουργεία έχει παρατηρηθεί αύξηση των επιπέδων της TSH ορού τις πρώτες 2-3 ώρες από την χειρουργική τομή (9) τα οποία στην συνέχεια διατηρούνται στα προεγχειρητικά επίπεδα και κατάργηση της φυσιολογικής μεταμεσονύκτιου αιχμής της 1 με 5 μέρες αργότερα (10). Σε βαρέως πάσχοντες σε μονάδες εντατικής θεραπείας με παρατεταμένη νοσηλεία, οι οποίοι επιβιώνουν λόγω της μηχανικής και αιμοδυναμικής υποστήριξης που τούς προσφέρεται παρατηρούνται πολύ χαμηλές τιμές της TSH ορού καθώς και κατάργηση της κατά ώσεις έκκρισης της όπως φάνηκε σε βραδινά 9ωρα προφίλ ανά 20 λεπτά (11).

Εικόνα 2. Μεταβολές των ορμονών σε οξεία και παρατεταμένη νόσο (7).
Ελεύθερα κλάσματα – Δεσμευτικές πρωτεΐνες των θυρεοειδικών ορμονών. Οι θυρεοειδικές ορμόνες (ΘΟ) κυκλοφορούν στον ορό ελεύθερες κατά ένα πολύ μικρό ποσοστό, που είναι 0,03 – 0,05% για την Τ4 και 0,3% για την Τ3 (12). Οι θυρεοειδικές ορμόνες κυκλοφορούν στον ορό συνδεδεμένες με δεσμευτικές πρωτεΐνες, οι οποίες παράγονται στο ήπαρ και είναι η Thyroxine Binding Globulin (TBG) (δεσμεύει το 75% των ΘΟ), η τρανσθυρετίνη (TTR) (δεσμεύει το 10-20% των ΘΟ) και η αλβουμίνη (δεσμεύει το 10-20% των ΘΟ). (13). Στα διάφορα νοσήματα και στη νηστεία παρατηρούνται τόσο μεταβολές των συγκεντρώσεων των δεσμευτικών πρωτεϊνών όσο και αλλαγές της συγγένειας τους με τις ΘΟ (14). Τα επίπεδα των δεσμευτικών πρωτεϊνών γενικά μειώνονται από τις πρώτες ώρες στη νηστεία και στα διάφορα νοσήματα (4) (12), με εξαίρεση την αύξηση της TBG σε ηπατικά νοσήματα και λοίμωξη από τον ιό του HIV. Επίσης τα επίπεδα της TBG επανέρχονται σχεδόν στα φυσιολογικά επίπεδα σε ασθενείς με παρατεταμένη νοσηλεία (12). Επιπλέον, φάρμακα όπως η φουροσεμίδη σε υψηλές δόσεις, τα αντιεπηλιπτικά, σαλικυλικά, διάφοροι μεταβολίτες που αθροίζονται στο πλάσμα όπως στη σοβαρή νεφρική και ηπατική ανεπάρκεια (4), και τα ελεύθερα λιπαρά οξέα (σε υψηλές συγκεντρώσεις 2-5 mmol/l) αναστέλλουν την σύνδεση των ΘΟ με τις δεσμευτικές τους πρωτεΐνες (2,14,15). Η χορήγηση ηπαρίνης όπως συχνά συμβαίνει σε νοσηλευόμενους ασθενείς ενεργοποιεί την τριχοειδική λιποπρωτεινική λιπάση και αυξάνει τις συγκεντρώσεις των ελευθερων λιπαρων οξέων. Οι αλλαγές αυτές έχουν ως αποτέλεσμα την δημιουργία μεθοδολογικών προβλημάτων στις μετρήσεις των ελευθέρων κλασμάτων της Τ4 και Τ3. Μέθοδοι αναφοράς για τις μετρήσεις των ελευθέρων κλασμάτων αποτελούν η εξισορροπούμενη διάλυση (equilibrium dialysis) και η υπερδιήθηση οι οποίες όμως δεν μπορούν να χρησιμοποιηθούν στη καθημερινή πράξη (4). Τα διάφορα εμπορικά kit που χρησιμοποιούνται σήμερα δεν είναι αξιόπιστα για τις μετρήσεις των ελευθέρων κλασμάτων σε νοσούντες, έτσι μπορεί ο ίδιος ορός μετρούμενος με διαφορετικές μεθόδους να δώσει φυσιολογικές, υψηλές ή χαμηλές τιμές (2,4) με αποτέλεσμα συχνά αντικρουόμενα αποτελέσματα στην βιβλιογραφία. Επιπλέον φαίνεται ότι τα ποσοστά χαμηλών ελευθέρων κλασμάτων σε διάφορες καταστάσεις στις οποίες έχει περιγραφεί το σύνδρομο είναι κατά πολύ μικρότερα αυτών των ολικών κλασμάτων (2,4), με αποτέλεσμα να αμφισβητηται από διαφόρους μελετητές η ύπαρξη του συνδρόμου η οποία στηρίζεται ουσιαστικά σε βιοχημικό ορισμό.
3. Παθογένεια
Η παθογένεια του συνδρόμου είναι πολύπλοκη γιατί φαίνεται να διαφέρει στην οξεία από ότι στην χρόνια φάση των νοσημάτων καθώς και από νόσημα σε νόσημα. Το σύνδρομο όπως ήδη έχει αναφερθεί, παρατηρείται σε ετερογενή ομάδα νοσημάτων με διαφορετική παθοφυσιολογία το καθένα και επιπλέον το κάθε νόσημα μπορεί να συνοδεύεται από νηστεία η οποία από μόνη της αποτελεί ξεχωριστή κατηγορία συνδρόμου χαμηλής Τ3. Φαίνεται ότι στο σύνδρομο ΜΘΝ δεν πάσχει ο άξονας Υ-Υ-Θ αλλά τροποποιείται o ουδός της έκκρισης των ορμονών τους, αλλάζει ο περιφερικός μεταβολισμός των θυρεοειδικών ορμονών καθώς και η ευαισθησία των ιστών σε αυτές.
3.1. Υποθάλαμος
Στην οξεία φάση των νοσημάτων παρατηρείται πτώση της Τ3 ενώ TSH του ορού μπορεί να παραμένει είτε στα φυσιολογικά όρια ή και να παρουσιάζει ταχεία παροδική αύξηση τις πρώτες ώρες από την έναρξη του στρες, όπως καταγράφθηκε σε προγραμματισμένα χειρουργεία (9). Αντίθετα στην χρόνια φάση ή όταν η βαρύτητα του νοσήματος επιδεινώνεται τότε επιτείνεται η πτώση της Τ3 και επιπλέον μειώνονται και τα επίπεδα της Τ4 και TSH. Αυτές οι αλλαγές της TSH φαίνεται να προκαλούνται από αλλαγές της έκκρισης και έκφρασης του TRH. Αυτή η άποψη ενισχύεται από σειρά μελετών της ομάδας Van den Berghe στις οποίες η χορήγηση ενδοφλεβίως TRH αποκατέστησε τον άξονα υποθάλαμος-υπόφυση θυρεοειδής καθώς και από μελέτες με in-situ υβριδισμό σε υποθαλάμους αποθανόντων. Συγκεκριμένα σε ασθενείς που νοσηλεύονται επί μακρόν σε μονάδες εντατικής θεραπείας η συνεχής στάγδην ενδοφλέβια χορήγηση TRH είτε για 9 ώρες (16) είτε για 5 μέρες (17,18) αποκατέστησε την βασική έκκριση της TSH αλλά και τα επίπεδα των θυρεοειδικών ορμονών (Εικόνα 4). Στις ίδιες μελέτες η επιπλέον χορήγηση GHRP-2 βελτίωσε και την κατά ώσεις έκκριση της TSH. Ανοσοϊστοχημεία του υποθαλάμου ανθρώπων σε νεκροτομικό υλικό έδειξε ότι σε άτομα που πεθαίνουν αιφνίδια η έκφραση του TRH δεν μειώνεται σε αντίθεση με την μεγάλη μείωση που παρατηρείται σε άτομα με παρατεταμένη νοσηλεία (Εικόνα 3) (19). Στην ίδια μελέτη ελήφθησαν αιμοληψίες 24 ώρες πριν τον θάνατο των ασθενών για τον προσδιορισμό θυρεοειδικών ορμονών του ορού και υπήρξε θετική συσχέτιση του TRH-mRNA με την T3 και με log-TSH ορού.

Εικόνα 3. Ανοσοϊστοχημεία για το ΤRH στον υποθάλαμο σε ανθρώπινο νεκροτομικό υλικό. Α: Υποθάλαμος σε άτομα με παρατεταμένη νοσηλεία Β: Υποθάλαμος σε άτομα με καρδιακή ανακοπή (19).

Εικόνα 4. Αντιπροσωπευτικό 24ωρο προφίλ έκκρισης TSH σε βαρέως πάσχοντα πριν και μετά την ενδοφλέβιο στάγδην έγχυση TRH (1 μg/kg bolus στις 09:00, ακολουθούμενο από 1 μg/kg/h συνεχούς έγχυσης έως τις 06:00) (16).
Η ρύθμιση της έκκρισης και σύνθεσης του TRH από τους υποφυσιοτρόπους υποθαλαμικούς νευρώνες υπόκειται αφενός στην αρνητική παλίνδρομη δράση των θυρεοεδικών ορμονών αλλά και σε άλλα ευοδωτικά ή ανασταλτικά σήματα που δέχεται από άλλους νευρώνες του εγκεφάλου (Εικόνα 5) (20). Έτσι λοιπόν οι νευρώνες αυτοί δέχονται πληθώρα μηνυμάτων και η τελική απάντηση δηλαδή αύξηση ή μείωση της έκφρασης του TRH είναι η συνισταμένη όλων αυτών των δράσεων. Οι ενδοκυττάριοι μεταγραφικοί παράγοντες που καθορίζουν αυτήν την απάντηση, ανάμεσα σε άλλους, είναι ο φωσφορυλιωμένος CREB και η T3 (20).
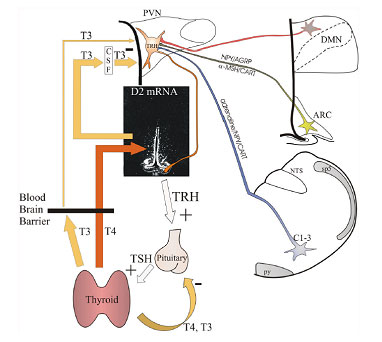
Εικόνα 5. Ρύθμιση της έκκρισης TRH στους υποφυσιοτρόπους TRH νευρώνες του παρακοιλιακού πυρήνα του εγκεφάλου.
Η νηστεία αποτελεί χαρακτηριστικό παράδειγμα συνδρόμου ΜΘΝ στο οποίο έχει μελετηθεί λεπτομερώς ο μηχανισμός πτώσης του TRH σε πειραματόζωα. Κατά την νηστεία τα επίπεδα της λεπτίνης μειώνονται απότομα και ανεξάρτητα της απώλειας λίπους (21,22). Σε πειραματόζωα έχει δειχθεί ότι, η πτώση της λεπτίνης προκαλεί αλλαγές στην έκφραση και έκκριση διαφόρων πεπτιδίων στους νευρώνες του τοξοειδή πυρήνα του υποθαλάμου οι οποίοι με τη σειρά τους νευρώνουν τους υποφυσιοτρόπους νευρώνες TRH του παρακοιλιακού πυρήνα. Συγκεκριμένα παρατηρείται αύξηση των επιπέδων των NPY (νευροπεπτιδιο Υ) και AGRP (Agouti-related protein) και ταυτόχρονη μείωση του α-MSH (α-melanocyte stimulating hormone) με αποτέλεσμα να μειώνονται τα επίπεδα TRH υπερισχύουσας της ευοδωτικής δράσης των μειωμένων θυρεοειδικών ορμονών (Εικόνα 6) (4,20). Νηστεία 72 ωρών σε νορμοβαρείς άνδρες έχει ως αποτέλεσμα την μείωση κατά κύριο λόγο της κατά ώσεις έκκρισης της TSH καθώς και πτώση κατά 30% της Τ3, αύξηση της ανάστροφης Τ3, χωρίς αλλαγές στα επίπεδα της Τ4 και TBG (21). Στην ίδια μελέτη η χορήγηση υποδορίως ανασυνδυασμένης λεπτίνης για 3 ημέρες αποκατέστησε το προφίλ έκκρισης της TSH χωρίς όμως να επηρεάσει τα επίπεδα των θυρεοειδικών ορμονών. Προκειμένου να διαπιστωθεί εάν η δράση της λεπτίνης είναι στο υποθάλαμο ή στην υπόφυση έγινε TRH τεστ στους νηστεύοντες με η χωρίς χορήγηση λεπτίνης και δεν βρεθηκαν διαφορές.

Εικόνα 6. Μηχανισμός πτώσης του TRH σε νηστεία.
Επίσης σε πειραματόζωα έχει μελετηθεί ο μηχανισμός του κεντρικού υποθυρεοειδισμού στην σήψη. Η χορήγηση λιποπολυσακχαρίδης προκαλεί αύξηση της έκφρασης και δραστικότητας της υποθαλαμικής D2 με αποτέλεσμα τοπικό Τ3 υπερθυρεοειδισμό και καταστολής της σύνθεσης του TRH (Εικόνα 7) (4, 20, 23).
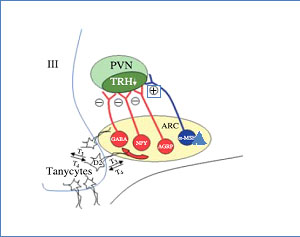
Εικόνα 7. Μηχανισμός πτώσης του TRH στη σήψη (4).
3.2. Περιφερικός μεταβολισμός των θυρεοειδικών ορμονών – Αποϊωδινάσες.
Η θυροξίνη του ορού προέρχεται εξολοκλήρου από θυρεοειδική έκκριση ενώ αντίθετα η Τ3 του ορού προέρχεται κατά 15-20% από θυρεοειδική έκκριση και κατά το υπόλοιπο από περιφερική αποϊωδίωση της Τ4 μεσω των αποϊωδινασών (24). Αξίζει να σημειωθεί ότι στα τρωκτικά η Τ3 προέρχεται κατά 50% από θυρεοειδική έκκριση (25). Οι αποϊωδινάσες (D1,D2,D3) είναι μια ομάδα 3 ισοενζύμων που κωδικοποιούνται από διαφορετικά γονίδια εκφράζονται σε διαφορετικούς ιστούς και οι οποίες απομακρύνουν ένα άτομο ιωδίου από τον εξωτερικό ή εσωτερικό δακτύλιο της Τ4. Οι αποϊωδινάσες είναι οξειδοαναγωγάσες και διαφέρουν μεταξύ τους ως προς τις κινητικές τους ιδιότητες, την συγγένεια με τα υποστρώματα, την ιστική κατανομή, και την ρυθμιση τους σε υπερ ή υποθυρεοειδισμό (Πίνακας 1). Η αποϊωδινάση D1 καταλύει και τις 2 αντιδράσεις δηλαδή αποϊωδιωση της Τ4 προς Τ3 (5’ αντίδραση) αλλά και προς rT3 (5 αντίδραση) (4). Οι αποϊωδινάσες είναι μεμβρανικές πρωτεΐνες με το ενεργό τμήμα προς το κυταροπλασμα. Οι D1 και D3 βρίσκονται στην κυταροπλασματική μεμβράση οπότε το προϊόν τους ευκολότερα μεταφέρεται στο πλάσμα ενώ η D2 στην μεμβράνη του ενδοπλασματικού δικτύου και το προϊόν της μεταφέρεται ευκολότερα στον πυρήνα (26). Η δράση τους εξαρτάται από το σελήνιο. Υπάρχει ασάφεια στη βιβλιογραφία σχετικά με την κυρίαρχη πηγή περιφερικής παραγωγής της Τ3 από την Τ4. Αρχικά θεωρήθηκε ότι η περιφερική Τ3 προσέρχεται από το ήπαρ και νεφρό μέσω της D1 (24). Αργότερα διατυπώθηκε η άποψη ότι είναι πολύ σημαντική η συμβολή της D2 στην περιφερική μετατροπή της Τ4 αφού η χορήγηση προπυλθειοουρακίλης η οποία αναστέλλει την D1 και όχι την D2 μειώνει την περιφερική μετατροπή της Τ3 μόνο κατά 30% (27). Στην συνέχεια in vitro, μελέτες κινητικής σε ανθρωπινά κύτταρα έδειξαν ότι η κυρίαρχη πηγή της Τ3 ορού σε ευθυρεοειδικούς και υποθυρεοειδικούς είναι οι σκελετικοί μύες μέσω της D2 ενώ στους υπερθυρεοειδικούς το ήπαρ μέσω της D1(28). Στην συνέχεια όμως φάνηκε ότι υπερεκτιμήθηκε η δραστικότητας τη D2 στο σκελετικό μυ λογω εσφαλμένης μεθοδολογίας. Αρχικά υπολογίστηκε η δραστικότητα με βάσει το ποσό του ιωδίου που απελευθερώνονταν το οποίο όμως δεν συμβάδιζε με το ποσό της Τ3 που παρήχθει. Ο νέος τρόπος εκτίμησης απαιτεί την χρήση ραδιοϊσοτόπων και τον προσδιορισμό ραδιοσεσημασμένης Τ3 με HPLC προκειμένου να είναι πιο ακριβείς οι προσδιορισμοί (29). Στην συνέχεια αμφισβητηθηκε η σημαντική συμβολή της Τ3 από τον σκελετικό μυ (30), αν και η Τ3 μπορεί να προέρχεται από άλλες θέσεις ύπαρξης της D2 (29).
Πίνακας 1. Ιδιότητες των αποϊωδινασών (από το βιβλίο της Εντατικής Εκπαιδευσης 14ος κύκλος).
Στο σύνδρομο ΜΘΝ παρατηρούνται σημαντικές αλλαγές στην δράση των αποϊωδινασών και μάλιστα είναι αποκλειστικά υπεύθυνες για την εκδήλωση του συνδρόμου ΜΘΝ στην οξεία φάση. Γενικά θεωρείται ότι η μειώνεται η δράση της ηπατικής D1 και της D2 των σκελετικών μυών ενώ αυξάνεται της D3 με αποτέλεσμα την μείωση της Τ3 και αύξηση της rT3 (Εικόνα 8) (2,4,12,31). Πιθανά η παραγωγή φλεγμονωδών κυταροκινών (32,33) και κορτιζόλης τροποποιεί την έκφραση και δραστικότητα τους αν και τελευταία από μελέτες σε πειραματόζωα υποστηρίχθηκε ότι οι αλλαγές αυτές ακολουθούν την πτώση της Τ3 και δεν την προκαλούν. Σειρά μελετών σε πειραματόζωα στα οποία προκλήθηκε σύνδρομο ΜΘΝ με την χορήγηση ενδοτοξίνης με (34) ή χωρίς (23) απαλοιφή του γονιδίου της D1 είτε με απαλοιφή του υποδοχέα TRβ1 (35) μέσω του οποίου ρυθμίζεται η έκφραση της ηπατικής D1, δείχνουν ότι η μειωμένη δραστικότητα της D1 μάλλον είναι αποτέλεσμα και όχι αίτιο της χαμηλής Τ3. Ελάχιστες δημοσιεύσεις υπάρχουν σε ανθρώπους που μελέτησαν την δράση των αποιωδινασών. Τα τελευταία χρόνια δίνεται μεγάλη σημασία στη δράση της D2 στο σκελετικό μυ, της οποίας η δραστικότητα είναι μειωμένη σε σχέση με την δραστικότητα της D1 στο ήπαρ (29).

Εικόνα 8. Αλλαγές των αποιωδινασών στο σύνδρομο ΜΘΝ (31).
Η νηστεία είναι ένα από τα πρώτα παραδείγματα συνδρόμου ΜΘΝ στα οποία περιγράφθηκε η αλλαγή του περιφερικού μεταβολισμού των ΘΟ (5). Στην μελέτη αυτή σε 4 εβδομάδες πλήρους νηστείας τα επίπεδα της Τ3 μειώνονται και αυξάνουν αντίστοιχα τα επίπεδα της rT3 υποδηλώνοντας μειωμένη δραστικότητα της D1. Στην ίδια μελέτη, επανειληφθηκε η νηστεία σε 4 εθελοντές στους οποίους χορηγήθηκε για 1 μήνα θυροξίνη ώστε να κατασταλούν τα επίπεδα της TSH και τα αποτελέσματα ήταν παρόμοια. Έκτοτε έχουν γίνει πολλές μελέτες σε νηστεία κυρίως σε πειραματόζωα. Σε μιά πρόσφατη μελέτη σε ανθρώπους εξετάσθηκε η δράση σκελετικής D2 σε 6 υγιείς εθελοντές που νήστεψαν και βρέθηκε ότι η έκφραση της σκελετικής D2 μειώθηκε στις 62 ώρες νηστείας ενώ η δραστικότητα της δεν άλλαξε (30). Παρόμοια αποτελέσματα σχετικα με την σκελετική D2 στη νηστεία σε ανθρώπους εχουν περιγραφεί και σε σηπτικό shock. Σε 13 ασθενείς με σηπτικό shock 5 ημέρες μετά την είσοδο τους στην ΜΕΘ, σε βιοψίες σκελετικού μυός και υποδορίου λίπους, η έκφραση της σκελετικής D2 ήταν μειωμένη ενώ η δραστικότητα της δε διέφερε από την ομάδα ελέγχου (36).
Αντίθετα αποτελέσματα σε σχέση με τις προηγούμενες μελέτες έχουν βρεθεί σε βαρέως πάσχοντες. Σε αυτή την κατηγορία των ασθενών εξετάσθηκαν οι θυρεοειδικές ορμόνες του ορού και οι D1, D2, D3 στο ήπαρ και τον σκελετικό μυ εντός μισής ώρας από το θάνατο τους. Στην μελέτη αυτή φάνηκε ότι η δράση της ηπατικής D1 είναι ανάλογη του λόγου Τ3/rT3 ορού ενώ της ηπατικής D3 αντιστρόφως ανάλογη. Έτσι λοιπόν, οι αλλαγές των αποϊωδινασών συμβάλλουν στην πτώση της Τ3 χωρίς όμως να μπορεί να αποδειχθεί εάν οι αλλαγές αυτές προηγήθηκαν ή απλά ακολούθησαν την πτώση της Τ3 (37). Στην ίδια μελέτη, αξίζει να σημειωθεί ότι δεν ανιχνεύτηκε δράση της D2 ούτε στο ήπαρ ούτε στο σκελετικό μυ. Παραδόξως όμως, η ίδια ομάδα ερευνητών σε μια επόμενη μελέτη τους, με παρόμοιο σχεδιασμό βρήκαν αυξημένη έκφραση και δραστικότητα της σκελετικής D2 σε βαρέως πάσχοντες με παρατεταμένη νοσηλεία σε σχέση με αυτούς που πέθαιναν οξέως ή τους υγιείς μάρτυρες (38). Την αντίφαση αυτή αποδίδουν οι ερευνητές σε διαφορετική μεθοδολογια εκτίμησης της δραστικότητας της D2.
Το θέμα του περιφερικού μεταβολισμού των ΘΟ όπως προκύπτει από τις πολυάριθμες μελέτες που έχουν γίνει τα τελευταία χρόνια κυρίως σε πειραματόζωα είναι εξαιρετικά πολύπλοκο και εξειδικευμένο. Πιο συγκεκριμένα η δράση των αποιωδινασων εξαρτάται από το είδος του νοσήματος, την φάση του νοσήματος και από τον ιστό που εξετάζεται (αναλυτικά περιγράφονται στην ανασκόπηση (39)) (Εικόνα 9).
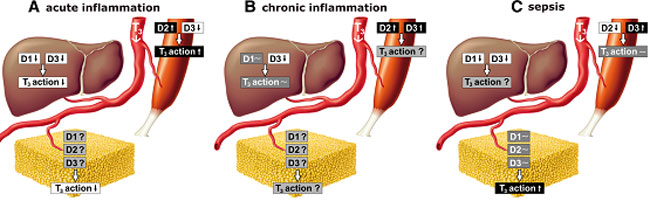
Εικόνα 9. Αλλαγές των αποιωδινασών ανάλογα με το νόσημα, τη φάση του νοσήματος και τον ιστό.
3.3. Ο ρόλος των κυτταροκινών
Στην παθογένεια του συνδρόμου έχουν ενοχοποιηθεί οι προφλεγμονώδεις κυτταροκίνες. Η χορήγηση κυταροκινών σε υγιή τρωκτικά ή υγιείς ανθρώπους προκαλεί αντίστοιχες αλλαγές με αυτές που παρατηρούνται στο σύνδρομο ΜΘΝ (Πίνακας 2) (39). Σε άλλη μελέτη in vitro, η προσθήκη IL-6 σε καλλιέργειες ανθρωπίνων κυττάρων ανέστειλε την έκφραση της D1 και επήγαγε την έκφραση της D3 (40). Θα μπορούσαν οι κυτταροκίνες να αποτελούν τον κοινό διαμεσολαβητή ανάμεσα στην ετερογενή ομάδα των νοσημάτων και καταστάσεων που παρατηρείται το σύνδρομο και να εξηγήσουν τις κοινές αλλαγες που παρατηρούνται. Όμως ο ρόλος των κυτταροκινων και πιο συγκεκριμένα του TNFα και της IL-6 στην εκδήλωση του συνδρόμου ΜΘΝ δεν επιβεβαιώθηκε σε όλες τις μελέτες. Σε προγραμματισμένα χειρουργεία η πτώση της προηγήθηκε της αύξησης της IL-6 ενώ δεν είχε καμιά συσχέτιση με τον TNFα. Επομένως δεν απεδείχθη η αιτιολογική συσχέτιση τους (9).
Πίνακας 2. Αποτελέσματα της χορήγησης κυτταροκινών σε τρωκτικά και ανθρώπους (39).
4. Είναι υποθυρεοειδικός ο ασθενής;
Προκειμένου να απαντήσει κανείς το ερώτημα του εάν τελικά ο ασθενής είναι υποθυρεοειδικός, θα πρέπει να εξετάσει αφενός τις ενδοκυττάριες συγκεντρώσεις των ΘΟ και την αποτελεσματική σύνδεση τους με τους υποδοχείς τους στους διάφορους ιστούς. Η ενδοκυττάρια συγκέντρωση των ΘΟ εξαρτάται αφενός από τα κυκλοφορούντα επίπεδα στο αίμα και αφετέρου από την δυνατότητα να εισέλθουν στο κύτταρο μέσω των ATP εξαρτώμενων μεταφορέων τους καθώς και την έκφραση και δραστικότητα των ενδοκυττάριων αποϊωδινάσων (Εικόνα 10). Σε μια μελέτη νοσηλευμένων ασθενών σε ΜΕΘ οι οποίοι τελικά πέθαναν, βρέθηκε ότι οι ενδοκυττάριες συγκεντρώσεις των ΘΟ στο ήπαρ και σκελετικό μυ ήταν ανάλογες του πλάσματος. Στην ιδια μελέτη φανηκε ότι η έκφραση των μεμβρανικών μεταφορέων δεν επηρέαζε την ενδοκυτάρια συγκέντρωση και επιπλέον εξετάσθηκε η δράση των D1, D2, D3 (41).
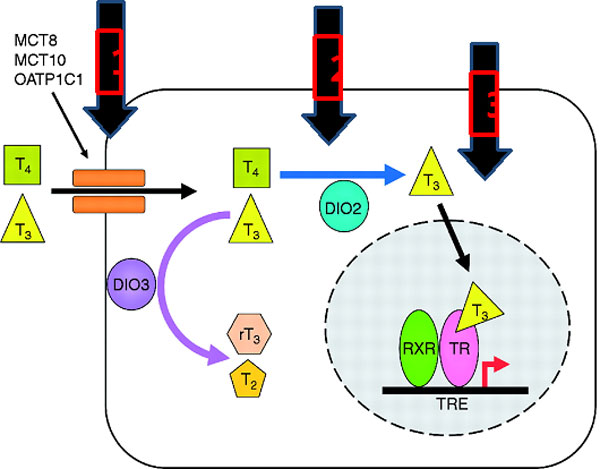
Εικόνα 10. Ενδοκυττάρια δράση των θυρεοειδικών ορμονών.
Όσον αφορά τώρα την έκφραση των υποδοχέων της δραστικής ορμόνης Τ3 σε διάφορους ιστούς σε ανθρώπους και πάλι υπάρχει μια μελέτη η οποία προέρχεται από την ιδια ομάδα με παρομοιο σχεδιασμό σε ασθενείς ΜΕΘ που πέθαναν και έλαβαν βιοψίες ηπατος. Στη μελέτη αυτή βρέθηκε ότι η έκφραση του TRα1 είναι αυξημένη σε 58 αποθανόντες στην ΜΕΘ συγκρινόμενες με 3 υγιεις και επιπλέον ο λόγος TRα1/TRα2 συσχετίζεται θετικά με τη σοβαρότητα της νόσου και την ηλικία. Η έκφραση του κύριου ηπατικού υποδοχέα TRβ1 δεν έδειξε συσχέτιση με καμία μεταβλητή. Ο TRα2 δεν ενεργοποιείται από την Τ3 και αναστέλλει την μεταγραφή. Τα ευρήματα αυτά υποδηλώνουν σχετικά αυξημένη ευαισθησία των ιστών στην Τ3 αντιρροπώντας τα χαμηλά επίπεδα Τ3 στο πλάσμα και στο κύτταρο αν και όπως αναφέρθηκε ο TRα1 δεν είναι ο επικρατών τύπος υποδοχέα στο ήπαρ (42).
Επιπλέον σημαντικό ρόλο στη δράση των ΘΟ παίζει και διαθεσιμότητα των ενδοκυτάριων συν-ενεργοποιητών/συν-κατασταλτών των υποδοχέων τους. Παράδειγμα αποτελεί η μειωρύθμιση της ηπατικής D1 στην οξεια φλεγμονη. Η παραγωγή προφλεγμονωδών κυταροκινών επάγουν την έκφραση ηπατικών πρωτεινών οξείας φάσης εξαντλώντας τον κοινό συν-ενεργοποιητή SRC-1 του TRβ1. Η προσθήκη SRC-1 αποκαθιστά εν μέρει τα επίπεδα του mRNA της ηπατικής D1 (32).
5. Διαφορική διάγνωση
Το σύνδρομο ΜΘΝ θα πρέπει να διαφοροδιαγνωσθεί από τις κάτωθι καταστάσεις:
- Από προϋπάρχοντα υπερθυρεοειδισμό σε νοσούντα. Σε αυτή την περίπτωση από την κλινική εικόνα βοηθά η ύπαρξη ταχυκαρδίας η κολπικής μαρμαρυγής και τα πολύ χαμηλά επίπεδα TSH < 0,01 μU/mL και τα επίπεδα της Τ3 τα οποία συνήθως είναι προς τα ανώτερα φυσιολογικά όρια (43).
- Από υποθυρεοειδισμό στην φάση ανάρρωσης. Στην περίπτωση αυτή εάν μετρηθούν θυρεοειδικές ορμόνες σε ασθενή που ανανήπτει και βελτιώνεται η υγεία του, τότε τα επίπεδα της ΤSH είναι τα πρώτα που ανεβαίνουν (έως 20) και ακολουθούν οι Τ4 και Τ3. Για να διαφοροδιαγνωστεί από προϋπάρχοντα υποθυρεοειδισμό θα πρέπει να ληφθεί ιστορικό και να μετρήθούν αντισώματα κατά της θυρεοειδικής υπεροξειδάσης.
- Από υποφυσιακή ανεπάρκεια σε βαρέως πάσχοντες (συνήθως σε ασθενείς που νοσηλεύονται σε ΜΕΘ). Στην περίπτωση αυτή τα υψηλά επίπεδα κορτιζόλης θα ξεχωρίσουν το σύνδρομο από την υποφυσιακή ανεπάρκεια εκτός εάνάν συνυπάρχει σχετική επινεφριδιακή ανεπάρκεια (CIRCI)
6. Θεραπεία
Η θεραπεία του συνδρόμου ΜΘΝ με θυρεοειδικές ορμόνες σε σειρά μελετών δεν έδειξε ότι βελτιώνει την νοσηρότητα και την θνητότητα (44). Μόνο σε περιπτώσεις μεταμόσχευσης καρδιάς υπάρχει αποδοχή στις ΗΠΑ (45) της χορήγησης Τ3 όταν το κλάσμα εξώθησης του δότη είναι μικρότερο του 45%. Δημιουργούνται διάφορα ερωτήματα σχετικά με το ποιά θα πρέπει να είναι η θεραπεία του συνδρόμου, όπως του εάν θα πρέπει να χορηγεί κανείς Τ4 ή και Τ3 ή μόνο Τ3, σε ποιά φάση οξεία ή χρόνια και σε ποιούς ασθενείς. Εναλλακτική προσέγγιση αποτελεί η χορήγηση υποθαλαμικών εκλυτικών παραγόντων στη χρόνια φάση σε ασθενείς της ΜΕΘ αφού όπως φαίνεται θα θεράπευε την αιτία του συνδρόμου σε αυτούς τους ασθενείς. Σε μια εργασία σε 33 ασθενείς της ΜΕΘ χορηγήθηκαν σε συνεχή ενδοφλέβια έγχυση για 5 ημέρες TRH, GHRP-2 και κατά ώσεις GnRH αυξήθηκαν τα επίπεδα των θυρεοειδικών ορμονών, των στεροειδών του φύλου, και IGF-I ενώ βελτιώθηκαν αναβολικοί δείκτες (18). Στη μελέτη όμως αυτή δεν εξετάσθηκε η νοσηρότητα και η θνητότητα.
Βιβλιογραφία
1. Oppenheimer JH, Squef R, Surks MI, et al. Binding of Thyroxine by Serum Proteins Evaluated by Equilibrum Dialysis and Electrophoretic Techniques. Alterations in Nonthyroidal Illness. The Journal of clinical investigation. 1963; 42:1769-1782.
2. De Groot LJ. Dangerous dogmas in medicine: the nonthyroidal illness syndrome. The Journal of clinical endocrinology and metabolism. 1999; 84:151-164.
3. Pappa TA, Vagenakis AG, Alevizaki M. The nonthyroidal illness syndrome in the non-critically ill patient. European journal of clinical investigation. 2011; 41:212-220.
4. Warner MH, Beckett GJ. Mechanisms behind the non-thyroidal illness syndrome: an update. The Journal of endocrinology. 2010; 205:1-13.
5. Vagenakis AG, Burger A, Portnary GI, et al. Diversion of peripheral thyroxine metabolism from activating to inactivating pathways during complete fasting. The Journal of clinical endocrinology and metabolism. 1975; 41:191-194.
6. Madeddu G, Spanu A, Chessa F, et al. Thyroid function in human immunodeficiency virus patients treated with highly active antiretroviral therapy (HAART): a longitudinal study. Clinical endocrinology. 2006; 64:375-383.
7. Van den Berghe G, de Zegher F, Bouillon R. Clinical review 95: Acute and prolonged critical illness as different neuroendocrine paradigms. The Journal of clinical endocrinology and metabolism. 1998; 83:1827-1834.
8. Wartofsky L, Burman KD. Alterations in thyroid function in patients with systemic illness: the “euthyroid sick syndrome”. Endocrine reviews. 1982; 3:164-217.
9. Michalaki M, Vagenakis AG, Makri M, et al. Dissociation of the early decline in serum T(3) concentration and serum IL-6 rise and TNFalpha in nonthyroidal illness syndrome induced by abdominal surgery. The Journal of clinical endocrinology and metabolism. 2001; 86:4198-4205.
10. Bartalena L, Martino E, Brandi LS, et al. Lack of nocturnal serum thyrotropin surge after surgery. The Journal of clinical endocrinology and metabolism. 1990; 70:293-296.
11. Van den Berghe G, de Zegher F, Veldhuis JD, et al. Thyrotrophin and prolactin release in prolonged critical illness: dynamics of spontaneous secretion and effects of growth hormone-secretagogues. Clinical endocrinology. 1997; 47:599-612.
12. Mebis L, Van den Berghe G. Thyroid axis function and dysfunction in critical illness. Best practice & research Clinical endocrinology & metabolism. 2011; 25:745-757.
13. Lester R 2001 Thyroid physiology : synthesis and release, iodine metabolism, binding and transport. In: Bekker k, (ed) Principles and Practice of Endocrinology and Metabolism. 3rd ed. Vol. Lippincott Williams & Wilkins, Philadelphia, 314-321.
14. Farwell AP. Nonthyroidal illness syndrome. Current opinion in endocrinology, diabetes, and obesity. 2013; 20:478-484.
15. Wilcox RB, Nelson JC, Tomei RT. Heterogeneity in affinities of serum proteins for thyroxine among patients with non-thyroidal illness as indicated by the serum free thyroxine response to serum dilution. European journal of endocrinology / European Federation of Endocrine Societies. 1994; 131:9-13.
16. Van den Berghe G, de Zegher F, Baxter RC, et al. Neuroendocrinology of prolonged critical illness: effects of exogenous thyrotropin-releasing hormone and its combination with growth hormone secretagogues. The Journal of clinical endocrinology and metabolism. 1998; 83:309-319.
17. Van den Berghe G, Wouters P, Weekers F, et al. Reactivation of pituitary hormone release and metabolic improvement by infusion of growth hormone-releasing peptide and thyrotropin-releasing hormone in patients with protracted critical illness. The Journal of clinical endocrinology and metabolism. 1999; 84:1311-1323.
18. Van den Berghe G, Baxter RC, Weekers F, et al. The combined administration of GH-releasing peptide-2 (GHRP-2), TRH and GnRH to men with prolonged critical illness evokes superior endocrine and metabolic effects compared to treatment with GHRP-2 alone. Clinical endocrinology. 2002; 56:655-669.
19. Fliers E, Guldenaar SE, Wiersinga WM, et al. Decreased hypothalamic thyrotropin-releasing hormone gene expression in patients with nonthyroidal illness. The Journal of clinical endocrinology and metabolism. 1997; 82:4032-4036.
20. Fekete C, Lechan RM. Negative feedback regulation of hypophysiotropic thyrotropin-releasing hormone (TRH) synthesizing neurons: role of neuronal afferents and type 2 deiodinase. Frontiers in neuroendocrinology. 2007; 28:97-114.
21. Chan JL, Heist K, DePaoli AM, et al. The role of falling leptin levels in the neuroendocrine and metabolic adaptation to short-term starvation in healthy men. The Journal of clinical investigation. 2003; 111:1409-1421.
22. Ahima RS, Prabakaran D, Mantzoros C, et al. Role of leptin in the neuroendocrine response to fasting. Nature. 1996; 382:250-252.
23. Boelen A, Kwakkel J, Thijssen-Timmer DC, et al. Simultaneous changes in central and peripheral components of the hypothalamus-pituitary-thyroid axis in lipopolysaccharide-induced acute illness in mice. The Journal of endocrinology. 2004; 182:315-323.
24. Reed L 2001 Thyroid Physiology: synthesis and Release, Iodine Metabolism, Binding and Transport. In: Bekker k, (ed) Principles and Practice of Endocrinology and Metabolism. 3rd ed. Vol. Lippincott Williams & Wilkins, Philadelphia, 314-321.
25. Tibaldi JM, Surks MI. Animal models of nonthyroidal disease. Endocrine reviews. 1985; 6:87-102.
26. Zeold A, Pormuller L, Dentice M, et al. Metabolic instability of type 2 deiodinase is transferable to stable proteins independently of subcellular localization. The Journal of biological chemistry. 2006; 281:31538-31543.
27. LoPresti JS, Eigen A, Kaptein E, et al. Alterations in 3,3’5′-triiodothyronine metabolism in response to propylthiouracil, dexamethasone, and thyroxine administration in man. The Journal of clinical investigation. 1989; 84:1650-1656.
28. Maia AL, Kim BW, Huang SA, et al. Type 2 iodothyronine deiodinase is the major source of plasma T3 in euthyroid humans. The Journal of clinical investigation. 2005; 115:2524-2533.
29. Larsen PR. Type 2 iodothyronine deiodinase in human skeletal muscle: new insights into its physiological role and regulation. The Journal of clinical endocrinology and metabolism. 2009; 94:1893-1895.
30. Heemstra KA, Soeters MR, Fliers E, et al. Type 2 iodothyronine deiodinase in skeletal muscle: effects of hypothyroidism and fasting. The Journal of clinical endocrinology and metabolism. 2009; 94:2144-2150.
31. Wajner SM, Maia AL. New Insights toward the Acute Non-Thyroidal Illness Syndrome. Frontiers in endocrinology. 2012; 3:8.
32. Yu J, Koenig RJ. Regulation of hepatocyte thyroxine 5′-deiodinase by T3 and nuclear receptor coactivators as a model of the sick euthyroid syndrome. The Journal of biological chemistry. 2000; 275:38296-38301.
33. Ogiwara T, Araki O, Morimura T, et al. A novel mechanism for the inhibition of type 2 iodothyronine deiodinase by tumor necrosis factor alpha: involvement of proteasomal degradation. Endocrine journal. 2013; 60:1035-1045.
34. St Germain DL, Galton VA, Hernandez A. Minireview: Defining the roles of the iodothyronine deiodinases: current concepts and challenges. Endocrinology. 2009; 150:1097-1107.
35. Kwakkel J, Chassande O, van Beeren HC, et al. Lacking thyroid hormone receptor beta gene does not influence alterations in peripheral thyroid hormone metabolism during acute illness. The Journal of endocrinology. 2008; 197:151-158.
36. Rodriguez-Perez A, Palos-Paz F, Kaptein E, et al. Identification of molecular mechanisms related to nonthyroidal illness syndrome in skeletal muscle and adipose tissue from patients with septic shock. Clinical endocrinology. 2008; 68:821-827.
37. Peeters RP, Wouters PJ, Kaptein E, et al. Reduced activation and increased inactivation of thyroid hormone in tissues of critically ill patients. The Journal of clinical endocrinology and metabolism. 2003; 88:3202-3211.
38. Mebis L, Langouche L, Visser TJ, et al. The type II iodothyronine deiodinase is up-regulated in skeletal muscle during prolonged critical illness. The Journal of clinical endocrinology and metabolism. 2007; 92:3330-3333.
39. Boelen A, Kwakkel J, Fliers E. Beyond low plasma T3: local thyroid hormone metabolism during inflammation and infection. Endocrine reviews. 2011; 32:670-693.
40. Wajner SM, Goemann IM, Bueno AL, et al. IL-6 promotes nonthyroidal illness syndrome by blocking thyroxine activation while promoting thyroid hormone inactivation in human cells. The Journal of clinical investigation. 2011; 121:1834-1845.
41. Peeters RP, van der Geyten S, Wouters PJ, et al. Tissue thyroid hormone levels in critical illness. The Journal of clinical endocrinology and metabolism. 2005; 90:6498-6507.
42. Thijssen-Timmer DC, Peeters RP, Wouters P, et al. Thyroid hormone receptor isoform expression in livers of critically ill patients. Thyroid : official journal of the American Thyroid Association. 2007; 17:105-112.
43. Franklyn JA, Black EG, Betteridge J, et al. Comparison of second and third generation methods for measurement of serum thyrotropin in patients with overt hyperthyroidism, patients receiving thyroxine therapy, and those with nonthyroidal illness. The Journal of clinical endocrinology and metabolism. 1994; 78:1368-1371.
44. Brent GA, Hershman JM. Thyroxine therapy in patients with severe nonthyroidal illnesses and low serum thyroxine concentration. The Journal of clinical endocrinology and metabolism. 1986; 63:1-8.
45. Zaroff JG, Rosengard BR, Armstrong WF, et al. Consensus conference report: maximizing use of organs recovered from the cadaver donor: cardiac recommendations, March 28-29, 2001, Crystal City, Va. Circulation. 2002; 106:836-841.
Created: October 27, 2014
Last update: October 27, 2014

