Ι. Ηλίας1, Ι.Α. Σκιτζής2, Σ.Χ. Νικοπούλου1
1Τμήμα Ενδοκρινολογίας, Διαβήτη και Μεταβολισμού, Νοσοκομείο Έλενα Βενιζέλου, Αθήνα
2Ψυχιατρικό Νοσοκομείο Αττικής, Δαφνί, Αθήνα
1. Εισαγωγή
Στο ερώτημα τι είναι γήρας δεν υπάρχει σαφής απάντηση – για λόγους σύμβασης η παγκόσμια οργάνωση υγείας θεωρεί ως ηλικιωμένα τα άτομα που είναι 60 ετών και άνω (http://www.who.int/healthinfo/survey/ageingdefnolder/en/index.html). Παρά τον προβληματισμό στον ορισμό του γήρατος, υπάρχει πλούτος πληροφοριών, αν και αποσπασματικών, στο τι το χαρακτηρίζει και ποιοι μοριακοί μηχανισμοί το διέπουν (και η σχετική βιβλιογραφία αν και εμπλουτίζεται διαρκώς δεν έχει να επιδείξει κάτι το συγκλονιστικό τα τελευταία έτη) (1).
2. Νευροβιολογία / Βιοχημεία της γήρανσης
Περίπου 30% της μεταβλητότητας του προσδόκιμου επιβίωσης αποδίδεται σε κληρονομήσιμους παράγοντες (2). Με τη γήρανση παρατηρείται – μεταξύ άλλων – υπέρμετρη διέγερση των υποδοχέων του Ν-μεθυλ-D-ασπαρτικού οξέος στον εγκέφαλο καθώς και σταδιακή μιτοχονδριακή δυσλειτουργία, με επακόλουθη δυσλειτουργία του συστήματος ουμπικουιτίνης-πρωτεασώματος (που δράση του είναι η κάθαρση «παθολογικών» πρωτεϊνών) καθώς και συσσώρευση ελεύθερων ριζών με τοξική δράση σε κυτταρικό επίπεδο (3, 4). Στο γήρας αυξάνει τοπικά και η συγκέντρωση λιποφουσκίνης, που ίσως συσχετίζεται με τη συσσώρευση των ελεύθερων ριζών. Η διαδικασία της απόπτωσης (δηλαδή του προγραμματισμένου κυτταρικού θανάτου μέσω μιτοχονδριακών μηχανισμών) ευοδώνεται και αναστέλλεται αντίστοιχα από τα προϊόντα των γονιδίων Bax και Bcl-2. Στο γήρας φαίνεται ότι επέρχεται σε άλλοτε άλλο βαθμό απορρύθμιση στη διαδικασία της απόπτωσης. Με το πέρασμα της ηλικίας βραχύνεται το μήκος των τελομερών και ελαττώνεται το δυναμικό πολλαπλασιασμού των κυττάρων. Επίσης στο γήρας επέρχονται αλλοιώσεις στον διάμεσο ιστό, στην διακυτταρική ανταλλαγή τροφικών παραγόντων, στην απελευθέρωση φλεγμονωδών κυτταροκινών, ενώ αλλάζουν οι συσχετισμοί των νευρογλοιακών κυττάρων με τους νευρώνες (νευροστεροειδή από τα νευρογλοιακά κύτταρα ελέγχουν την δραστηριότητα των νευρωνικών διαύλων ιόντων πχ μέσω υποδοχέων GABA-A) (3).
3. Νευροενδοκρινολογία της γήρανσης
Στην προχωρημένη ηλικία επηρεάζονται τα κύτταρα που απαρτίζουν το ενδοκρινικό σύστημα, οι ορμόνες που παράγονται από αυτά τα κύτταρα, οι ορμονικοί υποδοχείς αλλά και οι διαδικασίες μετά τον υποδοχέα στα κύτταρα-στόχους. Η «τακτικότητα» της έκκρισης ορμονών ελαττώνεται (5), με μεταβολές στην προσεγγιστική εντροπία τους (η έννοια της προσεγγιστικής εντροπίας [ApEn από τα αρχικά των λέξεων Approximate Entropy] χρησιμοποιείται για να εκφράσει μαθηματικά την κανονικότητα [regularity] μιας χρονοσειράς, και στην περίπτωση της νευροενδοκρινολογίας για τις μεταβολές ορμονών ή εκλυτικών παραγόντων στον χρόνο) (6). Στην ουσία η νευροενδοκρινολογία του γήρατος αφορά τον υποθάλαμο και τις ενδοκρινικές διασυνδέσεις προς αυτόν και από αυτόν προς την υπόφυση και τα όργανα-στόχους (7).
3.1. Ντοπαμινεργικό σύστημα
H ντοπαμινεργική δραστηριότητα του υποθαλάμου εδράζεται σε τουλάχιστον τρία νευρωνικά συστήματα, τα οποία διαφέρουν στη βασική δραστηριότητά τους, στην ανταπόκριση στις περιφερικές ορμόνες και στις φυσιολογικές διαδικασίες που ρυθμίζουν. Ιδιαίτερα σε ένα από αυτά, στο φυματοχοανικό σύστημα, εμφανίζεται η μεγαλύτερη μείωση της ντοπαμίνης με το πέρασμα της ηλικίας. Υπάρχει σταθερή πτώση στα ντοπαμινεργικά κύτταρα της μέλαινας ουσίας με την ηλικία, από 400.000 κατά τη γέννηση σε 250.000 στην ηλικία των 60 ετών. Οι υποδοχείς ντοπαμίνης διακρίνονται σε υποκατηγορίες: D-1 και D-2 (7). Με το γήρας οι D-2 μειώνονται ειδικά στον κερκοφόρο πυρήνα, στη μέλαινα ουσία και στην ωχρά σφαίρα. Αντίθετα, οι D-1 μάλλον δεν παρουσιάζουν καμία αλλαγή με την ηλικία.
3.2. Σύστημα της μονοαμινοοξειδάσης
Οι μονοαμινοοξειδάσες (MAOs) είναι τα κύρια ένζυμα αρμόδια για τον καταβολισμό των νευροδιαβιβαστών μονοαμίνης (πχ νοραδρεναλίνης ή σεροτονίνης). Βάσει της επιλεκτικότητας υποστρώματος, δύο μορφές αναγνωρίζονται: ΜΑΟ-Α και ΜΑΟ-Β. Στον γηράσκοντα εγκέφαλο δεν παρατηρούνται αλλαγές στην ΜΑΟ-Α αλλά όλες οι δομές του εγκεφάλου παρουσιάζουν αύξηση της ΜΑΟ-Β (7).
3.3. To νοραδρενεργικό σύστημα
Η συγκέντρωση νοραδρεναλίνης και ο ρυθμός εναλλαγής της μειώνονται με την ηλικία στον υποθάλαμο (7). Η μεγαλύτερη ομάδα νοραδρενεργικών νευρώνων βρίσκεται στον υπομέλανα τόπο. Η μείωση της νοραδρενεργικής λειτουργίας του υποθαλάμου επηρεάζει την έκκριση της LH, GH και της TSH, ενώ σχετίζεται με τη νόσο Alzheimer (7).
3.4. Το σύστημα σεροτονίνης
Συνολικά η σεροτονίνη (5-ΗΤ) στον εγκέφαλο μειώνεται με το πέρασμα των ετών, ιδίως στον πρόσθιο φλοιό (7). Καθώς η 5-ΗΤ είναι ένας από τους κύριους ρυθμιστές των διημερήσιων (κιρκάδιων) κύκλων, η μείωσή της συνδέεται με πολλές ψυχιατρικές και νευρολογικές διαταραχές, συμπεριλαμβανομένων αυτών του ύπνου.
3.5. Αμινοξέα-μεταβιβαστές
Η συγκέντρωση του γ-αμινοβουτυρικού οξέος (GABA) και η δραστηριότητα της αποκαρβοξυλάσης του γλουταμικού οξέος ελαττώνονται με το γήρας, ενώ το πλήθος των υποδοχέων GABA δεν μεταβάλλεται (σχετίζονται με δυσχέρεια αντίληψης λόγου/ομιλίας των ηλικιωμένων και διαταραχές ύπνου) (7).
3.6. Χολινεργικό σύστημα
Η δραστηριότητα του χολινεργικού συστήματος του εγκεφάλου μειώνεται με την ηλικία και μειώνονται οι μουσκαρινικοί υποδοχείς (στον κερκοφόρο πυρήνα και τον ιππόκαμπο η μείωση ξεπερνά το 50-60%) (7). Τα ελλείμματα του χολινεργικού συστήματος συνδέονται άρρηκτα με τη νόσο Alzheimer. Παραδόξως η διατήρηση νικοτινικών υποδοχέων μπορεί να έχει σημασία για τη διατήρηση των νευρώνων (οι καπνιστές έχουν μικρότερη πιθανότητα ανάπτυξης νόσου Alzheimer ή Parkinson).
3.7. Οπιοειδή και πεπτίδια προερχόμενα από την προ-οπιο-μελανοκορτίνη
Η συγκέντρωση των κύριων πεπτιδίων προερχόμενων από την προ-οπιο-μελανοκορτίνη ελαττώνονται με την ηλικία (στον υποθάλαμο μειώνονται η β-MSH, ACTH και β-λιποτροπίνη) (7).
3.8. Ορμόνη εκλύουσα τις γοναδοτροφίνες (GnRH)
Η ελάττωση και η παύση της αναπαραγωγικής ικανότητας στον άνδρα και τη γυναίκα αντίστοιχα είναι αποτέλεσμα αλλαγών στις γονάδες, την υπόφυση και τον υποθάλαμο (δεν είναι γνωστό ποια είναι η πρωταρχική αλλαγή ωστόσο).
Οι γυναίκες έχουν μία πεπερασμένη και μη ανανεώσιμη δεξαμενή ωοκυττάρων που ως εκ τούτου είναι ο καθοριστικός παράγοντας της διάρκειας της αναπαραγωγικής ζωής τους (και στους όρχεις υπάρχουν αλλαγές με την ηλικία, αλλά όχι με τη σταθερότητα που παρατηρούνται αλλαγές στις γυναίκες: στους άνδρες παρατηρείται άλλοτε άλλου βαθμού έκπτωση στη λειτουργία των κυττάρων Sertoli & Leydig) (7, 8).
Στις γυναίκες, το πρώτο κλινικό σημείο αναπαραγωγικής γήρανσης είναι η βράχυνση του κύκλου, λόγω βράχυνσης της ωοθυλακικής φάσης, αφού η επιλογή του επικρατούντος ωοθυλακίου, λόγω αύξησης της FSH, επέρχεται νωρίτερα (9). Στα πρώιμα στάδια της εμμηνόπαυσης, μετά την εξάλειψη της αρνητικής ανατροφοδότησης από τις ωοθήκες οι FSH και LH αυξάνουν και μετά σταδιακά ελαττώνονται. Η συχνότητα της έκκρισης GnRH κατά ώσεις μειώνεται ενώ η συνολική ποσότητα της εκκρινόμενης GnRH ίσως να αυξάνεται (δεν υπάρχει συμφωνία σε αυτό, κατ’άλλους η συγκέντρωση της GnRH ελαττώνεται με την ηλικία) (10). Η ευαισθησία του άξονα υποθάλαμος-υπόφυση στην αρνητική ανατροφοδότηση ελαττώνεται στις μετεμμηνοπαυσιακές γυναίκες, μάλλον περισσότερο λόγω υποθαλαμικής έκπτωσης παρά υπολειτουργίας της υπόφυσης (11). Οι παρατηρούμενες μεταβολές στην πορεία της LH στο γήρας ίσως να οφείλονται σε δράση των κατεχολαμινών και ενδογενών οπιοειδών στον υποθάλαμο (7, 10).
Σε υγιείς ηλικιωμένους άνδρες η υποθαλαμική έκκριση GnRH ελαττώνεται > 30% αν και η βασική έκκριση των LH και FSH αυξάνει με την ηλικία. Ειδικότερα, ενώ οι παλμοί της LH είναι κατά 35% μικρότεροι και κατά 50% συχνότεροι συγκριτικά με νέους άνδρες η διάρκειά τους αυξάνει (12) και αυξάνει παράλληλα και η ApEn (Εικόνα 1).
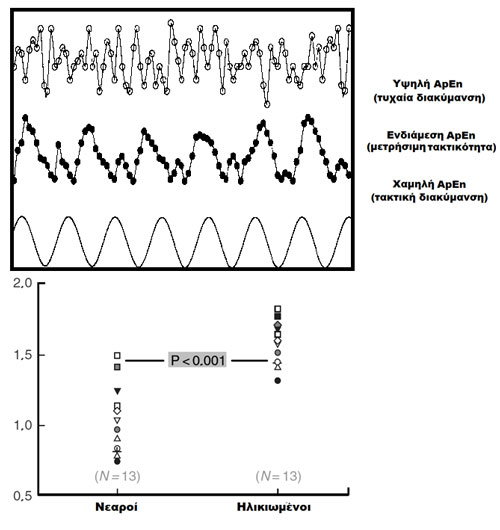
Εικόνα 1. Άνω: σχηματική αναπαράσταση της ApEn. Κάτω: διαφορές στην ApEn της έκκρισης LH σε νεαρούς και ηλικιωμένους άνδρες (τροποποιημένο από (6)).
Η αρνητική ανατροφοδότηση της τεστοστερόνης επί της έκκρισης GnRH και LH μειώνεται. Όμως, το γήρας δεν μεταβάλλει την αποτελεσματικότητα της ίδιας της GnRH και φαίνεται ότι τελικά αυξάνει την ευαισθησία των γοναδοτρόπων κυττάρων στην GnRH μόνον επί εδάφους χαμηλής τεστοστερόνης, ενώ το εύρος της απάντησης των LH και FSH στην GnRH μειώνεται (12). Η αύξηση της βασικής έκκρισης της FSH είναι ανάλογη της ατροφίας των σπερματικών σωληναρίων (8).
Η επίδραση των μεταβολών της GnRH στην έκκριση γοναδοτροφινών έχουν αντανάκλαση σε πολλούς ιστούς, μεταξύ αυτών και στα οστά κατά άμεσο τρόπο. Μηχανιστικές αποδείξεις για την FSH ως διαμεσολαβητή της οστικής απώλειας προέρχονται από μελέτες που δείχνουν ότι η FSH αυξάνει την οστεοκλαστογένεση και την επαναρρόφηση οστού, καθώς και από in vivo μελέτες που δείχνουν ότι, παρά την ανεπάρκεια οιστραδιόλης, ποντίκια χωρίς υποδοχείς FSH έχουν φυσιολογική οστική μάζα. Επίσης, αγωνιστές GnRH προκαλούν οστική απώλεια με υψηλό ρυθμό εναλλαγής, παρά το μειωμένο επίπεδο FSH (13).
Η υψηλότερη συχνότητα εμφάνισης ινομυαλγίας και χρόνιου διάχυτου άλγους (με επιπολασμό περίπου 9% επί του πληθυσμού) είναι κατά τη διάρκεια και κατά τα έτη αμέσως μετά την εμμηνόπαυση (14). Έχει προταθεί ότι οι LH και FSH συμβάλλουν στην προδιάθεση στον πόνο τόσο σε γυναίκες μεγαλύτερης ηλικίας, καθώς και σε ηλικιωμένους άνδρες. Οι υποδοχείς LH/χοριακής γοναδοτροπίνης (hCG) διαδραματίζουν ρυθμιστικό ρόλο στην αντίληψη του πόνου. Οι μηχανισμοί είναι αδιευκρίνιστοι ακόμη, καθώς οι μη αναπαραγωγικές λειτουργίες των γοναδοτροπινών, στην πραγματικότητα, μόλις τώρα αρχίζουν να διερευνώνται (14). Ενδεικτικά, είναι γνωστό ότι η ενεργοποίηση του υποδοχέα LH/hCG διεγείρει την παραγωγή της κυκλοοξυγενασών (COX) 1 & 2 (ενζύμων που εμπλέκονται στην παραγωγή προσταγλανδινών και που αναστέλλονται φαρμακολογικά με μη στερινοειδή αντιφλεγμονώδη) (14).
3.9. Εκλυτική ορμόνη της κορτικοτροπίνης (CRH)
Μελέτες σε πειραματόζωα και σε ανθρώπους έχουν αναφέρει αυξημένη, αμετάβλητη ή μειωμένη έκφραση υποθαλαμικής CRH με τη γήρανση (η πλειονότητα των ερευνητών περιγράφουν ευρήματα συμβατά με αυξημένη παραγωγή CRH με προχωρημένη ηλικία) (15). Ο διημερήσιος ρυθμός της CRH και κορτικοτροπίνης (ACTH) διαταράσσεται με το γήρας, οδηγώντας – σύμφωνα με ορισμένους ερευνητές – σε ζενίθ νωρίτερα και ναδίρ αργότερα συγκριτικά με νέους και – κατ’άλλους ερευνητές – σε υψηλότερο επίπεδο κορτιζόλης τις απογευματινές και βραδινές ώρες συγκριτικά με μικρότερες ηλικίες (7). Το αδρό διημερήσιο προφίλ της κορτιζόλης παρ’όλα αυτά διατηρείται, αν και σε ορισμένες δημοσιεύσεις αναφέρεται ότι οι διακυμάνσεις αμβλύνονται. Η ανταπόκριση σε στρεσσογόνους παράγοντες διατηρείται καθώς διατηρείται και η απάντηση σε CRH και ACTH (7). H υψηλή συχνότητα εμφάνισης κατάθλιψης και άγχους σε ηλικιωμένους θα μπορούσε να έχει συνάφεια με την αυξημένη δραστηριότητα των νευρώνων CRH που περιγράφεται στο γήρας (15), ενώ παρατεταμένη έκθεση σε γλυκοκορτικοειδή (έστω και με ανεπαίσθητες μεταβολές) έχει συνδεθεί με κατάθλιψη και αλλοιώσεις στον ιππόκαμπο (με συνακόλουθα ελλείμματα μνήμης) (15).
3.10. Υποθαλαμικά πεπτίδια εμπλεκόμενα στην έκκριση αυξητικής ορμόνης (GH)
Η κατά ώσεις έκκριση της GH επηρεάζεται με το γήρας λόγω μείωσης του εύρους των παλμών χωρίς να αλλάζει η συχνότητα (5, 16). Στους άνδρες, περίπου 70% της ημερήσιας έκκρισής της συμβαίνει στην αρχή του ύπνου ενώ στις γυναίκες το ποσοστό αυτό είναι μικρότερο. Στο γήρας η μείωση της GH ακολουθεί τη μείωση των φάσεων ύπνου που χαρακτηρίζονται από βραδέα κύματα και εξαρτάται από την έκκριση της ορμόνης εκλύουσας την GH (GHRH) (εξαρτάται όμως και από τη διατροφή, την άσκηση και σε κυτταρικό/βιοχημικό επίπεδο παίζουν ρόλο οι μεταβολές των κατεχολαμινών στον εγκέφαλο, ιδίως της νορεπινεφρίνης καθώς και της αργινίνης και της γ-αλανίνης) (12). Η δε GHRH παράγεται και εκτός του υποθαλάμου και δρα και σε τοπικό επίπεδο στο μυοκάρδιο και στα παγκρεατικά νησίδια (17, 18). Το πόσο αλλάζει με την ηλικία το εύρος της απάντησης της GH στην GHRH αποτελεί αντικείμενο διχογνωμίας, όμως η απάντηση της IGF-1 στην GHRH δεν μεταβάλλεται. Ο όγκος των σωματοτρόφων κυττάρων της υπόφυσης δεν μεταβάλλεται αισθητά σε ηλικιωμένα άτομα, αλλά γενικά μειώνονται οι θέσεις δέσμευσης GH στον εγκέφαλο.
Η μείωση της GH μπορεί να οδηγεί στη μείωση της πρωτεινοσύνθεσης που παρατηρείται στο γήρας (μέσω ελάττωσης του IGF-1 και μείωσης της σηματοδότησης που διαμεσολαβείται από τον mTOR [(mammalian target of rapamycin](19)) και σε συνακόλουθη σαρκοπενία και οστεοπενία/οστεοπόρωση αλλά και σε έκπτωση της καρδιακής λειτουργίας . Βέβαια, στα θηλαστικά, τα επίπεδα του IGF-1 μειώνονται με την ηλικία και στον άνθρωπο αυτό παρατηρείται σχετικά νωρίς, κατά την τρίτη δεκαετία της ζωής, αλλά το ερώτημα εάν η μεταβολή αυτή είναι προσαρμοστική ή απλώς αντανακλά μια γενική φθορά του οργανισμού δεν έχει απαντηθεί (20). Από δεδομένα σε πειραματόζωα ωστόσο η έλλειψη GH ή η αντίσταση σ’αυτήν συνδέονται με – σχετική – μακροζωία (στον άνθρωπο όμως η έλλειψη GH δεν φαίνεται να επηρεάζει το προσδόκιμο επιβίωσης). Η εξωγενής χορήγηση GH σε κατά τα άλλα υγιή ηλικιωμένα άτομα δεν απέδωσε θετικά αποτελέσματα και δεν συνιστάται.
3.11. Ορμόνη εκλύουσα την θυρεοτροπίνη (ΤRH)
Η TRH στον υποθάλαμο δεν μεταβάλλεται – ιδίως στις γυναίκες – ενώ στους ηλικιωμένους άνδρες μειώνεται η απάντηση της TSH στην TRH χωρίς αυτό να είναι παθολογικό [7). Η διημερήσια κορύφωση της TSH προ ύπνου αμβλύνεται στο γήρας. Οι Τ3, ανάστροφη Τ3, Τ4 δεν μεταβάλλονται ουσιαστικά με την ηλικία ενώ η TSH ίσως να εμφανίζει μία ήπια αύξηση (καθώς η χρήση και η αποδόμηση των Τ3 και Τ4 ελαττώνονται με την ηλικία) που έχει συσχετισθεί με μακροζωία (21), για επίπεδο TSH πάντως < 10 mIU/L (22, 23) (Εικόνα 2). H γνωστή σχέση μεταξύ logTSH και ελεύθερης T4 στον ορό, επηρεάζεται από το κάπνισμα και το φύλο αλλά όχι από την ηλικία (24).
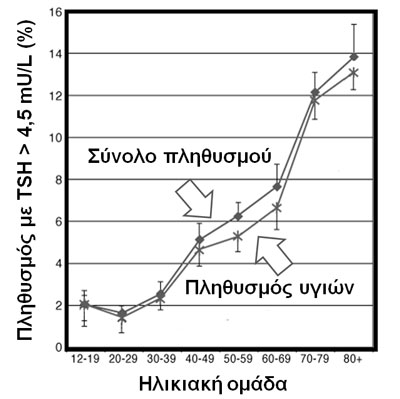
Εικόνα 2. TSH ανάλογα με την ηλικία στις ΗΠΑ (τροποποιημένο από (23)).
3.12. Νευροϋπόφυση
Στα ηλικιωμένα άτομα διαπιστώνεται αυξημένη δραστηριότητα αντιδιουρητικής ορμόνης (ADH/βαζοπρεσίνη, VP) στα κύτταρα των υποθαλαμικών και υπεροπτικών πυρήνων του υποθαλάμου (κυρίως στους νευρώνες του έσω γονατώδους πυρήνα) (15). Παράλληλα η έκφρασή της στον υπερχιασματικό πυρήνα μειώνεται και δεν παρουσιάζει χαρακτηριστικές κιρκάδιες διακυμάνσεις (οι μεταβολές αυτές θα μπορούσαν να συμβάλλουν στους παθολογικούς κιρκάδιους ρυθμούς που παρατηρούνται στο γήρας). Παθολογοανατομικές μελέτες σε εγκεφάλους δείχνουν συσχέτιση μεταξύ μειωμένης έκφρασης ADH στους νευρώνες του υπερχιασματικού πυρήνα και διαταραχών ύπνου (15). Η ευαισθησία των ωσμοϋποδοχέων αυξάνει (η περιφερική ADH αυξάνει κατά τρόπο πιο απότομο σε απάντηση στην άνοδο της ωσμωτικότητας του ορού στα ηλικιωμένα άτομα συγκριτικά με νέα άτομα, αλλά η ευαισθησία των νεφρικών σωληναρίων στην ADH ελαττώνεται) (7). Η απάντηση της ADH στην όρθια θέση αμβλύνεται. Έχει ενδιαφέρον ότι η απάντηση της ADH στο κάπνισμα είναι εντονότερη στους ηλικιωμένους σε σχέση με νέα άτομα. Γενικά οι ηλικιωμένοι τείνουν να αποβάλλουν λιγότερο φορτίο ύδατος απ’όσο οι νέοι και αυτό μπορεί να παίζει ρόλο στην εμφάνιση υπονατριαιμίας και ορθοστατικής υπότασης.
3.13. Προλακτίνη (PRL)
Στα ηλικιωμένα άτομα διαπιστώνονται αυξημένη ίνωση, εστιακή νέκρωση, εναπόθεση σιδήρου και σχηματισμός αδενωμάτων στην πρόσθια υπόφυση, ενώ το συνολικό μέγεθός της μειώνεται. Δεν μεταβάλλεται το πλήθος των λακτοτρόφων κυττάρων αλλά μειώνεται η νυκτερινή έκκριση PRL (7). Στις γυναίκες η πτώση της PRL αρχίζει περί την εμμηνόπαυση, ενώ στους άνδρες δεν υπάρχει ομοφωνία ποιά είναι η πορεία της PRL στον χρόνο.
3.14. Μελατονίνη
Η μελατονίνη (Ν-ακετυλ-5-μεθοξυτρυπταμίνη) είναι μεταβολίτης της τρυπτοφάνης και συντίθεται κυρίως από την επίφυση. Φαίνεται ότι διαδραματίζει ρόλο στη ρύθμιση των νυχθημερήσιων (κιρκάδιων) ρυθμών. Η νυκτερινή έκκριση μελατονίνης ελαττώνεται με τον χρόνο κατά 50% (Εικόνα 3) και μέσα από αποσπασματικές πληροφορίες φαίνεται η πτώση αυτή ίσως να διαδραματίζει ρόλο στην ίδια τη διαδικασία της γήρανσης (7, 25). Η μείωση στην έκκριση μελατονίνης κατά τη γήρανση φαίνεται να οφείλεται, κατά κύριο λόγο, στη μείωση του αριθμού ή/και της ευαισθησίας των νοραδρενεργικών υποδοχέων. Οι ποιοτικές και ποσοτικές μεταβολές στην έκκριση μελατονίνης έχουν επίσης σχέση με το βαθμό γνωστικής δυσλειτουργίας (Εικόνα 3). Η μείωσή της στο γήρας συνεισφέρει στην ανοσιακή γήρανση (που συχνά συνδέεται με αυτοάνοσες νόσους και φλεγμονώδεις διεργασίες). Σε μεγάλη ηλικία μπορεί να σχετίζεται με επιδείνωση των κιρκάδιων ρυθμών (26).
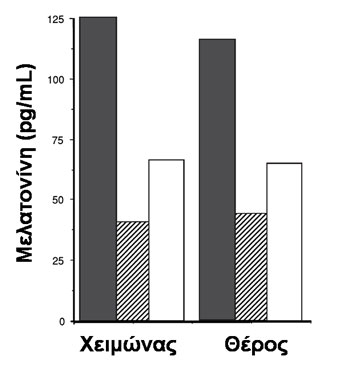
Εικόνα 3. Επίπεδα μελατονίνης σε νεαρούς άνδρες (γκρι σκίαση), άνδρες ασθενείς με Alzheimer (σκίαση με διαγράμμιση) και ηλικιωμένους άνδρες (χωρίς σκίαση) (τροποποιημένο από (25)).
3.15. Ορεξιογόνα πεπτίδια (κυρίως από δεδομένα σε πειραματόζωα)
Η λεπτίνη αναστέλλει την υποθαλαμική έκκριση του γνωστότερου ορεξιογόνου, του νευροπεπτίδιου Υ (ΝΡΥ). Με το πέρασμα της ηλικίας η έκφραση και η δράση των υποθαλαμικών υποδοχέων λεπτίνης ελαττώνεται (ενώ το επίπεδο της λεπτίνης στον ορό αυξάνεται (27)) όπως ελαττώνονται η έκκριση των ΝΡΥ (ενδεχομένως ως αποτέλεσμα «αντίστασης» στη λεπτίνη) και ghrelin (5, 28, 29). Εδώ ίσως βρίσκεται – εν μέρει – η αιτία της έλλειψης ενδιαφέροντος για τροφή στους ηλικιωμένους (σε πειραματόζωα η μείωση της θερμιδικής πρόσληψης έχει συνδεθεί με αυξημένη επιβίωση).
4. Συζήτηση
Η σχετική απορρύθμιση της νευροενδοκρινικής απάντησης από το κεντρικό νευρικό σύστημα χαρακτηρίζει το γήρας, αλλά γεννά και ερωτήματα. Ποιός είναι ο κεντρικός μηχανισμός? Σε ποιό βαθμό η ανεπάρκεια των περιφερικών οργάνων συνεισφέρει στη διαταραχή των διάφορων βρόχων παλίνδρομης ρύθμισης και ποιές είναι οι βαθύτερες διαφορές – αν υπάρχουν – ανάμεσα στα φύλα? Ίσως, βλέποντας το γήρας με μία ενοποιημένη οπτική, να ήταν σκόπιμο να το εκλάβουμε ως μία διαδικασία αλληλοεξαρτώμενων νευροορμονικών και κυτταρικών μηχανισμών, συνυφασμένη με την εξέλιξη της ίδιας της ζωής και όχι σαν έναν προγραμματισμένο υπερμηχανισμό ή μια γραμμική αλληλουχία γεγονότων όπου και καλούμαστε να αναζητήσουμε το σημείο μηδέν.
Βιβλιογραφία
1. Panno J: Aging: Modern Theories and Therapies, 2nd edn. New York, NY: Infobase Publishing; 2011.
2. Tower J: Hsps and aging. Trends Endocrinol Metabol 2008; 20:216-221.
3. Nakamura T, Hansen M, Oldham SM, Lipton SA: The neurobiology of aging: free radical stress and metabolic pathways. In: Brocklehurst’s Textbook of Geriatric Medicine and Clinical Gerontology. Edited by Fillit HM, Rockwood K, Woodhouse K, 7th edn. Philadelphia, PA: Saunders-Elsevier; 2010: 150-157.
4. Quinlan CS, Treberg JL, Brand MD: Mechanisms of Mitochondrial free Radical Production and their Relationship to the Aging Process. In: Handbook of the Biology of Aging. Edited by Masoro EJ, Austad SN, 7th edn. London, UK: Academic press; 2011.
5. Smith RG, Betancourt L, Sun Y: Molecular endocrinology and physiology of the aging central nervous system. Endocr Rev 2005; 26:203-250.
6. Veldhius JD, Keenan DM, Pincus SM: Regulation of complex pulsatile and rhythmic neuroendocrine systems: the male gonadal axis as a prototype. In: Progress in brain research Neuroendocrinology: the normal neuroendocrine system. Edited by Martini L, vol. 181. Oxford: Elsevier; 2010: 79-110.
7. Rehman HU, Masson EA: Neuroendocrinology of aging. Age Aging 2001; 30:279-287.
8. Sartorius GA, Nieschlag E: Paternal age and reproduction. Human Reprod Update 2010; 16:65-79.
9. Broekmans FJ, Knauff EAH, te Velde ER, Macklon N, Fauser BC: Female reproductive ageing: current knowledge and future trends. Trends Endocrinol Metabol 2008; 18:58-65.
10. Veldhuis JD: Endocrinology of Aging. Medscape Diabetes & Endocrinology 2000; 2:1.
11. Shaw ND, Srouji SS, Histed SN, McCurnin KE, Hall JE: Aging attenuates the pituitary response to gonadotropin-releasing hormone. J Clin Endocrinol Metab 2009; 94:3259-3264.
12. Veldhuis JD: Aging and Hormones of the Hypothalamo-Pituitary Axis: gonadotropic axis in men and somatotropic axes in men and women. Ageing Res Rev 2008; 7:189-208.
13. Atwood CS, Bowen RL: The reproductive-cell cycle theory of aging: An update. Experiment Gerontol 2011; 46:100-107.
14. Abbott FV: Neuroendocrine function and pain in aging men. Pain 2011; 152:1451-1452.
15. Aguilera G: HPA axis responsiveness to stress: Implications for healthy aging. Experiment Gerontol 2011; 46:90-95.
16. Azcoitia I, Garcia-Segura LM: Hormones and the Aging Brain. In: Handbook of Neuroendocrinology. Edited by Fink G, Pfaff DW, Levine J. London, UK: Academic Press; 2012: 573-596.
17. Bartke A: Pleiotropic effects of growth hormone signaling in aging. Trends Endocrinol Metabol 2011; 22:437-442.
18. Kiaris H, Chatzistamou I, Papavassiliou AG, Schally AV: Growth hormone-releasing hormone: not only a neurohormone. Trends Endocrinol Metabol 2011; 22:311-317.
19. Bartke A: Growth hormone, insulin and aging: The benefits of endocrine defects. Experiment Gerontol 2011; 46:108-111.
20. Piriz J, Muller A, Trejo JL, Torres-Aleman I: IGF-I and the aging mammalian brain. Experiment Gerontol 2011; 46:96-99.
21. Barzilai N, Gabriely I: Genetic studies reveal the role of the endocrine and metabolic systems in aging. J Clin Endocrinol Metabol 2010; 95:4493-4500.
22. Yeap BB: Hormones and health outcomes in aging men. Experiment Gerontol 2012; 48:677-681.
23. Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, Braverman LE: Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002; 87:489-499.
24. Clark PM, Holder RL, Haque SM, Hobbs FDR, Roberts LM, Franklyn JA: The relationship between serum TSH and free T4 in older people. J Clin Pathol 2012; 65:463-465.
25. Touitou Y, Haus E: Alterations with aging of the endocrine and neuroendocrine circadian system in humans Chronobiology Int 2000; 17:369-390.
26. Ferrari E, Magri F: Role of neuroendocrine pathways in cognitive decline during aging. Ageing Research Reviews 2008; 7:225-233.
27. Carrascosa JM, Ros M, Andrés A, Fernández-Agulló T, Arribas C: Changes in the neuroendocrine control of energy homeostasis by adiposity signals during aging. Experiment Gerontol 2009; 44:20-25.
28. Anderson RM, Weindruch R: Metabolic reprogramming, caloric restriction and aging. Trends Endocrinol Metabol 2009; 21:134-141.
29. Kmiec Z: Aging and peptide control of food intake. Curr Prot Pept Sci 2011; 12:271-279.
Created: April 20, 2014
Last update: April 20, 2014

