Γεώργιος Τροβάς
Εργαστήριο Έρευνας Παθήσεων Μυοσκελετικού Συστήματος «Θ. Γαροφαλίδης»,
Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών, ΓΝΑ ΚΑΤ
Ιωάννης Π. Σταθόπουλος
Εργαστήριο Έρευνας Παθήσεων Μυοσκελετικού Συστήματος «Θ. Γαροφαλίδης»,
Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών, ΓΝΑ ΚΑΤ
Γ’ Ορθοπαιδική Κλινική, Εθνικό και Καποδιστριακό Πανεπιστήμιο Αθηνών, ΓΝΑ ΚΑΤ
1. Ορισμός της οστεοπόρωσης στους άνδρες
Ο ορισμός της οστεοπόρωσης από τον Παγκόσμιο Οργανισμό Υγεία με βάση την τιμή του Τ-score στη μέτρηση της οστικής πυκνότητας (BMD) με απορροφησιομετρία ακτινών Χ διπλής ενέργειας (DXA) (1), αν και είναι μια πολύ καλή σύμβαση για να υπάρχει κοινή γλώσσα στην επιστημονική κοινότητα, έχει το μειονέκτημα ότι δε λαμβάνει υπόψη τις αρχιτεκτονικές διαταραχές στον οστίτη ιστό, παρά μόνο τα προβλήματα της επιμετάλλωσής του. Ειδικότερα για τους άνδρες, ο παραπάνω ορισμός έχει και άλλα προβλήματα. Ο υπολογισμός του Τ-score, αρχικά, γινόταν και εξακολουθεί, σε αρκετά εργαστήρια, να γίνεται χρησιμοποιώντας γυναικείες τιμές αναφοράς. Γνωρίζουμε, όμως, ότι οι νεαρές γυναίκες έχουν μικρότερη κορυφαία οστική μάζα και μικρότερη κορυφαία «επιφανειακή» (areal) οστική πυκνότητα από τους νεαρούς άνδρες, οπότε η χρήση τιμών αναφοράς από νεαρούς άνδρες ίσως να είναι πιο σωστή, αν και μπορεί να οδηγήσει σε αύξηση του ποσοστού των οστεοπορωτικών ανδρών (με την προϋπόθεση ότι το όριο για να χαρακτηριστεί κάποιος άνδρας οστεοπορωτικός παραμένει το Τ-score<-2,5). Πράγματι, στη μελέτη NHANES III, όταν χρησιμοποιήθηκαν ανδρικές τιμές αναφοράς, 3-6% των ανδρών άνω των 50 ετών θεωρήθηκαν οστεοπορωτικοί και 28-47% οστεοπενικοί, ενώ όταν η σύγκριση έγινε με γυναικείες τιμές αναφοράς τα αντίστοιχα ποσοστά ήταν 1-4% και 15-33% (2). Αναλογιζόμενη τα παραπάνω η Διεθνής Κοινότητα για την Κλινική Πυκνομετρία (ISCD) στις κατευθυντήριες συστάσεις της προτείνει τη χρήση βάσης δεδομένων νεαρών ενήλικών ανδρών Καυκάσιας φυλής για τον υπολογισμό των T- και Ζ-scores (3).
Επιπλέον, υπάρχουν χρειάζονται βάσεις δεδομένων για διαφορετικές φυλές και, πιθανόν, αναπροσαρμογή του ανώτερου ορίου του Τ-score για να θεωρείται κάποιος άνδρας οστεοπορωτικός. Η ανάγκη για το τελευταίο προκύπτει, κυρίως, από το γεγονός ότι μεγάλο ποσοστό ανδρών (σε αρκετές μελέτες πάνω από 80%) που εμφανίζουν κατάγματα χαμηλής βίας έχουν μη οστεοπορωτικό Τ-score (4) και είναι λογικό ότι η μετάθεση του οστεοπορωτικού ορίου προς μεγαλύτερη τιμή θα οδηγούσε στη διάγνωση και θεραπεία της πάθησης (με τα πυκνομετρικά μόνο κριτήρια) σε περισσότερους άνδρες.
2. Επιδημιολογία
Σύμφωνα με το Εθνικό Ίδρυμα Οστεοπόρωσης (NOF) στις ΗΠΑ το 2002 υπήρχαν 43,6 εκατομμύρια άτομα άνω των 50 ετών με χαμηλή οστική μάζα, από τα οποία 10,1 εκατομμύρια είχαν οστεοπόρωση. Για το 2010 τα αντίστοιχα νούμερα που υπολογίστηκαν ήταν 52,4 και 12 εκατομμύρια. Οι άνδρες που έπασχαν από οστεοπόρωση ήταν 2,3 εκατομμύρια το 2002, ενώ το 2010 περίπου 2,8 εκατομμύρια. Επιπρόσθετα, οι άνδρες με χαμηλή οστική μάζα, χωρίς να πάσχουν από οστεοπόρωση, ήταν 11,8 εκατομμύρια το 2002 και 14,4 εκατομμύρια το 2010 (5).
Επειδή είναι δύσκολη η καταγραφή του επιπολασμού και της επίπτωσης της οστεοπόρωσης, έμμεσα συμπεράσματα εξάγονται από τη μελέτη της επιδημιολογίας των τελικών της αποτελεσμάτων, δηλαδή των καταγμάτων, καθώς και από τον υπολογισμό του καταγματικού κινδύνου. Έτσι, έχει βρεθεί ότι κίνδυνος για να υποστεί κάποιος άνδρας άνω των 50 ετών οποιοδήποτε οστεοπορωτικό κάταγμα στο υπόλοιπο της ζωής του κυμαίνεται από 13,1% (στις ΗΠΑ) ως 22,4% (στη Σουηδία), ενώ για τις γυναίκες είναι αρκετά μεγαλύτερος (μέχρι 53,2% στη Μεγάλη Βρετανία). Ο κίνδυνος των ανδρών για κάταγμα ισχίου είναι 3,1% (Μεγάλη Βρετανία) ως 10,7% (Σουηδία) και για κλινικό σπονδυλικό κάταγμα 1,2% (Μεγάλη Βρετανία) ως 8,3% (Σουηδία) (6).
Σύμφωνα με τους Johnell και Kanis, το 2000 συνέβησαν, σε άτομα άνω των 50 ετών, 8.959 εκατομμύρια οστεοπορωτικά κατάγματα παγκοσμίως, από τα οποία τα 3.463 εκατομμύρια (38,6%) σε άνδρες. Σε σχέση με τις γυναίκες, οι άνδρες εμφάνισαν λιγότερα κατάγματα στο ισχίο (30% των συνολικών καταγμάτων ισχίου), τη σπονδυλική στήλη (42% του συνόλου), το αντιβράχιο (20% του συνόλου) και το βραχιόνιο (25% του συνόλου), αλλά συνολικά περισσότερα στις υπόλοιπες θέσεις των οστεοπορωτικών καταγμάτων (54% του συνόλου) (εικόνα 1) (7).

Εικόνα 1. Παγκόσμια επίπτωση οστεοπορωτικών καταγμάτων σε άτομα άνω των 50 ετών (σε χιλιάδες) κατά το έτος 2000. (στοιχεία από Johnell O και συν.(2006) OsteoporosInt 17: 1726-33)
Η αυξημένη θνητότητα που συνοδεύει τα οστεοπορωτικά κατάγματα έχει προσελκύσει την προσοχή της ιατρικής κοινότητας. Στις πολυάριθμες μελέτες που έχουν γίνει για το θέμα τα ποσοστά των θανάτων μέσα στο πρώτο έτος μετά από κάταγμα ισχίου ποικίλουν από 5,9 ως 50% (8). Οι άνδρες είναι πιο πιθανό να αποβιώσουν μετά από κάταγμα ισχίου σε σχέση με τις γυναίκες. Κατά τη διάρκεια της νοσηλείας η θνητότητα στους άνδρες είναι σχεδόν διπλάσια από αυτή των γυναικών (9), ενώ κατά τον πρώτο μήνα η θνητότητα είναι σημαντικά διαφορετική (12% έναντι 7%) (10). Επίσης, οι άνδρες έχουν αυξημένο κίνδυνο να πεθάνουν προ του χειρουργείου και να εμφανίσουν τουλάχιστο μία μετεγχειρητική επιπλοκή (9). Ο κίνδυνος των ανδρών εξακολουθεί να είναι μεγαλύτερος από των γυναικών για αρκετό καιρό μετά το κάταγμα, αλλά η διαφορά μεταξύ των δύο φύλων αμβλύνεται μετά τους πρώτους 6 μήνες (11). Η αιτιολογία της παρατηρούμενης υπεροχής των γυναικών δεν έχει αποσαφηνισθεί, μολονότι έχει αποδοθεί στο παρελθόν στο ότι οι άνδρες έχουν πιο σοβαρές νόσους προ του κατάγματος και μεγαλύτερη πιθανότητα για μετεγχειρητικές επιπλοκές, όπως πνευμονία, αρρυθμία και πνευμονική εμβολή (9, 10).
Επίσης, μετά από κάταγμα ισχίου έχει διαπιστωθεί ότι μεγάλο ποσοστό των ασθενών δεν μπορεί να επανέλθει στην πρότερη λειτουργική του κατάσταση, δεν μπορεί να ανταποκριθεί στις βασικές του ανάγκες, εμφανίζει εξάρτηση από τρίτους και, γενικά, παρατηρείται υποβάθμιση της ποιότητας της ζωής του. Έτσι, μεγάλο ποσοστό ανδρών (>15%) μετά από κάταγμα ισχίου δεν μπορούν να περπατήσουν καθόλου ακόμα και δύο χρόνια μετά το κάταγμα, ενώ μόλις 34% μπορεί να περπατήσει χωρίς βοήθεια (12).
Στην Ευρώπη μέχρι το 2050 ο πληθυσμός των ατόμων άνω των 50 ετών αναμένεται να αυξηθεί κατά 36% για τους άνδρες και 26% για τις γυναίκες. Η αύξηση θα είναι μεγαλύτερη για τα άτομα άνω των 80 ετών (239% και 160% για άνδρες και γυναίκες, αντίστοιχα). Υπό αυτές τις συνθήκες αύξησης και γήρανσης του πληθυσμού προβλέπεται ότι θα αυξηθεί σημαντικά και η επίπτωση της οστεοπόρωσης και των οστεοπορωτικών καταγμάτων, καθώς και του οικονομικού κόστους αυτών. Έτσι, υπολογίζεται ότι το κόστος των οστεοπορωτικών καταγμάτων για το 2025 και το 2050 θα φτάσει τα 54 και 76,8 δισεκατομμύρια ευρώ, αντίστοιχα, από τα οποία τα 14,7 και 22,8 δισεκατομμύρια ευρώ θα δαπανηθούν για τους άνδρες (13).
Οι Gullberg και συν. το 1997 δημοσίευσαν τις εκτιμήσεις τους για την επίπτωση των καταγμάτων ισχίου παγκοσμίως, βασιζόμενοι στα τότε επιδημιολογικά δεδομένα και κάνοντας υποθέσεις για τις τάσεις στην επίπτωση των καταγμάτων αυτών ανάλογα με το φύλο και την ηλικία. Με τις πιο αισιόδοξες υποθέσεις εκτίμησαν ότι, ενώ το 1990 συνέβησαν 1,26 εκατομμύρια κατάγματα ισχίου σε όλον τον κόσμο (27% σε άνδρες), το 2025 θα φτάσουν τα 2,6 εκατομμύρια (30% σε άνδρες) και το 2050 τα 4,5 εκατομμύρια (31% σε άνδρες). Με τις πιο απαισιόδοξες υποθέσεις (4% ετήσια αύξηση στην επίπτωση κατά ηλικία και κατά φύλο σε όλον τον κόσμο, εκτός από τη Β. Αμερική και τη Β. Ευρώπη) τα κατάγματα ισχίου θα φτάσουν τα 8,2 εκατομμύρια (31% σε άνδρες) και τα 37,2 εκατομμύρια (32% σε άνδρες). Οι άνδρες θα έχουν τις πιο μεγάλες αυξήσεις (310% από το 1990 ως το 2050 με την αισιόδοξη θεώρηση), κυρίως λόγω της μεγαλύτερης αύξησης στο προσδόκιμο επιβίωσης από τις γυναίκες (14). Οι παραπάνω εκτιμήσεις είναι πολύ πιθανό να μην επαληθευτούν. Αν και σε αρκετές χώρες διαπιστώνεται τα τελευταία χρόνια διαρκής αύξηση στην επίπτωση των καταγμάτων ισχίου, σε άλλες παρατηρείται σταθερότητα ή και μείωση. Επίσης, παρατηρείται διαφορά στις τάσεις της επίπτωσης, ανάλογα με το φύλο και την ηλικιακή ομάδα. Γενικά, στις περισσότερες μελέτες επικρατεί μια αυξητική τάση για τους άνδρες, ενώ σε λίγες χώρες φαίνεται να μειώνεται η επίπτωση των καταγμάτων ισχίου και στα δύο φύλα.
3. Ταξινόμηση της οστεοπόρωσης στους άνδρες
Η οστεοπόρωση στους άνδρες μπορεί να είναι πρωτοπαθής ή δευτεροπαθής ανάλογα με το αν υπάρχει συγκεκριμένη αιτία που την προκαλεί ή όχι (Πίνακας 1). Η πρωτοπαθής ανδρική οστεοπόρωση περιλαμβάνει τη γεροντική ή ηλικιοεξαρτώμενη και την ιδιοπαθή που εμφανίζεται σε νεότερους άνδρες (κάτω των 60 ετών). Τα όρια μεταξύ των δύο τύπων της πρωτοπαθούς οστεοπόρωσης είναι δυσδιάκριτα και είναι πολύ πιθανό να μοιράζονται τους ίδιους παθογενετικούς μηχανισμούς.
Παραδοσιακά θεωρείται ότι το ποσοστό της πρωτοπαθούς οστεοπόρωσης στους άνδρες είναι μικρότερο από αυτό που εμφανίζεται στις γυναίκες. Η άποψη αυτή, όμως, μπορεί να μην ανταποκρίνεται στην πραγματικότητα αν λάβουμε υπ’ όψιν ότι το ποσοστό των ανδρών που ελέγχεται για οστεοπόρωση, χωρίς να έχει κάποιο υποκείμενο νόσημα – δευτεροπαθές αίτιο οστεοπόρωσης, είναι μικρό.
Το ποσοστό της δευτεροπαθούς ανδρικής οστεοπόρωσης ποικίλει στις διάφορες σειρές από 30 ως 70% (15). Σε μια ελληνική σειρά το ποσοστό των ανδρών με αναγνωρισμένο δευτεροπαθές αίτιο ήταν 43% (16). Είναι βέβαιο ότι, με την πρόοδο της ιατρικής μεθοδολογίας και της τεχνολογίας που την εξυπηρετεί, το ποσοστό αυτό θα μεγαλώσει στο μέλλον μια και ο εντοπισμός της δευτεροπαθούς αιτίας θα είναι πιο εύκολος.
Τα πιο συχνά αίτια δευτεροπαθούς ανδρικής οστεοπόρωσης είναι η κατάχρηση οινοπνεύματος, η λήψη γλυκοκορτικοστεροειδών και ο υπογοναδισμός. Στην προηγούμενη ελληνική σειρά το ποσοστό των δύο τελευταίων ήταν 11,4% και 10% , αντίστοιχα, επί του συνόλου των οστεοπορωτικών ανδρών, ενώ δεν παρατηρήθηκε οστεοπόρωση λόγω αλκοολισμού (16). Σε διεθνείς σειρές το ποσοστό και των τριών κυμαίνεται περί το 45% (15). Αρκετές φορές, πάντως, περισσότερα από ένα αίτια δευτεροπαθούς ανδρικής οστεοπόρωσης υπάρχουν ταυτόχρονα.
4. Παθογένεια της οστικής απώλειας στους άνδρες
4.1. Πρωτοπαθής ανδρική οστεοπόρωση
Στη διεθνή βιβλιογραφία η πρωτοπαθής ανδρική οστεοπόρωση διαχωρίζεται σε γεροντική ή ηλικιοεξαρτώμενη και ιδιοπαθή, που εμφανίζεται σε νεότερους άνδρες. Υπάρχει διχογνωμία γύρω από τον καθορισμό ενός ηλικιακού ορίου κάτω από το οποίο μπορούμε να μιλάμε για ιδιοπαθή οστεοπόρωση. Άλλοι θεωρούν ότι τα 60 έτη είναι το κατάλληλο (17), ενώ άλλοι τα 65 ή ακόμα και τα 70 (4, 15). Με δεδομένο ότι οι ηλικιοεξαρτώμενες αλλαγές στον ανδρικό σκελετό ξεκινούν αρκετά νωρίς στην ενήλικο ζωή, όπως αναφέρεται παρακάτω, και με μεγάλη την πιθανότητα η γεροντική οστεοπόρωση να προκαλείται, εκτός των άλλων, από τη μη επίτευξη ικανοποιητικής κορυφαίας οστικής μάζας σε νεαρή ηλικία, η παθογένεια των δύο τύπων της πρωτοπαθούς ανδρικής οστεοπόρωσης εξετάζεται σαν ενιαίο σύνολο. Η ηλικιοεξαρτώμενη οστική απώλεια έχει ως κύριες συνιστώσες ποσοτικές και ποιοτικές αλλαγές των οστών με το πέρασμα του χρόνου, οι οποίες οφείλονται εν μέρει σε αλλαγές στην κυκλοφορούσα συγκέντρωση ενδογενών παραγόντων που ρυθμίζουν τον οστικό μεταβολισμό. Όταν οι αλλαγές αυτές είναι έντονες οδηγούν σε οστική απώλεια μεγαλύτερη του αναμενόμενου.
4.1.1. Αλλαγές στο μέγεθος των οστών και την οστική πυκνότητα των ανδρών με το πέρασμα της ηλικίας
Με τη χρήση της ποσοτικής υπολογιστικής τομογραφίας, τόσο της κεντρικής (QCT), όσο και της περιφερικής (pQCT), καθώς και των πιο εξελιγμένων τεχνικών υψηλής ανάλυσης αυτών (HR – QCT και HR – pQCT), έγινε δυνατό τα τελευταία χρόνια να μελετηθεί η επίδραση της ηλικίας στην οστική μάζα και γεωμετρία του ανδρικού σκελετού.
Οι άνδρες έχουν μεγαλύτερο μέγεθος οστών (bone area) κατά 25 – 33% και μεγαλύτερη οστική μάζα κατά 18 – 21% σε σχέση με τις γυναίκες στη νεαρή ενήλικο ζωή, διαφορές που διατηρούνται σε όλες τις μετέπειτα ηλικίες. Με το πέρασμα της ηλικίας παρατηρείται αύξηση του bone area και στα δύο φύλα κατά 7 – 15% στα κεντρικά σημεία (ΟΜΣΣ, αυχένα μηριαίου) και κατά 2 – 16% στα περιφερικά σημεία (κνήμη, κερκίδα) (18, 19).
Φαίνεται ότι και στα δύο φύλα η απώλεια της ογκομετρικής οστικής πυκνότητας (vBMD) ξεκινά από πολύ νωρίς, κατά την τρίτη και τέταρτη δεκαετία, τουλάχιστο όσον αφορά στο σπογγώδες οστό. Η απώλεια της vBMD του σπογγώδους στα κεντρικά σημεία είναι πιο μεγάλη στις γυναίκες (55%) από ότι στους άνδρες (46%), ενώ στα περιφερικά σημεία είναι περίπου η ίδια και στα δύο φύλα (24 και 26%, αντίστοιχα). Επίσης, βρέθηκε ότι η απώλεια της vBMD του σπογγώδους ήταν πιο απότομη στις γυναίκες, ιδιαίτερα κατά τα πρώτα μεταεμμηνοπαυσιακά χρόνια (18). Το 42% της συνολικής απώλειας της vBMD του σπογγώδους στους άνδρες συμβαίνει πριν την ηλικία των 50 ετών. Ο ρυθμός απώλειας παραμένει σχεδόν σταθερός σε όλη την ενήλικο ζωή για τα περιφερικά σημεία, με την εξαίρεση της τρίτης δεκαετίας που είναι λίγο αυξημένος, ενώ στην ΟΜΣΣ διπλασιάζεται μετά τα 50 έτη και η μεγαλύτερη επιτάχυνση συμβαίνει μετά τα 70 έτη (εικόνα 2) (20).
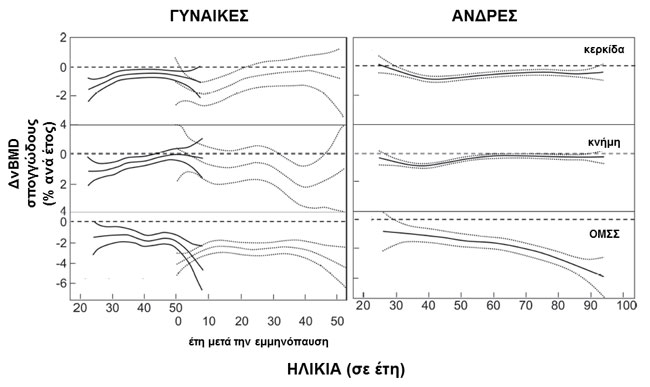
Εικόνα 2. Ηλικιοεξαρτώμενες μεταβολές στη vBMD του σπογγώδους στο άπω πέρας της κερκίδας και της κνήμης, καθώς και στην ΟΜΣΣ μετρούμενες με pQCT και QCT σε γυναίκες και άνδρες. Η οστική απώλεια ξεκινά κατά την τρίτη δεκαετία της ζωής (τροποποιημένη από Riggs και συν. (2008) JBoneMinerRes 23: 205-214).
Σημαντική είναι και η απώλεια της vBMD του φλοιώδους με το πέρασμα της ηλικίας, αλλά σε αντίθεση με το σπογγώδες, αυτή είναι εμφανής από τη μέση ηλικία και ύστερα και στα δύο φύλα, με τη διαφορά ότι οι άνδρες χάνουν μικρότερο ποσοστό vBMD φλοιώδους από τις γυναίκες (18% έναντι 28%, αντίστοιχα) και η απώλεια ξεκινά λίγο νωρίτερα (18, 20). Μόλις 15% της απώλειας αυτής συμβαίνει πριν τα 50 στους άνδρες, ενώ ο ρυθμός της μείωσης της vBMD του φλοιώδους αυξάνει κατά 2 με 4 φορές μετά την ηλικία αυτή και η σημαντικότερη επιτάχυνσή του παρατηρείται μετά τα 75 έτη (20).
Η αύξηση του μεγέθους των οστών και ιδιαίτερα η αύξηση της διαμέτρου των μακρών αυλοειδών οστών και στα δύο φύλα είναι ένας τρόπος για να αυξηθεί η μηχανική αντοχή τους. Επιτυγχάνεται με περιοστική εναπόθεση καθόλη τη διάρκεια της ενηλίκου ζωής. Ταυτόχρονα, όμως, παρατηρείται ενδοφλοιώδης οστική απορρόφηση και επακόλουθη αύξηση του χώρου που καταλαμβάνει ο μυελός των οστών. Επειδή η περιοστική εναπόθεση υπολείπεται της ενδοφλοιώδους απορρόφησης, το τελικό αποτέλεσμα είναι η μείωση στην επιφάνεια του φλοιώδους στην εγκάρσια τομή (cross – sectional cortical area). Οι Riggs και συν. παρατήρησαν ότι στον αυχένα του μηριαίου η ποσοστιαία αύξηση του μυελικού χώρου είναι μικρότερη στους άνδρες από ότι στις γυναίκες (25 και 38%, αντίστοιχα), αλλά η διαφορά δεν είναι στατιστικά σημαντική (18). Σε αντίστοιχη μελέτη στην κνήμη οι Lauretani και συν. βρήκαν ότι μεταξύ των ηλικιών 20 και 90 ετών η αύξηση του μυελικού χώρου που εκφράζει την ενδοφλοιώδη απορρόφηση φτάνει το 114% στις γυναίκες και το 30% στους άνδρες. Έτσι, αν και σε νεαρές ηλικίες οι άνδρες έχουν, σε απόλυτες τιμές, μεγαλύτερο μυελικό χώρο, μετά τα 75 οι γυναίκες έχουν μεγαλύτερη μυελική έκταση. Αντίθετα, η αύξηση της ολικής επιφάνειας οστού (total bone area) (εκφραστής της περιοστικής εναπόθεσης) είναι μεγαλύτερη στους άνδρες (9%) σε σχέση με τις γυναίκες (5,7%). Τελικά, στους άνδρες παρατηρείται μικρή λέπτυνση του φλοιού, ενώ στις γυναίκες εκσεσημασμένη. Μάλιστα, φαίνεται ότι στους άνδρες μέχρι τα 70 παρατηρείται μικρή αύξηση της επιφάνειας του φλοιώδους (cortical bone area) (εικόνα 3) (21). Ανάλογα είναι και τα ευρήματα για την κερκίδα, μόνο που στο οστό αυτό οι διαφορές των δύο φύλων δεν είναι τόσο έντονες (19). Τέλος, στο μηριαίο οστό των ανδρών το φαινόμενο αυτό είναι πιο έντονο στη διάφυση παρά στον αυχένα. Έχει βρεθεί ότι η εγκάρσια επιφάνεια του αυχένα του μηριαίου είναι μεγαλύτερη κατά 1,6% σε άνδρες άνω των 85 ετών από άνδρες 65 – 69 ετών, ενώ στη διάφυση αυτό το ποσοστό είναι 8,9% (22).
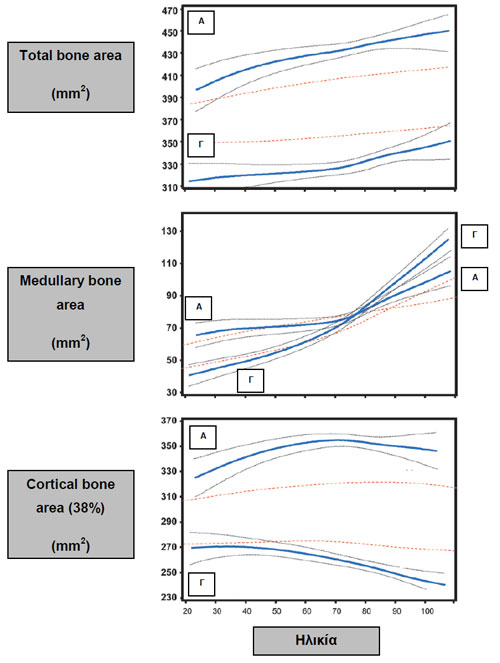
Εικόνα 3. Ηλικιοεξαρτώμενες αλλαγές στη γεωμετρία της κνήμης σε άνδρες (Α) και γυναίκες (Γ) μετρούμενες με pQCT. Πάνω: αύξηση του μεγέθους των οστών, που αποτελεί δείκτη περιοστικής εναπόθεσης οστού (επιφάνεια οστού εγκάρσιας τομής – Total bone area). Η ποσοστιαία αύξηση είναι μεγαλύτερη στους άνδρες. Μέσον: αύξηση του μυελικού χώρου, που είναι δείκτης ενδοφλοιώδους οστικής απορρόφησης (επιφάνεια μυελικού αυλού σε εγκάρσια τομή – Medullary bone area). Η αύξηση είναι πολύ μεγαλύτερη στις γυναίκες. Κάτω: αλλαγές στην επιφάνεια του φλοιώδους σε εγκάρσια τομή στο 38% της κνήμης (Cortical bone area). Οι άνδρες παρουσιάζουν απώλεια σε μεγάλη ηλικία (τροποποιημένη από Lauretani και συν. (2008). J Bone Miner Res 23: 400-8).
4.1.2. Αλλαγές στη μικροαρχιτεκτονική των ανδρικών οστών σε σχέση με την ηλικία
Με τη χρήση της περιφερικής ποσοτικής υπολογιστικής τομογραφίας υψηλής ευκρίνειας στο άπω πέρας της κερκίδας έγινε δυνατό να μελετηθούν οι μικροαρχιτεκτονικές ιδιότητές της και η διαφοροποίησή τους ανάλογα με την ηλικία. Έχει παρατηρηθεί ότι οι νέοι άνδρες έχουν μεγαλύτερο σπογγώδη όγκο οστού (trabecular BV/TV) από τις συνομήλικές τους γυναίκες, αλλά ο ρυθμός μείωσης αυτού του λόγου με το πέρασμα της ηλικίας είναι περίπου ίδιος και για τα δύο φύλα. Η διαφορά μεταξύ ανδρών και γυναικών έγκειται στον τρόπο που συμβαίνει αυτή η μείωση στον όγκο του σπογγώδους. Στις γυναίκες παρατηρείται μείωση του αριθμού των οστεοδοκίδων, ενώ στους άνδρες έχουμε αύξηση του αριθμού και σημαντική λέπτυνσή τους (εικόνα 4). Συγκεκριμένα, στους άνδρες κατά τις τρεις πρώτες δεκαετίες τις ενήλικου ζωής παρατηρείται αύξηση του αριθμού των οστεοδοκίδων κατά 13,6%, η οποία ακολουθείται από μικρή μείωση (8,2%) κατά τις επόμενες δεκαετίες, ενώ ταυτόχρονα συμβαίνει και σημαντικότατη μείωση (24%) στο πάχος των οστεοδοκίδων (trabecular thickness), κυρίως κατά το διάστημα που αυξάνονται οι οστεοδοκίδες, και μείωση 2% στο διαχωρισμό των δοκίδων του σπογγώδους (trabecular separation) (8% από τα 20 ως τα 49) (19). Με αυτό το μηχανισμό οι άνδρες επιτυγχάνουν καλύτερη προσαρμογή του οστού στην απώλεια σπογγώδους, αφού γνωρίζουμε ότι η μείωση στον αριθμό των οστεοδοκίδων έχει 2 με 5 φορές μεγαλύτερη επίπτωση στις μηχανικές ιδιότητες του οστού από τη μείωση του πάχους τους (trabecular thickness) που προκαλεί την ίδια απώλεια στον όγκο του οστού (23).

Εικόνα 4. Διαφορά στην απώλεια σπογγώδους σε άνδρες – γυναίκες. Οι γυναίκες χάνουν σημαντικό αριθμό οστεοδοκίδων, ενώ οι άνδρες παρουσιάζουν λέπτυνσή τους (τροποποιημένη από Gagnon και συν. (2008). Clinical Interventions in Aging 3(4) 635–645).
Οι παραπάνω παρατηρήσεις έρχονται σε συμφωνία με παλαιότερες που είχαν προέλθει από ιστομορφομετρική μελέτη οστού μετά από βιοψία λαγονίου ακρολοφίας σε πτώματα (24). Πιθανολογείται, λοιπόν, ότι το παραπάνω πρότυπο μπορεί να ισχύει για όλο τον ανδρικό σκελετό και να εξηγεί εν μέρει τη μικρότερη συχνότητα καταγμάτων με το πέρασμα της ηλικίας σε σχέση με τις γυναίκες.
Όσον αφορά στο φλοιώδες, τα δεδομένα για το πρότυπο της απώλειας σε μικροαρχιτεκτονικό επίπεδο είναι ελάχιστα. Θεωρείται ότι και στα δύο φύλα αυξάνει η πορωτικότητα του φλοιού, λόγω αύξησης των περιοχών οστικής απορρόφησης και πλημμελούς επανόρθωσης των κατεστραμμένων οστεώνων που επιφέρει το πέρασμα της ηλικίας (18).
4.1.3. Επίδραση των ορμονών του φύλου στον ανδρικό σκελετό
Στα κύτταρα του οστίτη ιστού των ανδρών βρίσκονται τόσο ανδρογονικοί (ΑR) όσο και οιστρογονικοί υποδοχείς (ERα, ERβ), καθώς και ένζυμα που εμπλέκονται στο μεταβολισμό των φυλετικών ορμονών (αρωματάση, 5α – ρεδουκτάση, 17β – δεϋδρογενάση, 3β – δεϋδρογενάση κ.α.). Φαίνεται ότι και τα δύο είδη στεροειδών παίζουν ρόλο κατά την ανάπτυξη των οστών. Τα οιστρογόνα, κυρίως μέσω των ERα υποδοχέων και, πιθανόν, με τη μεσολάβηση αλλαγών στη συγκέντρωση του IGF – 1, ευνοούν την κατά μήκος αύξηση από τις επιφυσιακές πλάκες. Τα ανδρογόνα είναι υπεύθυνα για την αύξηση στο πάχος των οστών (μέσω περιοστικής εναπόθεσης) και την απόκτηση ικανοποιητικής μάζας φλοιώδους, συνεπικουρούμενα από τα οιστρογόνα (πάλι μέσω των ERα) και ικανοποιητικής μάζας σπογγώδους. Σημαντικός είναι ο ρόλος των φυλετικών ορμονών και στη διατήρηση της οστικής μάζας με το πέρασμα της ηλικίας: τα οιστρογόνα προστατεύουν τόσο το σπογγώδες όσο και το φλοιώδες, ενώ τα ανδρογόνα κυρίως το πρώτο (25).
Προϊούσας της ηλικίας στους άνδρες παρατηρείται σημαντική μείωση των ελεύθερων και βιοδιαθέσιμων κλασμάτων τεστοστερόνης και 17β – οιστραδιόλης, καθώς και αύξηση της SHBG (26), (27), (28), (29). Στη μελέτη MrOS παρατηρήθηκε ότι η συγκέντρωση της ολικής και της ελεύθερης τεστοστερόνης ήταν μικρότερη στους άνδρες με τη μεγαλύτερη ηλικία και μάλιστα ο ρυθμός της πτώσης ήταν περίπου 10% ανά δεκαετία, ενώ ακόμα πιο ισχυρή ήταν η συσχέτιση της ηλικίας με την πτώση των επιπέδων της ολικής και ελεύθερης οιστραδιόλης. Μάλιστα, τα χαμηλότερα επίπεδα ελεύθερης οιστραδιόλης βρέθηκαν σε αυτούς που είχαν χαμηλά επίπεδα ελεύθερης τεστοστερόνης και αυξημένη SHBG (27). Οι μεταβολές αυτές έχουν συσχετισθεί σε αρκετές μελέτες με την οστική απώλεια που συνοδεύει τη μεγάλη ηλικία.
Στην προηγούμενη μελέτη παρατηρήθηκε ότι η συχνότητα της οστεοπόρωσης σε άνδρες άνω των 65 ετών με χαμηλά επίπεδα ολικής τεστοστερόνης (< 200 ng/ dl) ήταν 12,3%, ενώ σε αυτούς με φυσιολογικά επίπεδα (> 400 ng/ dl) ήταν 6%. Επίσης, σε άνδρες με χαμηλή ολική οιστραδιόλη (< 10 pg/ ml) και φυσιολογικές τιμές αυτής (> 20 pg/ ml) τα αντίστοιχα ποσοστά ήταν 15,4 και 2,8%, υποδηλώνοντας μια πιο ισχυρή συσχέτιση της πτώσης της ολικής οιστραδιόλης με τη μείωση της BMD. Σε συμφωνία με αυτό ήταν και η διαπίστωση ότι μεταξύ των οστεοπορωτικών ανδρών 6,9% είχαν ολική τεστοστερόνη < 200 ng/ dl και 9,2% ολική οιστραδιόλη < 10 pg/ ml. Ανάλογα ήταν και τα αποτελέσματα για τα βιοδιαθέσιμα κλάσματα. Από την άλλη μεριά, η χαμηλή ολική και βιοδιαθέσιμη τεστοστερόνη συσχετιζόταν καλύτερα από τη χαμηλή ολική και βιοδιαθέσιμη οιστραδιόλη με την ύπαρξη ταχείας οστικής απώλειας (> 3% ετησίως) στο ισχίο (30).
Οι μελέτες των Falahati – Nini και συν. (31) και των Leder και συν. (32) κατέδειξαν τον ανεξάρτητο ρόλο των οιστρογόνων και των ανδρογόνων στον οστικό μεταβολισμό υγιών ανδρών μέσω φαρμακευτικών χειρισμών δημιουργίας εκλεκτικής ανεπάρκειας των στεροειδών του φύλου. Η πρώτη (σε ηλικιωμένους φυσιολογικούς άνδρες) διαπίστωσε ότι τα οιστρογόνα ευθύνονται για πάνω από το 70% της δράσης των ορμονών του φύλου στην οστική απορρόφηση, αλλά στην οστική κατασκευή συμβάλλουν εξίσου και τα δύο είδη στεροειδών, ενώ η δεύτερη (σε νεαρότερους φυσιολογικούς άνδρες) κατέδειξε υπεροχή των ανδρογόνων στη διατήρηση της οστικής κατασκευής και σημαντική και ανεξάρτητη δράση και των δύο κατηγοριών ορμόνης στην οστική απορρόφηση.
Χρησιμοποιώντας την ποσοτική υπολογιστική τομογραφία (QCT) οι Khosla και συν. προσπάθησαν να συσχετίσουν τα επίπεδα της βιοδιαθέσιμης τεστοστερόνης και οιστραδιόλης με την ογκομετρική BMD (vBMD) και παραμέτρους της οστικής γεωμετρίας σε έναν ηλικιακά διαστρωματωμένο ανδρικό πληθυσμό (26). Διαπίστωσαν ότι στους νέους άνδρες, που είχαν υψηλά επίπεδα των βιοδιαθέσιμων κλασμάτων, αυτά δεν σχετίζονταν με τις υπό εξέταση παραμέτρους, ενώ στους μεγαλύτερους με τις χαμηλότερες τιμές υπήρχε συσχέτιση τόσο με τη vBMD όσο και με τις περισσότερες παραμέτρους της οστικής γεωμετρίας. Γενικά, η βιοδιαθέσιμη οιστραδιόλη ήταν πιο καθοριστική από την βιοδιαθέσιμη τεστοστερόνη για τις περισσότερες παραμέτρους. Για παράδειγμα, αυτό φάνηκε για τη vBMD σε όλα τα σημεία μέτρησης (ΟΜΣΣ, ισχίο, άπω πέρας κνήμης και κερκίδας), εκτός από τη vBMD του φλοιώδους στον αυχένα του μηριαίου (μεγαλύτερη συσχέτιση με τη βιοδιαθέσιμη τεστοστερόνη), καθώς και για την επιφάνεια του φλοιώδους (θετική συσχέτιση) και την υποφλοιώδη επιφάνεια (αρνητική συσχέτιση). Ακόμη, φάνηκε ότι πιθανόν να υπάρχει και μια οριακή τιμή (~ 8 pg / ml) κάτω από την οποία υπάρχει σαφής επηρεασμός του σκελετού. Η διαπίστωση ότι αυτή η οριακή τιμή ισχύει κυρίως για το φλοιώδες, ενώ για το σπογγώδες είναι μάλλον υψηλότερη, πιθανόν να οφείλεται στο ότι τα κύτταρα του οστίτη ιστού στο σπογγώδες εκφράζουν πολύ μεγαλύτερη αναλογία ERβ σε σχέση με τα οστικά κύτταρα του φλοιώδους. Με δεδομένο ότι οι ERβ παίζουν υποδεέστερο ρόλο στον οστικό μεταβολισμό από τους ERα είναι λογικό για να παρατηρηθούν οι ίδιες οιστρογονικές δράσεις και στα δύο είδη οστού να χρειάζονται μεγαλύτερες συγκεντρώσεις οιστρογόνων στο σπογγώδες από ότι στο φλοιώδες (33).
Η σημαντική επίδραση των ορμονών του φύλου στον ανδρικό σκελετό καταδεικνύεται και σε μελέτες που συσχέτισαν τα χαμηλά επίπεδά τους με τον αυξημένο καταγματικό κίνδυνο (34), (29).
Το γεγονός ότι σε αρκετές μελέτες η τεστοστερόνη φαίνεται να μη σχετίζεται ισχυρά με την οστική μάζα και την απώλειά της, αλλά σε άλλες να είναι ισχυρός προγνωστικός παράγοντας για κάταγμα έχει την πιθανή εξήγηση ότι η ορμόνη αυτή δρα επηρεάζοντας άλλες, εξωσκελετικές, συνιστώσες του καταγματικού κινδύνου. Η επάρκεια σε τεστοστερόνη εξασφαλίζει την καλή διανοητική κατάσταση και την καλή λειτουργία του μυϊκού συστήματος, διατηρώντας ικανοποιητική μυϊκή μάζα και ισχύ, καθώς και την ισορροπία του σώματος, προστατεύοντας από τις πτώσεις που αποτελούν σημαντικό προδιαθεσικό παράγοντα για κατάγματα (17), (35), (36), (34), (37), (38). Βέβαια, πιθανολογείται από μερικούς ότι ακόμα και αυτές οι εξωσκελετικές δράσεις της τεστοστερόνης επιτυγχάνονται εν μέρει μετά την αρωματοποίησή της σε οιστρογόνα (39).
Έχοντας ως δεδομένη πλέον τη σημαντική επίδραση της οιστραδιόλης (ολικής, ελεύθερης ή βιοδιαθέσιμης) στον ανδρικό σκελετό είναι λογικό στην παθογένεια της οστικής απώλειας στους άνδρες να εμπλέκονται και παράγοντες που σχετίζονται με την παραγωγή της και τον τρόπο με τον οποίο επιτυγχάνονται οι δράσεις της. Έτσι, για την αιτιοπαθογένεια της ανδρικής οστεοπόρωσης προτείνονται ποσοτικές και ποιοτικές μεταβολές της αρωματάσης και των οιστρογονικών υποδοχέων που, κυρίως, προκύπτουν από γενετικές διαφοροποιήσεις των αντίστοιχων γονιδίων. Χαρακτηριστικά είναι τα παραδείγματα ανδρών με μεταλλάξεις στο γονίδιο των οιστρογονικών υποδοχέων (ERα) και στο γονίδιο της αρωματάσης (CYP19) (33), που λόγω της αντίστασης στη δράση ή της ανεπάρκειας της οιστραδιόλης, αντίστοιχα, είχαν πολύ χαμηλές τιμές BMD. Επιπρόσθετα, πολυμορφισμοί του γονιδίου της αρωματάσης φαίνεται ότι μεταβάλλουν τη δραστικότητα του ενζύμου με ανάλογες συνέπειες στη BMD (40), (25) και πιθανόν μεγάλες μελέτες με αντικείμενο την εντόπιση αυτών των γενετικών πολυμορφισμών να ρίξουν περισσότερο φως στην παθογένεια της οστικής απώλειας στους άνδρες.
Τέλος, η ύπαρξη μιας οριακής τιμής οιστραδιόλης ορού κάτω από την οποία δημιουργείται ανεπάρκεια στο σκελετό των ανδρών και παρατηρείται αύξηση του καταγματικού κινδύνου είναι πολύ πιθανή, όπως φαίνεται σε αρκετές από τις παραπάνω μελέτες (26), (29), (34), (36). Ο καθορισμός του ακριβούς επιπέδου και η κλινική χρήση του είναι σίγουρα από τα θέματα που θα μας απασχολήσουν στο μέλλον.
4.1.4. Επίδραση άλλων ορμονών και ενδογενών παραγόντων
Αυξητική ορμόνη (GH) – ινσουλινοειδής αυξητικός παράγοντας Ι (IGF-I). Η GH και ο IGF-I έχουν αναβολική δράση κατά την ανάπτυξη του σκελετού. Μέσω των υποδοχέων τους στα χονδροκύτταρα των επιφυσιακών πλακών των μακρών οστών προάγουν την κατά μήκος αύξησή τους με ενδοχόνδρινη οστεογένεση. Υποδοχείς τους, όμως, απαντώνται στους οστεοβλάστες και τους οστεοκλάστες.
Η GH διεγείρει τον πολλαπλασιασμό των κυττάρων της οστεοβλαστικής σειράς, καθώς και την εκτροπή της διαφοροποίησης των προγονικών μεσεγχυματικών κυττάρων προς οστεοβλάστες σε βάρος της λιποκυτταρογένεσης. Επίσης, προάγει τη διαφοροποίηση των οστεοβλαστών και τη λειτουργικότητα των ώριμων οστεοβλαστών μέσω αύξησης της παραγωγής των οστικών μορφογενετικών πρωτεϊνών (ΒΜΡs) και της οστεοπροτεγερίνης. Εκτός, από τις παραπάνω άμεσες δράσεις της GH στον οστικό μεταβολισμό έχουν παρατηρηθεί και έμμεσες. Έτσι, η GH επηρεάζει τον κιρκάδιο ρυθμό έκκρισης της παραθορμόνης (ΡΤΗ) πιθανόν μέσω αύξησης της νεφρικής επαναρρόφησης του φωσφόρου, ενώ αυξάνει και την παραγωγή της 1,25 διυδροξυ- βιταμίνης D3 με την επαγωγή της 1α- υδροξυλάσης και την αναστολή της 24- υδροξυλάσης (41).
Ο IGF-I παράγεται και στους οστεοβλάστες κάτω από την επίδραση διαφόρων παραγόντων, όπως η ΡΤΗ, τα οιστρογόνα, οι θυρεοειδικές ορμόνες και η ΒΜΡ- 2, ενώ άλλοι παράγοντες δρουν ανασταλτικά στην παραγωγή του, όπως τα γλυκοκορτικοειδή και ο αιμοπεταλιακός αυξητικός παράγοντας και πιθανολογείται ότι οι δράσεις των παραπάνω ουσιών στα οστά επιτυγχάνονται, εν μέρει, μέσω των μεταβολών στις τοπικές συγκεντρώσεις του IGF-I. Ο κύριος ρόλος του IGF-I στα οστά είναι η διέγερση της οστεοβλαστικής λειτουργίας. Αυξάνει τη σύνθεση του κολλαγόνου τύπου Ι, ενώ ταυτόχρονα μειώνει τη σύνθεση της κολλαγενάσης 3 ευνοώντας την οστική παραγωγή. Αντίθετα, δε φαίνεται να έχει σημαντική δράση στην οστεοβλαστογένεση και τη διαφοροποίηση προς ώριμους οστεοβλάστες. Παράλληλα, δρα και στους οστεοκλάστες διεγείροντας την οστική απορρόφηση, ενώ αυξάνει και την παραγωγή του RANKL προάγοντας την οστεοκλαστογένεση (41).
Με την πάροδο της ηλικίας παρατηρείται μείωση των επιπέδων της GH και του IGF-I (42). Ειδικά στους άνδρες, η ημερήσια έκκριση GH μπορεί να είναι τόσο μειωμένη στους ηλικιωμένους ώστε να φτάνει στο 1/20 των τιμών των νεαρών ενηλίκων (43), ενώ σε σχέση με τις γυναίκες η πτώση είναι δύο φορές ταχύτερη με αποτέλεσμα η έκκριση GH μετά τα 50 έτη να παραμένει υψηλότερη στις γυναίκες από ότι στους άνδρες (41).
O IGF-I τόσο στη συστηματική κυκλοφορία, όσο και τοπικά, βρίσκεται κατά 99% ως σύμπλοκο με ειδικές πρωτεΐνες, τις δεσμευτικές πρωτεΐνες του IGF-I (IGFΒΡs), οι οποίες δρουν κυρίως ως μεταφορικά μόρια, αλλά έχουν τη δυνατότητα να τροποποιούν και τη λειτουργία του IGF-I. Συνήθως δρουν ως αναστολείς της δράσης του IGF-I και ως εκ τούτου πιθανολογείται η συμμετοχή τους στην παθογένεια της οστεοπόρωσης. Μάλιστα, έχει βρεθεί ότι η IGFΒΡ-2 αυξάνει σημαντικά με το πέρασμα της ηλικίας τόσο σε άνδρες όσο και σε γυναίκες και συσχετίζεται αρνητικά με τη BMD (44) και θετικά με τους βιοχημικούς δείκτες της οστικής εναλλαγής (44). Επίσης, έχει βρεθεί ότι η IGFΒΡ-3, η οποία είναι η κατ` εξοχήν πρωτεΐνη που δεσμεύει τον IGF-I στην κυκλοφορία, μειώνεται προϊούσας της ηλικίας και αυτή η μείωση μαζί με τη συνοδό μείωση του IGF-I σχετίζεται περισσότερο από κάθε άλλον παράγοντα με τις αλλαγές που παρατηρούνται στο σπογγώδες των ανδρών κατά τις δύο πρώτες δεκαετίες της ενήλικου ζωής (βλ. «Αλλαγές στη μικροαρχιτεκτονική των ανδρικών οστών σε σχέση με την ηλικία»), ενώ αργότερα το ρόλο αυτό έχουν τα στεροειδή του φύλου (42).
Τέλος, από τις μέχρι τώρα παρατηρήσεις (κυρίως σε διαγονιδιακά ποντίκια, αλλά και σε ανθρώπους με ανεπάρκεια GH) φαίνεται ότι ο IGF-I που υπάρχει στη συστηματική κυκλοφορία είναι υπεύθυνος για τη διατήρηση της οστικής μάζας του φλοιώδους, ενώ ο τοπικά παραγόμενος στα οστά IGF-I δρα προστατεύοντας το σπογγώδες (41).
Ενδογενείς παράγοντες που σχετίζονται με το λιπώδη ιστό. Η διαπίστωση ότι το σωματικό βάρος και ο δείκτης μάζας σώματος είναι καθοριστές της BMD και του καταγματικού κινδύνου (45), (46), με τους υπέρβαρους να έχουν μεγαλύτερη BMD και μικρότερο κίνδυνο να υποστούν κάταγμα ευθραυστότητας, έχει οδηγήσει τα τελευταία χρόνια σε προσπάθειες να εξηγηθεί η σχέση του λιπώδους με τον οστίτη ιστό και κατ` επέκταση ο ρόλος ενδογενών παραγόντων που σχετίζονται με το λίπος στην παθογένεια της ανδρικής οστεοπόρωσης.
Οι πιο πιθανοί από τους μηχανισμούς με τους οποίους το αυξημένο λίπος προκαλεί αύξηση της BMD φαίνονται στον πίνακα 2. Η μεγαλύτερη φόρτιση των οστών δημιουργεί τις συνθήκες για θετικές αλλαγές στην οστική μάζα, αλλά και στη γεωμετρία τους. Η περιφερική αρωματοποίηση των ανδρογόνων σε οιστρογόνα είναι αυξημένη σε άτομα με μεγάλη ποσότητα λίπους και ο ευεργετικός ρόλος των τελευταίων είναι πλέον αποδεδειγμένος, όπως έχει συζητηθεί παραπάνω. Όμως, στα λιποκύτταρα παράγονται και άλλες ουσίες με πιθανή σημαντική δράση στα οστά: η λεπτίνη και η αδιπονεκτίνη.
Η λεπτίνη είναι ένα ορμονικό πεπτίδιο που παράγεται από τα λιποκύτταρα και επηρεάζει τον οστικό μεταβολισμό δρώντας τόσο άμεσα στα οστικά κύτταρα όσο και έμμεσα με τη μεσολάβηση του κεντρικού νευρικού συστήματος. Οι περισσότερες πληροφορίες που έχουμε προέρχονται από μελέτες σε ζώα και καλλιέργειες ανθρώπινων οστικών κυττάρων. Η λεπτίνη προκαλεί επαγωγή του πολλαπλασιασμού και της διαφοροποίησης των οστεοβλαστών (47), (48) και μείωση της παραγωγής του RANK-L και αύξηση της παραγωγής της οστεοπροτεγερίνης, που οδηγούν σε αναστολή της οστεοκλαστογένεσης (49). Το τελικό αποτέλεσμα της περιφερικής δράσης της είναι η αυξημένη οστική μάζα.
Αντίθετα, όταν η λεπτίνη δρα κεντρικά φαίνεται ότι προκαλεί μείωση της BMD. Ο κύριος στόχος της είναι ο υποθάλαμος και πιο συγκεκριμένα ο τοξοειδής πυρήνας, όπου ρυθμίζεται το ισοζύγιο ενέργειας (δυναμική ισορροπία ενεργειακών αναγκών και πρόσληψης τροφής). Μέσω ενός πολύπλοκου συστήματος αναστολής και επαγωγής της λειτουργίας διαφορετικών νευρωνικών συστημάτων, κάποια από τα οποία ανήκουν στο συμπαθητικό νευρικό σύστημα, η λεπτίνη προκαλεί ελάττωση του αισθήματος της πείνας, ελάττωση της πρόσληψης τροφής και απώλεια βάρους με ανάλογες συνέπειες στη BMD, αλλά και αναστολή της οστικής παραγωγής με ταυτόχρονη αύξηση της οστεοκλαστικής δράσης με έμμεση δράση στους β- αδρενεργικούς υποδοχείς των οστεοβλαστών (50), (51).
Η συνισταμένη δράση της λεπτίνης στην οστική μάζα φαίνεται να είναι θετική, δηλαδή η περιφερική δράση υπερισχύει έναντι της κεντρικής στις περισσότερες περιπτώσεις (52). Επιπρόσθετα, σε πειράματα συστηματικής χορήγησης λεπτίνης σε πειραματόζωα με ανεπάρκεια της ορμόνης βρέθηκε ότι υπάρχει διαφορετική απόκριση ανάλογα με τη δόση (χαμηλές δόσεις – που προσομοιάζουν με τα επίπεδα που κυκλοφορούν φυσιολογικά στο αίμα – έχουν θετική επίδραση στα οστά, ενώ υψηλές δόσεις προκαλούν σημαντική απώλεια βάρους και οστικής μάζας) (53). Στους ανθρώπους οι μελέτες που αφορούν στη λεπτίνη είναι λίγες με τα αποτελέσματα να συμφωνούν, γενικά, με τη θετική επίδραση της λεπτίνης στο σκελετό (52). Αν και οι περισσότερες έχουν γίνει σε γυναικείους πληθυσμούς, πιθανολογείται ότι ισχύουν οι ίδιες αρχές και στους άνδρες, καθιστώντας τις διαταραχές των επιπέδων της λεπτίνης πιθανές αιτίες της οστεοπόρωσης.
Η αδιπονεκτίνη είναι κι αυτή μια πρωτεΐνη που παράγεται από τα λιποκύτταρα, αλλά σε αντίθεση με τη λεπτίνη η έκκρισή της μειώνεται όταν αυξάνει η μάζα του λίπους (52). Ο ρόλος της στον οστικό μεταβολισμό δεν έχει αποσαφηνισθεί, αλλά τα υπάρχοντα δεδομένα συνηγορούν υπέρ μιας διττής δράσης: επάγει τη διαφοροποίηση των οστεοβλαστών, αλλά, κυρίως, την οστεοκλαστογένεση, μέσω της αύξησης της παραγωγής του RANK-L και της μείωσης της έκκρισης της οστεοπροτεγερίνης από τους οστεοβλάστες (54), (55). Έτσι, υποστηρίζεται ότι σε άτομα με πολύ μικρά ποσά λίπους τα επίπεδα της αδιπονεκτίνης είναι υψηλά και ευνοείται η δράση των οστεοκλαστών με αποτέλεσμα την οστική απώλεια. Πράγματι, σε μια πρόσφατη μελέτη σε άνδρες άνω των 60 ετών βρέθηκε ότι η ορμόνη αυτή συσχετιζόταν αρνητικά με τη BMD στην οσφυϊκή μοίρα της σπονδυλικής στήλης και στον αυχένα του μηριαίου, αρνητικά με το δείκτη μάζας σώματος και θετικά με την ηλικία (56). Ο συνδυασμός των παραπάνω συσχετίσεων αποτελεί μια ένδειξη ότι η αύξηση των επιπέδων της αδιπονεκτίνης είναι πιθανό αίτιο της ανδρικής (ηλικιοεξαρτώμενης) οστεοπόρωσης.
Εκτός από τους παράγοντες που εκκρίνονται από τα λιποκύτταρα, επηρεάζουν τον οστικό μεταβολισμό και ουσίες που η παραγωγή τους ρυθμίζεται έμμεσα από τη μάζα του λιπώδους ιστού. Χαρακτηριστικό παράδειγμα είναι η ινσουλίνη. Σε περιπτώσεις αυξημένης μάζας λιπώδους ιστού παρατηρείται αντίσταση στην ινσουλίνη. Αντιρροπιστικά, τα β- κύτταρα του παγκρέατος υπερεκκρίνουν ινσουλίνη. Η ακόλουθη υπερινσουλιναιμία προκαλεί αύξηση της παραγωγής των φυλετικών ορμονών και μείωση της παραγωγής της SHBG με τα αποτελέσματα που έχουν προαναφερθεί. Επίσης, τόσο η ίδια η ινσουλίνη όσο και αμυλίνη και η πρεπτίνη, που εκκρίνονται μαζί της, έχουν άμεση αναβολική δράση στους οστεοβλάστες (επάγουν τον πολλαπλασιασμό τους). Τελικά, η αυξημένη ποσότητα λίπους μέσω της τροποποίησης στην εκκριτική λειτουργία των β- κυττάρων αυξάνει την οστική μάζα (52). Στους άνδρες, έχει βρεθεί ότι η ευαισθησία στην ινσουλίνη (που συνοδεύεται από φυσιολογικώς χαμηλά επίπεδα της ορμόνης) σχετίζεται αρνητικά με την οστική πυκνότητα. Στην ίδια μελέτη η εξάρτηση της οστικής πυκνότητας από τη μάζα του λίπους χάθηκε, μετά από την προσαρμογή ως προς την ευαισθησία στην ινσουλίνη, υποδηλώνοντας ότι η σχέση λίπους – οστικής πυκνότητας διαμεσολαβείται από τη δράση της ινσουλίνης (57). Λαμβάνοντας υπόψη τα παραπάνω, μπορούμε να θεωρήσουμε ότι καταστάσεις σχετικής ινσουλινοπενίας μπορούν να συνοδεύονται από χαμηλή οστική μάζα και πιθανόν να εξηγούν, κατά ένα μέρος, την παθογένεια της πρωτοπαθούς ανδρικής οστεοπόρωσης.
4.2. Δευτεροπαθής ανδρική οστεοπόρωση
Η δευτεροπαθής οστεοπόρωση λόγω κορτικοστεροειδών και κατάχρησης οινοπνεύματος αναλύονται εκτενώς σε άλλα κεφάλαια.
4.2.1. Οστεοπόρωση από υπογοναδισμό
Πέρα από την ηλικιοεξαρτώμενη έκπτωση στην παραγωγή των ανδρογόνων που, εξηγεί, κατά ένα μέρος, την εμφάνιση της πρωτοπαθούς ανδρικής οστεοπόρωσης, η σημαντική μείωσή τους, που παρατηρείται στον έκδηλο υπογοναδισμό, αποτελεί συχνό αίτιο δευτεροπαθούς οστεοπόρωσης. Οι κατώτερες φυσιολογικές τιμές της ολικής τεστοστερόνης στον ορό είναι αντικείμενο διαφωνίας. Η Endocrine Society συστήνει τα 300 ng/dl (10,4 nmol/lt), η American Association of Clinical Endocrinologists τα 200 ng/dl και οι International Society of Andrology (ISA), International Society for the Study of Ageing Male (ISSAM), European Association of Urology (EAU), European Academy of Andrology (EAA), American Society of Andrology (ASA) τα 230 ng/dl (58). Τα κυριότερα αίτια της ανδρογονικής ανεπάρκειας στους άνδρες εμφανίζονται στον πίνακα 3. Οι άνδρες με χαμηλά επίπεδα τεστοστερόνης μπορεί να παρουσιάζουν διάφορα σημεία και συμπτώματα, όπως μειωμένη σεξουαλική επιθυμία, διαταραχές της στύσης, ελάττωση της μυικής μάζας και ισχύος, κατάθλιψη, χρόνια κόπωση, διαταραχές του ύπνου, αύξηση του λίπους και χαμηλή οστική μάζα (58), (59).
Ο ρόλος της τεστοστερόνης στον οστίτη ιστό έχει αναφερθεί παραπάνω. Το μεγάλο πλήθος των μελετών που αναδεικνύουν τον κυρίαρχο ρόλο των οιστρογόνων στον οστικό μεταβολισμό οδηγεί στο λογικό συμπέρασμα ότι η οστική απώλεια που επιφέρει ο υπογοναδισμός οφείλεται, κατά ένα μεγάλο μέρος, στη μειωμένη παραγωγή αυτών (60). Κρίσιμο σημείο αποτελεί ο χρόνος που παρουσιάζεται η ένδεια των ανδρογόνων. Αν εμφανιστεί πριν την εφηβεία, οι συνέπειες είναι βαρύτερες, μια και εμποδίζεται η επίτευξη της μέγιστης δυνατής οστικής μάζας. Το γεγονός αυτό καθιστά τους νεαρούς υπογοναδικούς άνδρες περισσότερο ευάλωτους στις αλλαγές που επιφέρει το πέρασμα της ηλικίας στα οστά και, σε συνδυασμό με την απώλεια των ευεργετικών εξωσκελετικών δράσεων των ανδρογόνων, επιρρεπείς στις πτώσεις και τα κατάγματα.
5. Διάγνωση
Η διάγνωση της οστεοπόρωσης στους άνδρες βασίζεται στις ίδιες θεμελιώδεις αρχές όπως και η διάγνωση άλλων νόσων: ιστορικό, κλινική εξέταση, παρακλινικός έλεγχος. Τα παραπάνω θα εξυπηρετήσουν ακόμη τη διαφορική διάγνωση, τον εντοπισμό πιθανών αιτιών δευτεροπαθούς οστεοπόρωσης και την εκτίμηση του καταγματικού κινδύνου, που αποτελεί σημαντικό στοιχείο για τη λήψη της θεραπευτικής απόφασης.
5.1. Ιστορικό και κλινική εξέταση
Από το ιστορικό αναζητείται η ύπαρξη παραγόντων κινδύνου για οστική απώλεια, αλλά και οστεοπορωτικό κάταγμα, καθώς και η ύπαρξη άτυπων συμπτωμάτων, όπως ραχιαλγία (ενδεικτική πιθανής σπονδυλικής παραμόρφωσης) και απώλεια ύψους (ενδεικτική πολλαπλών σπονδυλικών παραμορφώσεων) ή συμπτωμάτων νόσων που προκαλούν δευτεροπαθή ανδρική οστεοπόρωση και δεν έχουν διαγνωστεί ακόμη. Συστήνεται να επιμένουμε σε ερωτήσεις για το οικογενειακό – κληρονομικό ιστορικό, το ιστορικό προηγούμενου κατάγματος στον ίδιο τον ασθενή ή τους γονείς του, παλαιών ή παρουσών νόσων, τη χρήση φαρμάκων, τις συνήθειες του τρόπου ζωής (διαιτητικές, κάπνισμα, αλκοόλ, άσκηση) και το ιστορικό πτώσεων (4).
Μια πρόσφατη συστηματική ανασκόπηση της διεθνούς βιβλιογραφίας για να αναδειχθούν οι πιο σημαντικοί παράγοντες κινδύνου για κατάγματα που σχετίζονται με χαμηλή BMD σε άνδρες κατέληξε στο συμπέρασμα ότι οι πιο ισχυροί παράγοντες κινδύνου είναι η ηλικία άνω των 70 ετών, το μικρό σωματικό βάρος (δείκτης μάζας σώματος < 20 kg/m2), η απώλεια σωματικού βάρους (>10% του αρχικού), η μειωμένη σωματική δραστηριότητα και το προηγούμενο οστεοπορωτικό κάταγμα. Λιγότερο αξιόπιστα ήταν τα δεδομένα για άλλους παράγοντες όπως το κάπνισμα (μέτρια ισχυρός παράγοντας κινδύνου για απώλεια BMD και λιγότερο σημαντικός παράγοντας κινδύνου για κάταγμα) και την κατανάλωση οινοπνεύματος (μέτρια ισχυρός παράγοντας κινδύνου για κάταγμα και λιγότερο σημαντικός παράγοντας κινδύνου για απώλεια BMD) (61).
Η κλινική εξέταση, συνήθως, δεν έχει να προσφέρει πολλά στη διάγνωση της ανδρικής οστεοπόρωσης, μια και η νόσος σπάνια εμφανίζει σημεία. Συνήθως το κάταγμα αποτελεί την πρώτη κλινική εκδήλωση της πάθησης και είναι και ο λόγος που ωθεί τον άνδρα ασθενή σε διαγνωστική για οστεοπόρωση διαδικασία. Κυφωτικές παραμορφώσεις της σπονδυλικής στήλης ή εντοπισμένο άλγος κατά την ψηλάφηση των σπονδύλων μπορεί να σημειωθούν και να οδηγήσουν στην περαιτέρω διερεύνηση. Πρέπει να αναζητούνται σημεία νόσων που προκαλούν δευτεροπαθή οστεοπόρωση και να μετρώνται οι ανθρωπομετρικοί δείκτες, δηλαδή το ύψος και το σωματικό βάρος, και να υπολογίζεται ο δείκτης μάζας σώματος (4).
5.2. Παρακλινικός έλεγχος
Ο παρακλινικός έλεγχος περιλαμβάνει την οστική πυκνομετρία, τον ακτινολογικό έλεγχο για σπονδυλικές παραμορφώσεις, εργαστηριακές εξετάσεις αίματος και ούρων και σε σπάνιες περιπτώσεις την ιστομορφομετρία μετά από οστική βιοψία.
5.2.1. Οστική πυκνομετρία
Η οστική πυκνομετρία με τη μέθοδο της απορροφησιομετρίας ακτίνων Χ διπλής ενέργειας (DXA) είναι η κατεξοχήν μέθοδος για τη διάγνωση της ανδρικής οστεοπόρωσης. Σύμφωνα με τις επίσημες θέσεις της Διεθνούς Κοινότητας για την Κλινική Πυκνομετρία (ISCD, 2007), ένδειξη για μέτρηση της BMD έχουν άνδρες 70 ετών και άνω, καθώς και άνδρες κάτω των 70 με κλινικούς παράγοντες κινδύνου για κάταγμα. Επίσης, ένδειξη υπάρχει για οποιονδήποτε άνδρα έχει υποστεί κάταγμα ευθραυστότητας, πάσχει από νόσο ή βρίσκεται σε κατάσταση ή λαμβάνει θεραπεία που σχετίζεται με χαμηλή BMD ή οστική απώλεια, πρόκειται να λάβει αντιοστεοπορωτική θεραπεία, λαμβάνει αντιοστεοπορωτική θεραπεία (προκειμένου να εκτιμηθεί το θεραπευτικό αποτέλεσμα) και, τέλος, για οποιονδήποτε η ευρισκόμενη οστική απώλεια θα οδηγήσει σε απόφαση για θεραπεία (3). Συστήνεται η χρήση βάσης δεδομένων νεαρών ενήλικών ανδρών Καυκάσιας φυλής για τον υπολογισμό των T – scores (3).
Για τη μέτρηση με DXA ακολουθείται η ταξινόμηση του ΠΟΥ με βάση το T – score, αλλά αυτή ισχύει μόνο για τους άνδρες άνω των 50 ετών. Για άνδρες κάτω από αυτήν την ηλικία χρησιμοποιείται το Ζ – score και με όριο την τιμή -2 κάνουμε τη διάκριση σε «τιμές εντός των αναμενόμενων για την ηλικία ορίων» (Ζ – score > -2) και «τιμές εκτός των αναμενόμενων για την ηλικία ορίων» (Ζ – score ≤ -2) και δεν κάνουμε λόγο για οστεοπόρωση και οστεοπενία (χαμηλή οστική μάζα). Για τη διάγνωση της οστεοπόρωσης με τη μέθοδο DXA αξιολογούνται τα T – score της ΟΜΣΣ, του ολικού ισχίου, του αυχένα του μηριαίου και του 33% της κερκίδας. Η σύσταση της ISCD είναι να μετρώνται οπωσδήποτε η ΟΜΣΣ και οποιοδήποτε ισχίο, ενώ η μέτρηση στη μη επικρατούσα κερκίδα να γίνεται σε περίπτωση που δεν είναι δυνατή η μέτρηση στα παραπάνω σημεία ή σε υπερπαραθυρεοειδικούς ασθενείς ή σε πολύ παχύσαρκους (πάνω από το όριο βάρους του τραπεζιού της συσκευής) (3).
Οι υπόλοιπες μέθοδοι οστικής πυκνομετρίας [QCT, pQCT, περιφερική DXA (pDXA), ποσοτική υπερηχοτομογραφία (QUS)] δε μπορούν να χρησιμοποιηθούν για τη διάγνωση της οστεοπόρωσης στους άνδρες (με την εξαίρεση της pDXA στην κερκίδα). Παρόλα αυτά, η BMD του σπογγώδους στην ΟΜΣΣ, όπως αυτή προκύπτει από μέτρηση με QCT, μπορεί να χρησιμοποιηθεί για παρακολούθηση αλλαγών που έχουν σχέση με την ηλικία, κάποια νόσο ή θεραπεία, ενώ η ολική BMD και η BMD του σπογγώδους, όπως αυτή προκύπτει από μέτρηση με pQCT στην άπω κερκίδα, μπορεί να χρησιμεύσει στην παρακολούθηση των ηλικιοεξαρτώμενων αλλαγών στη BMD. Επίσης, η QUS στην πτέρνα μπορεί να προβλέψει κάταγμα ευθραυστότητας (ισχίου και μη σπονδυλικό) σε άνδρες άνω των 65 ετών ανεξάρτητα από τη BMD στη DXA. Ακόμα, τόσο τα αποτελέσματα της QUS, όσο και της pDXA, αν συνυπολογιστούν με κλινικούς παράγοντες κινδύνου, μπορούν να οδηγήσουν στην αναγνώριση ατόμων με πολύ χαμηλό κίνδυνο για κάταγμα στους οποίους δε θα χρειαστεί καμιά άλλη διαγνωστική διαδικασία, ενώ σε περιπτώσεις που δε μπορεί να γίνει DXA, μπορούν να οδηγήσουν στην απόφαση για θεραπεία, αν αυτός ο κίνδυνος είναι πολύ μεγάλος (3).
5.2.2. Απλή ακτινογραφία
Ο έλεγχος με απλή ακτινογραφία της σπονδυλικής στήλης χρησιμοποιείται για να συμπληρώσει την κλινική εξέταση, αποσαφηνίζοντας το αν υπάρχει σπονδυλικό κάταγμα και παραμόρφωση ή όχι επί παρουσίας ραχιαλγίας. Επίσης, μπορεί να αποκαλύψει «σιωπηλές» σπονδυλικές παραμορφώσεις και να βοηθήσει στη διαφορική διάγνωση από άλλες ομοιάζουσες καταστάσεις όπως η νόσος του Sheuermann (4). Τέλος, η απλή ακτινογραφία (σε οποιοδήποτε σημείο του σκελετού) είναι αρκετές φορές το έναυσμα για την περεταίρω διερεύνηση, αφού είναι δυνατό να αναδείξει αραιωτικά οστά.
5.2.3. Εργαστηριακός έλεγχος αίματος και ούρων
Ο εργαστηριακός έλεγχος με εξετάσεις αίματος και ούρων χρησιμοποιείται κυρίως σε άνδρες με χαμηλή BMD ή κάταγμα ευθραυστότητας για να διαλευκανθούν τα αίτια της διαταραχής του οστικού μεταβολισμού. Με βάση τα αποτελέσματά του γίνεται η διαφορική διάγνωση από άλλες οστεοπενικές καταστάσεις, όπως η οστεομαλακία, και η εξακρίβωση του δευτεροπαθούς αιτίου της οστεοπόρωσης, αν υπάρχει.
Στην περίπτωση που από το ιστορικό και την κλινική εξέταση δεν έχουν προκύψει στοιχεία που θα κατευθύνουν τον εργαστηριακό έλεγχο, τότε ένα βασικό πακέτο εξετάσεων πρέπει να γίνουν (πίνακας 4). Αυτό θα περιλαμβάνει γενική αίματος, ταχύτητα καθίζησης ερυθρών, ασβέστιο και αλβουμίνη ορού (για υπολογισμό του βιοδιαθέσιμου ασβεστίου), κρεατινίνη ορού (κυρίως για να ελεγχθεί η νεφρική λειτουργία), φωσφόρο ορού, αλκαλική φωσφατάση ορού (και το οστικό της κλάσμα), τρανσαμινάσες και φερριτίνη (για να αποκλειστεί η αιμοχρωμάτωση και η χρόνια ηπατική βλάβη), 25(ΟΗ)βιταμίνη D, παραθορμόνη, τεστοστερόνη ορού, θυρεοτρόπο ορμόνη (για να αποκλειστεί ο υπερπαραθυρεοειδισμός, ο υπογοναδισμός και ο υπερθυρεοειδισμός, αντίστοιχα), ηλεκτροφόρηση πρωτεϊνών αίματος και ούρων (για αποκλεισμό του πολλαπλού μυελώματος) και προστατικό αντιγόνο (PSA). Τέλος, το ασβέστιο και η κρεατινίνη ούρων 24ώρου πρέπει να μετρηθούν για τον αποκλεισμό της ιδιοπαθούς υπερασβεστιουρίας (Ca U 24h > 300 mg) και της υπασβεστιουρίας (Ca U 24h < 100 mg), που είναι ενδεικτική χαμηλής πρόσληψης ή διαταραγμένης απορρόφησης του ασβεστίου (με την προϋπόθεση της μη λήψης ασβεστιοσυντηρητικών διουρητικών).
Μια δεύτερη ομάδα εξετάσεων θα πρέπει να γίνουν στην περίπτωση που ο παραπάνω έλεγχος δεν αναδείξει την αιτιολογία της διαταραχής του οστικού μεταβολισμού (πίνακας 4). Η ελεύθερη κορτιζόλη ούρων 24ώρου θα αναδείξει την ύπαρξη συνδρόμου Cushing ή όχι, ενώ η Ν – μεθυλισταμίνη των ούρων θα μας βοηθήσει στη διάγνωση της μαστοκύττωσης. Επίσης, η αναζήτηση αντισωμάτων κατά της τρανσγλουταμινάσης και του ενδομυίου θα οδηγήσει στη διάγνωση της κοιλιοκάκης. Στην περίπτωση ανδρών με ανδρογονική ανεπάρκεια θα πρέπει να καθοριστούν τα επίπεδα της ωχρινοποιητικής ορμόνης (LH) και της προλακτίνης στον ορό για να είναι δυνατή η διαφοροδιάγνωση μεταξύ πρωτοπαθούς και δευτεροπαθούς υπογοναδισμού και για να εντοπιστεί ένα πιθανό προλακτίνωμα. Τέλος, στη διεθνή βιβλιογραφία υπάρχει διχογνωμία για το αν θα πρέπει στον εργαστηριακό έλεγχο των ανδρών με χαμηλή οστική πυκνότητα να περιλαμβάνονται μετρήσεις της οιστραδιόλης και της SHBG (και κατ‘ επέκταση της βιοδιαθέσιμης οιστραδιόλης και τεστοστερόνης).
Οι βιοχημικοί δείκτες του οστικού μεταβολισμού, αν και φαίνεται ότι σχετίζονται με τον καταγματικό κίνδυνο και στους άνδρες και μάλιστα ανεξάρτητα από τη BMD (62), δε χρησιμοποιούνται για τη διάγνωση, αλλά κυρίως για την παρακολούθηση των οστεοπορωτικών ανδρών και την διαπίστωση της ανταπόκρισης ή μη στη θεραπεία (63).
5.2.4. Ιστομορφομετρία
Η ιστομορφομετρία είναι, μάλλον, η πιο αξιόπιστη μέθοδος για τη διάγνωση της οστεοπόρωσης και τη διαφοροδιάγνωση από άλλες διαταραχές του οστικού μεταβολισμού όπως η οστεομαλακία και οστική αδυναμική νόσος. Ο περιορισμός στη χρήση της οφείλεται στο γεγονός ότι προϋποθέτει τη βιοψία οστού (συνήθως της λαγόνιας ακρολοφίας) και έτσι χρησιμοποιείται σπάνια, σε περιπτώσεις σοβαρής οστεοπόρωσης που με τον παραπάνω έλεγχο δεν έχει ανευρεθεί το αίτιο.
Μια πρακτική σύνοψη των παραπάνω αποτελεί ο αλγόριθμος της εικόνας 5.

Εικόνα 5. Αλγόριθμος διαγνωστικής προσέγγισης άνδρα με πιθανή οστεοπόρωση
6. Πρόληψη
Η πρόληψη της οστεοπόρωσης στους άνδρες δε διαφέρει στις γενικές κατευθύνσεις από την πρόληψη της γυναικείας οστεοπόρωσης. Οι κύριοι άξονες είναι δύο: έλεγχος των δευτεροπαθών αιτίων της νόσου και τροποποίηση του τρόπου ζωής (τροποποίηση του διαιτολογίου ώστε να προσλαμβάνονται από τις τροφές τα απαραίτητα θρεπτικά συστατικά με προεξάρχουσα την επαρκή πρόσληψη ασβεστίου, επαρκής έκθεση στον ήλιο, ώστε να είναι δυνατή η ικανοποιητική παραγωγή βιταμίνης D από τον οργανισμό, διακοπή συνηθειών που εμπλέκονται στην απώλεια της οστικής μάζας και την αύξηση του καταγματικού κινδύνου, όπως το κάπνισμα και η υπερκατανάλωση οινοπνεύματος, άσκηση).
Η θεραπεία νόσων που προκαλούν δευτεροπαθή οστεοπόρωση είναι αυτονόητο ότι προλαμβάνει την εμφάνιση της πάθησης στους άνδρες. Σε εκείνες τις περιπτώσεις που οι παράγοντες που δυνητικά προκαλούν οστεοπόρωση δεν είναι δυνατό να αρθούν, πχ λήψη κορτικοστεροειδών, η πρόληψη επιτυγχάνεται με αγωγή με φάρμακα που συζητούνται παρακάτω.
Ο ρόλος του ασβεστίου και της βιταμίνης D στο μεταβολισμό των οστών είναι γνωστός και δε θα αναλυθεί εδώ. Όταν δεν είναι δυνατή η επίτευξη ικανοποιητικών επιπέδων με τη δίαιτα και την έκθεση στον ήλιο, η χορήγηση συμπληρωμάτων ασβεστίου ή/και βιταμίνης D είναι απαραίτητη. Τα επιθυμητά προσλαμβανόμενα επίπεδα δεν έχουν καθοριστεί ακόμα με σιγουριά για τους άνδρες. Άλλοι υποστηρίζουν ότι 1200mg ασβεστίου την ημέρα συν 800 IU βιταμίνης D είναι αρκετά (US Institute of Medicine), άλλοι ανεβάζουν το βέλτιστο ποσό βιταμίνης D σε 1000 IU την ημέρα (64), ενώ παλιότερα είχε θεωρηθεί ότι σε άνδρες άνω των 65 ετών η ημερήσια πρόσληψη ασβεστίου πρέπει να ξεπερνά τα 1500 mg (65). Τα αποτελέσματα μελετών της δράσης των συμπληρωμάτων ασβεστίου ή/ και βιταμίνης D στον καταγματικό κίνδυνο και τη BMD είναι αντικρουόμενα, όμως δύο πρόσφατες μετα-αναλύσεις υποδεικνύουν ότι ο συνδυασμός των δύο παραγόντων, όντως, μειώνει τον κίνδυνο για κάταγμα τόσο σε άνδρες όσο και σε γυναίκες (66), (67). Γενικά, φαίνεται ότι τα συμπληρώματα αυτά έχουν καλύτερα αποτελέσματα σε άνδρες που έχουν ανεπάρκεια ασβεστίου και βιταμίνης D, που λαμβάνουν γλυκοκορτικοειδή, αντιοστεοκλαστικά ή αναβολική αντιοστεοπορωτική θεραπεία, σε αυτούς που λαμβάνουν 800 IU βιταμίνης D και 1000 – 1200 mg ασβεστίου την ημέρα και σε αυτούς με καλή συμμόρφωση (68).
Τέλος, στα μέτρα για την πρόληψη της ανδρικής οστεοπόρωσης πρέπει να περιλαμβάνεται και η σωστή ενημέρωση, κάτι που στον ελληνικό χώρο είναι ιδιαίτερης σημασίας με δεδομένη την ιδιοσυγκρασιακή ιδιαιτερότητα της πλειοψηφίας των Ελλήνων να αντιμετωπίζουν το συγκεκριμένο θέμα με σχετική αδιαφορία.
7. Θεραπεία
Οι προοπτικές τυχαιοποιημένες μελέτες για αντιοστεοπορωτική θεραπεία αποκλειστικά σε άνδρες είναι πολύ λίγες. Οι περισσότερες αφορούν σε σχετικά μικρούς αριθμούς ανδρών, ενώ μεγάλο τους μειονέκτημα είναι ότι, στην πλειοψηφία τους, το πρωτογενές αντικείμενο μελέτης είναι η μεταβολή στη BMD και όχι η μεταβολή στην επίπτωση των καταγμάτων και τον καταγματικό κίνδυνο. Παρόλα αυτά, συγκεκριμένα φάρμακα έχουν δοκιμαστεί σε άνδρες με ανάλογη αποτελεσματικότητα και ασφάλεια όπως σε μετεμμηνοπαυσιακές γυναίκες. Έτσι, μέχρι στιγμής, ο FDA (Food and Drug Administration) και ο ΕΜΕΑ (European Medicines Agency) έχουν εγκρίνει τη χορήγηση της αλενδρονάτης, της ρισενδρονάτης, του ζολεδρονικού οξέος, της τεριπαρατίδης και του ρανελικού στροντίου για τη θεραπεία της οστεοπόρωσης στους άνδρες. Βέβαια, η φαρμακευτική θεραπεία της ανδρικής οστεοπόρωσης πρέπει να συνδυάζεται με τα μέτρα του προηγούμενου κεφαλαίου και, κυρίως, με την επαρκή πρόσληψη ασβεστίου και βιταμίνης D, η σημασία της οποίας φαίνεται από το γεγονός ότι σε σχεδόν όλες τις μελέτες της θεραπείας της ανδρικής οστεοπόρωσης οι ασθενείς λάμβαναν και συμπληρώματα αυτών των παραγόντων.
7.1. Διφωσφονικά
Τα διφωσφονικά είναι τα πλέον χρησιμοποιούμενα φάρμακα για την πρόληψη και θεραπεία της οστικής απώλειας στους άνδρες. Παρεμβαίνουν στο μονοπάτι του μεβαλονικού οξέος, αναστέλλοντας τη δράση των οστεοκλαστών, μειώνοντας, έτσι, το ρυθμό οστικής εναλλαγής με τελικό αποτέλεσμα την αύξηση της οστικής πυκνότητας.
7.1.1. Αλενδρονάτη
Σε μια μελέτη 241 ανδρών, 31 – 87 ετών, με Τ – score ≤ – 2 (στο μηριαίο ή την ΟΜΣΣ), η p.o. χορήγηση 10 mg αλενδρονάτης την ημέρα (μαζί με 500 mg ασβεστίου και 400 IU βιταμίνης D) οδήγησε μετά από δύο χρόνια σε σημαντική αύξηση στη BMD της ΟΜΣΣ σε σχέση με την ομάδα που έλαβε placebo. Επίσης, αν και η μελέτη δεν ήταν σχεδιασμένη για να αναδείξει την αντικαταγματική δράση του φαρμάκου, φάνηκε ότι οι άνδρες που έλαβαν αλενδρονάτη εμφάνισαν λιγότερα σπονδυλικά κατάγματα από αυτούς που έλαβαν placebo (69). Παρόμοια δράση στη BMD της ΟΜΣΣ και του ισχίου είχε και η εβδομαδιαία p.o. χορήγηση 70 mg αλενδρονάτης, όπως φάνηκε σε άλλη μελέτη έναντι placebo (70). Τέλος, σε μια μικρή open label μελέτη αναδείχθηκε η υπεροχή της ημερήσιας p.o. χορήγησης αλενδρονάτης σε άνδρες με χαμηλή οστική πυκνότητα στην αύξηση της BMD της ΟΜΣΣ και στη μείωση των ακτινολογικών σπονδυλικών καταγμάτων έναντι της αλφακαλσιδόλης μετά από τρία χρόνια θεραπείας (71). Η αλενδρονάτη έχει αποδειχθεί χρήσιμη και στη θεραπεία ανδρών με δευτεροπαθή οστεοπόρωση, όπως η οστεοπόρωση από γλυκοκορτικοειδή (72).
7.1.2. Ρισενδρονάτη
Ανάλογες μελέτες σε άνδρες με αυτές της αλενδρονάτης υπάρχουν και για τη ρισενδρονάτη. Έτσι, σε μια τυχαιοποιημένη διπλή – τυφλή πολυκεντρική μελέτη στην οποία έλαβαν μέρος 284 άνδρες, βρέθηκε ότι η p.o. χορήγηση 35 mg ρισενδρονάτης μια φορά την εβδομάδα, σε συνδυασμό με ημερήσια χορήγηση ασβεστίου και βιταμίνης D, για δύο έτη αύξησε στατιστικά σημαντικά τη BMD στην ΟΜΣΣ σε σχέση με το εικονικό φάρμακο (6% έναντι 1,4% στους 24 μήνες), ενώ ανάλογα ήταν τα αποτελέσματα και στα άλλα σημεία μέτρησης της BMD. Μάλιστα, η δράση της ρισενδρονάτης ήταν ταχεία, όπως φάνηκε από την καταπίεση των δεικτών της οστικής εναλλαγής από το πρώτο τρίμηνο χορήγησης και από τα αποτελέσματα της DXA στο πρώτο εξάμηνο, καθώς και ανεξάρτητη της ηλικίας και του ιστορικού προηγούμενου σπονδυλικού κατάγματος. Παρόλα αυτά δεν παρατηρήθηκε διαφορά στην επίπτωση νέων σπονδυλικών καταγμάτων (73). Παρόμοια επίδραση στη BMD είχε και η ημερήσια p.o. δόση των 5 mg (μαζί με συμπληρώματα ασβεστίου και βιταμίνης D) σε μια διετή τυχαιοποιημένη open label μελέτη 316 ανδρών με πρωτοπαθή και δευτεροπαθή οστεοπόρωση (74). Σε αυτή τη μελέτη, όμως, αναδείχθηκε και ο αντικαταγματικός ρόλος του φαρμάκου μια και παρατηρήθηκε μειωμένο ποσοστό σπονδυλικών και μη σπονδυλικών καταγμάτων μεταξύ αυτών που έλαβαν ρισενδρονάτη και αυτών που δεν έλαβαν (9,2% και 11,8% έναντι 23,6% και 22,3%, αντίστοιχα). Τέλος, σε μια μελέτη 280 ανδρών, άνω των 65 ετών, που είχαν υποστεί αγγειακό εγκεφαλικό επεισόδιο, η ημερήσια p.o. χορήγηση ρισενδρονάτης μείωσε τον κίνδυνο για κάταγμα ισχίου σε σχέση με το placebo (75).
7.1.3. Ζολεδρονικό οξύ
Τα ενδοφλεβίως χορηγούμενα διφωσφονικά, όπως το ζολεδρονικό οξύ, έχουν το πλεονέκτημα ότι ολόκληρη η δόση τους είναι βιοδιαθέσιμη, μπορούν να χορηγηθούν σε άτομα που αδυνατούν να λάβουν φάρμακα από το στόμα, δεν εμφανίζουν συχνά ανεπιθύμητες ενέργειες από το πεπτικό και οι ασθενείς συμμορφώνονται καλώς, μια και χορηγούνται με αραιά μεσοδιαστήματα (στην προκειμένη περίπτωση συνήθως ετησίως). Στη μελέτη HORIZON (Health Outcomes and Reduced Incidence with Zoledronic acid ONce yearly) 2127 άτομα εκ των οποίων το 24% ήταν άνδρες τυχαιοποιήθηκαν για την ετήσια ενδοφλέβια χορήγηση είτε 5 mg ζολεδρονικού οξέος είτε εικονικού φαρμάκου. Οι συμμετέχοντες είχαν υποστεί κάταγμα ισχίου χαμηλής βίας (το οποίο αντιμετωπίστηκε χειρουργικά) και έλαβαν την πρώτη δόση του φαρμάκου μέσα στις πρώτες 90 ημέρες από το χειρουργείο. Στους 36 μήνες όσοι έλαβαν ζολεδρονικό οξύ είχαν αυξήσει σημαντικά τη BMD στο ισχίο σε σχέση με αυτούς που έλαβαν εικονικό φάρμακο. Το σημαντικότερο, όμως, ήταν ότι στην ομάδα του ζολεδρονικού οξέος παρατηρήθηκε και σημαντική μείωση στην εμφάνιση νέων κλινικών καταγμάτων σε σχέση με την ομάδα του placebo (35%, 46% και 27% μείωση του καταγματικού κινδύνου για οποιοδήποτε κάταγμα, σπονδυλικό και μη σπονδυλικό κάταγμα, αντίστοιχα), καθώς και μείωση στους θανάτους από οποιαδήποτε αιτία κατά 28% (76). Η έγκριση για τη χρήση του ζολεδρονικού οξέος στη θεραπεία της ανδρικής οστεοπόρωσης από τον FDA βασίστηκε, κυρίως, στα αποτελέσματα μιας πολυκεντρικής, διπλής – τυφλής, τυχαιοποιημένης μελέτης κατά την οποία 302 άνδρες έλαβαν είτε p.o. 70 mg αλενδρονάτης την εβδομάδα είτε 5 mg ζολεδρονικού οξέος ενδοφλεβίως το χρόνο για δύο έτη. Σύμφωνα με τους ερευνητές το ζολεδρονικό οξύ προκαλούσε παρόμοια αύξηση της BMD στην ΟΜΣΣ και το ισχίο και ανάλογη μείωση των δεικτών της οστικής εναλλαγής σε σχέση με την αλενδρονάτη, με τη διαφορά ότι το 74% των συμμετεχόντων προτιμούσαν τη θεραπεία με ζολεδρονικό οξύ, κυρίως λόγω του ετήσιου σχήματος χορήγησης (77). Τέλος, σε μια πρόσφατη μελέτη 1199 ανδρών 50 – 85 ετών με πρωτοπαθή ή δευτεροπαθή λόγω υπογοναδισμού οστεοπόρωση η θεραπεία με 5 mg ζολεδρονικού οξέος ενδοφλεβίως μια φορά ετησίως μείωσε τον κίνδυνο για νέα μορφομετρικά σπονδυλικά κατάγματα κατά 67% σε σχέση με το εικονικό φάρμακο (78).
7.2. Τεριπαρατίδη
Η παρατήρηση ότι η διακεκομμένη χορήγηση παραθορμόνης (PTH) έχει ευεργετικά αποτελέσματα στην οστική πυκνότητα, σε αντίθεση με την οστική απώλεια που προκαλεί η συνεχής έκθεση σε υψηλά επίπεδα της ορμόνης, οδήγησε στη δημιουργία της 1-34 PTH ή τεριπαρατίδης, του μοναδικού αναβολικού φαρμάκου για τη θεραπεία της οστεοπόρωσης. Η τεριπαρατίδη έχει ένδειξη χορήγησης σε οστεοπορωτικούς άνδρες με υψηλό κίνδυνο κατάγματος. Στη μεγαλύτερη, μέχρι σήμερα, σειρά ανδρών που έχει αναφερθεί σε μελέτη για την τεριπαρατίδη, 437 άνδρες με χαμηλή οστική πυκνότητα πρωτοπαθώς ή λόγω υπογοναδισμού τυχαιοποιήθηκαν για τη λήψη placebo ή 20 μg ή 40 μg τεριπαρατίδης την ημέρα υποδορίως μαζί με p.o. συμπληρώματα ασβεστίου και βιταμίνης D (79). Η μέση διάρκεια της θεραπείας ήταν 11 μήνες (από 2 ως 15 μήνες), γιατί η μελέτη διακόπηκε πρώιμα, λόγω της παρατήρησης ότι η θεραπεία με τεριπαρατίδη προκαλούσε αυξημένη συχνότητα οστεοσαρκώματος σε πειραματόζωα. Οι άνδρες που είχαν λάβει τεριπαρατίδη εμφάνισαν αύξηση της BMD στην ΟΜΣΣ κατά 5,9% (20 μg) και 9,0% (40 μg), τιμές στατιστικά σημαντικές σε σχέση με αυτές των ασθενών που έλαβαν εικονικό φάρμακο. Μάλιστα, το θεραπευτικό αποτέλεσμα της τεριπαρατίδης ήταν εμφανές από το τρίτο τρίμηνο χορήγησης, όπως διαπιστώθηκε από τις μετρήσεις των βιοχημικών δεικτών του οστικού μεταβολισμού και τις μετρήσεις τις οστικής πυκνότητας. Στην επέκταση της μελέτης έλαβαν μέρος 355 άνδρες, οι οποίοι παρακολουθήθηκαν για 30 μήνες ακόμα (80). Ένα ποσοστό από αυτούς συνέχισε αντιοστεοπορωτική αγωγή με διφωσφονικά ή θεραπεία με τεστοστερόνη, ενώ άλλοι συνέχισαν χωρίς θεραπεία. Παρατηρήθηκε ότι οι τιμές της BMD στην ΟΜΣΣ και το ισχίο και για τις δύο ομάδες της τεριπαρατίδης ήταν σημαντικά μεγαλύτερες σε σχέση με αυτές της ομάδας του placebo, τόσο στους 18 όσο και στους 30 μήνες της παρακολούθησης, αν και διαπιστώθηκε σταδιακή μείωση της BMD μετά τη διακοπή της θεραπείας. Επίσης, όσοι συνέχισαν τη θεραπεία με διφωσφονικά παρουσίασαν περεταίρω αύξηση της BMD τόσο στην ΟΜΣΣ όσο και στο ισχίο. Τέλος, η επίπτωση των νέων σπονδυλικών καταγμάτων στο πέρας της μελέτης ήταν μικρότερη σε αυτούς που είχαν λάβει τεριπαρατίδη σε σχέση με αυτούς που είχαν λάβει εικονικό φάρμακο (5,4% για την ομάδα των 20 μg, 6,0% για την ομάδα των 40 μg και 11,7% για την ομάδα του placebo), ενώ όσον αφορούσε στα μετρίου και σοβαρού βαθμού κατάγματα η επίπτωση ήταν μειωμένη κατά 83% στους προηγούμενους χρήστες τεριπαρατίδης.
7.3. Denosumab
Πρόσφατα, ένα νέο φάρμακο προστέθηκε στη θεραπευτική μας φαρέτρα κατά της οστικής απώλειας. Το denosumab είναι ένα μονοκλωνικό αντίσωμα κατά του RANKL και δεσμεύοντας αυτόν τον παράγοντα προκαλεί καταστολή της οστεοκλαστογένεσης και της οστεοκλαστικής δραστηριότητας. Η χορήγησή του έχει εγκριθεί σε άνδρες με καρκίνο του προστάτη και οστική απώλεια, λόγω θεραπείας καταστολής των ανδρογόνων. Η έγκριση δόθηκε με βάση τα αποτελέσματα μιας πολυκεντρικής (156 ερευνητικά κέντρα σε Β. Αμερική και Ευρώπη), τυχαιοποιημένης, διπλής – τυφλής μελέτης κατά την οποία 1468 άνδρες με ορμονοευαίσθητο, μη μεταστατικό καρκίνο του προστάτη, υπό θεραπεία καταστολής των ανδρογόνων τυχαιοποιήθηκαν να λάβουν είτε 60 mg denosumab υποδορίως ανά εξάμηνο είτε εικονικό φάρμακο, αρχικά για 24 και στη συνέχεια για 36 μήνες (81). Στους 24 μήνες οι ασθενείς της ομάδας του denosumab εμφάνισαν αύξηση στη BMD της ΟΜΣΣ κατά 5,6%, ενώ αυτοί που έλαβαν placebo παρουσίασαν μείωση κατά 1%. Ανάλογα ήταν και τα αποτελέσματα από το ισχίο και την κερκίδα. Επιπρόσθετα, εντυπωσιακή ήταν η μείωση του καταγματικού κινδύνου στην ομάδα του denosumab: στους 36 μήνες οι ασθενείς που είχαν λάβει denosumab εμφάνισαν 62% μικρότερη επίπτωση νέων σπονδυλικών καταγμάτων σε σχέση με αυτούς της ομάδας του εικονικού φαρμάκου.
7.4. Ρανελικό στρόντιο
Το ρανελικό στρόντιο, αν και χρησιμοποιείται στη θεραπεία της μετεμμηνοπαυσιακής οστεοπόρωσης αρκετά χρόνια, εγκρίθηκε πολύ πρόσφατα για την αντιμετώπιση της ανδρικής οστεοπόρωσης από τον ΕΜΕΑ. Σε μια πρόσφατη open- label μελέτη, 152 άνδρες με πρωτοπαθή οστεοπόρωση τυχαιοποιήθηκαν για την p.o. λήψη είτε 2 g ρανελικού στροντίου την ημέρα είτε 70 mg αλενδρονάτης την εβδομάδα για 12 μήνες (82). Αυτοί που έλαβαν ρανελικό στρόντιο εμφάνισαν 22% μεγαλύτερη αύξηση της BMD στην ΟΜΣΣ και 23% στο ισχίο σε σχέση με όσους έλαβαν αλενδρονάτη, ενώ είχαν και μεγαλύτερη μείωση του άλγους στην πλάτη. Σε άλλη πολυκεντρική διπλή-τυφλή μελέτη στην οποία βασίστηκε και η έγκριση από τον ΕΜΕΑ 261 άνδρες με χαμηλή οστική μάζα τυχαιοποιήθηκαν για τη λήψη είτε 2 g ρανελικού στροντίου από το στόμα ημερησίως είτε εικονικού φαρμάκου. Μετά από ένα χρόνο θεραπείας, παρατηρήθηκε στατιστικά σημαντική αύξηση της BMD στην ΟΜΣΣ και το ισχίο στην ομάδα του στροντίου σε σχέση με την ομάδα του εικονικού φαρμάκου [5,3%±0,75 (p<0,001) και 2,9%±0,62 (p<0,001), αντίστοιχα](83). Οι μέσες τιμές της αύξησης της BMD στα σημεία μέτρησης ήταν παρόμοιες με αυτές που έχουν αναφερθεί και σε μετεμμηνοπαυσιακές γυναίκες, υποδηλώνοντας ότι είναι πιθανή και ανάλογη αντικαταγματική δράση του ρανελικού στροντίου στους οστεοπορωτικούς άνδρες.
7.5. Τεστοστερόνη
Η θεραπεία ορμονικής υποκατάστασης σε υπογοναδικούς άνδρες προκαλεί, εκτός των υπόλοιπων ευεργετικών δράσεων της, πρόληψη της οστικής απώλειας ή ακόμα και αύξηση της οστικής μάζας, τουλάχιστον σε περιοχές σπογγώδους οστού (84). Σε άνδρες με τιμές ολικής τεστοστερόνης εντός των φυσιολογικών ορίων η χορήγηση της ορμόνης δε φαίνεται να έχει θετικά αποτελέσματα στη BMD. Οι περισσότερες μελέτες που αφορούν στο θέμα είναι μικρής διάρκειας και παρουσιάζουν αρκετά προβλήματα στο σχεδιασμό, όπως το μικρό αριθμό των συμμετεχόντων. Σε μια από τις μεγαλύτερες, 108 άνδρες άνω των 65 ετών με επίπεδα ολικής τεστοστερόνης στις κατώτερες φυσιολογικές τιμές τυχαιοποιήθηκαν για τη διαδερμική χορήγηση τεστοστερόνης ή placebo με αυτοκόλλητο επίθεμα για 36 μήνες (85). Αν και η οστική πυκνότητα στην ΟΜΣΣ αυξήθηκε στην ομάδα της τεστοστερόνης, κάτι ανάλογο παρατηρήθηκε και στην ομάδα του placebo με αποτέλεσμα να μην αναδειχθεί υπεροχή της ορμονικής υποκατάστασης στην αύξηση της BMD. Η θεραπεία είχε πολύ μικρό αποτέλεσμα σε αυτούς που στην αρχή της μελέτης είχαν επίπεδα τεστοστερόνης 400 ng/dl, ενώ ήταν σαφώς πιο ευεργετική σε αυτούς που ξεκίνησαν με επίπεδα της τάξης των 200 ng/dl. Αντίθετα, σε μια πιο πρόσφατη μελέτη 70 ανδρών άνω των 65 ετών με ολική τεστοστερόνη κάτω από 12,1 nmol/l η ενδομυϊκή χορήγηση 200 mg τεστοστερόνης ανά δύο εβδομάδες για 36 μήνες προκάλεσε στατιστικά σημαντική αύξηση της BMD τόσο στο ισχίο όσο και στην ΟΜΣΣ σε σχέση με το εικονικό φάρμακο (86). Παρόλο που η ορμονική υποκατάσταση φαίνεται να έχει ευεργετικά αποτελέσματα στην οστική πυκνότητα ανδρών με οριακά φυσιολογική ολική τεστοστερόνη, δεν υπάρχουν δεδομένα ούτε για την αντικαταγματική της δράση στον πληθυσμό αυτόν ούτε για τη μακροχρόνια ασφαλή χορήγησή της (πχ είναι πιθανό να δημιουργήσει αυξημένο κίνδυνο για καρκίνο του προστάτη και καρδιαγγειακά συμβάμματα). Έτσι, από τους περισσότερους θεωρείται ως θεραπεία δεύτερης γραμμής για την ανδρική οστεοπόρωση με κύρια εφαρμογή σε αυτούς που έχουν χαμηλά επίπεδα τεστοστερόνης και κλινική εικόνα υπογοναδισμού.
7.6. Ποιοι άνδρες πρέπει να λάβουν θεραπεία;
Οι κατευθυντήριες οδηγίες του Εθνικού Οργανισμού Φαρμάκων που αφορούν στη φαρμακολογική θεραπεία της οστεοπόρωσης υπογραμμίζουν ότι υποψήφιοι για θεραπεία είναι οι άνδρες άνω των 50 ετών που έχουν:
Α) υποστεί σπονδυλικό κάταγμα ή/και κάταγμα ισχίου
Β) περισσότερα από ένα έτερα κατάγματα χαμηλής βίας (πχ κάταγμα κερκίδας)
Γ) T – score ≤ -2,5 στον αυχένα του μηριαίου, το ολικό ισχίο ή την ΟΜΣΣ
Δ) χαμηλή οστική μάζα (T – score μεταξύ -1 και -2,5) και κίνδυνο να υποστούν μέσα στην επόμενη δεκαετία κάταγμα ισχίου ≥ 3% ή κάποιο από τα μείζονα οστεοπορωτικά κατάγματα ≥ 20% (όπως αυτός υπολογίζεται με το εργαλείο FRAX)
Ε) χαμηλή οστική μάζα (T – score μεταξύ -1 και -2,5) και κίνδυνο να υποστούν μέσα στην επόμενη δεκαετία κάποιο από τα μείζονα οστεοπορωτικά κατάγματα 10 – 20% (όπως αυτός υπολογίζεται με το εργαλείο FRAX) και τουλάχιστον έναν από τους παρακάτω παράγοντες:
- Κάταγμα καρπού σε ηλικία ≥ 65 ετών
- Οστική πυκνότητα ΟΜΣΣ σημαντικά ελαττωμένη σε σχέση με αυτή του ισχίου
- Σημαντική ελάττωση της οστικής πυκνότητας σε διαδοχικές μετρήσεις με μεσοδιάστημα μεγαλύτερο του ενός έτους (ταχεία απώλεια οστού)
- Αντιανδρογονική θεραπεία για καρκίνο προστάτη
- Μακροχρόνια ή/και επαναλαμβανόμενη συστηματική θεραπεία με γλυκοκορτικοειδή σε δόσεις μικρότερες από αυτές της παρατεταμένης συστηματικής αγωγής με γλυκοκορτικοειδή
- Περισσότερα από δύο επεισόδια πτώσης κατά το τελευταίο έτος, λόγω διαταραχών βάδισης – ισορροπίας, διαταραχών όρασης κτλ.
Βιβλιογραφία
1. WHO. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Technical Report Series. WHO, Geneva. 1994;
2. Looker AC, Orwoll ES, Johnston CC, Jr., Lindsay RL, Wahner HW, Dunn WL, et al. Prevalence of low femoral bone density in older U.S. adults from NHANES III. J Bone Miner Res. 1997;12:1761-1768
3. Baim S, Binkley N, Bilezikian JP, Kendler DL, Hans DB, Lewiecki EM, et al. Official Positions of the International Society for Clinical Densitometry and executive summary of the 2007 ISCD Position Development Conference. J Clin Densitom. 2008;11:75-91
4. Kaufman JM and Goemaere S. Osteoporosis in men. Best Pract Res Clin Endocrinol Metab. 2008;22:787-812
5. NOF. America’s Bone Health: The State of Osteoporosis and Low Bone Mass in Our Nation. Washington, DC: National Osteoporosis Foundation. 2002;
6. Johnell O and Kanis J. Epidemiology of osteoporotic fractures. Osteoporos Int. 2005;16 Suppl 2:S3-7
7. Johnell O and Kanis JA. An estimate of the worldwide prevalence and disability associated with osteoporotic fractures. Osteoporos Int. 2006;17:1726-1733
8. Abrahamsen B, van Staa T, Ariely R, Olson M and Cooper C. Excess mortality following hip fracture: a systematic epidemiological review. Osteoporos Int. 2009;20:1633-1650
9. Endo Y, Aharonoff GB, Zuckerman JD, Egol KA and Koval KJ. Gender differences in patients with hip fracture: a greater risk of morbidity and mortality in men. J Orthop Trauma. 2005;19:29-35
10. Holt G, Smith R, Duncan K, Hutchison JD and Gregori A. Gender differences in epidemiology and outcome after hip fracture: evidence from the Scottish Hip Fracture Audit. J Bone Joint Surg Br. 2008;90:480-483
11. Tosteson AN, Gottlieb DJ, Radley DC, Fisher ES and Melton LJ, 3rd. Excess mortality following hip fracture: the role of underlying health status. Osteoporos Int. 2007;18:1463-1472
12. Pande I, Scott DL, O’Neill TW, Pritchard C, Woolf AD and Davis MJ. Quality of life, morbidity, and mortality after low trauma hip fracture in men. Ann Rheum Dis. 2006;65:87-92
13. Kanis JA and Johnell O. Requirements for DXA for the management of osteoporosis in Europe. Osteoporos Int. 2005;16:229-238
14. Gullberg B, Johnell O and Kanis JA. World-wide projections for hip fracture. Osteoporos Int. 1997;7:407-413
15. Boonen S, Kaufman JM, Goemaere S, Bouillon R and Vanderschueren D. The diagnosis and treatment of male osteoporosis: Defining, assessing, and preventing skeletal fragility in men. Eur J Intern Med. 2007;18:6-17
16. Trovas GP and Lyritis GP. Aetiology in male osteoporosis. J Bone Miner Res. 1997;12:S 370
17. Khosla S, Amin S and Orwoll E. Osteoporosis in men. Endocr Rev. 2008;29:441-464
18. Riggs BL, Melton Iii LJ, 3rd, Robb RA, Camp JJ, Atkinson EJ, Peterson JM, et al. Population-based study of age and sex differences in bone volumetric density, size, geometry, and structure at different skeletal sites. J Bone Miner Res. 2004;19:1945-1954
19. Khosla S, Riggs BL, Atkinson EJ, Oberg AL, McDaniel LJ, Holets M, et al. Effects of sex and age on bone microstructure at the ultradistal radius: a population-based noninvasive in vivo assessment. J Bone Miner Res. 2006;21:124-131
20. Riggs BL, Melton LJ, Robb RA, Camp JJ, Atkinson EJ, McDaniel L, et al. A population-based assessment of rates of bone loss at multiple skeletal sites: evidence for substantial trabecular bone loss in young adult women and men. J Bone Miner Res. 2008;23:205-214
21. Lauretani F, Bandinelli S, Griswold ME, Maggio M, Semba R, Guralnik JM, et al. Longitudinal changes in BMD and bone geometry in a population-based study. J Bone Miner Res. 2008;23:400-408
22. Marshall LM, Lang TF, Lambert LC, Zmuda JM, Ensrud KE and Orwoll ES. Dimensions and volumetric BMD of the proximal femur and their relation to age among older U.S. men. J Bone Miner Res. 2006;21:1197-1206
23. Silva MJ and Gibson LJ. Modeling the mechanical behavior of vertebral trabecular bone: effects of age-related changes in microstructure. Bone. 1997;21:191-199
24. Aaron JE, Makins NB and Sagreiya K. The microanatomy of trabecular bone loss in normal aging men and women. Clin Orthop Relat Res. 1987;260-271
25. Callewaert F, Boonen S and Vanderschueren D. Sex steroids and the male skeleton: a tale of two hormones. Trends Endocrinol Metab. 2010;21:89-95
26. Khosla S, Melton LJ, 3rd, Robb RA, Camp JJ, Atkinson EJ, Oberg AL, et al. Relationship of volumetric BMD and structural parameters at different skeletal sites to sex steroid levels in men. J Bone Miner Res. 2005;20:730-740
27. Orwoll E, Lambert LC, Marshall LM, Phipps K, Blank J, Barrett-Connor E, et al. Testosterone and estradiol among older men. J Clin Endocrinol Metab. 2006;91:1336-1344
28. Gennari L, Merlotti D, Martini G, Gonnelli S, Franci B, Campagna S, et al. Longitudinal association between sex hormone levels, bone loss, and bone turnover in elderly men. J Clin Endocrinol Metab. 2003;88:5327-5333
29. Mellstrom D, Vandenput L, Mallmin H, Holmberg AH, Lorentzon M, Oden A, et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures. J Bone Miner Res. 2008;23:1552-1560
30. Fink HA, Ewing SK, Ensrud KE, Barrett-Connor E, Taylor BC, Cauley JA, et al. Association of testosterone and estradiol deficiency with osteoporosis and rapid bone loss in older men. J Clin Endocrinol Metab. 2006;91:3908-3915
31. Falahati-Nini A, Riggs BL, Atkinson EJ, O’Fallon WM, Eastell R and Khosla S. Relative contributions of testosterone and estrogen in regulating bone resorption and formation in normal elderly men. J Clin Invest. 2000;106:1553-1560
32. Leder BZ, LeBlanc KM, Schoenfeld DA, Eastell R and Finkelstein JS. Differential effects of androgens and estrogens on bone turnover in normal men. J Clin Endocrinol Metab. 2003;88:204-210
33. Khosla S. Estrogen and bone: insights from estrogen-resistant, aromatase-deficient, and normal men. Bone. 2008;43:414-417
34. LeBlanc ES, Nielson CM, Marshall LM, Lapidus JA, Barrett-Connor E, Ensrud KE, et al. The effects of serum testosterone, estradiol, and sex hormone binding globulin levels on fracture risk in older men. J Clin Endocrinol Metab. 2009;94:3337-3346
35. Khosla S. Update in male osteoporosis. J Clin Endocrinol Metab. 2010;95:3-10
36. Amin S, Zhang Y, Felson DT, Sawin CT, Hannan MT, Wilson PW, et al. Estradiol, testosterone, and the risk for hip fractures in elderly men from the Framingham Study. Am J Med. 2006;119:426-433
37. Mellstrom D, Johnell O, Ljunggren O, Eriksson AL, Lorentzon M, Mallmin H, et al. Free testosterone is an independent predictor of BMD and prevalent fractures in elderly men: MrOS Sweden. J Bone Miner Res. 2006;21:529-535
38. Haney EM and Bliziotes MM. Male osteoporosis: new insights in an understudied disease. Curr Opin Rheumatol. 2008;20:423-428
39. Khosla S. Testosterone: more is not always better. J Clin Endocrinol Metab. 2009;94:4665-4667
40. Van Pottelbergh I, Goemaere S and Kaufman JM. Bioavailable estradiol and an aromatase gene polymorphism are determinants of bone mineral density changes in men over 70 years of age. J Clin Endocrinol Metab. 2003;88:3075-3081
41. Giustina A, Mazziotti G and Canalis E. Growth hormone, insulin-like growth factors, and the skeleton. Endocr Rev. 2008;29:535-559
42. Khosla S, Melton LJ, 3rd, Achenbach SJ, Oberg AL and Riggs BL. Hormonal and biochemical determinants of trabecular microstructure at the ultradistal radius in women and men. J Clin Endocrinol Metab. 2006;91:885-891
43. Veldhuis JD and Bowers CY. Human GH pulsatility: an ensemble property regulated by age and gender. J Endocrinol Invest. 2003;26:799-813
44. Amin S, Riggs BL, Melton LJ, 3rd, Achenbach SJ, Atkinson EJ and Khosla S. High serum IGFBP-2 is predictive of increased bone turnover in aging men and women. J Bone Miner Res. 2007;22:799-807
45. Felson DT, Zhang Y, Hannan MT and Anderson JJ. Effects of weight and body mass index on bone mineral density in men and women: the Framingham study. J Bone Miner Res. 1993;8:567-573
46. De Laet C, Kanis JA, Oden A, Johanson H, Johnell O, Delmas P, et al. Body mass index as a predictor of fracture risk: a meta-analysis. Osteoporos Int. 2005;16:1330-1338
47. Cornish J, Callon KE, Bava U, Lin C, Naot D, Hill BL, et al. Leptin directly regulates bone cell function in vitro and reduces bone fragility in vivo. J Endocrinol. 2002;175:405-415
48. Gordeladze JO, Drevon CA, Syversen U and Reseland JE. Leptin stimulates human osteoblastic cell proliferation, de novo collagen synthesis, and mineralization: Impact on differentiation markers, apoptosis, and osteoclastic signaling. J Cell Biochem. 2002;85:825-836
49. Holloway WR, Collier FM, Aitken CJ, Myers DE, Hodge JM, Malakellis M, et al. Leptin inhibits osteoclast generation. J Bone Miner Res. 2002;17:200-209
50. Elefteriou F, Ahn JD, Takeda S, Starbuck M, Yang X, Liu X, et al. Leptin regulation of bone resorption by the sympathetic nervous system and CART. Nature. 2005;434:514-520
51. Takeda S, Elefteriou F, Levasseur R, Liu X, Zhao L, Parker KL, et al. Leptin regulates bone formation via the sympathetic nervous system. Cell. 2002;111:305-317
52. Reid IR. Relationships between fat and bone. Osteoporos Int. 2008;19:595-606
53. Martin A, David V, Malaval L, Lafage-Proust MH, Vico L and Thomas T. Opposite effects of leptin on bone metabolism: a dose-dependent balance related to energy intake and insulin-like growth factor-I pathway. Endocrinology. 2007;148:3419-3425
54. Luo XH, Guo LJ, Xie H, Yuan LQ, Wu XP, Zhou HD, et al. Adiponectin stimulates RANKL and inhibits OPG expression in human osteoblasts through the MAPK signaling pathway. J Bone Miner Res. 2006;21:1648-1656
55. Shinoda Y, Yamaguchi M, Ogata N, Akune T, Kubota N, Yamauchi T, et al. Regulation of bone formation by adiponectin through autocrine/paracrine and endocrine pathways. J Cell Biochem. 2006;99:196-208
56. Basurto L, Galvan R, Cordova N, Saucedo R, Vargas C, Campos S, et al. Adiponectin is associated with low bone mineral density in elderly men. Eur J Endocrinol. 2009;160:289-293
57. Abrahamsen B, Rohold A, Henriksen JE and Beck-Nielsen H. Correlations between insulin sensitivity and bone mineral density in non-diabetic men. Diabet Med. 2000;17:124-129
58. Dandona P and Rosenberg MT. A practical guide to male hypogonadism in the primary care setting. Int J Clin Pract. 2010;64:682-696
59. Yeap BB. Testosterone and ill-health in aging men. Nat Clin Pract Endocrinol Metab. 2009;5:113-121
60. Rochira V, Balestrieri A, Madeo B, Zirilli L, Granata AR and Carani C. Osteoporosis and male age-related hypogonadism: role of sex steroids on bone (patho)physiology. Eur J Endocrinol. 2006;154:175-185
61. Liu H, Paige NM, Goldzweig CL, Wong E, Zhou A, Suttorp MJ, et al. Screening for osteoporosis in men: a systematic review for an American College of Physicians guideline. Ann Intern Med. 2008;148:685-701
62. Meier C, Nguyen TV, Center JR, Seibel MJ and Eisman JA. Bone resorption and osteoporotic fractures in elderly men: the dubbo osteoporosis epidemiology study. J Bone Miner Res. 2005;20:579-587
63. Szulc P, Kaufman JM and Delmas PD. Biochemical assessment of bone turnover and bone fragility in men. Osteoporos Int. 2007;18:1451-1461
64. Cannell JJ, Hollis BW, Zasloff M and Heaney RP. Diagnosis and treatment of vitamin D deficiency. Expert Opin Pharmacother. 2008;9:107-118
65. NIH. NIH Consensus statement, Volume 12, Number 4(ed.). Bethesda, MD: National Institutes of Health. 1994;
66. Tang BM, Eslick GD, Nowson C, Smith C and Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet. 2007;370:657-666
67. Boonen S, Lips P, Bouillon R, Bischoff-Ferrari HA, Vanderschueren D and Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin d supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92:1415-1423
68. Boonen S, Vanderschueren D, Haentjens P and Lips P. Calcium and vitamin D in the prevention and treatment of osteoporosis – a clinical update. J Intern Med. 2006;259:539-552
69. Orwoll E, Ettinger M, Weiss S, Miller P, Kendler D, Graham J, et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med. 2000;343:604-610
70. Miller PD, Schnitzer T, Emkey R, Orwoll E, Rosen C, Ettinger M, et al. Weekly oral alendronic Acid in male osteoporosis. Clin Drug Investig. 2004;24:333-341
71. Ringe JD, Dorst A, Faber H and Ibach K. Alendronate treatment of established primary osteoporosis in men: 3-year results of a prospective, comparative, two-arm study. Rheumatol Int. 2004;24:110-113
72. Iwamoto J, Takeda T and Sato Y. Effects of antifracture drugs in postmenopausal, male and glucocorticoid-induced osteoporosis–usefulness of alendronate and risedronate. Expert Opin Pharmacother. 2007;8:2743-2756
73. Boonen S, Orwoll ES, Wenderoth D, Stoner KJ, Eusebio R and Delmas PD. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebo-controlled, double-blind, multicenter study. J Bone Miner Res. 2009;24:719-725
74. Ringe JD, Farahmand P, Faber H and Dorst A. Sustained efficacy of risedronate in men with primary and secondary osteoporosis: results of a 2-year study. Rheumatol Int. 2009;29:311-315
75. Sato Y, Iwamoto J, Kanoko T and Satoh K. Risedronate sodium therapy for prevention of hip fracture in men 65 years or older after stroke. Arch Intern Med. 2005;165:1743-1748
76. Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007;357:1799-1809
77. Orwoll ES, Miller PD, Adachi JD, Brown J, Adler RA, Kendler D, et al. Efficacy and safety of a once-yearly i.v. Infusion of zoledronic acid 5 mg versus a once-weekly 70-mg oral alendronate in the treatment of male osteoporosis: a randomized, multicenter, double-blind, active-controlled study. J Bone Miner Res. 2010;25:2239-2250
78. Boonen S, Reginster JY, Kaufman JM, Lippuner K, Zanchetta J, Langdahl B, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012;367:1714-1723
79. Orwoll ES, Scheele WH, Paul S, Adami S, Syversen U, Diez-Perez A, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003;18:9-17
80. Kaufman JM, Orwoll E, Goemaere S, San Martin J, Hossain A, Dalsky GP, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int. 2005;16:510-516
81. Smith MR, Egerdie B, Hernandez Toriz N, Feldman R, Tammela TL, Saad F, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009;361:745-755
82. Ringe JD, Dorst A and Farahmand P. Efficacy of strontium ranelate on bone mineral density in men with osteoporosis. Arzneimittelforschung. 2010;60:267-272
83. Kaufman JM, Ringe J, Felsenberg D, Audran M, Bianchi G, Boonen S, et al. Efficacy and safety of strontium renalate in the treatment of male osteoporosis. Osteoporos Int. 2011;22:S114-115
84. Katznelson L, Finkelstein JS, Schoenfeld DA, Rosenthal DI, Anderson EJ and Klibanski A. Increase in bone density and lean body mass during testosterone administration in men with acquired hypogonadism. J Clin Endocrinol Metab. 1996;81:4358-4365
85. Snyder PJ, Peachey H, Hannoush P, Berlin JA, Loh L, Holmes JH, et al. Effect of testosterone treatment on bone mineral density in men over 65 years of age. J Clin Endocrinol Metab. 1999;84:1966-1972
86. Amory JK, Watts NB, Easley KA, Sutton PR, Anawalt BD, Matsumoto AM, et al. Exogenous testosterone or testosterone with finasteride increases bone mineral density in older men with low serum testosterone. J Clin Endocrinol Metab. 2004;89:503-510
Created: October 28, 2014
Last update: October 28, 2014

