Δημήτριος-Νικηφόρος Κιόρτσης, Γεώργιος Χρήστου
Εργαστήριο Φυσιολογίας, Ιατρική Σχολή Πανεπιστημίου Ιωαννίνων
1. Αλγόριθμος φαρμακευτικής αντιμετώπισης της παχυσαρκίας
Σύμφωνα με τις νέες κατευθυντήριες οδηγίες του 2013 για την αντιμετώπιση των υπέρβαρων και παχύσαρκων ενηλίκων η απώλεια βάρους συστήνεται να επιτευχθεί μέσω μίας ολοκληρωμένης υγιεινοδιαιτητικής παρέμβασης, η οποία αποτελείται από τα εξής στοιχεία: 1) ήπια υποθερμιδική δίαιτα, 2) αυξημένη φυσική δραστηριότητα, 3) χρήση συμπεριφορικών στρατηγικών που αυξάνουν τη συμμόρφωση στις συστάσεις που αφορούν τη δίαιτα και την άσκηση (1). Ως αρχικός στόχος της απώλειας βάρους μπορεί να τεθεί η απώλεια βάρους ≥ 5% επί του αρχικού μέσα σε 6 μήνες. Σε ασθενείς με Δείκτη Μάζας Σώματος (BMI) ≥ 30 kg/ m2 ή ≥ 27 kg/ m2 με συνύπαρξη τουλάχιστον μίας κατάστασης σχετιζόμενης με την παχυσαρκία, εφόσον διαπιστωθεί η αδυναμία να επιτευχθεί ο προεπιλεγμένος στόχος της 5% απώλειας βάρους στους 6 μήνες ή να διατηρηθεί αυτή η απώλεια στο χρόνο μέσω ολοκληρωμένων υγιεινοδιαιτητικών παρεμβάσεων, είναι δυνατό να επιλεχθείκάποιο φάρμακο, το οποίο θα συνεπικουρήσει την απώλεια βάρους.
Ο ρόλος της φαρμακοθεραπείας είναι να αυξήσει τη δυνατότητα του ασθενούς να συμμορφωθεί σε μια υποθερμιδική δίαιτα και να ενισχύσει την προκαλούμενη απώλεια βάρους, ώστε σε συνδυασμό με την αυξημένη σωματική άσκηση να επιτευχθούν οι επιδιωκόμενοι στόχοι της απώλειας βάρους. Υπό αυτήν την έννοια, η φαρμακοθεραπεία είναι αναγκαίο να προστίθεται σε μια ολοκληρωμένη υγιεινοδιαιτητική παρέμβαση που στοχεύει στην απώλεια βάρους και σε καμία περίπτωση δεν επιτρέπεται να την υποκαθιστά. Εάν ένας ασθενής λαμβάνει φαρμακευτική αγωγή για την παχυσαρκία και δεν έχει επιτευχθεί απώλεια βάρους τουλάχιστον 5% επί του αρχικού βάρους εντός 12 εβδομάδων υπό μέγιστη δοσολογία του εν λόγω φαρμάκου θα πρέπει να εξετασθεί το ενδεχόμενο διακοπής του φαρμάκου.
Στα άτομα που ακολουθούν μία υγιεινοδιαιτητική παρέμβαση η απώλεια βάρους συνήθως μεγιστοποιείται στους 6 μήνες με ακόλουθη δημιουργία πλατό, λόγωεξισορρόπησης ανάμεσα στην ενεργειακή πρόσληψη και την κατανάλωση ενέργειας, και στη συνέχεια συμβαίνει προοδευτική αύξηση του σωματικού βάρους. Το ίδιο πρότυπο ισχύει και στην περίπτωση της υγιεινοδιαιτητικής παρέμβασης υποβοηθούμενης από φαρμακοθεραπεία, αν και η επαναπρόσληψη του σωματικού βάρους γίνεται με βραδύτερο ρυθμό όταν υπάρχει συνεχιζόμενη χρήση του φαρμάκου.
2. Φάρμακα για την αντιμετώπιση της παχυσαρκίας
Όπως συμβαίνει σε κάθε φαρμακευτική θεραπεία, η αξιολόγηση της χρησιμότητας ενός συγκεκριμένου φαρμάκου για την παχυσαρκία πραγματοποιείται μέσω της στάθμισης του ισοζυγίου μεταξύ του μεγέθους του οφέλους από την απώλεια βάρους και της σοβαρότητας, όπως επίσης και της συχνότητας των παρενεργειών. Ωστόσο, ειδικά στη φαρμακοθεραπεία της παχυσαρκίας, η αποτελεσματικότητα των φαρμάκων όσον αφορά την απώλεια βάρους είναι το πολύ μέτρια και η επίδρασή τους στην πρόληψη των καρδιαγγειακών συμβαμάτων είναι έμμεση μέσω βελτίωσης των παραγόντων κινδύνου. Οπότε, η έγκριση για την εμπορική κυκλοφορία των φαρμάκων για την παχυσαρκία τείνει να καθοδηγείται σημαντικά από το προφίλ ασφαλείας τους, εκτός από την αποτελεσματικότητά τους.
Τα κριτήρια για την αποτελεσματικότητα των φαρμάκων για την παχυσαρκία σε μελέτες που περιλαμβάνουν σύγκριση του συνδυασμού του μελετώμενου φαρμάκου με υγιεινοδιαιτητική παρέμβαση σε σχέση με το συνδυασμό του εικονικού φαρμάκου με υγιεινοδιαιτητική παρέμβαση διαφέρουν μεταξύ του Ευρωπαϊκού Οργανισμού Φαρμάκων (EMA) και του Αμερικάνικου Οργανισμού Φαρμάκων (FDA) (2,3).Ο EMA θεωρεί ως αποτελεσματικό ένα φάρμακο που ικανοποιεί και τα εξής δύο καταληκτικά σημεία αποτελεσματικότητας: 1) Το κύριο πρωτογενές κριτήριο αποτελεσματικότητας είναι το μελετώμενο φάρμακο να προκαλεί ≥10% απώλεια βάρους μετά από 1 έτος, η οποία να είναι ≥5% μεγαλύτερη από αυτή του εικονικού φαρμάκου, 2) Δευτερογενή κριτήρια αποτελεσματικότητας είναι η βελτίωση των παραμέτρων που σχετίζονται με την παχυσαρκία [λιπίδια, μεταβολισμός γλυκόζης, Αρτηριακή Πίεση (ΑΠ), καρδιακή λειτουργία, λόγος περιμέτρου μέσης προς περίμετρο ισχίων, υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη (hs-CRP), υπνική άπνοια, ποιότητα ζωής] ή η αποφυγή αύξησης του σωματικού βάρους μετά την επίτευξη πλατό στην απώλεια βάρους.Ο FDA θεωρεί ως αποτελεσματικό ένα φάρμακο που ικανοποιεί τουλάχιστον ένα από τα εξής κριτήρια: 1) Η διαφορά στη μέση απώλεια βάρους μεταξύ του μελετώμενου φαρμάκου και του εικονικού φαρμάκου είναι >5% και είναι στατιστικά σημαντική, 2) Το ποσοστό των ασθενών που έχουν ≥5% απώλεια βάρους στο σκέλος του μελετώμενου φαρμάκου είναι ≥35% και είναι περίπου διπλάσιο από το αντίστοιχο ποσοστό στο σκέλος του εικονικού φαρμάκου, ενώ η διαφορά αυτή μεταξύ των ποσοστών θα πρέπει να είναι στατιστικά σημαντική.
Στο παρελθόν δοκιμάσθηκαν διάφορα φάρμακα για την παχυσαρκία τα οποία αποσύρθηκαν από το εμπόριο, λόγω σημαντικών παρενεργειών. Συγκεκριμένα, η ριμοναμπάντη (rimonabant) αποτελεί ανταγωνιστή του υποδοχέα των κανναβινοειδών τύπου 1 (CB1) και μειώνει την όρεξη και την πρόσληψη τροφής (4,5). Ωστόσο, ηλήψη ριμοναμπάντης, εκτός από την απώλεια βάρους,συνοδευόταν και από σημαντικές παρενέργειες, από τις οποίες η πιο ανησυχητική ήταν η πρόκληση ψυχιατρικών διαταραχών, με αύξηση της συχνότητας εμφάνισης καταθλιπτικού και αγχωτικού συναισθήματος, όπως επίσης και αυτοκτονικού ιδεασμού (5). Έτσι, ο EMA απέσυρε τη ριμοναμπάντη από την κυκλοφορία το 2008, ενώ ο FDA δεν έδωσε ποτέ έγκριση για την κυκλοφορία της ριμοναμπάντης. Επίσης, η σιμπουτραμίνη (sibutramine) αναστέλλει την επαναπρόσληψη νευροδιαβιβαστών στον εγκέφαλο, κυρίως της σεροτονίνης και της νορεπινεφρίνης, με αποτέλεσμα την αύξηση του αισθήματος του κορεσμού και τελικά την απώλεια βάρους (6).Οι παρενέργειες της σιμπουτραμίνης στο καρδιαγγειακό σύστημα περιλαμβάνουν αύξηση της καρδιακής συχνότητας (ΚΣ) και της ΑΠ και παράταση QT, με αποτέλεσμα την αύξηση του κινδύνου εμφάνισης επικίνδυνων κοιλιακών αρρυθμιών (7). Η μελέτη SCOUT έδειξε ότι η σιμπουτραμίνη αύξησε κατά 16% την επίπτωση των καρδιαγγειακών συμβαμάτων, παρά τη μείωση του σωματικού βάρους, σε ασθενείς με ιστορικό καρδιαγγειακής νόσου ή Σακχαρώδη Διαβήτη (ΣΔ) τύπου 2 κατά τη διάρκεια μιας μέσης περιόδου παρακολούθησης 3,4 ετών (8). Οπότε, ο EMA και oFDA απέσυραν από την κυκλοφορία τη σιμπουτραμίνη το 2010. Στον Πίνακα 1 παρουσιάζονται η αποτελεσματικότητα, καθώς και οι συχνότερες παρενέργειες των φαρμάκων που χρησιμοποιούνται σήμερα για την αντιμετώπιση της παχυσαρκίας.
2.1. Ορλιστάτη
Η ορλιστάτη (orlistat) είναι εγκεκριμένη ως θεραπεία για την απώλεια βάρους τόσο από τον EMA όσο και από τον FDA. Η ορλιστάτη είναι αναστολέας της γαστρικής και παγκρεατικής λιπάσης, με αποτέλεσμα να αναστέλλει την υδρόλυση των τριγλυκεριδίων μέσα στο γαστρεντερικό σωλήνα, ώστε τελικά να μειώνεται η απορρόφηση των ελεύθερων λιπαρών οξέων και των μονογλυκεριδίων(9).Η ορλιστάτη συνιστάται να λαμβάνεται σε δοσολογία μίας κάψουλας 120 mg αμέσως πριν, κατά τη διάρκεια ή μέχρι το πολύ 1 h μετά από κάθε κύριο γεύμα. Αν το γεύμα δεν περιέχει λίπη, η ορλιστάτη δεν θα πρέπει να λαμβάνεται. Δόσεις ορλιστάτης άνω των 120 mg 3 φορές την ημέρα έχουν βρεθεί ότι δεν προσφέρουν επιπλέον όφελος.Ο συνδυασμός ορλιστάτης120 mg 3 φορές την ημέρα και υποθερμιδικής δίαιταςέχει βρεθεί ότι προκαλεί 8,8-10,2% απώλεια βάρους μετά από ένα έτοςκαι 3,0-4,1% μεγαλύτερη απώλεια βάρους μετά από έναέτος σε σχέση με το συνδυασμό εικονικού φαρμάκου και υποθερμιδικής δίαιτας(10-12). Η μελέτη XENDOS έδειξε ότι ο συνδυασμός ορλιστάτης 120 mg 3 φορές την ημέρα και υποθερμιδικής δίαιτας μείωσε σε μεγαλύτερο βαθμό την επίπτωση ΣΔ τύπου 2 σε παχύσαρκα άτομα κατά τη διάρκεια 4 ετών παρακολούθησης σε σχέση με το συνδυασμό εικονικού φαρμάκου και υποθερμιδικής δίαιτας (13).Ο συνδυασμόςορλιστάτης και υγιεινοδιαιτητικής παρέμβασης, εκτός από τη βελτίωση των καρδιομεταβολικών παραγόντων κινδύνου που οφείλονται στην απώλεια βάρους [ινσουλινοαντίσταση, υπέρταση, τριγλυκερίδια ορού, υψηλής πυκνότητας λιποπρωτείνη ορού (HDL-C)], έχει βρεθεί ότι προκαλείμείωση της συγκέντρωσης στον ορό της χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-C)μεγαλύτερηαπό αυτή που θα αναμένονταν από την απώλεια βάρους (11,12,14-17). Αυτή η μείωση της LDL-C από την ορλιστάτη ανεξάρτητα από την απώλεια βάρους αποδίδεται στη μείωση της διαιτητικής πρόσληψης κορεσμένων λιπαρών οξέων από την ορλιστάτη.Συγκεκριμένα, ο συνδυασμός ορλιστάτης και υγιεινοδιαιτητικής παρέμβασης έχει βρεθεί ότι μειώνει την LDL-C 1,2% στο 1 έτος και 0,6% στα 2 έτη (11). Επίσης, ο συνδυασμός ορλιστάτης και υγιεινοδιαιτητικής παρέμβασης έχει βρεθεί ότιπροκαλεί6,3% μεγαλύτερη μείωση της LDL-C στο 1 έτος και 6,7% μεγαλύτερη μείωση της LDL-Cστα 2 έτη σε σχέση με το συνδυασμό εικονικού φαρμάκου και υγιεινοδιαιτητικής παρέμβασης (11). Πρέπει να τονιστεί, ότιόλες αυτές οι μεταβολές της LDL-C αναφέρονται σε σχέση με το τέλος της αρχικής περιόδου των 4 εβδομάδων λήψης εικονικού φαρμάκου (run-inperiod), μετά την οποία συμβαίνει η τυχαιοποίηση των ασθενών στο σκέλος της ορλιστάτης και του εικονικού φαρμάκου. Το γεγονός ότι οι μεταβολές του λιποπρωτεϊνικού προφίλ γενικά είναι μέγιστες κατά τις πρώτες εβδομάδες της διαιτητικής παρέμβασης και μειώνονται στη συνέχεια ερμηνεύει το μικρό μέγεθος στις προαναφερθείσες απόλυτες μειώσεις της LDL-C από το συνδυασμό ορλιστάτης και υγιεινοδιαιτητικής παρέμβασης (18). Εκτός αυτού, η ορλιστάτη έχει δειχθεί ότι είναι αποτελεσματική και σχετικά ασφαλής για την αντιμετώπιση παχύσαρκων εφήβων, οπότε επιτρέπεται η χρήση της σε εφήβους > 12 ετών (19). Μάλιστα, η ορλιστάτη αποτελεί το μοναδικό φάρμακο για την παχυσαρκία που είναι εγκεκριμένο για εφήβους.
Η λαμβανόμενη ορλιστάτη αποβάλλεται στο 97% με τα κόπρανα, ενώ απορροφάται από το γαστρεντερικό σωλήνα σε ένα πολύ μικρό ποσοστό. Συνεπώς, οι κύριες παρενέργειες της ορλιστάτης προέρχονται από το γαστρεντερικό σύστημα, είναι συνήθως ήπιας προς μέτριας έντασης και είναι γενικά είναι καλά ανεκτές (11-13). Οι γαστρεντερικές παρενέργειες εμφανίζονται κυρίως κατά την έναρξη της θεραπείας, ενώ μετά μειώνονται σε συχνότητα, πιθανώς επειδή το ίδιο το άτομο τροποποιεί τη δίαιτά του μαθαίνοντας να χρησιμοποιεί το φάρμακο πιο αποτελεσματικά(10-13). Συγκεκριμένα, οι πιο συχνές παρενέργειες της ορλιστάτης είναι κοιλιακός μετεωρισμόςκαι λιπαρές διάρροιες (11,12). Η πιθανότητα εμφάνισης παρενεργειών από την ορλιστάτη αυξάνεται όταν ο ασθενής λάβει την ορλιστάτη με ένα γεύμα αυξημένης περιεκτικότητας σε λίπη. Προκειμένου να ελαχιστοποιηθούν οι παρενέργειες της ορλιστάτης είναι σκόπιμο η υποθερμιδική δίαιτα που θα ακολουθεί ο ασθενής να είναι χαμηλής περιεκτικότητας σε λίπη και η ημερήσια πρόσληψη λιπών να κατανέμεται σε 3 κύρια γεύματα. Η συστηματική χορήγηση ορλιστάτης οδηγεί σε μείωση των επιπέδων στον πλάσμα όλων των λιποδιαλυτών βιταμινών, χωρίς ωστόσο να οδηγεί σε βιταμινική ανεπάρκεια στα άτομα με φυσιολογικά επίπεδα των αντίστοιχων βιταμινών πριν την έναρξη της θεραπείας (13). Για αυτό το λόγο τα άτομα που λαμβάνουν ορλιστάτη συνιστάται να ακολουθούν δίαιτα πλούσια σε φρούτα και λαχανικά, ενώ η λήψη πολυβιταμινούχων σκευασμάτων αποτελεί μια αποδεκτή επιλογή. Επίσης, η ορλιστάτη μειώνει τα επίπεδα στο πλάσμα της κυκλοσπορίνης και της αμιωδαρόνης, ενώ επηρεάζει και τη δράση των κουμαρινικών αντιπηκτικών. Οι αντενδείξεις της ορλιστάτης περιλαμβάνουν: κύηση, δυσαπορρόφηση, χολόσταση και υπερευαισθησία στην ορλιστάτη.
2.2. Ναλτρεξόνη/Βουπροπιόνη
Ο συνδυασμός Ναλτρεξόνη/Βουπροπιόνη [naltrexone/bupropion (NB)]είναι εγκεκριμένος ως θεραπεία για την απώλεια βάρους τόσο από τον EMA όσο και από τον FDA.Η βουπροπιόνη ενδείκνυται ως μονοθεραπεία για την κατάθλιψη και για τη διακοπή του καπνίσματος, ενώ η ναλτρεξόνη ενδείκνυται ως μονοθεραπεία για την απεξάρτηση από τον αλκοολισμό και τα οπιούχα. Στην Εικόνα 1 φαίνεται ο μηχανισμός μέσω του οποίου ο συνδυασμός NB οδηγεί σε απώλεια βάρους. Η βουπροπιόνη αναστέλλει την επαναπρόσληψη της ντοπαμίνης και της νοραδρεναλίνης στους νευρώνες του τοξοειδή πυρήνα του υποθαλάμου με αποτέλεσμα τη διέγερση των νευρώνων προ-οπιομελανοκορτίνης [pro-opiomelanocortin (POMC)] (20). Η POMCείναι πρόδρομο μόριο για τη σύνθεση της α-διεγερτικής ορμόνης των μελανοκυττάρων[α-melanocytestimulatinghormone (α-MSH)]και της β-ενδορφίνης σε αυτούς τους νευρώνες. Η α-MSHδρα στους υποδοχείς μελανοκορτίνης-4 (MC4R)προκαλώντας μείωση της πρόσληψης τροφής, ενώ η β-ενδορφίνη προκαλεί αναστολή των POMC νευρώνων. Αυτή η αναστολή πιθανώς ερμηνεύει τη σχετικά περιορισμένη αποτελεσματικότητα της μονοθεραπείας με βουπροπιόνη όσον αφορά την προκαλούμενη απώλεια βάρους.Η ναλτρεξόνη είναι ανταγωνιστής των οπιοειδών με υψηλή συγγένεια σύνδεσης για τον μ-υποδοχέα των οπιοειδών. Η ναλτρεξόνη μειώνει την πρόσληψη τροφής πιθανώς λόγω αναστολής της δράσης της β-ενδορφίνης στον μ-υποδοχέα των οπιοειδών, αποτρέποντας έτσι την αυτοαναστολή των POMC νευρώνων(20). Ο συνδυασμός NB είναι διαθέσιμος στο εμπόριο με τη μορφή δισκίων παρατεταμένης αποδέσμευσης, όπου το κάθε δισκίο περιέχει τοσταθερόσυνδυασμό 8mgναλτρεξόνης και 90mg βουπροπιόνης. Η τελική δόση στόχος είναι 32 mg ναλτρεξόνη/360 mg βουπροπιόνη (NB32),δηλαδή 2 δισκία την ημέρα. Η τιτλοποίηση της δοσολογίας του NB κατά την έναρξη της θεραπείας στοχεύει στη μείωση της ναυτίας, η οποία είναι η κύρια παρενέργεια του NB:
- 1η εβδομάδα: 1 δισκίο την ημέρα το πρωί.
- 2η εβδομάδα: 1 δισκίο το πρωί και 1 δισκίο το βράδυ.
- 3η εβδομάδα: 2 δισκία το πρωί και 1 δισκίο το βράδυ.
- 4η εβδομάδα και μετά: 2 δισκία το πρωί και 2 δισκία το βράδυ.
Οι ασθενείς που λαμβάνουν NB32 θα πρέπει να αξιολογούνται μετά από 12 εβδομάδες, προκειμένου να καθορισθεί αν η θεραπεία είναι αποτελεσματική. Αν η απώλεια βάρους είναι <5%, η αγωγή με NB32 θα πρέπει να διακόπτεται, γιατί δε θεωρείται πιθανό να επιτευχθεί κλινικά σημαντική απώλεια βάρους με συνεχιζόμενη θεραπεία.
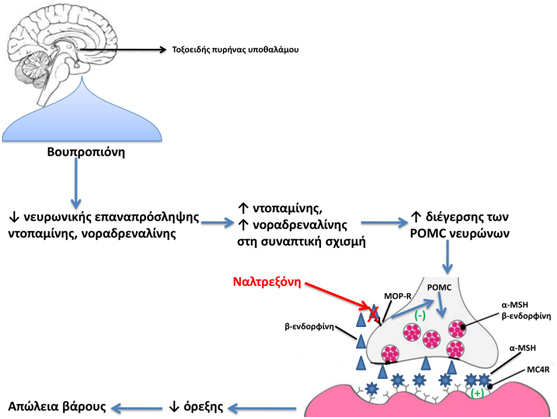
Εικόνα 1. Ο μηχανισμός της προκαλούμενης απώλειας βάρους από το συνδυασμό ναλτρεξόνη/βουπροπιόνη. α-MSH: α-διεγερτική ορμόνη των μελανοκυττάρων, MC4R: υποδοχέας μελανοκορτίνης-4, MOP-R: μ-υποδοχέας των οπιοειδών, POMC: προ-οπιομελανοκορτίνη.
Η αποτελεσματικότητα του NB32 όσον αφορά την απώλεια βάρους διερευνήθηκε στις μελέτες COR-I, COR-II, COR-BMOD και COR-Diabetes (21-24). Έτσι, ο συνδυασμός NB32 και υγιεινοδιαιτητικής παρέμβασης έχει βρεθεί ότι οδηγεί σε 5,0-9,3% απώλεια βάρους μετά από ένα έτος, ενώ σε σχέση με το συνδυασμό εικονικού φαρμάκου και υγιεινοδιαιτητικής παρέμβασης προκαλεί 3,2-5,2% μεγαλύτερη απώλεια βάρους μετά από ένα έτος. Λόγω της γνωστής αποτελεσματικότητας της βουπροπιόνης στη διακοπή του καπνίσματος, παχύσαρκα άτομα που επιθυμούν να διακόψουν το κάπνισμα πιθανώς είναι κατάλληλοι υποψήφιοι για τη θεραπεία με NB32, προκειμένου να αποφευχθεί η αύξηση του σωματικού βάρους κατά τη διάρκεια της διακοπής του καπνίσματος (25). Η θεραπεία με NB32 μπορεί να βελτιώσει όλους τους παράγοντες του Μεταβολικού Συνδρόμου (ΜΣ), εκτός από την ΑΠ. Η θεραπεία με NB32 τείνει να προκαλεί ήπια αύξηση στη Συστολική ΑΠ (ΣΑΠ), στη Διαστολική ΑΠ (ΔΑΠ) και στην καρδιακή συχνότητα (ΚΣ), πιθανώς λόγω της συμπαθητικομιμητικής επίδρασης της βουπροπιόνης. Συγκεκριμένα, ο συνδυασμός NB32 με υγιεινοδιαιτητική παρέμβαση έχει βρεθεί ότι προκαλείήπιες διακυμάνσεις στη ΣΑΠ και στη ΔΑΠ εντός 2 mmHg σε σχέση με τις αρχικές τιμές και μικρές αυξήσεις στην ΚΣ έως 2 σφύξεις/min, ενώ σε σχέση με το συνδυασμό εικονικού φαρμάκου και ολοκληρωμένης υγιεινοδιαιτητικής παρέμβασηςπροκαλεί μικρότερη μείωση ή καθόλου μεταβολή των ΣΑΠ και ΔΑΠ και μικρή αύξηση ή καμία μεταβολή της ΚΣ (21-24). Μεγαλύτερη απώλεια βάρους προκαλούμενη από την αγωγή με NB32 οδηγεί σε μεγαλύτερη μείωση της Μέσης ΑΠ.
Οι παρενέργειες του συνδυασμού NB32 οφείλονται στις ξεχωριστές παρενέργειες της ναλτρεξόνης και της βουπροπιόνης. Η πιο συχνή παρενέργεια της ναλτρεξόνης είναι η ναυτία. Οι πιο συχνές παρενέργειες της βουπροπιόνης είναι αϋπνία και κεφαλαλγία. Έτσι, οι παρενέργειες του συνδυασμού NB32 είναιναυτία, δυσκοιλιότητα, κεφαλαλγία, έμετος, ζάλη, αϋπνία, ξηροστομία, και διάρροια (20). Γενικά οι παρενέργειες του NB32 είναι ήπιας προς μέτριας σοβαρότητας, συμβαίνουν νωρίς κατά τη θεραπεία κατά τη διάρκεια της τιτλοποίησης της δοσολογίας και συνήθως δεν οδηγούν σε διακοπή της θεραπείας (21). Η πιο συχνή παρενέργεια είναι ήπια ναυτία, η οποία αποδίδεται στη ναλτρεξόνη. Η θεραπεία με NB32 σχετίζεται πολύ σπάνια με σοβαρές παρενέργειες. Συγκεκριμένα, είναι δυνατό να εμφανισθεί αυτοκτονικός ιδεασμός, αποδιδόμενος στη ναλτρεξόνη. Επίσης, το NB32 ενδέχεται να προκαλέσει επιληπτικούς σπασμούς, λόγω της βουπροπιόνης, και δε θα πρέπει να λαμβάνεται από άτομα με ιστορικό επιληπτικών διαταραχών. Το NB32 θα πρέπει να διακόπτεται και να μην γίνεται επανέναρξη σε περίπτωση που υπάρξει περιστατικό επιληπτικών σπασμών. Επειδή τοNB32 είναι δυνατό να αυξήσει την ΑΠ και την ΚΣ, δεν θα πρέπει να χρησιμοποιείται από ασθενείς με αρρύθμιστη υπέρταση.Η κλινική σημασία των ήπιων αυξήσεων της ΑΠ και της ΚΣ από τη θεραπεία με NB32 δεν έχει διευκρινισθεί, ιδιαίτερα για ασθενείς με ιστορικό καρδιακής νόσου ή Αγγειακού Εγκεφαλικού Επεισοδίου (ΑΕΕ), δεδομένου ότι στις κλινικές μελέτες που χρησιμοποιήθηκε το NB32 αποκλείσθηκαν άτομα με ιστορικό Οξέος Εμφράγματος του Μυοκαρδίου ή ΑΕΕ τους προηγούμενους 6 μήνες, απειλητικών για τη ζωή αρρυθμιών και Καρδιακής Ανεπάρκειας (ΚΑ). Η ΑΠ και η ΚΣ θα πρέπει να μετρώνται πριν την έναρξη της θεραπείας με NB32 και να επανεκτιμώνται σε τακτικά διαστήματα. Φαρμακευτικά προϊόντα που περιέχουν βουπροπιόνη δεν θα πρέπει να λαμβάνονται μαζί με NB32. Εκτός αυτού, το NB32 δεν θα πρέπει να συγχορηγείται με οπιούχα και δεν θα πρέπει να λαμβάνεται από άτομα με στερητικό σύνδρομο από οπιούχα. Επιπλέον, το NB32 αντενδείκνυται κατά τη διάρκεια της διακοπής της χρόνιας χρήσης αλκοόλ, βενζοδιαζεπινών και αντιεπιληπτικών φαρμάκων. Η κύηση καθώς και η επιθυμία για εγκυμοσύνη αποτελούν αντενδείξεις για το NB32. Το NB32 αντενδείκνυται σε παιδιά και εφήβους.
2.3. Λιραγλουτίδη
Η λιραγλουτίδη είναι εγκεκριμένη ως θεραπεία για την απώλεια βάρους τόσο από τον EMA όσο και από τον FDA. Η λιραγλουτίδη αποτελεί ένα μακράς διάρκειας δράσης αγωνιστή των υποδοχέων του παρόμοιου με τη γλυκαγόνη πεπτιδίου-1 [glucagon-likepeptide-1 (GLP-1)], η οποία συνδέεται στους ίδιους υποδοχείς με το ενδογενέςGLP-1 (26). Το GLP-1 εκκρίνεται μετά την κατανάλωση γεύματος στην κυκλοφορία από τα εντεροενδοκρινικά L κύτταρα που εντοπίζονται στο περιφερικό τμήμα της νήστιδας και στον ειλεό, οδηγώντας σε αυξημένη μεταγευματική έκκριση ινσουλίνης, μειωμένη έκκριση γλυκαγόνης και μείωση των γαστρεντερικών εκκρίσεων και της κινητικότητας. Ενώ τοGLP-1 υπόκειται σε ταχύ καταβολισμό από το ένζυμο διπεπτιδυλ πεπτιδάση-4[dipeptidylpeptidase-4 (DDP-4)] στο εντερικό ενδοθήλιο με αποτέλεσμα να έχει χρόνο ημίσειας ζωής στο πλάσμα 1–2 min, η λιραγλουτίδη είναι ανθεκτική στη δράση του DDP-4 και ο χρόνος ημίσειας ζωής της στο πλάσμα είναι 13 h (27,28). Αυτό το γεγονός καθιστά τη λιραγλουτίδη κατάλληλη για χορήγηση μία φορά την ημέρα. Η λιραγλουτίδη δεν προκαλεί μόνο μείωση της μεταγευματικής υπεργλυκαιμίας, αλλά οδηγεί επίσης και σε απώλεια βάρους. Οι υπεύθυνοι μηχανισμοί για την προκαλούμενη από τη λιραγλουτίδη απώλεια βάρους περιλαμβάνουν το αυξημένο αίσθημα κορεσμού, το οποίο σηματοδοτείται τόσο έμμεσα μέσω βαγοτονικών οδών από το γαστρεντρικό σύστημα, όσο και άμεσα στον εγκέφαλο, λόγω διόδου της λιραγλουτίδης μέσω του αιματοεγκεφαλικού φραγμού (29). Όσον αφορά την έμμεση επίδραση, η λιραγλουτίδη μπορεί να επιβραδύνει την κένωση του στομάχου οδηγώντας σε απώλεια βάρους, αφού είναι γνωστό ότι η γαστρική διάταση σχετίζεται με μείωση της όρεξης και της πρόσληψης τροφής (30,31). Η ναυτία αποτελεί συχνή παρενέργεια της λιραγλουτίδης και έχει βρεθεί ότι συμβάλλει σε κάποιο βαθμό στην επαγόμενη από τη λιραγλουτίδη απώλεια βάρους (32,33). Εκτός αυτού, η λιραγλουτίδη φαίνεται να αναστέλλει την όρεξη ανεξάρτητα από την επίδρασή της στη γαστρική κένωση, επειδή η ανορεξιογόνος δράση της έχει επίσης παρατηρηθεί και σε νηστικά άτομα(27). Αυτή η άμεση δράση της λιραγλουτίδης στο Κεντρικό Νευρικό Σύστημα (Κ.Ν.Σ.) διαμεσολαβείται από τους υποδοχείς GLP-1 στον τοξοειδή πυρήνα του υποθαλάμου, οδηγώντας στην άμεση ενεργοποίησητων ανορεξιογόνων νευρώνωνPOMC/CART(POMC/cocaine- andamphetamine-regulatedtranscript) και στην έμμεση αναστολή των ορεξιογόνων νευρώνων που εκφράζουν νευροπεπτίδιο Y καιAgRP (agouti-relatedpeptide)μέσω GABA-εξαρτώμενης σηματοδότησης(34,35). Πρέπει να τονιστεί ότι η πλειονότητα των στοιχείων σχετικά με τη δράση της λιραγλουτίδης στο Κ.Ν.Σ. προέρχονται από πειραματικές μελέτες σε μη ανθρώπινα είδη, των οποίων η φυσιολογία του εγκεφάλου παρουσιάζει κάποιου βαθμού αποκλίσεις σε σχέση με τη φυσιολογία του ανθρώπινου εγκεφάλου. Πρόσφατα ερευνητικά δεδομένα επιβεβαιώνουν τη σημασία της δράσης της λιραγλουτίδης στον ανθρώπινο εγκέφαλο όσον αφορά τη μείωση της πρόσληψης τροφής (36). Χρειάζεται η διενέργεια περαιτέρω μελετών που να διερευνούν τον ακριβή τρόπο με τον οποίο η λιραγλουτίδη δρα στον ανθρώπινο εγκέφαλο προκειμένου να μειώσει την πρόσληψη τροφής και τη σχετική σημασία αυτού του άμεσου μηχανισμού σε σχέση με άλλους έμμεσους μηχανισμούς δράσης της λιραγλουτίδης στην πρόσληψη τροφής μέσω του γαστρεντερικού συστήματος.
Η λιραγλουτίδη χορηγείται υποδόρια και, ενώ για τη θεραπεία του ΣΔ τύπου 2 η μέγιστη ημερήσια δόση είναι 1,8 mg, για την επίτευξη απώλειας βάρους η ενδεικνυόμενη ημερήσια δόση είναι 3,0 mg. Κατά την έναρξη της θεραπείας με λιραγλουτίδη απαιτείται προσεκτική αύξηση της δοσολογίας προκειμένου να μειωθεί η πιθανότητα εμφάνισης γαστρεντερικών συμπτωμάτων. Η ημερήσια δόση της λιραγλουτίδης συνιστάται να αυξάνεται κατά 0,6 mgκάθε εβδομάδα ξεκινώντας από μία αρχική δόση 0,6 mgμέχρι την επίτευξη της ημερήσιας δόσης στόχου 3.0 mg. Αν ο ασθενής δεν μπορεί να ανεχθεί την αυξημένη δόση, η αύξηση της δοσολογίας θα πρέπει να καθυστερήσει για μία επιπλέον εβδομάδα. Η αγωγή με λιραγλουτίδη θα πρέπει να διακοπεί αν ο ασθενής δεν μπορεί να ανεχθεί την ημερήσια δόση 3,0 mg, επειδή η αποτελεσματικότητα της λιραγλουτίδης όσον αφορά την απώλεια βάρους δεν έχει τεκμηριωθεί σε χαμηλότερη δοσολογία. Το σωματικό βάρος θα πρέπει να επανεκτιμάται 12 εβδομάδες μετά την έναρξη της θεραπείας με 3,0 mgλιραγλουτίδη και η αγωγή με λιραγλουτίδη θα πρέπει να διακόπτεται αν η απώλεια βάρους είναι <5%, γιατί δε θεωρείται πιθανό να επιτευχθεί κλινικά σημαντική απώλεια βάρους με συνεχιζόμενη θεραπεία.
Η λιραγλουτίδη σε δοσολογία 3,0 mg ημερησίως ως θεραπεία για την παχυσαρκία μελετήθηκε στη μελέτη Astrupetal και στις 4 SCALE μελέτες (SCALE-Maintenance, SCALE-ObesityandPre-diabetes, SCALE-Diabetes,SCALE-SleepApnoea) (37-41,NCT01557166). Έτσι, βρέθηκε ότι ο συνδυασμός λιραγλουτίδης 3,0 mgημερησίως και υγιεινοδιαιτητικής παρέμβασης οδηγεί σε απώλεια βάρους 5,9-8,0% μετά από 1 έτος, ενώ σε σχέση με το συνδυασμό εικονικού φαρμάκου και υγιεινοδιαιτητικής παρέμβασης προκαλεί 3,9-6,0% μεγαλύτερη απώλεια βάρους μετά από 1 έτος. Μάλιστα, η λιραγλουτίδη 3,0 mgημερησίως έχει βρεθεί ότι προκαλεί μεγαλύτερη απώλεια βάρους από την ορλιστάτη 360 mgημερησίως (37,38). Η θεραπεία με λιραγλουτίδη 3,0 mg ημερησίως βελτιώνει όλους τους μεμονωμένους παράγοντες του ΜΣ. Η μείωση της ΑΠ από τη λιραγλουτίδη πιθανώς οφείλεται όχι μόνο στην απώλεια βάρους, αλλά και στην προκαλούμενη από τη λιραγλουτίδη αύξηση της νεφρικής απέκκρισης Na (42). Ειδικά όσον αφορά τη βελτίωση της ινσουλινοαντίστασης, η λιραγλουτίδη μειώνει τη γλυκόζη νηστείας και τη γλυκοζυλιωμένη αιμοσφαιρίνη (HbA1c), κυρίως λόγω αυξημένης μεταγευματικής έκκρισης ινσουλίνης, οδηγώντας έτσι σε βελτίωση του γλυκαιμικού προφίλ ανεξάρτητα από την προκαλούμενη απώλεια βάρους. Συγκεκριμένα, η SCALE-Diabetes έδειξε ότι η αγωγή με λιραγλουτίδη 3,0 mgημερησίως για 1 έτος οδηγεί σε σχέση με τη λιραγλουτίδη 1,8 mg ημερησίωςσε μεγαλύτερη μείωση της HbA1c (1.3 vs 1.1 %) και μεγαλύτερο ποσοστό ατόμων επιτυγχάνουν τιμές HbA1c< 6,5 (56,5 vs 45,6 %) (41).Άρα, η επιλογή της λιραγλουτίδης 3,0 mgημερησίως αποτελεί μία ελκυστική επιλογή προκειμένου να επιτευχθεί απώλεια βάρους σε παχύσαρκα άτομα με ΣΔ τύπου 2. Ωστόσο, η αποτελεσματικότητα της λιραγλουτίδης 3,0 mg ημερησίως σε ασθενείς με ΣΔ τύπου 1 δεν έχει μελετηθεί μέχρι σήμερα. Η λιραγλουτίδη προκαλεί αύξηση της ΚΣ ηρεμίας έως 3 σφύξεις/min, πιθανώς λόγω διέγερσης των υποδοχέων GLP-1 στον φλεβόκομβο από τη λιραγλουτίδη (40,43,44).Γενικά, η αυξημένη ΚΣ έχει συσχετιστεί με αυξημένο κίνδυνο για αθηροσκλήρωση των στεφανιαίων αρτηριών, καρδιαγγειακή νοσηρότητα (κυρίως ΚΑ) και θνητότητα (43,45). Αυτή η συσχέτιση μπορεί να αποδοθεί τουλάχιστον εν μέρει στη μειωμένη δραστηριότητα του Παρασυμπαθητικού Νευρικού Συστήματος (ΠΝΣ) και/ή στην αυξημένη δραστηριότητα του Συμπαθητικού Νευρικού Συστήματος (ΣΝΣ)(45). Αξίζει να σημειωθεί ότι ο πιθανός μηχανισμός της αύξησης της ΚΣ από τη λιραγλουτίδη εμπλέκει την ενεργοποίηση των υποδοχέων GLP-1 στον φλεβόκομβο και συνεπώς εκθέτει την καρδιά σε μικρότερο καρδιαγγειακό στρες σε σχέση με την περίπτωση της τροποποίησης της δραστηριότητας των ΠΝΣ και ΣΝΣ, η οποία μπορεί να έχει προαρρυθμική δράση, θετική ινότροπη δράση και να αυξήσει την ΑΠ (44,46). Υπό αυτήν την έννοια η αύξηση της ΚΣ από τη λιραγλουτίδη πιθανώς έχει διαφορετική προγνωστική σημασία από την προκαλούμενη αύξηση της ΚΣ από τα φάρμακα για την παχυσαρκία σιμπουτραμίνη, NB και φεντερμίνη/τοπιραμάτη (PHEN/TOP), η οποία οφείλεται σε αυξημένη αδρενεργική διέγερση. Ωστόσο, η αύξηση της ΚΣ από τη λιραγλουτίδη πιθανώς να δυσχεράνει την επίτευξη του στόχου της χαμηλής ΚΣ σε ασθενείς με Στεφανιαία Νόσο ή ΚΑ.
Οι πιο συχνές παρενέργειες της λιραγλουτίδης σε δοσολογία3,0 mg ημερησίως είναι ναυτία, έμετος, δυσκοιλιότητα, διάρροια, κεφαλαλγία και υπογλυκαιμία. Η πιο συχνή παρενέργεια είναι η ναυτία, η οποία είναι δοσοεξαρτώμενη (37). Η εμφανιζόμενη ναυτία είναι ήπιας ή μέτριας σοβαρότητας, είναι παροδική και γενικά είναι καλά ανεκτή (32). Ηπροοδευτική αύξηση της δοσολογίας της λιραγλουτίδης ανά εβδομάδα οδηγεί σε μείωση της συχνότητας και της σοβαρότητας της ναυτίας. Σοβαρές παρενέργειες από την αγωγή με λιραγλουτίδη 3,0 mgείναι πολύ σπάνιες. Η χορήγηση λιραγλουτίδης έχει συσχετισθεί με ανάπτυξη όγκων των κυττάρων C του θυρεοειδούς (αδενώματα, καρκινώματα) σε πειραματόζωα, αλλά όχι στους ανθρώπους (47). Στις κλινικές μελέτες που χρησιμοποιήθηκε λιραγλουτίδη 3,0 mg ημερησίως δεν παρατηρήθηκε καμία περίπτωση όγκων των κυττάρων C του θυρεοειδούς. Η αγωγή με λιραγλουτίδη 3,0 mg ημερησίως δεν οδήγησε σε μεταβολή των επιπέδων καλσιτονίνης του ορού σε όλες τις σχετικές κλινικές μελέτες, με όλες τις μετρήσεις της καλσιτονίνης να είναι κάτω από το ανώτερο φυσιολογικό όριο (37-39). Η μέγιστη διάρκεια των μελετών που αξιολόγησαν την ασφάλεια της αγωγής με λιραγλουτίδη όσον αφορά τη δυνητική ανάπτυξη όγκων των κυττάρων C του θυρεοειδούς ήταν 104 εβδομάδες. Αν και αυτή η χρονική διάρκεια είναι αρκετά παρατεταμένη, είναι αναγκαία η μακρόχρονη παρακολούθηση για πιθανή εμφάνιση όγκων των κυττάρων C του θυρεοειδούς κατά την εμπορική χρήση της λιραγλουτίδης 3,0 mg ημερησίως. Η λιραγλουτίδη 3,0 mg ημερησίως δε θαπρέπει να συγχορηγείται με τα ακόλουθα αντιδιαβητικά φάρμακα: ινσουλίνη, λιραγλουτίδη 1,8 mg ημερησίως,άλλοι αγωνιστές των GLP-1 υποδοχέων και αναστολείς του DPP-4. Η λιραγλουτίδη 3,0 mg ημερησίως επίσης αντενδείκνυται στις ακόλουθες καταστάσεις: ατομικό ή οικογενειακό ιστορικό μυελοειδούς καρκινώματος του θυρεοειδούς ή συνδρόμου πολλαπλής ενδοκρινικής νεοπλασίας τύπου 2 (MEN 2), γνωστή σοβαρή υπερευαισθησία στη λιραγλουτίδη ή στα έκδοχα που περιέχονται στο αντίστοιχο φαρμακευτικό προϊόν, κύηση, γαλουχία και ηλικία < 18 ετών.
2.4. Φεντερμίνη/Τοπιραμάτη
Ο συνδυασμός φεντερμίνη/τοπιραμάτη [phentermine/topiramate (PHEN/TOP)] είναι εγκεκριμένος ως θεραπεία για απώλεια βάρους από τον FDA, αλλά όχι από τον EMA. Η φεντερμίνη είναι ένας συμπαθητικομιμητικός παράγοντας, ο οποίος απελευθερώνει νοραδρεναλίνη από τα προσυναπτικά κυστίδια στον πλάγιο υποθάλαμο (48). Η αύξηση της συγκέντρωσης της νοραδρεναλίνης στη συναπτική σχισμή οδηγεί σε διέγερση των β2-αδρενεργικών υποδοχέων (49,50). Υπάρχει η θεωρία ότι η απώλεια βάρους που προκαλείται από την φεντερμίνη οφείλεται σε αύξηση του βασικού μεταβολικού ρυθμού ηρεμίας (51). Η χημική δομή της φεντερμίνης μοιάζει με της αμφεταμίνης, αλλά η χρήση της φεντερμίνης δε συνοδεύεται από εθισμό. Η τοπιραμάτη χρησιμοποιείται για τη θεραπεία της επιληψίας και της ημικρανίας. Η τοπιραμάτη προέρχεται από προσθήκη σουλφαμίδης σε ένα μονοσακχαρίτη, που είναι παράγωγο της d-φρουκτόζης (48). Οι μηχανισμοί της προκαλούμενης από την τοπιραμάτη απώλειας βάρους δεν είναι πλήρως ξεκαθαρισμένοι. Η τοπιραμάτη είναι ανταγωνιστής των υποδοχέων a-amino-3-hydroxy-5-methyl-4-isoxazole- propionicacidkainate (AMPA/KA), οι οποίοι εμπλέκονται σε ψυχοπαθολογικές καταστάσεις ψυχαναγκαστικών και εθιστικών συμπεριφορών (52). Όντως, η τοπιραμάτη έχει βρεθεί ότι μειώνει το «τσιμπολόγημα» τροφής (bingeeatingdisorder) (53). Εκτός αυτού, η ενεργοποίηση των υποδοχέων GABA από την τοπιραμάτη πιθανώς να συμβάλλει στη μείωση της πρόσληψης τροφής (54). Παράλληλα, η τοπιραμάτη φαίνεται να μειώνει την αποθήκευση λίπους ανεξάρτητα από μεταβολές της πρόσληψης τροφής (55). Συγκεκριμένα, η τοπιραμάτη αναστέλλει το ισοένζυμο V της μιτοχονδριακής καρβονικής ανυδράσης των λιποκυττάρων και συνεπώς αναστέλλει τη λιπογέννεση, οδηγώντας σε μείωση της αποθήκευσης λίπους (56-58) Επίσης, η τοπιραμάτη αυξάνει τη δραστηριότητα της λιποπρωτεϊνικής λιπάσης στον καφεοειδή λιπώδη ιστό και στους σκελετικούς μύες, αυξάνοντας αντίστοιχα τη θερμογένεση και τον καταβολισμό των ενεργειακών υποστρωμάτων (55).
Ο συνδυασμός PHEN/TOP είναι εμπορικά διαθέσιμος σε μορφή κάψουλας παρατεταμένης αποδέσμευσης με 4 διαφορετικές περιεκτικότητες: 3,75 mg/23 mg, 7,5 mg/46mg, 11,25 mg/69 mg και 15 mg/92 mg. Το συστεινόμενο δοσολογικό σχήμα είναι 3,75 mg/23 mg για 14 ημέρες και ακολούθως 7,5 mg/46mg για 12 εβδομάδες. Αν σε αυτό το χρονικό σημείο η απώλεια βάρους είναι < 3% του αρχικού βάρους, τότε θα πρέπει το φάρμακο να διακοπεί ή να αυξηθεί η δοσολογία του, γιατί δε θεωρείται πιθανό να επιτευχθεί κλινικά σημαντική απώλεια βάρους με συνεχιζόμενη θεραπεία στη δόση 7,5 mg/46mg. Προκειμένου να αυξηθεί η δοσολογία, θα πρέπει να δοθεί 11,25 mg/69 mg για 14 ημέρες και στη συνέχεια 15 mg/92 mg για 12 εβδομάδες. Αν σε αυτό το χρονικό σημείο η απώλεια βάρους είναι < 5% του αρχικού βάρους, τότε θα πρέπει το φάρμακο να διακοπεί, γιατί δε θεωρείται πιθανό να επιτευχθεί κλινικά σημαντική απώλεια βάρους με συνεχιζόμενη θεραπεία στη δόση 15 mg/92 mg. Το PHEN/TOP συστήνεται να λαμβάνεται το πρωί με ή χωρίς ταυτόχρονη λήψη φαγητού, ενώ θα πρέπει να αποφεύγεται η λήψη του το βράδυ για το πιθανό ενδεχόμενο της πρόκλησης αϋπνίας. Η διακοπή της δόσης 15 mg/92 mg ενδείκνυται να γίνεται προοδευτικά με μείωση της δόσης κάθε δεύτερη ημέρα για τουλάχιστον 1 εβδομάδα πριν την πλήρη διακοπή της θεραπείας, λόγω του ενδεχομένου πρόκλησης επιληπτικών σπασμών.Ο συνδυασμός PHEN/TOP στις δόσεις 3,75 mg/23 mg, 7,5 mg/46mg και 15 mg/92 mg και υγιεινοδιαιτητικής παρέμβασης βρέθηκε στις μελέτες CONQUER καιEQUIP ότι προκαλεί 5,1%, 8,1 % και 10,2-10,9% απώλεια βάρους αντίστοιχα μετά από 1 έτος και 3,5%, 6,7% και 8,8-9,3% μεγαλύτερη απώλεια βάρους αντίστοιχα μετά από 1 έτος σε σχέση με το συνδυασμό εικονικού φαρμάκου και υγιεινοδιαιτητικής παρέμβασης (59,60).
Οι παρενέργειες του συνδυασμού PHEN/TOP μπορούν να αποδοθούν στις ανεπιθύμητες ενέργειες της φεντερμίνης και της τοπιραμάτης ξεχωριστά. Οι πιο συχνές παρενέργειες του PHEN/TOP είναι παραισθησία, δυσγευσία, ξηροστομία, δυσκοιλιότητα και αϋπνία (48). Λιγότερο συχνές παρενέργειες είναι ευερεθιστότητα, άγχος, διαταραχή προσοχής και νεφρολιθίαση. Αυτές οι παρενέργειες έχουν παρατηρηθεί με τις δόσεις 7,5 mg/46mg και 15 mg/92 mg, αλλά όχι με τη δόση 3,75 mg/23 mg. Γενικά το PHEN/TOP έχει βρεθεί ότι είναι καλά ανεκτό κατά τη διάρκεια 2 ετών, με τη συχνότητα των παρενεργειών να είναι μειωμένη το δεύτερο έτος σε σχέση με το πρώτο έτος χορήγησης (61). Αύξηση της ΚΣ από το PHEN/TOP σε σχέση με το εικονικό φάρμακο έχει παρατηρηθεί μόνο με τη δόση 15 mg/92 mg, αλλά όχι με τις δόσεις 3,75 mg/23 mg και 7,5 mg/46mg. Οι αυξήσεις της ΚΣ από το συνδυασμό PHEN/TOPκαι υγιεινοδιαιτητικής παρέμβασης ήταν έως 1,7 σφύξεις/min. Σοβαρές παρενέργειες δεν έχουν παρατηρηθεί σε υψηλότερη συχνότητα με το PHEN/TOP σε σχέση με το εικονικό φάρμακο. Η λήψη PHEN/TOP αντενδείκνυται σε γνωστή υπερευαισθησία στις συμπαθητικομιμητικές αμίνες, γλαύκωμα, υπερθυρεοειδισμό, κατά τη διάρκεια της κύησης και κατά τη διάρκεια της λήψης αναστολέων της Μονοαμινοοξειδάσης (MAOI) ή έως και 14 ημέρες μετά τη διακοπή της αγωγής με MAOI, λόγω του κινδύνου πρόκλησης υπερτασικής κρίσης. Συστήνεται η εφαρμογή μεθόδων αντισύλληψης σε γυναίκες αναπαραγωγικής ηλικίας που λαμβάνουν το φάρμακο, καθώς και διακοπή της αγωγής σε περίπτωση εγκυμοσύνης.
2.5. Λορκασερίνη
Η λορκασερίνη είναι εγκεκριμένη ως θεραπεία για την απώλεια βάρους από τον FDA, αλλά όχι από τον EMA. Η λορκασερίνη είναι ένας εκλεκτικός αγωνιστής των υποδοχέων σεροτονίνης 5-HT2C (62). Η ενεργοποίηση αυτών των υποδοχέων στον υποθάλαμο από τη λορκασερίνη θεωρείται ότι διεγείρει τουςPOMC νευρώνες, προάγοντας έτσι το αίσθημα του κορεσμού, ώστε να οδηγεί σε απώλεια βάρους. Η λορκασερίνη συστήνεται να λαμβάνεται σε δοσολογία 10 mg ανά 12ωρο, ενώ η θεραπεία θα πρέπει να διακοπεί εφόσον δεν επιτευχθεί >5% απώλεια βάρους μετά από 12 εβδομάδες. Οι μελέτες BLOOM, BLOSSOM και BLOOM-DM έδειξαν ότι ο συνδυασμός λορκασερίνης σε δοσολογία 10 mg ανά 12ωρο και υγιεινοδιαιτητικής παρέμβασης προκαλεί 4,5-5,8% απώλεια βάρους μετά από ένα έτος και σε σχέση με το συνδυασμό εικονικού φαρμάκου και υγιεινοδιαιτητικής παρέμβασης προκαλεί 3,0-3,7% μεγαλύτερη απώλεια βάρους μετά από ένα έτος (63-65).
Οι πιο συχνές παρενέργειες της λορκασερίνης είναι κεφαλαλγία, λοιμώξεις ανώτερου αναπνευστικού, ζάλη και ναυτία, ενώ γενικά δε φαίνεται να συνοδεύεται η χρήση της από σοβαρές παρενέργειες (63-65).Η διέγερση των υποδοχέων 5-HT2B στο διάμεσο συνδετικό ιστό των καρδιακών βαλβίδων έχει ενοχοποιηθεί για πρόκληση σεροτονινεργικής βαλβιδοπάθειας, ιδιαίτερα ανεπάρκεια της αορτικής και μιτροειδούς βαλβίδας, και ερμηνεύει τη βαλβιδοπάθεια που προκαλούνταν από τους μη εκλεκτικούς σεροτονινεργικούς αγωνιστές φενφλουραμίνη και δεξφενφλουραμίνη, οι οποίοι χρησιμοποιούνταν παλαιότερα ως φάρμακα για την αντιμετώπιση της παχυσαρκίας, αλλά τελικά αποσύρθηκαν από την εμπορική κυκλοφορία λόγω αυτών των παρενεργειών (66,67). Δεδομένης της σχετικής εκλεκτικότητας της λορκασερίνης για τους υποδοχείς 5-HT2C και της ασθενούς επίδρασής της στους υποδοχείς 5-HT2B, η λορκασερίνη θεωρητικά αναμένεται να έχει ένα ευνοϊκό προφίλ όσον αφορά την ενδεχόμενη πρόκληση βαλβιδοπάθειας (62). Αν και η κάθε μία από τις κλινικές μελέτες που χρησιμοποίησαν λορκασερίνη σε δοσολογία 10 mg ανά 12ωρο δεν είχαν ικανή στατιστική ισχύ για να αποκλείσουν με ασφάλεια το ενδεχόμενο πρόκλησης βαλβιδοπάθειας από τη λορκασερίνη, μία μετα-ανάλυση των τριών κλινικών μελετών έδειξε ότι η λορκασερίνη δεν προκάλεσε σε μεγαλύτερο βαθμό FDA-οριζόμενη βαλβιδοπάθεια (ήπια ή σοβαρότερη αορτική ανεπάρκεια, τουλάχιστον μέτρια μιτροειδική ανεπάρκεια) μετά από ένα έτος σε σχέση με το εικονικό φάρμακο (68).Ωστόσο, η FDA-οριζόμενη βαλβιδοπάθεια που παρουσιάσθηκεήταν κυρίως ανεπάρκεια μιτροειδούς και παρουσίασε αρνητική συσχέτιση με τημεταβολή του σωματικού βάρους, τα οποία υποδηλώνουν ότι το μεγαλύτερο ποσοστό ανίχνευσης βαλβιδοπάθειαςπιθανώς να οφείλεται τουλάχιστον εν μέρει σε τεχνικούς λόγους, δηλαδή στη μεγαλύτερη δυνατότητα ανίχνευσης βαλβιδοπάθειας σε ασθενείς που έχουν χάσει περισσότερα κιλά και οι οποίοι συνεπώς έχουν καλύτερο ηχοκαρδιογραφικό παράθυρο (68). Θα πρέπει να αναγνωρισθεί όμως ότι οι σχετικές μελέτες χρήσης της λορκασερίνης ήταν διάρκειας έως ενός έτους, ώστε να είναι παρακινδυνευμένη η εξαγωγή οποιωνδήποτε συμπερασμάτων για την ασφάλεια της λήψης λορκασερίνης για διάρκεια άνω του ενός έτους.Είναι σκόπιμο να διενεργείταιυπερηχοκαρδιογράφημα πριν την έναρξη της θεραπείας με λορκασερίνη και ένα έτος μετά την έναρξη της θεραπείας, για την ανίχνευση ενδεχόμενης βαλβιδοπάθειας.
| Πίνακας 1. Η αποτελεσματικότητα και οι συχνότερες παρενέργειες των φαρμάκων για την παχυσαρκία. | |||
| % απώλεια βάρους στο 1 έτος | Επιπλέον % απώλεια βάρους σε σχέση με το εικονικό φάρμακο στο 1 έτος |
Συχνότερες παρενέργειες | |
| Ορλιστάτη (360 mg) | 8,8-10,2 | 3,0-4,1 | κοιλιακός μετεωρισμός, λιπαρές διάρροιες |
| Ναλτρεξόνη (32 mg)/Βουπροπιόνη (360 mg) | 5,0-9,3 | 3,2-5,2 | ναυτία, δυσκοιλιότητα, κεφαλαλγία, έμετος, ζάλη, αϋπνία, ξηροστομία, διάρροια, ↑ΚΣ, ↑ ΑΠ |
| Λιραγλουτίδη (3,0 mg) | 5,9-8,0 | 3,9-6,0 | ναυτία, έμετος, δυσκοιλιότητα, διάρροια, κεφαλαλγία, υπογλυκαιμία, ↑ ΚΣ |
| Φεντερμίνη (15 mg)/ Τοπιραμάτη (92 mg) | 10,2-10,9 | 8,8-9,3 | παραισθησία, δυσγευσία, ξηροστομία, δυσκοιλιότητα, αϋπνία, ↑ΚΣ |
| Λορκασερίνη (20 mg) | 4,5-5,8 | 3,0-3,7 | κεφαλαλγία, λοιμώξεις ανώτερου αναπνευστικού, ζάλη, ναυτία |
Συντμήσεις: Καρδιακή συχνότητα (ΚΣ), Αρτηριακή πιέση (ΑΠ).
3. Συμπεράσματα
Η χρησιμοποίηση φαρμάκων για την παχυσαρκία ενδείκνυται σε ασθενείς με BMI ≥ 30 kg/ m2 ή ≥ 27 kg/ m2 με συνύπαρξη τουλάχιστον μίας κατάστασης σχετιζόμενης με την παχυσαρκία, εφόσον διαπιστωθεί η αδυναμία να επιτευχθεί ο προεπιλεγμένος στόχος της 5% απώλειας βάρους στους 6 μήνες ή να διατηρηθεί αυτή η απώλεια στο χρόνο μέσω ολοκληρωμένων υγιεινοδιαιτητικών παρεμβάσεων. Εάν ένας ασθενής λαμβάνει φαρμακευτική αγωγή για την παχυσαρκία και δεν έχει επιτευχθεί απώλεια βάρους τουλάχιστον 5% του αρχικού βάρους εντός 12 εβδομάδων υπό μέγιστη δοσολογία του εν λόγω φαρμάκου θα πρέπει να εξετασθεί το ενδεχόμενο διακοπής του. Η ορλιστάτη, το NB32 και η λιραγλουτίδη είναι εγκεκριμένα φάρμακα για την αντιμετώπιση της παχυσαρκίας τόσο από τον EMA όσο και από τον FDA, ενώ το PHEN/TOP και η λορκασερίνη είναι εγκεκριμένα μόνο από τον FDA, αλλά όχι από τον EMA.Αυτά τα φάρμακα, εκτός από την απώλεια βάρους, οδηγούν και σε βελτίωση των καρδιομεταβολικών παραγόντων κινδύνου που σχετίζονται με την παχυσαρκία, αν και δεν υπάρχουν μελέτες που να έχουν διερευνήσει αν τα φάρμακα αυτά μειώνουν τα καρδιαγγειακά συμβάματα. Οι σχετικές μελέτες έχουν δείξει ότι τα φάρμακα για την παχυσαρκία είναι γενικά καλά ανεκτά και δεν οδηγούν σε αυξημένη συχνότητα σοβαρών παρενεργειών σε μία περίοδο χρήσης των φαρμάκων μέχρι 2 έτη. Θα πρέπει να αναγνωρισθεί η ανάγκη για μακροχρόνια χρήση των φαρμάκων για την παχυσαρκία, προκειμένου να αποφευχθεί η επαναπρόσληψη του σωματικού βάρους μετά την διακοπή των φαρμάκων αυτών και να αποκομίσουν τα θεραπευόμενα άτομα τα οφέλη της παρατεταμένης διατήρησης του χαμηλότερου σωματικού βάρους.Έτσι, η μακροπρόθεσμη ασφάλεια των φαρμάκων αυτών είναι αναγκαίο να διερευνηθεί με μακροχρόνιες μελέτες χρήσης αυτών των φαρμάκων.
Βιβλιογραφία
1. Jensen MD, Ryan DH, Apovian CM, Ard JD, Comuzzie AG, Donato KA et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation. 2014;129(25 Suppl 2):S102-S138.
2. Colman E. Food and Drug Administration’s Obesity Drug Guidance Document: a short history. Circulation. 2012;125(17):2156-64.
3. European Medicines Agency. Committee For Medicinal Products For Human Use (CHMP). Guideline on clinical evaluation of medicinal products used in weight control, November 2007. Available at http:// www.ema.europa. eu/docs/en_GB/document_library/ Scientific_guideline/2009/09/WC500003264.pdf.
4. Christopoulou FD, Kiortsis DN. 2011 An overview of the metabolic effects of rimonabant in randomized controlled trials: potential for other cannabinoid 1 receptor blockers in obesity. J Clin Pharm Ther. 36(1):10-8.
5. Van Gaal L, Pi-Sunyer X, Després JP, McCarthy C, Scheen A. Efficacy and safety of rimonabant for improvement of multiple cardiometabolic risk factors in overweight/obese patients: pooled 1-year data from the Rimonabant in Obesity (RIO) program. Diabetes Care. 2008;31 Suppl 2:S229-40.
6. Filippatos TD, Kiortsis DN, Liberopoulos EN, Mikhailidis DP, Elisaf MS. 2005 A review of the metabolic effects of sibutramine. Curr Med Res Opin. 21(3):457-68.
7. Scheen AJ Cardiovascular risk-benefit profile of sibutramine. Am J Cardiovasc Drugs. 2010;10(5):321-34.
8. James WP, Caterson ID, Coutinho W, Finer N, Van Gaal LF, Maggioni AP et al.; SCOUT Investigators. Effect of sibutramine on cardiovascular outcomes in overweight and obese subjects. N Engl J Med. 2010;363(10):905-17.
9. Guerciolini R. Mode of action of orlistat. Int J Obes Relat Metab Disord. 1997;21 Suppl 3:S12-23.
10. Kiortsis DN, Filippatos TD, Elisaf MS. The effects of orlistat on metabolic parameters and other cardiovascular risk factors. Diabetes Metab. 2005;31(1):15-22.
11. Sjöström L, Rissanen A, Andersen T, Boldrin M, Golay A, Koppeschaar HP et al.. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. Lancet. 1998;352(9123):167-72.
12. Davidson MH, Hauptman J, DiGirolamo M, Foreyt JP, Halsted CH, Heber D et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA. 1999;281(3):235-42.
13. Torgerson JS, Hauptman J, Boldrin MN, Sjöström L. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care. 2004;27(1):155-61.
14. Nakou ES, Filippatos TD, Georgoula M, Kiortsis DN, Tselepis AD, Mikhailidis DP et al. The effect of orlistat and ezetimibe, alone or in combination, on serum LDL and small dense LDL cholesterol levels in overweight and obese patients with hypercholesterolaemia. Curr Med Res Opin. 2008;24(7):1919-29.
15. Nakou ES, Filippatos TD, Kiortsis DN, Derdemezis CS, Tselepis AD, Mikhailidis DP et al. The effects of ezetimibe and orlistat, alone or in combination, on high-density lipoprotein (HDL) subclasses and HDL-associated enzyme activities in overweight and obese patients with hyperlipidaemia. Expert Opin Pharmacother. 2008;9(18):3151-8.
16. Filippatos TD, Tsimihodimos V, Kostapanos M, Kostara C, Bairaktari ET, Kiortsis DN et al. Analysis of 6-month effect of orlistat administration, alone or in combination with fenofibrate, on triglyceride-rich lipoprotein metabolism in overweight and obese patients with metabolic syndrome. J Clin Lipidol. 2008;2(4):279-84.
17. Filippatos TD, Kiortsis DN, Liberopoulos EN, Georgoula M, Mikhailidis DP, Elisaf MS. Effect of orlistat, micronised fenofibrate and their combination on metabolic parameters in overweight and obese patients with the metabolic syndrome: the FenOrli study. Curr Med Res Opin. 2005;21(12):1997-2006.
18. Wadden TA, Anderson DA, Foster GD. Two-year changes in lipids and lipoproteins associated with the maintenance of a 5% to 10% reduction in initial weight: some findings and some questions. Obes Res. 1999;7(2):170-8.
19. Chanoine JP, Hampl S, Jensen C, Boldrin M, Hauptman J. Effect of orlistat on weight and body composition in obese adolescents: a randomized controlled trial. JAMA. 2005;293(23):2873-83.
20. Christou GA, Kiortsis DN. The efficacy and safety of the naltrexone/bupropion combination for the treatment of obesity: an update. Hormones (Athens). 2015;14(3):370-5.
21. Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J et al; COR-I Study Group. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2010;376(9741):595-605.
22. Wadden TA, Foreyt JP, Foster GD, Hill JO, Klein S, O’Neil PM et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obesity (Silver Spring). 2011;19(1):110-120.
23. Apovian CM, Aronne L, Rubino D, Still C, Wyatt H, Burns C et al; COR-II Study Group. A randomized, phase 3 trial of naltrexone SR/bupropion SR on weight and obesity-related risk factors (COR-II). Obesity (Silver Spring). 2013;21(5):935-943.
24. Hollander P, Gupta AK, Plodkowski R, Greenway F, Bays H, Burns C et al; COR-Diabetes Study Group. Effects of naltrexone sustained-release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care. 2013;36(12):4022-4029.
25. Wilcox CS, Oskooilar N, Erickson JS, Billes SK, Katz BB, Tollefson G et al. An open-label study of naltrexone and bupropion combination therapy for smoking cessation in overweight and obese subjects. Addict Behav. 2010;35(3):229-34.
26. Christou GA, Katsiki N, Kiortsis DN. The current role of liraglutide in the pharmacotherapy of obesity. Curr Vasc Pharmacol. 2015. [In press]
27. Holst JJ. The physiology of glucagon-like peptide 1. Physiol Rev. 2007;87(4):1409-39.
28. Agersø H, Jensen LB, Elbrønd B, Rolan P, Zdravkovic M. The pharmacokinetics, pharmacodynamics, safety and tolerability of NN2211, a new long-acting GLP-1 derivative, in healthy men. Diabetologia. 2002;45(2):195-202.
29. van Bloemendaal L, Ten Kulve JS, la Fleur SE, Ijzerman RG, Diamant M. Effects of glucagon-like peptide 1 on appetite and body weight: focus on the CNS. J Endocrinol. 2014;221(1):T1-16.
30. van Can J, Sloth B, Jensen CB, Flint A, Blaak EE, Saris WH. Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond). 2014;38(6):784-93.
31. Vrang N, Phifer CB, Corkern MM, Berthoud HR. Gastric distension induces c-Fos in medullary GLP-1/2-containing neurons. Am J Physiol Regul Integr Comp Physiol. 2003;285(2):R470-8.
32. Lean ME, Carraro R, Finer N, Hartvig H, Lindegaard ML, Rössner S et al; NN8022-1807 Investigators. Tolerability of nausea and vomiting and associations with weight loss in a randomized trial of liraglutide in obese, non-diabetic adults. nt J Obes (Lond). 2014;38(5):689-97.
33. Thum T, Anker SD. Liraglutide for weight loss in obese people. Lancet. 2010;375(9714):551-2.
34. Secher A, Jelsing J, Baquero AF, Hecksher-Sørensen J, Cowley MA, Dalbøge LS et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. J Clin Invest. 2014;124(10):4473-88.
35. Sisley S, Gutierrez-Aguilar R, Scott M, D’Alessio DA, Sandoval DA, Seeley RJ. Neuronal GLP1R mediates liraglutide’s anorectic but not glucose-lowering effect. J Clin Invest. 2014;124(6):2456-63.
36. Farr OM, Sofopoulos M, Tsoukas M, Dincer F, Thakkar B, Sahin-Efe A et al. GLP-1 receptors exist in the parietal cortex, hypothalamus, and medulla of human brains and the GLP-1 analog liraglutide administered in the context of a cross-over, randomized, placebo-controlled trial alters brain activity related to attention to highly desirable food cues in individuals with diabetes. Diabetologia. 2016 [In press]
37. Astrup A, Rössner S, Van Gaal L, Rissanen A, Niskanen L, Al Hakim M et al; NN8022-1807 Study Group. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet. 2009;374(9701):1606-16.
38. Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean ME et al; NN8022-1807 Investigators. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond). 2012;36(6):843-54.
39. Wadden TA, Hollander P, Klein S, Niswender K, Woo V, Hale PM et al; NN8022-1923 Investigators. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: the SCALE Maintenance randomized study. Int J Obes (Lond). 2013;37(11):1443-51.
40. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M et al; SCALE Obesity and Prediabetes NN8022-1839 Study Group. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015;373(1):11-22.
41. Davies MJ, Bergenstal R, Bode B, Kushner RF, Lewin A, Skjøth TV et al; NN8022-1922 Study Group. Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 Diabetes: The SCALE Diabetes Randomized Clinical Trial. JAMA. 2015;314(7):687-99.
42. Lovshin JA, Barnie A, DeAlmeida A, Logan A, Zinman B, Drucker DJ. Liraglutide promotes natriuresis but does not increase circulating levels of atrial natriuretic peptide in hypertensive subjects with type 2 diabetes. Diabetes Care. 2015;38(1):132-9.
43. Robinson LE, Holt TA, Rees K, Randeva HS, O’Hare JP. Effects of exenatide and liraglutide on heart rate, blood pressure and body weight: systematic review and meta-analysis. BMJ Open. 2013;3(1). pii: e001986.
44. Katsiki N, Christou GA, Kiortsis DN. Editorial: Liraglutide and Cardiometabolic Effects: More than Just Another Antiobesity Drug? Curr Vasc Pharmacol. 2016;14(1):76-9.
45. Giannoglou GD, Chatzizisis YS, Zamboulis C, Parcharidis GE, Mikhailidis DP, Louridas GE. Elevated heart rate and atherosclerosis: an overview of the pathogenetic mechanisms. Int J Cardiol. 2008;126(3):302-12.
46. Seufert J, Gallwitz B. The extra-pancreatic effects of GLP-1 receptor agonists: a focus on the cardiovascular, gastrointestinal and central nervous systems. Diabetes Obes Metab. 2014;16(8):673-88.
47. Chiu WY, Shih SR, Tseng CH. A review on the association between glucagon-like peptide-1 receptor agonists and thyroid cancer. Exp Diabetes Res. 2012;2012:924168.
48. Kiortsis DN. A review of the metabolic effects of controlled-release Phentermine/Topiramate. Hormones (Athens). 2013;12(4):507-16.
49. Ioannides-Demos LL, Piccenna L, McNeil JJ. Pharmacotherapies for obesity: past, current, and future therapies. J Obes. 2011;2011:179674.
50. Witkamp RF. Current and future drug targets in weight management. Pharm Res. 2011;28(8):1792-818.
51. Bays H. Phentermine, topiramate and their combination for the treatment of adiposopathy (‘sick fat’) and metabolic disease. Expert Rev Cardiovasc Ther. 2010;8(12):1777-801.
52. Khazaal Y, Zullino DF. Topiramate-induced weight loss is possibly due to the blockade of conditioned and automatic processes. Eur J Clin Pharmacol. 2007;63(9):891-2.
53. McElroy SL, Arnold LM, Shapira NA, Keck PE Jr, Rosenthal NR, Karim MR. Topiramate in the treatment of binge eating disorder associated with obesity: a randomized, placebo-controlled trial. Am J Psychiatry. 2003;160(2):255-61.
54. Turenius CI, Htut MM, Prodon DA, Ebersole PL, Ngo PT, Lara RN. GABA(A) receptors in the lateral hypothalamus as mediators of satiety and body weight regulation. Brain Res. 2009;1262:16-24.
55. Richard D, Ferland J, Lalonde J, Samson P, Deshaies Y. Influence of topiramate in the regulation of energy balance. Nutrition. 2000;16(10):961-6.
56. Winum JY, Scozzafava A, Montero JL, Supuran CT. Sulfamates and their therapeutic potential. Med Res Rev. 2005;25(2):186-228.
57. Poulsen SA, Wilkinson BL, Innocenti A, Vullo D, Supuran CT. Inhibition of human mitochondrial carbonic anhydrases VA and VB with para-(4-phenyltriazole-1-yl)-benzenesulfonamide derivatives. Bioorg Med Chem Lett. 2008;18(16):4624-7.
58. Vullo D, Franchi M, Gallori E, Antel J, Scozzafava A, Supuran CT. Carbonic anhydrase inhibitors. Inhibition of mitochondrial isozyme V with aromatic and heterocyclic sulfonamides. J Med Chem. 2004;47(5):1272-9.
59. Gadde KM, Allison DB, Ryan DH, Peterson CA, Troupin B, Schwiers ML. Effects of low-dose, controlled-release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo-controlled, phase 3 trial. Lancet. 2011;377(9774):1341-52.
60. Allison DB, Gadde KM, Garvey WT, Peterson CA, Schwiers ML, Najarian T. Controlled-release phentermine/topiramate in severely obese adults: a randomized controlled trial (EQUIP). Obesity (Silver Spring). 2012;20(2):330-42.
61. Garvey WT, Ryan DH, Look M, Gadde KM, Allison DB, Peterson CA. Two-year sustained weight loss and metabolic benefits with controlled-release phentermine/topiramate in obese and overweight adults (SEQUEL): a randomized, placebo-controlled, phase 3 extension study. Am J Clin Nutr. 2012;95(2):297-308.
62. Thomsen WJ, Grottick AJ, Menzaghi F, Reyes-Saldana H, Espitia S, Yuskin D. Lorcaserin, a novel selective human 5-hydroxytryptamine2C agonist: in vitro and in vivo pharmacological characterization. J Pharmacol Exp Ther. 2008;325(2):577-87.
63. Smith SR, Weissman NJ, Anderson CM, Sanchez M, Chuang E, Stubbe S et al; Behavioral Modification and Lorcaserin for Overweight and Obesity Management (BLOOM) Study Group.
64. Fidler MC, Sanchez M, Raether B, Weissman NJ, Smith SR, Shanahan WR et al; BLOSSOM Clinical Trial Group.
65. O’Neil PM, Smith SR, Weissman NJ, Fidler MC, Sanchez M, Zhang J et al. Randomized placebo-controlled clinical trial of lorcaserin for weight loss in type 2 diabetes mellitus: the BLOOM-DM study. Obesity (Silver Spring). 2012;20(7):1426-36.
66. Connolly HM1, Crary JL, McGoon MD, Hensrud DD, Edwards BS, Edwards WD et al. Valvular heart disease associated with fenfluramine-phentermine. N Engl J Med. 1997;337(9):581-8.
67. Weissman NJ, Tighe JF Jr, Gottdiener JS, Gwynne JT. An assessment of heart-valve abnormalities in obese patients taking dexfenfluramine, sustained-release dexfenfluramine, or placebo. Sustained-Release Dexfenfluramine Study Group. N Engl J Med. 1998;339(11):725-32.
68. Weissman NJ, Sanchez M, Koch GG, Smith SR, Shanahan WR, Anderson CM. Echocardiographic assessment of cardiac valvular regurgitation with lorcaserin from analysis of 3 phase 3 clinical trials. Circ Cardiovasc Imaging. 2013;6(4):560-7.
Created: September 12, 2016
Last update: September 12, 2016

