Αθηνά Παππά
Διπλωματύχος Χημικός Μηχανικός ΑΠΘ, Κλινικός Χημικός
Υπεύθυνη Ενδοκρινολογικού Εργαστηρίου Τμήμα Ενδοκρινολογίας,
Διαβήτου & Μεταβολισμού, Γ.Ν. Έλενα Βενιζέλου
Εισαγωγή
Οι ιατροί απαιτούν ποιότητα από τον υποστηρικτικό εργαστηριακό έλεγχο για την ακριβή διάγνωση αλλά και την οικονομική διαχείριση των διαταραχών του θυρεοειδούς των ασθενών. Όταν υπάρχει ισχυρή κλινική υποψία διαταραχής,όπως για παράδειγμα σ’ έναν έντονο κλινικό υπερθυρεοειδισμό ενός νέου ενήλικα, η ταχεία αύξηση των θυρεοειδικών ορμονών που μετράται στο εργαστήριο έρχεται να την επιβεβαιώσει. Στο μεγαλύτερο αριθμό των ασθενών, τα συμπτώματα μιας θυρεοειδικής νόσου είναι δυσδιάκριτα και έτσι ο βιοχημικός έλεγχος και η κυτταροπαθολογική εκτίμηση μπορούν να βοηθήσουν στην ανίχνευση της διαταραχής. Ως εκ τούτου το έντονο ή ασαφές θυρεοειδικό πρόβλημα ενός ασθενούς είναι μια ανοιχτή συνεργασία μεταξύ των ιατρών και των κλινικών εργαστηριακών επιστημόνων.
1. Ανοσοχημικές τεχνικές ανάλυσης
Γενικά, ο προσδιορισμός ουσιών στα βιολογικά υγρά παρουσιάζει προβλήματα λόγω της μικρής ποσότητας του δείγματος, της μικρής συγκέντρωσης ουσιών αλλά και του πλήθους των ουσιών που παρεμβαίνουν σ’ αυτόν. Για το λόγο αυτό απαιτούνται μέθοδοι προσδιορισμού με υψηλή ευασθησία και πολύ μεγάλη εξειδίκευση. Έτσι αναπτύχθηκαν οι ανοσοχημικές τεχνικές ανάλυσης (immunoassays) ώστε να προσδιορίζεται με ακρίβεια οποιαδήποτε ουσία για την οποία μπορεί να αναπτυχθεί ειδικό αντίσωμα. Η μη απαίτηση εδικής προετοιμασίας του δείγματος καθώς και η μερική ή πλήρης αυτοματοποίηση των μεθόδων αυτών οδήγησε σε μεγάλη αύξηση των εφαρμογών στην κλινική βιοχημεία, στην κλινική φαρμακολογία, στην ανοσολογία, στη μικροβιολογία και στην ενδοκρινολογία.
Η αρχή τους βασίζεται στην αντίδραση μεταξύ δύο ουσιών τη συνδετική (binder) και την επισημασμένη (ligand). Αρχικά γίνεται η αντίδραση μεταξύ binder και ligand,στη συνέχεια ακολουθεί ο κορεσμός του binder από το ligand και τέλος ο διαχωρισμός φάσεων του επισημασμένου ελεύθερου και συνδεδεμένου. Αν η συνδετική ένωση είναι αντίσωμα η ανάλυση καλείται Immunoassay(ανοσοανάλυση), αν είναι ειδική πρωτείνη αίματος Competitive Protein Binding assay και τέλος αν είναι ειδική πρωτείνη κυττάρου Receptor assay. Η αρχή των ανοσοαναλύσεων βασίζεται στην ένωση αντιγόνου (Ag) και αντισώματος (Ab) προς σχηματισμό σταθερού συμπλόκου Ag-Ab, από το οποίο υπολογίζεται η συγκέντρωση του Ag.
Ag+Ab«Ag–Ab
Η ευαισθησία της μεθόδου εξαρτάται από τη συγγένεια του αντισώματος με το αντιγόνο και την ευαισθησία της μεθόδου προσδιορισμού του συμπλόκου Ag-Ab.
Οι ανοσοχημικές τεχνικές διακρίνονται σε αυτές που δεν χρησιμοποιούν επισημασμένα αντιδραστήρια και έχουν περιορισμένη εφαρμογή λόγω μικρής ευαισθησίας και απαίτησης για δεύτερη αντίδραση ώστε να προσδιοριστεί το Ag-Ab και αυτές που χρησιμοποιούν επισημασμένα αντιδραστήρια με ιχνηθέτες (tracer) μόρια που εκπέμπουν κάποιο σήμα όπως ραδιενεργά ισότοπα, φθορίζουσες ουσίες, ένζυμα ή χημειοφωταυγείς ουσίες. Οι τελευταίες βασίζονται στην αντίδραση:
AgL+Ag+Ab ®Ag-Ab+AgL-Ab
Το AgL ανταγωνίζεται με Ag ως προς τη δέσμευσή του στο ειδικό αντίσωμα Ab. Μετρείται μόνο το AgL-Ab λόγω του σήματος του ιχνηθέτη. Διακρίνονται σε:
- Ανταγωνιστικές (RIA) και
- Μη Ανταγωνιστικές ή Μεθόδους προσδιορισμού 2 θέσεων (2 site assays) ή Προσδιορισμούς τύπου sandwich (IRMA).
Στις RIA το επισημασμένο AgL ανταγωνίζεται με το φυσικό Ag στη δέσμευσή του με το αντίσωμα που υπάρχει σε σταθερή, περιορισμένη συγκέντρωση στο μίγμα της αντίδρασης, ενώ στις IRMA το φυσικό Ag δεσμεύεται με 2 αντισώματα, το επισημασμένο και το μη επισημασμένο. Τα επισημασμένα αντιδραστήρια μπορεί να είναι αντιγόνα ή αντισώματα που συνδέονται στοιχειομετρικά μ’ ένα ή περισσότερα μόρια ιχνηθέτη και πρέπει να διατηρούν τις ίδιες ιδιότητες και την ίδια συμπεριφορά με τα φυσικά αντιδραστήρια.
Οι ιχνηθέτες είναι ουσίες που μπορούν να εκπέμπουν κάποιο σήμα ή να προκαλούν την παρουσία υποστρώματος. Χαρακτηρίζονται από την ειδική ενεργότητα (specific activity), που εκφράζει το μέγεθος του σήματος που παράγεται από 1 gmole επισημασμένου αντιδραστηρίου στη μονάδα του χρόνου. Το σήμα είναι ανάλογο με το είδος του ιχνηθέτη:
Αν ο ιχνηθέτης είναι ραδιενεργό ισότοπο τότε μετράται ο αριθμός των ραδιενεργών διασπάσεων (Radio-immunoassay). Αν ο ιχνηθέτης είναι ένζυμο μετράται ο αριθμός των μορίων του υποστρώματος που τροποποιήθηκαν, λόγω της δράσης του ενζύμου (Enzymo-immunoassay-Elisa). Η μέθοδος είναι κατάλληλη για ενώσεις που κυκλοφορούν στο αίμα σε μεγάλες ποσότητες και απαιτείται η ποιοτική τους ανάλυση Τέλος, αν ο ιχνηθέτης είναι φθορίζουσα ουσία ή ουσία που εκπέμπει χημειοφωταύγεια τότε μετράται η ένταση της εκπεμπόμενης ακτινοβολίας (Fluro-immunoassay & Chemiluminescence αντίστοιχα). Η ευαισθησία του προσδιορισμού εξαρτάται από την ειδική ενεργότητα του ιχνηθέτη, την καθαρότητα του επισημασμένου αντιδραστηρίου και την ακριβή μέτρηση του παραγόμενου σήματος.
2. Τεχνικές προσδιορισμού ορμονών θυρεοειδούς
Τα τελευταία 40 χρόνια, οι βελτιώσεις στην ευαισθησία και στην εξειδίκευση των βιοχημικών αναλύσεων του θυρεοειδούς όπως επίσης και στην ανάπτυξη του FNA και των βελτιωμένων κυτταρολογικών τεχνικών έχουν επιπτώσεις στις στρατηγικές κλινικής ανίχνευσης και θεραπείας των διαταραχών του θυρεοειδούς. Το 1950 μόνο ένα θυρεοειδικό τεστ βασιζόμενο σε ορό ήταν διαθέσιμο-μια έμμεση εκτίμηση της συγκέντρωσης της ολικής (ελεύθερης και δεσμευμένης με πρωτείνη) θυροξίνης (Τ4) με τη χρήση της PBI (protein bound iodide) τεχνικής. Σήμερα οι ιωδιούχες συγκεντρώσεις στα ούρα μετρώνται άμεσα με τεχνικές ξηρής ή υγρής τέφρας και χρησιμοποιούνται για την εκτίμηση διαιτητικής εισαγωγής ιωδίου.
Οι ανταγωνιστικές ανοσοαναλύσεις στις αρχές του 1970 και αργότερα οι μη ανταγωνιστικές ανοσομετρικές (IRMA) βελτίωσαν εντυπωσιακά την ευαισθησία και την εξειδίκευση των αναλύσεων των θυρεοειδικών ορμονών.
Σήμερα αναλύσεις ορού είναι διαθέσιμες για τη μέτρηση ολικών (ΤΤ4 και ΤΤ3) και ελεύθερων (fT4 και fT3) θυρεοειδικών ορμονών στην κυκλοφορία (2,3). Επίσης, είναι διαθέσιμες μετρήσεις πρωτεινών συνδεδεμένων με πλάσμα όπως θυρεοδεσμευτική σφαιρίνη (Thyroxine Binding Globulin, TBG), Τρανσθυρετίνη (TTR)/Προαλβουμίνη (TBPA) και Λευκωματίνη (4). Οι βελτιώσεις στη μέτρηση της θυρεοειδοτρόπου ορμόνης (TSH) οδήγησαν στη χρήση της για ανίχνευση υπερ- και υπο-θυρεοειδισμού. Οι μετρήσεις της θυρεοσφαιρίνης (Tg) και της καλσιτονίνης (CT) στον ορό έγιναν σημαντικοί δείκτες όγκων για την αντιμετώπιση ασθενών με διαφοροποιημένα και μυελοειδή θυρεοειδικά καρκινώματα. Η αναγνώριση ότι η αυτοανοσία είναι η μεγαλύτερη αιτία της δυσλειτουργίας του θυρεοειδούς οδήγησε στην ανάπτυξη περισσότερο ευαίσθητων και εξειδικευμένων αναλύσεων για τα αυτοαντισώματα της θυρεοειδικής υπεροξειδάσης (TPOAb), της θυρεοσφαιρίνης (TgAb) και των υποδοχέων της TSH (TRAb).
Οι τρέχουσες θυρεοειδικές αναλύσεις εκτελούνται στον ορό είτε με χειροποίητες είτε με αυτοματοποιημένες μεθόδους που χρησιμοποιούν εξειδικευμένα αντισώματα. Η μεθοδολογία συνεχίζει να εξελίσσεται καθώς τα πρότυπα της εκτέλεσης τροποποιούνται και αναπτύσσονται νέες τεχνολογίες με καινούρια μηχανήματα (5).
2.1. Ολική Θυροξίνη (ΤΤ4) – Ολική Τριωδοθυρονίνη (ΤΤ3)
Η Θυροξίνη (Τ4) είναι η κύρια ορμόνη που εκκρίνεται από τον θυρεοειδή αδένα. Όλη η Τ4 στην κυκλοφορία προέρχεται από θυρεοειδική έκκριση. Αντίθετα, μόνο το 20% της κυκλοφορούσας τριιωδοθυρονίνης (Τ3) είναι θυρεοειδικής προέλευσης. Η περισσότερη από την Τ3 στο αίμα παράγεται ενζυμικά σε μη θυρεοειδικούς ιστούς με 5’-αποιωδίωση της Τ4. Στην πραγματικότητα, η Τ4 φαίνεται να λειτουργεί ως μια προ-ορμόνη για την παραγωγή της πιο βιολογικά δραστικής μορφής της ορμόνης του θυρεοειδούς Τ3.
Στην κυκλοφορία, η περισσότερη (~99,98%) T4 δεσμεύεται με συγκεκριμένες πρωτεΐνες πλάσματος,την (TBG) (60-75%),TTR/ΤΒΡΑ (15-30%) και λευκωματίνη (~10%) (4). Περίπου το 99,7% της Τ3 στην κυκλοφορία συνδέεται με πρωτεΐνες του πλάσματος, ειδικά με TBG (6). Αυτό αντιπροσωπεύει μία κατά 10-φορές ασθενέστερη δέσμευση πρωτεϊνών από ό,τι παρατηρείται στην Τ4. Οι θυρεοειδικές ορμόνες που είναι προσδεδεμένες με τις πρωτείνες δεν εισέρχονται στα κύτταρα και συνεπώς θεωρούνται βιολογικά αδρανείς, οπότε λειτουργούν ως δεξαμενές αποθήκευσης για την κυκλοφορία των θυρεοειδικών ορμονών. Αντίθετα, τα λεπτά κλάσματα ελεύθερων ορμονών εισέρχονται εύκολα στα κύτταρα με εξειδικευμένους μηχανισμούς μεταφοράς στη μεμβράνη ώστε να ασκήσουν τις βιολογικές επιδράσεις τους. Στην υπόφυση, η αρνητική ανάδραση των θυρεοειδικών ορμονών στην έκκριση της TSH γίνεται κυρίως από T3 που παράγεται στο χώρο της εισόδου ελεύθερης Τ4 στα θυρεοειδοτρόπα κύτταρα.
Τεχνικά, είναι πιο εύκολο ν’ αναπτυχθούν μέθοδοι για τη μέτρηση της ολικής (ελεύθερης+προσδεδεμένης με πρωτεΐνη) θυρεοειδικής ορμόνης, παρά μόνο της ελεύθερης. Αυτό συμβαίνει γιατί οι ολικές συγκεντρώσεις ορμόνης (TT4 και TT3) μετρώνται σε επίπεδα nmoles, ενώ οι συγκεντρώσεις των ελεύθερων (FT4 και FT3) σε επίπεδα pmoles και για να είναι έγκυρες, πρέπει να είναι απαλλαγμένες από παρεμποδίσεις πολύ υψηλότερων συγκεντρώσεων ολικών ορμονών.
2.1.1. Μέθοδοι μέτρησης
Οι αναλύσεις PBI της δεκαετίας του 1950,που υπολόγιζαν τις συγκεντρώσεις TT4 ως «ιωδιούχες πρωτεΐνες πρόσδεσης» αντικαταστάθηκαν αρχικά με ανταγωνιστικές μεθόδους δέσμευσης πρωτείνης (δεκαετία του 1960), και με ραδιοανοσολογικές μεθόδους (RIA) (δεκαετία του 1970).
Σήμερα, οι συγκεντρώσεις TT4, ΤΤ3 μετρώνται με ανταγωνιστικές μεθόδους ανοσοανάλυσης που συνήθως είναι μη ισοτοπικές και χρησιμοποιούν ένζυμα, φθορισμό ή χημειοφωταυγή μόρια ως σήματα. Απαιτούν τη συμπερίληψη ενός αναστολέα (που αντικαθιστά ή μπλοκάρει), όπως το 8-ανιλινο-1-ναφθαλινο-σουλφονικό οξύ (ANS), ή σαλικυλικό άλας που απελευθερώνει την ορμόνη από τις πρωτεΐνες δέσμευσης (7,8). Η εκτόπιση της ορμόνης δέσμευσης από πρωτεΐνες ορού με τέτοιους παράγοντες, σε συνδυασμό με τη μεγάλη αραίωση του δείγματος που χρησιμοποιείται στις σύγχρονες αναλύσεις, διευκολύνει την πρόσδεση της ορμόνης στο αντιδραστήριο αντίσωμα.
Η χαμηλότερη κατά 10 φορές συγκέντρωση ΤΤ3, σε σύγκριση με την TT4, παρουσιάζει ευαισθησία στην τεχνική και μια ακρίβεια, παρά τη χρήση ενός μεγαλύτερου όγκου δείγματος. Αν και η αξιόπιστη μέτρηση TT3 σε μεγάλο εύρος είναι κρίσιμης σημασίας για τη διάγνωση υπερθυρεοειδισμού, αξιόπιστες μετρήσεις στην κανονική κλίμακα είναι επίσης σημαντικές για την προσαρμογή της δοσολογίας των αντιθυρεοειδικών φαρμάκων και τον εντοπισμό του υπερθυρεοειδισμού σε νοσηλευόμενους ασθενείς, στους οποίους παραδόξως η κανονική τιμή της T3 μπορεί να υποδεικνύει υπερθυρεοειδισμό.
Παρά τη διαθεσιμότητα εντελώς καθαρών παρασκευασμάτων κρυσταλλικής L-θυροξίνης και L-τριιωδοθυρονίνης, μέθοδοι αναφοράς για TT4 ή ΤΤ3 δεν έχουν ακόμα τεκμηριωθεί (9,10). Η υγροσκοπική φύση των κρυσταλλικών παρασκευασμάτων μπορεί να επηρεάσει την ακρίβεια. Επιπλέον, οι διαλύτες που χρησιμοποιούνται για την ανασύσταση L-T4 και L-T3 για χρήση ως βαθμονομητών είναι είτε τροποποιημένες πρωτεινικές μήτρες ή pools ανθρώπινων ορών που έχουν απογυμνωθεί από την ορμόνη με διάφορα μέσα (11). Σε κάθε περίπτωση, η σύνθεση των βαθμονομητών δεν είναι ταυτόσημη με αυτή των ορών των ασθενών. Αυτό μπορεί να επηρεάσει τη διαγνωστική ακρίβεια της ανάλυσης, όταν οι πρωτεΐνες πρόσδεσης είναι ανώμαλες, όπως στην περίπτωση NTI.
Συνεπώς σημαντικά για την ανάπτυξη τωνμεθόδων ΤΤ4 και ΤΤ3 είναι:
- η διασφάλιση ότι τα όργανα δεν είναι ευαίσθητα στις διαφορές μεταξύ ανθρώπινου ορού και βαθμονομητή και
- η εξασφάλιση ότι κατά τη διάρκεια της ανάλυσης, η ποσότητα της θυρεοειδικής ορμόνης που απελευθερώνεται από τις πρωτείνες δέσμευσης ορού είναι η ίδια με εκείνη που απελευθερώνεται από το βαθμονομητή
Η διαγνωστική ακρίβεια των μετρήσεων των ολικών θυρεοειδικών ορμονών θα ήταν ίση με εκείνη των ελεύθερων ορμονών, εάν όλοι οι ασθενείς είχαν ταυτόσημα επίπεδα πρωτεϊνών δέσμευσης (TBG, TTR/ΤΒΡΑ και λευκωματίνη) με παρόμοιες συνάφειες για τις θυρεοειδικές ορμόνες. Δυστυχώς, οι μη φυσιολογικές συγκεντρώσεις TT4 και ΤΤ3 πιο συχνά υπάρχουν ως αποτέλεσμα των ανωμαλιών πρωτεΐνης δέσμευσης παρά της αληθινής δυσλειτουργίας του θυρεοειδούς.
Οι ασθενείς με δευτερεύουσες ανωμαλίες TBG στην εγκυμοσύνη ή σε θεραπεία με οιστρογόνα, καθώς και γενετικές ανωμαλίες σε πρωτεΐνες πρόσδεσης, συχνότερα απαντώνται στην κλινική πρακτική. Αυτό μπορεί να στρεβλώσει τη σχέση μεταξύ της ολικής και της ελεύθερης ορμόνης. Επιπλέον, ορισμένοι οροί ασθενών περιέχουν άλλες παθολογικές πρωτεΐνες όπως αυτοαντισώματα έναντι των θυρεοειδικών ορμονών που καθιστούν τις μετρήσεις των ολικών ορμονών διαγνωστικά αναξιόπιστες. Αυτά τα προβλήματα καθιστούν τη χρήση των μετρήσεων TT4 και ΤΤ3 stand-alone εξετάσεις θυρεοειδούς.
Αντίθετα, οι μετρήσεις TT4 και TT3 ορού γίνονται συνήθως τμήμα ενός πίνακα δύο αναλύσεων που περιλαμβάνει την αξιολόγηση της κατάστασης πρωτεΐνης δέσμευσης, είτε απευθείας από μια ανάλυση TBG ή από ένα uptake test. Συγκεκριμένα, μια μαθηματική σχέση μεταξύ της συγκέντρωσης ολικής ορμόνης και του αποτελέσματος του uptake χρησιμοποιείται ως «δείκτης» ελεύθερης ορμόνης (12). Αυτοί οι δείκτες ελεύθερης ορμόνης (FT4I και FT3I) χρησιμοποιούνται για 3 δεκαετίες, αλλά γρήγορα αντικαταστάθηκαν από μονές ανοσοαναλύσεις εκτίμησης ελεύθερης ορμόνης.
Στην εικόνα 1 που ακολουθεί, η ολική ποσότητα πρωτεΐνης δέσμευσης αντιπροσωπεύεται από τις μη σκιασμένες ράβδους. Το μήκος της ράβδου δείχνει τη διαθέσιμη ικανότητα δέσμευσης. Σε ένα ευθυρεοειδικό άτομο προσεγγιστικά 50% της διαθέσιμης δεσμευτικής ικανότητας είναι κορεσμένο με θυρεοειδικές ορμόνες (ανοιχτό χρώμα). Το σκούρο κλάσμα είναι οι ελεύθερες ορμόνες (fT3, fT4), που στο τέλος καθορίζουν την κατάσταση του θυρεοειδούς του ασθενούς. Οι ολικές ορμόνες είναι το άθροισμα των δεσμευμένων και των ελεύθερων ορμονών (σκιασμένα τμήματα).

Εικόνα 1. Κυκλοφορούσες θυρεοειδικές ορμόνες-ελεύθερες και δεσμευμένες Τ3, Τ4.
Σε ασθενείς με υπερθυρεοσφαιριναιμία το ποσό της ολικής ορμόνης υπερβαίνει σαφώς αυτό ενός ατόμου με φυσιολογική θυρεοσφαιριναιμία αν και οι δύο είναι ευθυρεοειδικοί. Το αντίθετο αποτέλεσμα παρατηρείται σε πρόσωπα με υποθυρεοσφαιριναιμία, εφόσον το ποσό της συνολικής ορμόνης είναι μικρότερο από εκείνη ενός ατόμου με φυσιολογική θυρεοσφαιριναιμία, αν και οι δύο είναι ευθυρεοειδικοί. Σε αυτή την περίπτωση, η μέτρηση του συνόλου των ορμονών μπορεί να οδηγήσει σε λάθος διάγνωση, ενώ ο προσδιορισμός των ελεύθερων ορμονών δεν επηρεάζεται, γεγονός που οδηγεί σε σωστή διάγνωση!
Ο υπερ- και ο υποθυρεοειδισμός διαγιγνώσκονται σωστά χρησιμοποιώντας είτε ολικές ή ελεύθερες ορμόνες του θυρεοειδούς . Θεραπευτικά φάρμακα μπορούν να μειώσουν την ικανότητα δέσμευσης των δεσμευτικών πρωτεινών.
2.2. Ελεύθερη Θυροξίνη (FT4) – Τριιωδοθυρονίνη (FT3)
Η θυροξίνη στο αίμα είναι πιο στενά συνδεδεμένη με πρωτείνες ορού απ’ότι η Τ3 και έτσι η FT4, το βιοδιαθέσιμο κλάσμα, είναι μικρότερο από την FT3 αντίστοιχα (0,02% FT4, 0,2% FT3). Δυστυχώς οι φυσικές τεχνικές που χρησιμοποιούνται για το διαχωρισμό των ελεύθερων κλασμάτων από τα επικρατέστερα κλάσματα που είναι συνδεδεμένα με την πρωτείνη είναι τεχνικά απαιτητικές, δύσχρηστες, δεν αυτοματοποιούνται και είναι σχετικά δαπανηρές για χρήση ρουτίνας. Αυτές οι μέθοδοι όπως η διάλυση ισορροπίας, η υπερδιήθηση και η διήθηση γέλης είνσι τυπικά διαθέσιμες μόνο στα εργαστήρια αναφοράς.
Τα κλινικά εργαστήρια ρουτίνας χρησιμοποιούν μια ποικιλία αναλύσεων ελεύθερων ορμονών όπου εκτιμούν τη συγκέντρωση της ελεύθερης ορμόνης με την παρουσία ορμόνης συνδεδεμένης με την πρωτείνη.Υπάρχει αμφισβήτηση όσον αφορά την τεχνική σταθερότητα των μετρήσεων και την κλινική χρησιμότητά τους σε συνθήκες που συνδέονται με ανωμαλίες της σύνδεσης με τις πρωτείνες, (13,14,15).
Οι αναλύσεις των ελεύθερων ορμονών στα κλινικά εργαστήρια γίνονται χρησιμοποιώντας είτε μεθόδους δείκτες που απαιτούν δύο ξεχωριστά τεστ επισημασμένων αναλύσεων ή φυσικές μέθοδους διαχωρισμού που απομονώνουν το ελεύθερο από το δεσμευμένο κλάσμα της ορμόνης πριν μετρηθεί ευθέως το ελεύθερο. Οι αναλύσεις με επισημασμένα αντιδραστήρια τυποποιούνται είτε με διαλύματα που περιέχουν συγκεντρώσεις της ορμόνης δημιουργημένες βαρομετρικά ή με χρήση βαθμονομητών με τιμές που έχουν ληφθεί με μέθοδο φυσικού διαχωρισμού (διάλυση ισορροπίας και/ή υπερδιήθηση). Οι μέθοδοι δείκτες που έχουν επισημασμένα αντιδραστήρια είναι οι πιο ευρέως χρησιμοποιούμενες στα κλινικά εργαστήρια και τυπικά εκτελούνται σε αυτοματοποιημένους αναλυτές. Αυτές οι αναλύσεις εκτίμησης ελεύθερης ορμόνης συνήθως υπερεκτιμούν τα επίπεδα της FT4 σε ψηλές συγκεντρώσεις πρωτείνης και την υποεκτιμούν στις χαμηλές.
Υπάρχει ένα πλήθος όρων που χρησιμοποιούνται για να διακρίνουν τις διάφορες μεθόδους ελεύθερων ορμονών όπως «λόγος αποτελεσματικής θυροξίνης», «1 σταδίου», «αναλόγου», «2 σταδίων», «επανατιτλοδότησης», «διαδοχική», «ανοσοεκχύλιση» ή «ανοσοαπομόνωση», «επισημασμένη ανάλυση», γιατί οι κατασκευαστές έχουν τροποποιήσει τις αυθεντικές τεχνικές ή τις έχουν προσαρμόσει στην αυτοματοποίηση. Οι αναλύσεις αναλόγου-ορμόνης πρώτης γενιάς έδειξαν μεγάλη εξάρτηση από την προσδεδεμένη πρωτείνη και έτσι γρήγορα αντικαταστάθηκαν με τις αναλύσεις αναλόγου «επισημασμένου αντισώματος νέας γενιάς»,που είναι πιο ανθεκτικές στην ύπαρξη ανώμαλα προσδεδεμένων πρωτεινών.
2.2.1. Μέθοδοι Δείκτες: FT4I και FT3I
Αποτελούν αναλύσεις εκτίμησης ελεύθερης ορμόνης και απαιτούν δύο ξεχωριστές μετρήσεις. Η μία εξέταση είναι μέτρηση ολικής ορμόνης (ΤΤ4 ή ΤΤ3) και η άλλη μια εκτίμηση της προσδεδεμένης θυρεοειδικής πρωτείνης με χρήση ή μιας ανοσοανάλυσης για TBG ή μιας ανάλυσης Τ4 ή Τ3 “uptake” που ονομάζεται Λόγος Πρόσδεσης Θυρεοειδικής Ορμόνης (THBR). Εναλλακτικά, οι δείκτες μπορούν να υπολογιστούν από τον υπολογισμό μιας μέτρησης ΤΤ4 σε συνδυασμό με μια εκτίμηση κλάσματος ελεύθερης Τ4 που καθορίζεται από μια ισοτοπική διάλυση. Σ’αυτήν την περίπτωση η ποιότητα και η καθαρότητα του ιχνηθέτη έχει επιπτώσεις στην ακρίβεια του δείκτη (15,16).
2.2.1.1. Δείκτες με χρήση TBG μέτρησης
Ο υπολογισμός του FT4I χρησιμοποιώντας την TBG βελτιώνει τη διαγνωστική ακρίβεια συγκρινόμενη με την ΤΤ4. Παρά τα θεωρητικά πλεονεκτήματα της χρήσης της απευθείας μέτρησης TBG, οι TT4/TBG δείκτες σπάνια χρησιμοποιούνται γιατί η ικανότητα σύνδεσης TBG μπορεί να τροποποιηθεί ανεξάρτητα των αλλαγών της συγκέντρωσης TBG, ειδικά σε ασθενείς με ΝΤΙ. Επιπρόσθετα η σύνδεση της TBG αντανακλά το 60-75% της ικανότητας σύνδεσης που βασίζεται στην TBG μόνο, αποκλείοντας τη σύνδεσή της με την τρανσθυρετίνη και τη λευκωματίνη.
2.2.1.2. Δείκτες που χρησιμοποιούν το Λόγο Πρόσδεσης Θυρεοειδικής Ορμόνης (THBR) ή Uptake test
Τα uptake tests χρησιμοποιούνται για την εκτίμηση της πρωτείνης πρόσδεσης την θυρεοειδικών ορμονών από το 1950. Υπάρχουν δύο διαφορετικοί τύποι:
Τα «κλασικά» uptake tests όπου προστίθεται μια ποσότητα ίχνους ραδιοεπισημασμένου Τ3 ή Τ4 στο δείγμα και επιτρέπεται στην επισημασμένη ορμόνη να κατανέμεται κατά μήκος των πρωτεινών σύνδεσης θυροξίνης ακριβώς με τον ίδιο τρόπο με την ενδογενή ορμόνη (12,17). Αυτό μόλις που διαταράσσει την πραγματική ισορροπία. Η κατανομή του ιχνηθέτη εξαρτάται από τον κορεσμό των πρωτεινών. Επιπλέον ένα δεύτερο συνδετικό ή προσροφητικό υλικό (ρητίνη ανταλλαγής ιόντων, σπόγγος πολυουρεθάνης, κάρβουνο ή σφαιρίδια επικαλυμένα με αντίσωμα) επιφέρει μια ανακατανομή του ίχνους Τ3 ή Τ4 σε μια νέα ισορροπία, που τώρα περικλείει το συνδετικό.
Οι μετρήσεις του ιχνηθέτη που απορροφάται από το προσροφητικό υλικό, εξαρτώνται από τον κορεσμό των προσδεδεμένων πρωτεινών: μεγαλύτερος κορεσμός σημαίνει μεγαλύτερη ποσότητα του ιχνηθέτη στο προσροφητικό. Στην ουσία αποτελεί μια έμμεση μέτρηση TBG. Όταν η συγκέντρωση TBG είναι χαμηλή, οι πλευρικές συνδέσεις TBG είναι ισχυρά κορεσμένες με Τ4, έτσι ώστε μια μικρή ποσότητα προστιθέμενου ιχνηθέτη Τ3 συνδέεται με TBG και η μεγαλύτερη από το προσροφητικό. Δυστυχώς η σχέση μεταξύ THBR και συγκέντρωσης TBG είναι μη γραμμική και έτσι ο έλεγχος του δείκτη δεν διορθώνει τις ανωμαλίες ΤΤ4 που προέρχονται από ανώμαλες συγκεντρώσεις TBG.
Ένα κανονικό πρότυπο δείγμα ορού χρησιμοποιείται προκειμένου να ομαλοποιηθεί η απόκριση των αναλύσεων και να επιτραπεί η εκτύπωση του αποτελέσματος σαν πηλίκο προς το κανονικό (THBR) (17). Οι κλασσικές uptake αναλύσεις χρησιμοποιούν Τ3 ιχνηθέτη. Η διόρθωση της τιμής ΤΤ4 μ’ αυτόν τον τρόπο είναι αμφισβητήσιμη και έτσι οι τωρινές μη ισοτοπικές αναλύσεις χρησιμοποιούν Τ4 uptake.
Παραδοσιακά, ο δείκτης fT4, που πολλές φορές καλείται Τ7, προέρχεται από το προιόν ενός Τ3-uptake test και μιας μέτρησης ΤΤ4 και εκφράζεται σαν ένα % uptake (μετρήσεις προσδεδεμένου στο προσροφητικό προς ολικές μετρήσεις). Μια μεγάλη ποσότητα μη ισοτοπικά επισημασμένου ιχνηθέτη Τ4 χρησιμοποιείται για να αποφευχθεί η επίδραση της ενδογενούς Τ4.
Τα τρέχοντα THBR tests χρησιμοποιούνται για να παράγουν κανονικές τιμές FT4I και FT3I όταν υπάρχουν μέτριες ανωμαλίες TBG (εγκυμοσύνη). Κάποια απ’αυτά τα τεστ παράγουν ανώμαλες τιμές δεικτών, όταν οι ασθενείς έχουν ανώμαλες πρωτείνες σύνδεσης (εκ γενετής TBG ψηλή ή χαμηλή, οικογενή δυσαλβουμινική υπερθυροξιναιμία, θυρεοειδικά αυτοαντισώματα και ΝΤΙ) και με την παρουσία φαρμάκων που επηρεάζουν την πρωτεινική σύνδεση.
2.2.1.3. Δείκτες που χρησιμοποιούν τον καθορισμό κλάσματος ελεύθερης ορμόνης
Αναπτύχθηκαν το 1960 με υπολογισμό του κλάσματος ελεύθερης ορμόνης από ένα διήθημα πολλαπλασιασμένο με μια μέτρηση ΤΤ4 (PBI και ύστερα RIA). Αργότερα επεκτάθηκαν στη μέτρηση του ρυθμού μεταφοράς της ισοτοπικά επισημασμένης ορμόνης κατά μήκος μιας μεμβράνης που διαχωρίζει δύο θαλάμους, οι οποίοι περιέχουν το ίδιο αδιάλυτο δείγμα. Οι δείκτες ελεύθερης ορμόνης δεν είναι εντελώς ανεξάρτητοι από την TBG συγκέντρωση και επιπλέον επηράζονται από τη ραδιοχημική καθαρότητα, το ρυθμιστικό μήτρας και τον παράγοντα διάλυσης.
2.2.2. Επισημασμένες αναλύσεις για υπολογισμό-εκτίμηση της FT3 και FT4.
Σ’αυτές ανήκουν οι αναλύσεις 2 σταδίων και 1 σταδίου:
Οι πρώτες χρησιμοποιούν ένα φυσικό διαχωρισμό ελεύθερης από τη δεσμευμένη ορμόνη, πριν τη μέτρηση της ελεύθερης με μια ευαίσθητη ανοσοανάλυση. Εναλλακτικά χρησιμοποιείται ένα αντίσωμα για την ανοσοεκχύλιση ενός επισημασμένου κλάσματος του δείγματος πριν την ποσοτικοποίηση. Αντίθετα οι δεύτερες ποσοτικοποιούν την ελεύθερη ορμόνη με παρουσία των προσδεδεμένων πρωτεινών και μπορεί να γίνουν ασταθείς όταν το δείγμα και τα πρότυπα διαλύματα διαφέρουν ως προς την συνάφεια με τον ιχνηθέτη (13,18).
2.2.2.1. Επισημασμένες αναλύσεις με φυσικό διαχωρισμό
Τυποποιούνται χρησιμοποιώντας διαλύματα που περιέχουν βαρυμετρικά προετοιμασμένα πρότυπα Τ4. Η φυσική απομόνωση της ελεύθερης από τη δεσμευμένη ολοκληρώνεται είτε με μια ημιδιαπερατή μεμβράνη χρησιμοποιώντας ένα θάλαμο διάλυσης, μια τεχνική έξτρα διήθησης ή μια στήλη ρητίνης προσρόφησης. Μια εξαιρετικά ευαίσθητη Τ4 RIA μέθοδος απαιτείται για να μετρηθoύν οι συγκεντρώσεις FT4 (pmoles) σε διήθημα ή σε απομονωμένα ελεύθερα κλάσματα συγκρινόμενες με τις μετρήσεις της ολικής (nmoles).
Αν και δεν υπάρχουν “gold standard” μέθοδοι διαχωρισμού ελεύθερης ορμόνης, αυτές που περιλαμβάνουν φυσικό διαχωρισμό επηρεάζονται ελάχιστα από τις πρωτείνες πρόσδεσης και κατά τεκμήριο αντανακλούν καλύτερα τα επίπεδα της κυκλοφορούμενης ορμόνης. Οι μέθοδοι διάλυσης που περιλαμβάνουν ένα βήμα διάλυσης μπορεί να υποεκτιμούν την FT4, όταν υπάρχουν παρεμποδιστές πρόσδεσης στο δείγμα και η προσρόφηση της Τ4 στη μεμβράνη αποτελεί ένα θέμα. Αντίθετα, μπορεί να υπερεκτιμάται η FT4 στα δείγματα που είναι επεξεργασμένα με ηπαρίνη σαν αποτέλεσμα μιας in vitro παραγωγής FFA (19-22). Αυτή η επίδραση ηπαρίνης in vitro είναι η πρωταρχική αιτία σποραδικά υψηλών τιμών FT4 σε ΝΤΙ ασθενείς. Οι φυσικές μέθοδοι διαχωρισμού είναι πολύ εντατικές και ακριβές για ρουτίνα σε κλινικά εργαστήρια και συνήθως είναι διαθέσιμες μόνο σε εργαστήρια αναφοράς. Οι FT3 μέθοδοι με φυσικό διαχωρισμό είναι διαθέσιμες μόνο σε εξειδικευμένα εργαστήρια έρευνας.
2.2.2.2. Επισημασμένες αναλύσεις χωρίς φυσικό διαχωρισμό
Οι περισσότερες από τις παρούσες ανοσοδοκιμασίες ελεύθερης ορμόνης χρησιμοποιούν ένα ειδικό, υψηλής συγγένειας με την ορμόνη, αντίσωμα για να απομονώσουν μια μικρή ποσότητα ολικής ορμόνης από το δείγμα. Το μη κατειλημ-μένο αντίσωμα από δεσμευμένες θέσεις αντισώματος,είναι συνήθως αντιστρόφως ανάλογο με τη συγκέντρωση ελεύθερης ορμόνης και ποσοτικοποιείται με τη χρήση ορμόνης επισημασμένης με ραδιενέργεια, φθορισμό ή χημειοφωταύγεια.
Στην περίπτωση της επισήμανσης με ραδιενέργεια (RIA) η βασική καμπύλη έχει τη μορφή (23):
Εικόνα 2. Βασική καμπύλη RIA.
Η κλίση της καμπύλης εκφράζει τη χημική συγγένεια του αντισώματος με την ορμόνη. Η συνδεδεμένη ορμόνη μετριέται σε μετρητή γ-ακτινοβολίας και με βάση τηνκαμπύλη αναφοράς γίνεται ο υπολογισμός της αρχικής συγκέντρωσης της ορμόνης που υπάρχει στο εξεταζόμενο δείγμα. Για τη σωστή διενέργειa των RIA απαιτείται σωστή συλλογή και αποθήκευση βιολογικών δειγμάτων, συνδετική ένωση (binder) είτε αντίσωμα είτε ειδική πρωτείνη, επισημασμένη με ραδιενεργό ισότοπο ένωση (αντιγόνο ή αντίσωμα), ικανοποιητική μέθοδος διαχωρισμού ελεύθερης επισημασμένης από δεσμευμένη και τέλος πρότυπη ουσία που είναι καθαρή (23).
Το σήμα εξόδου στη συνέχεια μετατρέπεται σε μια συγκέντρωση ελεύθερης ορμόνης χρησιμοποιώντας βαθμονομητές με τιμές που έχουν εκχωρηθεί από μία μέθοδο που χρησιμοποιεί φυσικό διαχωρισμό. Το πραγματικό ποσοστό της ολικής θυρεοειδικής ορμόνης που έχει απορροφηθεί ποικίλλει ανάλογα με το σχεδιασμό της μεθόδου. Γενικά υπερβαίνει την πραγματική συγκέντρωση της ελεύθερης ορμόνης και θα πρέπει να είναι <1-2% προκειμένου να ελαχιστοποιήσει τη διατάραξη της ισορροπίας ελεύθερου-δεσμευμένου.
Το κλειδί για τη σταθερότητα αυτών των μεθόδων είναι διττό:
- Πρέπει να χρησιμοποιούνται συνθήκες που διατηρούν την ισορροπία ελεύθερης-δεσμευμένης ορμόνης και να ελαχιστοποιούνται τα αποτελέσματα της αραίωσης που αποδυναμώνουν την επίδραση οποιωνδήποτε ενδογενών αναστολέων που υπάρχουν στο δείγμα.
- Είναι σημαντικό να χρησιμοποιούνται βαθμονομητές ορού που περιέχουν γνωστές συγκεντρώσεις ελεύθερης ορμόνης και που συμπεριφέρονται κατά την ανάλυση με τον ίδιο τρόπο με τα δείγματα των ασθενών.
Τρεις γενικές προσεγγίσεις έχουν χρησιμοποιηθεί για να αναπτύξουν συγκρίσιμες μεθόδους FT4 και FT3:
- Δύο βημάτων επισημασμένης ορμόνης
- Eνός βήματος επισημασμένου αναλόγου
- Επισημασμένο αντίσωμα.
Μέθοδοι Δύο Σταδίων Επισημασμένης ορμόνης / Επανατιτλοποίηση. Αναπτύχθηκαν για πρώτη φορά για ερευνητικούς σκοπούς στα τέλη της δεκαετίας του 1970 και στη συνέχεια προσαρμόστηκαν για την παραγωγή εμπορικών μεθόδων FT4 και FT3. Κατά τη διάρκεια του 1ου σταδίου επώασης, αυτές οι μέθοδοι χρησιμοποιούν ένα αντίσωμα αντι-ορμόνης υψηλής συγγένειας (> 1 x 1011 L/mol) προσδεμένο σ’ ένα στερεό υπόστρωμα, (πολύ λεπτό Sephadex, σωληνάριο επιστρωμένo με αντίσωμα ή σωματίδια) ώστε να απομονωθεί μια μικρή ποσότητα ολικής ορμόνης από ένα αραιωμένο δείγμα ορού.
Μετά από μία σύντομη περίοδο επώασης, τα μη δεσμευμένα συστατικά αποχύνονται πριν να εκτελεστεί το 2ο στάδιο, στο οποίο προστίθεται επαρκής επισημασμένη ορμόνη για να δεσμεύσει όλες τις μη κατειλημμένες θέσεις δέσμευσης αντισώματος. Μετά την έκπλυση, η ποσότητα της επισημασμένης ορμόνης που συνδέθηκε με το αντίσωμα στερεάς φάσεως ποσοτικοποιείται σε σχέση με σταθμικά πρότυπα ή βαθμονομητές που έχουν τιμές ελεύθερων ορμονών καθορισμένες από μια μέθοδο αναφοράς.
Στα τέλη του 1970, εισήχθησαν νέες μέθοδοι επισημασμένης ορμόνης ενός σταδίου, που ήταν λιγότερο έντονης εργαστηριακής εργασίας. Έτσι οι μέθοδοι δύο σταδίων έχασαν τη δημοτικότητά τους παρά τις συγκριτικές μελέτες που έδειξαν ότι επηρεάζονταν λιγότερο από τη συγκέντρωση λευκωματίνης και τις ανωμαλίες της πρωτεινικής δέσμευσης, οι οποίες επηρέαζαν αρνητικά την διαγνωστική ακρίβεια των αναλογικών αναλύσεων ενός σταδίου (24,25).
Μέθοδοι ενός σταδίου επισημασμένης ορμόνης – αναλόγου. Η φυσικοχημική εγκυρότητα αυτών των αναλύσεων εξαρτάται από την ανάπτυξη μιας αναλόγου ορμόνης με μοριακή δομή μη-δραστική με πρωτεΐνες ορού, αλλά που θα μπορούσε να αντιδράσει με μη-κατειλημμένες θέσεις αντισώματος ορμόνης. Όταν πληρούνται αυτές οι προϋποθέσεις, η αναλογική ορμόνη, που είναι χημικά συζευγμένη μ’ ένα μοριακό σήμα, όπως ένα ισότοπο ή ένζυμο, μπορεί να ανταγωνιστεί την ελεύθερη για έναν περιορισμένο αριθμό θέσεων δέσμευσης του αντισώματος σε μια κλασική ανταγωνιστική ανοσοδοκιμασία.
Αν και εννοιολογικά ελκυστική, η προσέγγιση αυτή είναι τεχνικά δύσκολο να επιτευχθεί στην πράξη, παρά τις πρώτες επιτυχίες. Έχει κυρίως σχεδιαστεί για να δώσει κανονικές τιμές FT4 σε καταστάσεις υψηλής TBG (π.χ. εγκυμοσύνη). Έχει όμως κακή διαγνωστική ακρίβεια υπό την παρουσία των ανώμαλων συγκεντρώσεων λευκωματίνης, FDH, ΝΤΙ, υψηλών επιπέδων FFA ή αυτοαντισωμάτων όρμονών του θυρεοειδούς. Κατά τη δεκαετία του 1980 έγιναν σημαντικές προσπάθειες για να διορθωθούν αυτά τα προβλήματα με την προσθήκη ειδικών χημικών ώστε να εμποδιστεί η σύνδεση του αναλόγου με τη λευκωματίνη ή με χρήση εμπειρικά προσαρμοσμένων τιμών των βαθμονομητών. Ωστόσο, μετά από μια δεκαετία οι περισσότερες απ’αυτές τις μεθόδους εγκαταλήφθηκαν, διότι τα προβλήματα αυτά δεν μπόρεσαν να επιλυθούν (25).
Μέθοδοι με Επισημασμένο αντίσωμα. Οι μέθοδοι αυτές μετρούν επίσης ελεύθερη ορμόνη, ως συνάρτηση της κλασματικής κατοχής θέσεων δέσμευσης του αντισώματος. Αυτή η ανταγωνιστική προσέγγιση χρησιμοποιεί συγκεκριμένους ανοσοπροσροφητές ώστε να αξιολογήσει τις μη κατειλημμένες θέσεις σύνδεσης του αντισώματος στο μίγμα της αντίδρασης. Μια προσέγγιση είναι η χρήση της στερεής φάσης μη επισημασμένων ορμονών/πρωτεϊνικών συμπλόκων (μερικές φορές αναφερόμενα ως «ανάλογα»), που δεν αντιδρούν σημαντικά με πρωτεΐνες, για την ποσοτικοποίηση μη κατειλημμένων θέσεων σύνδεσης στο αντίσωμα αντι-ορμόνης στην υγρή φάση. Η φυσικοχημική βάση αυτών των μεθόδων επισημασμένου αντισώματος υποδηλώνει ότι μπορεί να είναι το ίδιο ευαίσθητες στα σφάλματα των παλαιότερων μεθόδων. Ωστόσο, οι φυσικοχημικές διαφορές που προκύπτουν από τη σύνδεση του αναλόγου με το στερεό υπόστρωμα προσδίδουν κινητικές διαφορές που αποφέρουν μειωμένη συγγένεια στις ενδογενείς πρωτεΐνες δέσμευσης και μια πιο αξιόπιστη μέτρηση ελεύθερης ορμόνης. Η προσέγγιση αυτή είναι σήμερα η πιο ευνοική δοκιμασία ελεύθερης ορμόνης στις περισσότερες αυτοματοποιημένες πλατφόρμες.
Οι πιo συνηθισμένες μέθοδοι που εφαρμόζονται ευρέως στους αυτόματους αναλυτές είναι:
Χημειοφωταύγεια (Chemiluminescence) ονομάζεται το φαινόμενο παραγωγής ακτινοβολίας από μια χημική αντίδραση. Η αντίδραση δίνει την απαιτούμενη ενέργεια για το σχηματισμό ενός διεγερμένου προϊόντος, το οποίο αποδιεγείρεται και εκπέμπει χαρακτηριστική ακτινοβολία, η οποία μετράται:
Άμεσος μηχανισμός
Αντίδραση διεγέρσεως : A+ B®C*
Αντίδραση αποδιεγέρσεως : C*®C+hν
Έμμεσος μηχανισμός
Παραγωγή ενέργειας : A+ B®AB*
Μεταφορά ενέργειας : AB*+ C®AB+C*
Αποδιέγερση : C*®C+ hν
Εξέλιξη της απλής χημειοφωταύγειας αποτελεί τα τελευταία χρόνια η εφαρμογή της χρήσης δυναμικού στην αντίδραση: μέθοδος ηλεκτροχημειοφωταύγειας.
Ηλεκτροχημειοφωταύγεια (Electrochemiluminescence, ECL). Διαδικασία κατά την οποία από σταθερά πρόδρομα είδη παράγονται υψηλής δραστικότητας είδη στην επιφάνεια ενός ηλεκτροδίου. Αυτά αντιδρούν το ένα με το άλλο παράγοντας φως. Βασίζονται στη χρήση τρις-διπυριδυλ-ρουθηνίου (Ru(bpy)3)2+ και τριπροπυλαμίνης (TPA). Το χαρακτηριστικό αυτής της μεθόδου είναι ότι ο έλεγχος είναι πλήρης, επακριβής και ολοκληρωτικός λόγω ενεργοποίησης της αντίδρασης ηλεκτρικά και όχι χημικά εφαρμόζοντας μια τάση στα ανοσολογικά μίγματα με την επίθεση μικροσφαιριδίων καλυμένων με στεπταβιδίνη.
Σχηματικές αναπαραστάσεις της μεθοδολογίας ακολουθούν στις παρακάτω εικόνες (52):
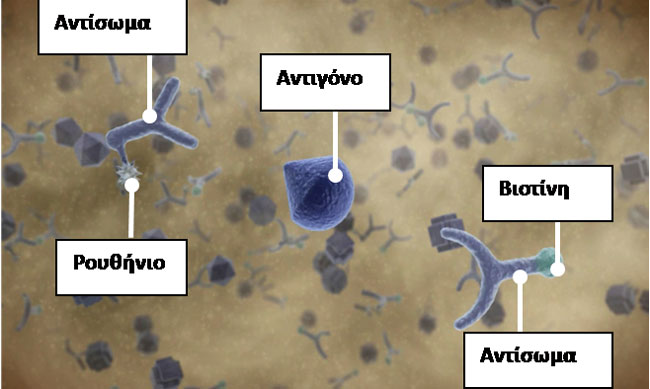
Εικόνα 3. Ανοσολογικά μίγματα που δημιουργούνται κατα τη διάρκεια της επώασης.
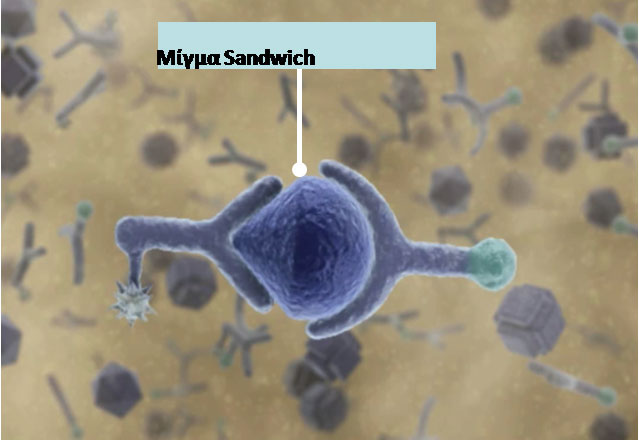
Εικόνα 4. Σχηματική αναπαράσταση του μίγματος τύπου Sandwich. Μαγνητικά σφαιρίδια καλύπτονται με στρεπταβιδίνη. Η βιοτίνη χρησιμοποιείται για να σχηματίσει ισχυρό δεσμό με τη στρεπταβιδίνη. Σε μια ανάλυση τύπου sandwich, το αντιγόνο αναγνωρίζεται από 2 αντισώματα, ένα συζευγμένο με βιοτίνη και το άλλο ενισχυμένο με ρουθήνιο. Μίγματα του τελευταίου εκπέμπουν φως.

Εικόνα 5. Μεταφορά στο κελί μέτρησης.
Τα πλεονεκτήματα αυτής της μεθόδου είναι:
- Ακρίβεια (accuracy)- Επαναληψιμότητα (precision)
- Ευαισθησία
- Μεγάλα εύρη μέτρησης
- Μεγάλη σταθερότητα κατά τη μέτρηση
- Απαιτήσεις μικρού όγκου δείγματος
- Μικρός χρόνος για τα αποτελέσματα

Εικόνα 6. Μαγνητική σύνδεση (binding) και διαχωρισμός δεσμευμένου-ελέυθερου (bound/free).

Εικόνα 7. Αντίδραση ECL στην επιφάνεια του ηλεκτροδίου.
Η διεγειρόμενη κατάσταση Ru(bpy)33+ καταπίπτει υπό την εκπομπή του φωτός που αναπαράγεται από τον αυθεντικό τύπο της ένωσης. Επιτυγχάνεται ανάγοντας το Ru(bpy)33+ σε Ru(bpy)32+με τη βοήθεια της τριπροπυλαμίνης (TPA) που έχει μια κρίσιμη ιδιότητα, όταν οξειδώνεται ενεργεί σαν αναγωγικός παράγοντας. Στο ηλεκτρόδιο η ΤΡΑ οξειδώνεται σε ΤΡΑ+, μία ρίζα κατιόντος που απελευθερώνει αυθόρμητα ένα πρωτόνιο για να γίνει μια ασταθής ρίζα. Η τελευταία, με τη σειρά της, δίνει ηλεκτρόνια στο Ru(bpy)33+ που μετατρέπεται σε Ru(bpy)32+. Αυτή η διεγερμένη κατάσταση, στη συνέχεια διασπάται με την εκπομπή ενός φωτονίου που έχει ένα μήκος κύματος 620 nm. Το σήμα που παράγεται κατά τη διάρκεια της μέτρησης με ηλεκτροχημειοφωταύγεια (ECL) είναι μακράς διάρκειας σε σχέση με αυτό που παράγεται από την απλή χημειοφωταύγεια (CL) (Εικόνα 8).
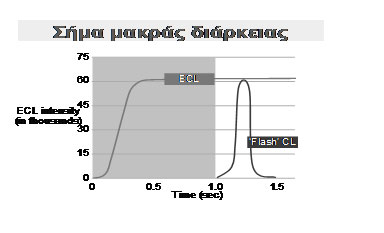 Εικόνα 8. Απεικόνηση σήματος ηλεκτροχημειοφωταύγειας-απλής χημειοφωταύγειας.
Εικόνα 8. Απεικόνηση σήματος ηλεκτροχημειοφωταύγειας-απλής χημειοφωταύγειας.
Η χρήση δυναμικού εξαλείφει τα προβλήματα που συνδέονται με την προσθήκη/ ανάμιξη αντιδραστηρίου και επιβεβαιώνει μια επακριβώς ελεγχόμενη αντίδραση. Επιπλέον το φωτεινό σήμα αναπαράγεται διαρκώς και έτσι εντοπίζεται με μεγάλη ακρίβεια με τη βοήθεια ενός φωτοπολλαπλασιαστή.
2.2.3. Επιδράσεις διαφόρων παραγόντων στις αναλύσεις FT4 και FT3
Ο μόνος λόγος για να επιλεγεί μια μέθοδος ελεύθερης ορμόνης του θυρεοειδούς (FT4 ή FT3) αντί της ολικής (TT4 ή ΤΤ3) είναι να βελτιωθεί η διαγνωστική ακρίβεια για την ανίχνευση υπο-και υπερθυρεοειδισμού σε ασθενείς με ανωμαλίες θυρεοειδικής ορμόνης δέσμευσης, που θέτουν σε κίνδυνο τη διαγνωστική ακρίβεια των μετρήσεων ολικών ορμονών (18). Δυστυχώς, η διαγνωστική ακρίβεια των μεθόδων FT4 ή FT3 δεν μπορεί να προβλεφθεί ούτε από τις μεθόδους ταξινόμησης (1 σταδίου, 2 σταδίων, επισημασμένου αντισώματος κλπ) ούτε απο τα τεστ in-vitro, όπως αραίωση του δείγματος. Οι αναλύσεις FT4 ή FT3 πρέπει να εκτελούνται σε θερμοκρασία 37°C, αφού όταν εκτελούνται σε θερμοκρασία περιβάλλοντος αυξάνουν ψευδώς τις τιμές τους, σε δείγματα με πολύ χαμηλές συγκεντρώσεις TBG.
Δυστυχώς, καμία τρέχουσα μέθοδος FT4 δεν εφαρμόζεται σε όλες τις κλινικές συνθήκες. Όταν η συγκέντρωση TBG είναι ανώμαλη, οι FT4 δίδουν πιο χρήσιμα διαγνωστικώς αποτελέσματα από τις TT4. Ωστόσο, προ-αναλυτικά ή τεχνικά προβλήματα αναλύσεων σχετίζονται με ανωμαλίες πρωτεινών δέσμευσης, όπως όταν η πρόσδεση του ιχνηθέτη στη λευκωματίνη είναι ανώμαλη, ή παρουσία των φαρμάκων που εκτοπίζουν Τ4 από TBG, ή κατά τη διάρκεια κρίσιμων φάσεων των ΝΤΙ, ή της κύησης. Συμπερασματικά, η TSH ή η TSH/FT4 σχέση είναι πιο αξιόπιστες θυρεοειδικές παράμετροι από μια εκτίμηση μόνο της FT4.
Όταν υπάρχει υποψία ότι ένα αποτέλεσμα FT4 είναι αντιφατικό, πρέπει να ελέγχεται με μέθοδο διαφορετικού κατασκευαστή (συνήθως σ’ ένα διαφορετικό εργαστήριο). Επιπρόσθετα, ή εναλλακτικά η FT4/TT4 σχέση μπορεί να ελεγχθεί για ασυμφωνία αφού η παρεμπόδιση σπάνια επηρεάζει και τις δύο μετρήσεις στον ίδιο βαθμό και προς την ίδια κατεύθυνση.
2.2.3.1. Εγκυμοσύνη
Η αύξηση TBG και των χαμηλών συγκεντρώσεων λευκωματίνης που συνδέονται με την εγκυμοσύνη αποφέρει μεταβολές στις μετρήσεις FT4 εξαρτώμενες από τη μέθοδο (26). Οι λευκωματοεξαρτώμενες μέθοδοι μπορούν να παράγουν χαμηλές τιμές FT4 έως 50% των ασθενών και είναι ακατάλληλες για την εκτίμηση της κατάστασης του θυρεοειδούς κατά την εγκυμοσύνη, λόγω της αρνητικής πόλωσης που σημειώνεται κατά την προοδευτική μείωση της συγκέντρωσης λευκωματίνης στο 3ο τρίμηνο. Αντιστρόφως, οι μέθοδοι διάλυσης ιχνηθέτη έχουν την τάση να δείχνουν μια θετική κλίση σχετικά με τα πρότυπα, πιθανόν λόγω ακαθαρσιών του ιχνηθέτη (18). Η χρήση των τιμών αναφοράς με βάση τη μέθοδο και το τρίμηνο θα μπορούσαν να βελτιώσουν τη διαγνωστική ακρίβεια της ελεύθερης ορμόνης κατά την εγκυμοσύνη. Ωστόσο, λίγοι κατασκευαστές έχουν αναπτύξει τέτοιες πληροφορίες για τις μεθόδους τους.
2.2.3.2. Πρόωρα βρέφη
Χαμηλά επίπεδα θυροξίνης χωρίς αυξημένη TSH συναντώνται συνήθως σε πρόωρα βρέφη κάτω των 28 εβδομάδων κύησης .Η θεραπεία με L-Τ4 μπορεί να βελτιώσει τη νευρολογική έκβαση (27). Ωστόσο, οι διαφορές στις μεθόδους FT4 είναι πιθανό να θέσουν σε κίνδυνο την αξιοπιστία της ανίχνευσης της υποθυροξυναιμίας προωρότητας.
2.2.3.3. Γενετικές ανωμαλίες σε πρωτεΐνες δέσμευσης
Η κληρονομικότητα και οι μεταβολές στη λευκωματίνη και στην TBG με τροποποιημένη συγγένεια για Τ4 ή Τ3 μπορεί να προκαλέσουν ανώμαλες συγκεντρώσεις ολικής ορμόνης σε ευθυρεοειδικά άτομα με φυσιολογικές συγκεντρώσεις ελεύθερης ορμόνης. Η μεταβολή λευκωματίνης υπεύθυνη για την οικογενή dysalbuminemic hyperthyroxinemia (FDH) έχει σημαντικά αυξημένη συγγένεια με την Τ4 και τους ανάλογους ιχνηθέτες, που αποφέρουν ψευδώς υψηλές εκτιμήσεις FT4 (13). Σε FDH, οι TT4 και οι FT4I, όπως και κάποιες επισημασμένες αναλύσεις FT4, δίδουν τιμές υπεράνω του κανονικού, ενώ οι ΤΤ3, FT3, TSH και FT4 μετρημένες με άλλες μεθόδους, συμπεριλαμβανομένης της ισορροπίας διάλυσης, είναι φυσιολογικές. Η αδυναμία να αναγνωριστεί η μεταβολή λευκωματίνης FDH που μπορεί να συμβεί με επικράτηση έως 1:1000 σε ορισμένους λατινοαμερικάνικους πληθυσμούς, μπορεί να οδηγήσει σε ακατάλληλη ερμηνεία αποτελέσματος του θυρεοειδούς που θα οδηγήσει σε εκτομή του θυρεοειδούς αδένα.
2.2.3.4. Αυτοαντισώματα
Μερικοί οροί ασθενών περιέχουν αντισώματα ορμονών του θυρεοειδούς που οδηγούν σε μεθοδολογικά προβλήματα στις μετρήσεις TT4 ή FT4. Τέτοιες παρεμβολές αντισώματος εξαρτώνται από τη μέθοδο. Ιχνηθέτης Τ4 ή δεσμευμένης Τ3 στο ενδογενές αντίσωμα χαρακτηρίζεται λανθασμένα ως δεσμευμένη ένωση από τις μεθόδους προσρόφησης ή ελεύθερη από τις μεθόδους διπλού αντισώματος, οδηγώντας σε ψευδώς χαμηλές ή ψευδώς υψηλές TT4 ή TT3, αντίστοιχα. Τα ανάλογα ιχνηθέτη Τ4 που χρησιμοποιούνται σε μερικές μεθόδους FT4 μπορεί να δεσμεύονται μ’ αυτά τα αυτοαντισώματα, οδηγώντας σε ψευδώς υψηλά αποτελέσματα FT4 ορού.
2.2.3.5. Θυρεοτοξίκωση και υποθυρεοειδισμός
Η σχέση μεταξύ ελεύθερης και ολικής T4 και T3 στη θυρεοτοξίκωση είναι μη γραμμική. Σε σοβαρές περιπτώσεις οι αυξήσεις των TT4 και FT4 είναι δυσανάλογες. Αυτή η μη-γραμμικότητα αντανακλά μια μείωση στα επίπεδα TBG και μια υπερβάλλουσα ικανότητα πρόσδεσης TBG παρά την αυξημένη πρόσδεση σε TTR και αλβουμίνη. Ομοίως, οι συγκεντρώσεις FT3 μπορεί να υποτιμηθούν ως αποτέλεσμα της ισχυρής δέσμευσης Τ4–TBG. Αντίστροφη κατάσταση υπάρχει σε σοβαρό υποθυρεοειδισμό, όπου υπάρχει μειωμένη κατάληψη των πρωτεϊνών δέσμευσης.
2.2.3.6. Φάρμακα που ανταγωνίζονται για σύνδεση με Θυρεοειδική Ορμόνη
Μερικοί θεραπευτικοί και διαγνωστικοί παράγοντες όπως η φαινυτοΐνη, η καρβομαζεπίνη ή Furosemide/Frusemide μπορούν να αναστέλλουν ανταγωνιστικά τη δέσμευση ορμονών του θυρεοειδούς με τις πρωτεΐνες ορού στο δείγμα. Η μειωμένη διαθεσιμότητα δεσμευμένης πρωτεΐνης αποφέρει μία οξεία αύξηση της FT4 και σε ορισμένες περιπτώσεις και αυξημένη δράση, όπως φαίνεται από τη μείωση της TSH. Οι μετρήσεις αυξημένης FT4 επηρεάζονται από την αραίωση του ορού που απαιτεί η μέθοδος ακόμη και σε μέθοδο διάλυσης. Κατά τη διάρκεια χρόνιας χορήγησης των εν λόγω ανταγωνιστών, υπάρχει ενισχυμένη καθαρότητα της ορμόνης. Ωστόσο, τελικά το σύστημα αποκαθιστά μια “κανονική” ισορροπία και τα επίπεδα FT4 ομαλοποιούνται σε βάρος μιας χαμηλής συγκέντρωσης TT4. Η απόσυρση του φαρμάκου σ’ αυτό το σημείο θα μπορούσε να προκαλέσει μια αρχική πτώση της FT4 καθώς περισσότεροι μεταφορείς πρωτεΐνης είναι διαθέσιμοι και μια εκ νέου κανονικοποίηση της FT4, καθώς η ισορροπία αποκαθίσταται μέσω μιας αυξημένης απελευθέρωσης της ορμόνης από τον θυρεοειδή αδένα. Η χρονική κλίμακα και το μέγεθος αυτών των επιδράσεων ανταγωνιστών διαφέρουν ως προς το χρόνο ημιζωής του παράγοντα ανταγωνιστή.
Τρέχουσες αναλύσεις FT4 με παράγοντα αραίωσης μπορεί να αποτύχουν ν’ ανιχνεύσουν αύξηση της FT4, δευτερεύουσας ως προς την παρουσία ανταγωνιστών πρωτεΐνης δέσμευσης. Για παράδειγμα, όταν ένα δείγμα που περιέχει και τις δύο Τ4 (ελεύθερο κλάσμα 1:4000) και ένα ανταγωνιστικό αναστολέα (ελεύθερο κλάσμα 1:100) υποβάλλεται σε σταδιακή αραίωση, θα διατηρήσει τη συγκέντρωση FT4 έως 1:100 αραίωση, δευτερογενώς της προοδευτικής διάσπασης της Τ4 από δεσμευτικές πρωτεΐνες. Αντίθετα, η ελεύθερη συγκέντρωση του φαρμάκου θα μειωθεί σημαντικά μόνο μετά από αραίωση 1:10. Έτσι, η ορμόνη εκτοπίζοντας την επίδραση των φαρμάκων που ανταγωνίζονται για τη δέσμευση Τ4, θα υποτιμηθεί χρησιμοποιώντας μεγάλη αραίωση του δείγματος. Η χρήση ισορροπίας διάλυσης και υπερδιήθησης αραιωμένου ορού μπορεί να ελαχιστοποιήσει αυτό το αποτέλεσμα (28,29).
2.2.3.7. Αποτελέσματα διεργασίας με ηπαρίνη
Είναι γνωστό ότι παρουσία κανονικής συγκέντρωσης λευκωματίνης, συγκεντρώσεων μη-εστεροποιημένων λιπαρών οξέων (FFA)>3mmol/L αυξάνουν τη FT4 εκτοπίζοντας την ορμόνη από TBG (19,20,21,22). Οροί ασθενών κατεργασμένων με ηπαρίνη, συμπεριλαμβανομένων των παρασκευασμάτων με χαμηλού ΜΒ ηπαρίνη, μπορεί να εμφανίζουν ψευδώς υψηλές τιμές FT4, δευτερεύουσες σε μια in vitro δράση της λιπάσης που προκαλείται από την ηπαρίνη και αυξάνει τα FFA. Αυτό συμβαίνει ακόμη και με δόσεις ηπαρίνης χαμηλές < 10 μον. και επιδεινώνεται με την αποθήκευση του δείγματος. Αυξημένα επίπεδα των τριγλυκεριδίων, χαμηλές συγκεντρώσεις λευκωματίνης ή παρατεταμένη επώαση στους 37°C οξύνει το πρόβλημα.
2.2.3.8. Κρίσιμη Μη θυρεοειδική Ασθένεια (ΝΤΙ)
Κατά τη διάρκεια άνω των δύο δεκαετιών έχουν συλλεχθεί στοιχεία για την ιδιαιτερότητα των διαφόρων μεθόδων FT4 σε νοσοκομειακούς ασθενείς με ΝΤΙ. Η βιβλιογραφία αυτή περιπλέκεται από την ετερογένεια των πληθυσμών και την εξάρτηση των αποτελεσμάτων από τη μέθοδο και μπορεί να προκαλέσει σύγχυση. Οι κατασκευαστές σταδιακά τροποποιούν τις μεθόδους, σε μια προσπάθεια να βελτιώσουν την εξειδίκευσή τους όταν οι πρωτεΐνες δέσμευσης είναι ανώμαλες. Ωστόσο, η ακριβής σύνθεση των σημερινών μεθόδων παραμένει μονοπωλιακή και είναι δύσκολο για τους κατασκευαστές να λάβουν γενεαλογικά δείγματα από τέτοιους ασθενείς για να ελέγξουν σχολαστικά τις μεθόδους τους.
Σε μία πρόσφατη συγκριτική μελέτη μεθόδων FT4, μια αξιοσημείωτη μεθοδο-εξαρτώμενη διαφορά παρατηρήθηκε την 7η ημέρα μετά τη μεταμόσχευση μυελού των οστών σε ευθυρεοειδικά άτομα που ελάμβαναν πολλαπλές θεραπείες που περιλάμβαναν ηπαρίνη και γλυκοκορτικοειδή. Σ’ αυτή τη μελέτη, οι συγκεντρώσεις TT4 ήταν φυσιολογικές στο 95% και η TSH < 0,1 mIU/L στο 50%. Αυτό συμφωνού-σε με τη θεραπεία με γλυκοκορτικοειδή. Αντίθετα, τόσο αυξημένες τιμές όσο και κάτω του φυσιολογικού αναφέρθηκαν σε διαφορετικές μεθόδους FT4. Φαίνεται ότι οι υπερεκτιμήσεις FT4 που αναφέρθηκαν από μεθόδους σε 20-40% των ασθενών, πιθανόν αντανακλούν την επίδραση της ηπαρίνης, ενώ υποεκτιμήσεις στο 20-30% των ασθενών την επίδραση του ιχνηθέτη που συνδέεται με τη λευκωματίνη. Λόγω της ασυμφωνίας μεταξύ αποτελεσμάτων FT4, TSH, αυξάνεται ο κίνδυνος εσφαλμένης διάγνωσης θυρεοτοξίκωσης ή δευτεροπαθούς υποθυρεοειδισμού και φαίνεται οι μετρήσεις TT4 να είναι πιο αξιόπιστες στον καθορισμό μια κρίσιμης νόσου.
Kλινική χρησιμότητα των μετρήσεων εκτίμησης FT3. Η μέτρηση της Τ3 έχει μικρή εξειδίκευση και ευαισθησία για διάγνωση του υποθυρεοειδισμού, δεδομένου ότι η μετατροπή T4 σε T3 διατηρεί κανονική τη συγκέντρωση της Τ3 μέχρι ο υποθυρεοειδισμός να γίνει σοβαρός. Ασθενείς με NTI ή θερμιδική στέρηση συνήθως έχουν χαμηλές τιμές ολικής και ελεύθερης Τ3. Οι μετρήσεις Τ3, ερμηνευμένες με FT4, είναι χρήσιμες στη διάγνωση πολύπλοκων ή ασυνήθιστων περιπτώσεων υπερθυρεοειδισμού και ορισμένων σπάνιων παθήσεων.
2.2.4. Επικύρωση μεθόδων FT4
Δυστυχώς, οι περισσότερες μέθοδοι εκτίμησης FT4 αξιολογούνται ανεπαρκώς πριν την εισαγωγή τους για κλινική χρήση. Οι κατασκευαστές σπάνια επεκτείνουν την επικύρωση των μεθόδων τους, πέρα της μελέτης των τυχαίων ασθενών με υπο-και υπερθυρεοειδισμό, τις εγκύους και ΝΤΙ νοσηλευόμενους ασθενείς. Σήμερα δεν υπάρχει συναίνεση ως προς τα καλύτερα κριτήρια για τη χρήση και αξιολόγηση των μεθόδων. Δεν είναι αρκετό η νέα μέθοδος να αποδείξει ότι μπορεί να διακρίνει τις τιμές μεταξύ υποθυρεοειδικών, φυσιολογικών και υπερθυρεοειδικών ατόμων και να συγκρίνεται με τις υπάρχουσες μεθόδους. Κάθε μέθοδος πρέπει να ικανοποιεί τα κριτήρια αυτά χωρίς απαραίτητα να παρέχει πληροφορίες για την αληθινή φυσιολογική συγκέντρωση της ελεύθερης ορμόνης.
Αξιολόγηση της διαγνωστικής ακρίβειας της FT4 ανάλυσης. Η διαγνωστική ακρίβεια της μεθόδου θα πρέπει να ελέγχεται χρησιμοποιώντας γενεαλογικά δείγματα από περιπατητικούς ασθενείς με τις ακόλουθες διαταραχές:
- TBG ανωμαλίες (υψηλά οιστρογόνα, εκ γενετής περίσσεια ή ανεπάρκεια TBG)
- Οικογενής δισαλβουμιναιμική υπερθυροξιναιμία (FDH)
- Αυξημένη συγγένεια τρανσθυρετίνης (TTR)
- Τ4 και Τ3 αυτοαντισώματα
- Ρευματοειδής παράγοντας
Η μέθοδος πρέπει να ελέγχεται για παρεμποδίσεις με δείγματα εμπλουτισμένα με κοινούς αναστολείς σε συγκεντρώσεις που προκαλούν εκτόπιση της ορμόνης από τις δεσμευτικές πρωτείνες σε μη αραιωμένους ορούς, αποτελέσματα που χάνονται μετά την αραίωση. Απαιτείται κατάλογος όλων των γνωστών παρεμποδιστών με το μέγεθος και την κατεύθυνση των σφαλμάτων που προκύπτουν και τέλος αρχείο των in-vitro επιδράσεων της ηπαρίνης στην παραγωγή ελεύθερων λιπαρών οξέων κατά τη διάρκεια της επώασης της ανάλυσης.
Οποιαδήποτε προσέγγιση υιοθετείται, τα βασικά ερωτήματα αφορούν την ομοιότητα μεταξύ των δειγμάτων και των προτύπων, διότι οι προσδιορισμοί γενικά είναι συγκρίσιμοι. Άλλες προσεγγίσεις περιλαμβάνουν τη δοκιμή της ποσοτικής ανάκτησης του προστιθέμενου L-T4, ή τον προσδιορισμό των επιπτώσεων της αραίωσης ορού, δεδομένου ότι μια 100πλάσια αραίωση ενός «κανονικού» ορού προκαλεί θεωρητικά ασήμαντη μείωση (< 2%) στη συγκέντρωση της FT4 .Οι προσεγγίσεις αυτές, ωστόσο, ελέγχουν μόνο την «εξάρτηση πρωτεΐνης» της μεθόδου, δηλαδή το βαθμό στον οποίο η FT4 εξαρτάται από την αποσύνδεση της ελεύθερης από τη δεσμευμένη ορμόνη. Δεν υπάρχει καμία ένδειξη που να τεκμηριώνει κατά πόσον αυτές οι προσεγγίσεις αντανακλούν πραγματικά τη διαγνωστική ακρίβεια της μεθόδου, όταν χρησιμοποιούνται για την αξιολόγηση δύσκολων κλινικών δειγμάτων.
Τελικά, η ιδιαιτερότητα μιας μεθόδου FT4 θα γίνει εμφανής μόνο μετά τη δοκιμή ενός πλήρους φάσματος δειγμάτων από άτομα με και χωρίς θυρεοειδική δυσλειτουργία, με ανωμαλίες πρωτείνης δέσμευσης ή φάρμακα που επιδρούν. Μια παρεμπόδιση μπορεί να σημειωθεί μόνο αφού η μέθοδος έχει χρησιμοποιηθεί για κάποιο χρονικό διάστημα, όπως στις επιπτώσεις της ρευματοειδούς παράγοντα που μπορεί να παράγει ψευδώς υψηλές FΤ4. Μη ειδικός φθορισμός οφειλόμενος στην παρουσία στο αίμα ουσιών όπως οργανικά οξέα σε ασθενείς με ουραιμία μπορεί να είναι μια άλλη αιτία μη-ειδικής παρεμβολής.
Δεδομένου ότι οι κατασκευαστές δεν έχουν δοκιμάσει επαρκώς τις μεθόδους τους σε σοβαρά άρρωστους ασθενείς, είναι δύσκολο για τους γιατρούς να έχουν εμπιστοσύνη, ότι τα μη φυσιολογικά αποτελέσματα FT4 σ’ αυτούς τους ασθενείς αντικατοπτρίζουν την πραγματική δυσλειτουργία του θυρεοειδούς και όχι ΝΤΙ. Έτσι, σε νοσηλευόμενους ασθενείς, με υποψία θυρεοειδικής δυσλειτουργίας, ένας συνδυασμός μετρήσεων TSH και TT4 ορού μπορεί να παρέχει περισσότερες πληροφορίες από ένα μόνο έλεγχο FT4, δίνοντας στην TT4 την ευκαιρία να καθορίζει το βαθμό σοβαρότητας της ασθένειας.
Συγκεκριμένα, η κατάσταση χαμηλής TT4 σε ΝΤΙ συνήθως περιορίζεται σε σοβαρά άρρωστους ασθενείς σε μονάδα εντατικής θεραπείας. Μια χαμηλή τιμή TT4 σε ασθενή που δεν είναι βαρέως πάσχων θα πρέπει να οδηγήσει σε έλεγχο δυσλειτουργίας της υπόφυσης. Σε τυχαίους ασθενείς, οι FT4 είναι συχνά πιο ακριβείς διαγνωστικά από τις TT4. Ωστόσο, όταν ένα μη φυσιολογικό αποτέλεσμα FT4 δεν ταιριάζει με την κλινική εικόνα ή υπάρχει μια ανεξήγητη διαφωνία στη σχέση TSH σε FT4, είναι απαραίτητος ένας έλεγχος TT4 για επιβεβαίωση, Εναλλακτικά, το εργαστήριο, είτε θα μπορούσε να στείλει το δείγμα σ’ ένα άλλο εργαστήριο που χρησιμοποιεί μέθοδο FT4 διαφορετικού κατασκευαστή, ή σε εργαστήριο αναφοράς που να μπορεί να εκτελέσει μία μέτρηση FT4 με φυσική μέθοδο διαχωρισμού, όπως ισορροπία διάλυσης ή υπερδιήθηση.
2.2.5. Παρεμβολές στις εξετάσεις θυρεοειδούς
Ιδανικά, μια εξέταση θυρεοειδικής ορμόνης πρέπει να εμφανίζει μηδενικές παρεμποδίσεις παρουσία οποιασδήποτε ένωσης, φαρμάκου ή ενδογενούς ουσίας (π.χ. χολερυθρίνης) σε κάθε δείγμα και σε οποιαδήποτε συγκέντρωση. Μελέτες που διατίθενται από τους κατασκευαστές ποικίλλουν ευρέως στον αριθμό των ενώσεων και στις συγκεντρώσεις που μελετήθηκαν. Συνήθως, το εργαστήριο μπορεί μόνο να ανιχνεύσει προληπτικά παρεμβολές με «έλεγχο ασφαλείας» τη σχέση μεταξύ των αποτελεσμάτων FT4 και TSH. Εάν μόνο μία εξέταση μετράται , η παρεμβολή είναι συνήθως η πρώτη υποψία από τον ιατρό, ο οποίος παρατηρεί αντίφαση μεταξύ της αναφερόμενης τιμής και της κλινικής κατάστασης του ασθενούς. Το εργαστήριο ελέγχει την επαλήθευση της ταυτότητας του δείγματος και την εκτέλεση της αραίωσης, αλλά μπορεί να μην ανιχνεύσει πάντα τις παρεμποδίσεις (30).
Οι παρεμποδίσεις σε ανταγωνιστικές ή μη-ανταγωνιστικές ανοσοδοκιμασίες εμπίπτουν σε τρεις κατηγορίες:
- διασταυρούμενη αντιδραστικότητα
- ενδογενή αυτοαντισώματα
- αλληλεπιδράσεις φαρμάκων
2.2.5.1. Η διασταυρούμενη αντιδραστικότητα
Προβλήματα διασταυρούμενης αντιδραστικότητας προκύπτουν από την ανικανότητα του αντιδραστηρίου αντισώματος να διακρίνει επιλεκτικά μεταξύ του αναλύτη και ενός σχετικού δομικά μορίου. Οι προσδιορισμοί θυρεοειδικών ορμονών είναι λιγότερο ευαίσθητοι σ’ αυτό το είδος των παρεμβολών απ’ότι το TSH, επειδή τα αντιδραστήρια αντισώματος ιωδοθυρονίνης επιλέγονται για εξειδίκευση από καθαρά παρασκευάσματα. Η διαθεσιμότητα των μονοκλωνικών και των καθαρών με συνάφεια πολυκλωνικών αντισωμάτων έχει ελαττώσει τη διασταυρούμενη αντιδραστικότητα των αναλύσεων Τ4 και Τ3 σε λιγότερο από 0,1%. Ωστόσο, έχουν υπάρξει αναφορές ότι το 3-3,5-τριιωδοθυροακετικό οξύ (TRIAC) παρεμβαίνει σε FT3 αναλύσεις και D-Τ4 σε FT4 (2,7).
2.2.5.2. Ενδογενή αυτοαντισώματα
Τα ενδογενή αυτοαντισώματα των Τ4 και Τ3 έχουν συχνά βρεθεί σε ορούς ασθενών με αυτοάνοσο θυρεοειδή, καθώς και σε μη-θυρεοειδικές διαταραχές. Παρά τον υψηλό επιπολασμό τους, οι παρεμποδίσεις που προκαλούνται από τέτοια αυτοαντισώματα είναι σχετικά σπάνιες. Χαρακτηρίζονται είτε από ψευδώς χαμηλές ή ψευδώς υψηλές τιμές, ανάλογα με το είδος και τη σύνθεση της ανάλυσης που χρησιμοποιείται.
2.2.5.3. Παρεμβολές φαρμάκων
Οι παρεμβολές των φαρμάκων μπορεί να προκύψουν από την παρουσία in-vitro θεραπευτικών ή διαγνωστικών παραγόντων στο δείγμα σε επαρκείς ποσότητες, ώστε να παρεμποδίσουν τις αναλύσεις. Μέθοδοι που εκπέμπουν φθορίζοντα σήματα μπορεί να είναι ευαίσθητες στην παρουσία φθοροφόρων παραγόντων που σχετίζονται θεραπευτικά ή διαγνωστικά με το δείγμα. Στην περίπτωση της I.V. χορήγησης ηπαρίνης, η in vitro ενεργοποίηση των λιπασών λιποπρωτεϊνών αποφέρει in vitro παραγωγή ελεύθερων λιπαρών οξέων που μπορεί να ανυψώσει ψευδώς τις FT4 τιμές.
2.2.6. Κανονικά διαστήματα αναφοράς FT4 και FT3 ορού
Οι φυσικές μέθοδοι διαχωρισμού χρησιμοποιούνται για να καθορίζονται οι τιμές βαθμονομητών που χρησιμοποιούνται στις περισσότερες δοκιμασίες FT4. Υπάρχει στενότερη συμφωνία μεταξύ διαστημάτων αναφοράς των διαφόρων επισημασμένων αναλύσεων που χρησιμοποιούνται από κλινικά εργαστήρια, απ’ό,τι υπάρχει μεταξύ των διαφόρων μεθόδων που χρησιμοποιούν φυσικό διαχωρισμό.Τα διαστήματα αναφοράς για ανοσοαναλύσεις FT4 είναι 9-23 pmol/L (0,7-1,8 ng/dL). Αντίθετα, το ανώτερο όριο για μεθόδους FT4, που χρησιμοποιούν φυσικό διαχωρισμό όπως διάλυση ισορροπίας, εκτείνεται πάνω από 30 pmol/L (2,5 ng/dL). Τα διαστήματα αναφοράς για FT3 ανοσολογικές μεθόδους προσεγγίζουν 3,5-7,7 pmol/L (0,2-0,5 ng/dL). Οι FT3 μέθοδοι που χρησιμοποιούν φυσικό διαχωρισμό είναι προς το παρόν διαθέσιμες μόνο ως αναλύσεις έρευνας.
2.2.6.1. Τυποποίηση ή βαθμονόμηση
Κάθε μέθοδος και κατασκευαστής προσεγγίζει το πρόβλημα της τυποποίησης από τη δική του μοναδική προοπτική. Μέθοδοι εκτίμησης FT4 που απαιτούν δύο ανεξάρτητες δοκιμασίες (ιχνηθέτης, διάλυση ισορροπίας και υπερδιήθηση, καθώς και μέθοδοι δείκτες) χρησιμοποιούν μια μέτρηση ολικής ορμόνης και μια μέτρηση του ελεύθερου κλάσματος της ορμόνης.
Οι αναλύσεις ολικής ορμόνης τυποποιούνται με σταθμικά προετοιμασμένους βαθμονομητές παρασκευασμένους από ορμόνη υψηλής καθαρότητας εμπορικά διαθέσιμους. Το ελεύθερο κλάσμα προσδιορίζεται από τις ραδιενεργείς μετρήσεις σ’ένα διήθημα ή υπερδιήθημα. Εναλλακτικά, στην περίπτωση των μεθόδων δεικτών, ο κορεσμός ή η δεσμευτική ικανότητα της πρωτεΐνης δέσμευσης μετριέται χρησιμοποιώντας το λόγο μιας ορμόνης (THBR) αναφερόμενη ως uptake test. Οι ΤΗBR τυποποιούνται με φυσιολογικές δεσμευτικές πρωτεΐνες και τους αποδίδεται η τιμή 1,00 (12,17).
Η κατάσταση είναι πιο περίπλοκη σε επισημασμένες αναλύσεις εκτίμησης ελεύθερων ορμονών. Γενικά, οι εξετάσεις αυτές χρησιμοποιούν πρότυπα ορμονών που προσδιορίζονται με μέθοδο αναφοράς (συνήθως διάλυση ισορροπίας με RIA για τη συγκέντρωση FT4 του διηθήματος). Αυτό συνήθως γίνεται από τον κατασκευαστή για τον καθορισμό τιμών της ελεύθερης ορμόνης σε ανθρώπινους ορούς βασισμένες σε βαθμονομητές που περιέχουν την ορμόνη και τη δεσμευτική της πρωτεΐνη ώστε να συμπεριληφθούν στο κιτ.
Εναλλακτικά, στην περίπτωση ισχυρά δεσμευμένων ορμονών, όπως η θυροξίνη, ο Νόμος Δράσης Μαζών μπορεί να χρησιμοποιηθεί για τον υπολογισμό της συγκέντρωσης της ελεύθερης ορμόνης. Η συγκέντρωση της ολικής, μια μέτρηση της ικανότητας σύνδεσης της ορμόνης στο δείγμα, και η σταθερά ισορροπίας παρέχουν τις απαραίτητες πληροφορίες για τον υπολογισμό της συγκέντρωσης της ελεύθερης. Η προσέγγιση αυτή ισχύει για βαθμονομητές και ορούς ελέγχου που παρασκευάζο-νται από ανθρώπινο ορό που περιέχει μια φυσιολογική ικανότητα σύνδεσης με TBG. Αυτό επιτρέπει στον κατασκευαστή να τους παρασκευάζει σε σταθερά επίπεδα.
Η χρήση τέτοιων βαθμονομητών, επίσης αντισταθμίζει την υπερεκχύλιση της ορμόνης από τις πρωτείνες δέσμευσης. Συγκεκριμένα, στην περίπτωση της θυροξίνης και τριιωδοθυρονίνης, το αντίσωμα στο κιτ μπορεί να δεσμεύει την ελεύθερη ορμόνη και να εκχυλίζει ένα σημαντικό ποσό (~1-2%) δεσμευμένης. Αν αναλυθεί απευθείας, η συγκέντρωση της ελεύθερης ορμόνης θα είναι αυξημένη λόγω της υπερεκχύλισης.
Η χρήση των βαθμονομητών με γνωστά επίπεδα ελεύθερης ορμόνης σε ανθρώπινο ορό επιτρέπει την εκχώρηση συγκεκριμένων επιπέδων σήματος από το σύστημα ανάγνωσης του σήματος της ανάλυσης (ανάλογη, ισοτοπική, ενζυμική, φθορισμού, ή χημειοφωταύγειας) που αντιστοιχεί σε συγκεκριμένες γνωστές συγκεντρώσεις της ελεύθερης ορμόνης μέσω μιας αναλογικής σχέσης. Αυτό είναι έγκυρο, μόνον αν το εκχυλισμένο ποσοστό ορμόνης από το βαθμονομητή είναι ταυτόσημο με εκείνο του δείγματος ασθενούς (χωρίς πρωτεϊνικές ανωμαλίες δέσμευσης).
2.2.6.2. Το μέλλον στη μέτρηση ελευθέρων ορμονών
Η εποχή των μεθόδων ανιχνεύσεως για τον ποσοτικό προσδιορισμό ορμονών του θυρεοειδούς και των στεροειδών σε βιολογικά υγρά πλησιάζει στο τέλος της. Η εποχή των προηγμένων -φασματομετρία μάζας- τώρα αναδύεται. Δεν υπάρχει κανένας λόγος αμφισβήτησης ότι η φασματομετρία μάζας θα παρέχει καλύτερη ποσοτικοποίηση λόγω της μεγαλύτερης αναλυτικής εξειδίκευσης και των λιγότερων παρεμποδίσεων από τις ανοσολογικές. Μέχρι στιγμής υπάρχουν τέτοιες τεχνικές που εφαρμόζονται συνήθως για τον προσδιορισμό TT4 (9,1). Ωστόσο, παραμένει η απαίτηση για πλήρη απελευθέρωση ορμονών από τα σύμπλοκα πρωτεΐνης-ορμόνης.
Για προσδιορισμούς ελεύθερων ορμονών, η απαίτηση για ένα φυσικό διαχωρισμό τους από τις δεσμευμένες, πριν την ποσοτικοποίηση, παραμένει. Προκειμένου να επιτευχθεί αυτό, θα χρειαστεί νέα τεχνολογία διαχωρισμού, πριν οποιαδήποτε μέθοδος θεωρηθεί χρυσό πρότυπο. Η αυτονόητη αραίωση μικρών μορίων είναι ένας περιορισμός της διάλυσης ισορροπίας που πρέπει να ξεπεραστεί.
Η υπερδιήθηση υπόσχεται, αλλά οι τρέχουσες μέθοδοι είναι είτε πολύ διαρρέουσες ή μεγάλης έλλειψης πρακτικής. Μετρήσεις φασματομετρίας μάζας ορμονών που σχηματίζουν σύμπλοκα με πρωτεΐνες ορού θα είναι μόνο τόσο καλές όσο τα βήματα της προετοιμασίας δείγματος συνδέονται με την ποσοτικοποίηση.
Πάντως, η ιδανική μέθοδος αναφοράς ελεύθερης ορμόνης θα είναι μια τεχνική που θα χρησιμοποιεί υπερδιήθηση στους 37°C, για να αποφευχθούν τα αποτελέσματα της αραίωσης και άμεση μέτρηση της ελεύθερης ορμόνης στο υπερδιήθημα με φασματομετρία μάζας.
3. Θυρεοειδοτρόπος / Ορμόνη διέγερσης του θυροειδούς (TSH)
Για περισσότερο από 25 χρόνια, οι TSH μέθοδοι έχουν τη δυνατότητα να ανιχνεύουν τα επίπεδα TSH που είναι χαρακτηριστικά του πρωτοπαθούς υποθυρεοειδισμού. Σύγχρονες μέθοδοι, ωστόσο, με βελτιωμένη ευαισθησία μπορούν να ανιχνεύσουν χαμηλές τιμές TSH, τυπικές του υπερθυρεοειδισμού. Αυτές βασίζονται σε μη-ισοτοπικές ανοσομετρικές αρχές ανάλυσης (ΙΜΑ) και είναι διαθέσιμες σε μια ποικιλία αυτοματοποιημένων μεθόδων σε αναλυτές. Οι περισσότερες από τις τρέχουσες μεθόδους είναι ικανές να επιτύχουν μία λειτουργική ευαισθησία 0.02 mIU/L ή λιγότερο, που είναι το απαραίτητο όριο ανίχνευσης για το πλήρες φάσμα τιμών της TSH. Με αυτό το επίπεδο ευαισθησίας, διακρίνεται η βαθιά καταστολή TSH χαρακτηριστική της σοβαρής θυρεοτοξίκωσης Graves (TSH<0.01mIU/L) από την καταστολή της TSH (0,01 έως 0,1 mIU/L) που παρατηρείται σε ήπιο (υποκλινικό) υπερθυρεοειδισμό και σε ορισμένους ασθενείς με μη θυρεοειδικές ασθένειες (ΝΤΙ).
Κατά την τελευταία δεκαετία, η διαγνωστική στρατηγική για χρήση των μετρήσεων TSH έχει αλλάξει, ως αποτέλεσμα των βελτιώσεων της ευαισθησίας. Η μέτρηση της TSH είναι πιο ευαίσθητη από την FT4 για την ανίχνευση τόσο υπο- όσο και υπερθυρεοειδισμού. Ως αποτέλεσμα, σε ορισμένες χώρες προωθούν την TSH-ως 1η στρατηγική για διάγνωση της δυσλειτουργίας του θυρεοειδούς (με προϋπόθεση η ευαισθησία της μεθόδου TSH ≤0,02 mIU/L). Άλλες χώρες εξακολουθούν να ευνοούν την TSH+FT4 προσέγγιση, αντί της TSH ώστε να ανιχνεύονται δείγματα με κεντρικό υποθυρεοειδισμό ή με έκκριση όγκων της υπόφυσης. Ένα πρόσθετο μειονέκτημα της TSH στρατηγικής είναι ότι η σχέση TSH-FT4 δεν μπορεί να χρησιμοποιηθεί ως μια «λογική ελέγχου» για παρεμποδίσεις ή ανίχνευση ασυνήθιστων συνθηκών που χαρακτηρίζονται από διαταραχή του λόγου TSH/FT4.
3.1. Εξειδίκευση
3.1.1. Ετερογένεια TSH
Η TSH είναι ένα ετερογενές μόριο και διαφορετικές ισομορφές της κυκλοφο-ρούν στο αίμα και είναι παρούσες σε εκχυλίσματα υπόφυσης που χρησιμοποιούνται για την τυποποίηση της μεθόδου. Στο μέλλον, τα παρασκευάσματα ανασυνδυασμένης ανθρώπινης TSH (rhTSH) θα μπορούσαν να χρησιμοποιηθούν ως πρωτογενή πρότυπα για την τυποποίηση TSH.
Οι τρέχουσες μέθοδοι TSH IMA χρησιμοποιούν μονοκλωνικά αντισώματα TSH που ουσιαστικά εξαλείφουν τη διασταυρούμενη αντιδραστικότητα με άλλες ορμόνες γλυκοπρωτεΐνης. Αυτές οι μέθοδοι ωστόσο, μπορούν να ανιχνεύουν διάφορα επίτοπα ανώμαλων ισομορφών TSH που εκκρίνονται από ευθυρεοειδικούς, καθώς και από ασθενείς με μη φυσιολογικές συνθήκες υπόφυσης. Για παράδειγμα, οι ασθενείς με κεντρικό υποθυρεοειδισμό που προκαλείται από δυσλειτουργία υπόφυσης ή υποθαλάμου, εκκρίνουν ισομορφές TSH με ανώμαλες ποσότητες γλυκοζυλίωσης και μειωμένη βιολογική δραστικότητα. Οι ισομορφές αυτές μετρώνται ως παραδόξως φυσιολογικές ή και αυξημένες συγκεντρώσεις TSH από τις περισσότερες μεθόδους. Ομοίως, παραδόξως κανονικά επίπεδα TSH μπορούν να παρατηρηθούν σε ασθενείς με υπερθυρεοειδισμό οφειλόμενα σε έκκριση όγκου της υπόφυσης, που φαίνεται να εκκρίνουν ισομορφές TSH με αυξημένη βιολογική δραστικότητα (31,32).
3.1.2. Τεχνικά προβλήματα
Τεχνικά προβλήματα, ειδικά με το στάδιο έκπλυσης, μπορούν να οδηγήσουν σε ψευδώς υψηλές τιμές TSH. Επιπλέον, οποιαδήποτε ουσία παρεμβαίνει στο δείγμα (π.χ. ετερόλογα αντισώματα, ΗΑΜΑ), παράγει ένα υψηλό υπόβαθρο ή μια ψευδή γέφυρα μεταξύ κατάληψης και αντισωμάτων σήματος, που θα δημιουργήσει ένα υψηλό σήμα στο στερεό υπόστρωμα, δίνοντας ως αποτέλεσμα ψευδώς υψηλές τιμές.
3.1.3. Μέθοδοι για ανίχνευση παρεμβολών σε TSH αποτελέσματα
Η συμβατική προσέγγιση για την εργαστηριακή επαλήθευση της συγκέντρωσης ενός διαλύτη, όπως η αραίωση, μπορεί να μην ανιχνεύσει πάντα ένα πρόβλημα παρεμβολής. Δεδομένου ότι οι μέθοδοι διαφέρουν στην ευαισθησία τους ως προς τις περισσότερες παρεμβαλλόμενες ουσίες, ο πιο πρακτικός τρόπος ανίχνευσης παρεμβολής είναι να μετρηθεί η συγκέντρωση TSH με μέθοδο διαφορετικού κατασκευαστή, ώστε να ελεγχθεί μια σημαντική ασυμφωνία των τιμών TSH.
Όταν η μεταβλητότητα των μετρήσεων που έγιναν στο ίδιο δείγμα με διαφορετικές μεθόδους υπερβαίνει κάποιου ορίου (>50% διαφορά), μπορεί να υπάρχει παρεμπόδιση. Βιολογικοί έλεγχοι μπορεί επίσης να είναι χρήσιμοι για την επαλήθευση ενός απροσδόκητου αποτελέσματος. Ανάρμοστα χαμηλές τιμές TSH μπορούν να ελεγχθούν με δοκιμή TRH-διέγερσης, που αναμένεται να ανυψώσει την TSH περισσότερο από 2-φορές (≥ 4,0 mIU/L προσαύξηση) σε φυσιολογικά άτομα. Σε περιπτώσεις όπου φαίνεται η TSH παράδοξα αυξημένη, μια δοκιμασία καταστολής ορμόνης του θυρεοειδούς αναμένεται να καταστείλει την TSH περισσότερο από 90% σε 48 ώρες σε κανονικά άτομα.
3.2. Ευαισθησία
Ιστορικά, η “ποιότητα” της μεθόδου TSH καθορίζεται από ένα κλινικό δείκτη αναφοράς, ως η ικανότητα να διακρίνει τα επίπεδα ευθυρεοειδικών (~ 0,4-4,0 mIU/L) από τη βαθιά χαμηλή συγκέντρωση TSH (< 0,01 mIU/L) τυπική θυρεοτοξίκωσης Graves. Οι περισσότεροι μέθοδοι TSH ισχυρίζονται ότι το όριο ανίχνευσης είναι 0,02 mIU/L ή λιγότερο (αναλύσεις “τρίτης γενιάς”). Ως λειτουργική ευαισθησία της TSH ανάλυσης ορίζεται ως το 20% του συντελεστή μεταβλητότητας (CV) μεταξύ των τρεξιμάτων καθορισμένου από το συνιστώμενο πρωτόκολλο. Οι κατασκευαστές έχουν εγκαταλείψει, σε μεγάλο βαθμό, τη χρήση της παραμέτρου «αναλυτική ευαισθησία» για τον προσδιορισμό της ευαισθησίας της ανάλυσης, διότι υπολογίζεται από την, εντός της ανάλυσης, ακρίβεια του μηδενικού βαθμονομητή που δεν αντικατοπτρίζει την ευαισθησία του τεστ στην κλινική πρακτική. Αντ’ αυτού, η παράμετρος «λειτουργική ευαισθησία» έχει εγκριθεί και χρησιμοποιείται για να καθοριστεί το χαμηλότερο αναφερόμενο όριο του τεστ.
Η λειτουργική ευαισθησία θα πρέπει να καθορίζεται από την αυστηρή τήρηση του συνιστώμενου πρωτοκόλλου, που έχει σχεδιαστεί για να αξιολογήσει το ελάχιστο όριο ανίχνευσης της δοκιμασίας στην κλινική πρακτική και να εξασφαλίσει ότι η παράμετρος αναπαριστά ρεαλιστικά το χαμηλότερο όριο ανίχνευσης. Είναι έτσι σχεδιασμένο ώστε να λαμβάνει υπόψη μια ποικιλία παραγόντων, όπως:
- Πινακοποιημένες διαφορές μεταξύ ορού του ασθενούς και πρότυπου διαλύτη.
- Εξάλειψη της ακρίβειας στην πάροδο του χρόνου
- Μεταβλητότητα των αντιδραστηρίων από παρτίδα σε παρτίδα.
- Διαφορές μεταξύ βαθμονόμησης του οργάνου και τεχνικών χειριστών
- Μεταφορά από υψηλά σε χαμηλά δείγματα
Με τη χρήση του ορίου λειτουργικής ευαισθησίας διασφαλίζεται ότι κάθε αποτέλεσμα TSH δεν είναι απλώς “θόρυβος”.
3.3. Διαστήματα αναφοράς
Παρά τους παράγοντες φύλο, ηλικία και εθνικότητα που σχετίζονται με διαφορές στα επίπεδα της TSH, που αποκάλυψαν δημοσιευθείσες έρευνες, δεν θεωρείται απαραίτητο να καθοριστούν διαστήματα αναφοράς γι’ αυτούς τους παράγοντες (33). Τα επίπεδα TSH ορού επιδεικνύουν μία ημερήσια διακύμανση με την κορυφή κατά τη διάρκεια της νύχτας και το ναδίρ, που προσεγγίζει το 50% της μέγιστης τιμής, να συμβαίνει μεταξύ 10.00 και 16.00 ώρες. Αυτή η βιολογική μεταβολή δεν επηρεάζει τη διαγνωστική ερμηνεία του αποτελέσματος, καθώς οι περισσότερες κλινικές μετρήσεις TSH εκτελούνται στους ασθενείς μεταξύ 08.00 και 18.00 και τα διαστήματα αναφοράς καθορίζονται από δείγματα που συλλέγονται κατά τη διάρκεια αυτής της χρονικής περιόδου,από ευθυρεοειδικά άτομα με TPOAb αρνητικά, χωρίς προσωπικό ή οικογενειακό ιστορικό δυσλειτουργίας του θυρεοειδούς και μη ορατή βρογχοκήλη. Η διακύμανση των διαστημάτων αναφοράς στις διάφορες μεθόδους αντικατοπτρίζει διαφορές στην αναγνώριση επιτόπου αντισώματος από διαφορετικά αντιδραστήρια και στην αυστηρότητα της εφαρμογής της επιλογής κατάλληλων φυσιολογικών ατόμων.
Οι καθορισμένες συγκεντρώσεις TSH ορού σε ευθυρεοειδικά άτομα λοξοδρομούν με μια σχετικά μακριά “ουρά” προς τις υψηλότερες τιμές της κατανομής. Οι τιμές κατανέμονται πιο κανονικά, όταν μετατραπούν λογαριθμικά. Για τον υπολογισμό του 95% διαστήματος αναφοράς, τα αποτελέσματα συνήθως μετατρέπονται λογαριθμικά (τυπική μέση τιμή πληθυσμού 1,5 mIU/L, εύρος 0,4 έως 4,0 mIU/L σε πληθυσμούς επαρκείς ιωδίου), (Εικόνα 9). Ωστόσο, δεδομένου της ισχυρής επικράτησης του ήπιου (υποκλινικού) υποθυρεοειδισμού στο γενικό πληθυσμό, είναι πιθανό ότι το σημερινό ανώτατο όριο εύρους αναφοράς αυξάνεται από την ένταξη ατόμων με ανεξήγητη δυσλειτουργία του θυρεοειδούς (33).
Εικόνα 9. Αλγόρυθμος εκτίμησης TSH
Κατά τα τελευταία 20 χρόνια, το ανώτατο όριο αναφοράς της TSH μειώνεται σταθερά από 10 σε περίπου ~ 4,0-4,5 mIU/L. Η μείωση αυτή αντανακλά μια σειρά παραγόντων, συμπεριλαμβανομένων της βελτιωμένης ευαισθησίας και εξειδίκευσης του τρέχοντος μονοκλωνικού αντισώματος στο οποίο βασίζονται οι ανοσομετρικές αναλύσεις, της αναγνώρισης ότι οι κανονικές τιμές TSH είναι log-κατανεμημένες και το πιο σημαντικό, των βελτιώσεων της ευαισθησίας και της ειδικότητας των αναλύσεων αντισωμάτων θυρεοειδούς που χρησιμοποιούνται για pre-screen θέματα.
Η πρόσφατη μελέτη παρακολούθησης της κλάσης Whickham διαπίστωσε ότι τα άτομα με TSH ορού > 2,0 mIU/L σε πρωτοβάθμια αξιολόγηση είχαν αυξημένο ποσοστό πιθανοτήτων ανάπτυξης υποθυρεοειδισμού κατά τα επόμενα 20 χρόνια, ειδικά αν τα αντισώματα του θυρεοειδούς ήταν αυξημένα. Ένας αυξημένος λόγος απόδοσης για υποθυρεοειδισμό βρέθηκε ακόμη και σε άτομα με αρνητικά αντισώματα. Είναι πιθανό ότι υπήρχαν χαμηλά επίπεδα αντισωμάτων θυρεοειδούς, μη ανιχνεύσιμα από τις μη ευαίσθητες δοκιμασίες μικροσωμιακής συγκόλλησης αντισωμάτων που χρησιμοποιήθηκαν σε αρχική φάση. Ακόμη και οι τρέχουσες ευαίσθητες ανοσοαναλύσεις TPOAb, δεν μπορούν να εντοπίσουν όλα τα άτομα με κρυφή θυρεοειδική ανεπάρκεια. Στο μέλλον, είναι πιθανό το ανώτατο όριο του εύρους αναφοράς της TSH ευθυρεοειδικών να μειωθεί σε 2,5 mIU/L, διότι > 95% φυσιολογικών εθελοντών ευθυρεοειδικών έχουν τιμές TSH από 0,4-2,5 mIU/L.
Πριν από την εποχή των ανοσομετρητικών δοκιμασιών, οι μέθοδοι TSH ήταν υπερβολικά ευαίσθητες για την ανίχνευση τιμών στο κατώτερο άκρο του εύρους αναφοράς. Οι τρέχουσες μέθοδοι, ωστόσο, είναι ικανές για μέτρηση TSH στο κάτω άκρο και τώρα πια αναφέρονται χαμηλότερα όρια από 0,2-0,4 mIU/L ή και <0,2.
Δεδομένης της βελτίωσης της ευαισθησίας των μεθόδων υπάρχει αυξημένο ενδιαφέρον για τον καθορισμό του πραγματικού κατώτερου φυσιολογικού ορίου για καλύτερο προσδιορισμό του ήπιου (υποκλινικού) υπερθυρεοειδισμού. Οι τρέχουσες μελέτες προτείνουν οι τιμές TSH στο εύρος 0,1-0,4 mIU/L να αντιπροσωπεύουν περίσσεια της ορμόνης θυρεοειδούς, που μπορεί να σχετίζεται με ηλικιωμένους ασθενείς με αυξημένο κίνδυνο κολπικής μαρμαρυγής και καρδιαγγειακή θνησιμότητα. Άρα, για μελέτη εύρους αναφοράς είναι σημαντικό να αποκλειστούν στην κανονική ομάδα, άτομα με βρογχοκήλη και οποιαδήποτε ασθένεια ή στρες.
3.4. Κλινική χρήση των μετρήσεων TSH ορού
Οι περισσότεροι επαγγελματίες συνιστούν να χρησιμοποιείται η TSH για την εύρεση ή το screening της δυσλειτουργίας του θυρεοειδούς, υπό την προϋπόθεση ότι η ανάλυση που χρησιμοποιείται έχει μια λειτουργική ευαισθησία < 0,02 mIU/L (34). Οι λιγότερο ευαίσθητες δοκιμασίες είναι επιρρεπείς να παράγουν ψευδώς αρνητικά αποτελέσματα (φυσιολογικές τιμές) σε δείγματα με συγκεντρώσεις κάτω του φυσιολογικού (1). Η λογαριθμική/γραμμική σχέση της TSH και FT4 υπαγορεύει ότι το προτιμώμενο τεστ είναι της TSH, δεδομένου ότι μόνο αυτό μπορεί να ανιχνεύσει μέτριους βαθμούς περίσσειας ή ανεπάρκειας θυρεοειδικής ορμόνης, (Εικόνα 10).
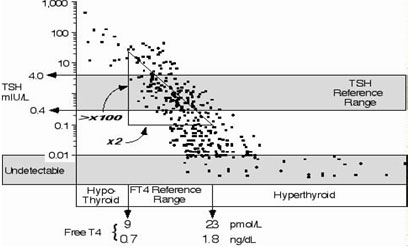
Εικόνα 10. Η σχέση μεταξύ TSH και FT4 συγκεντρώσεων σε άτομα με σταθερή κατάσταση του θυρεοειδούς και σε κανονική λειτουργία υποθαλάμου-υπόφυσης.
Ήπια (υποκλινική) δυσλειτουργία του θυρεοειδούς, χαρακτηριζόμενη από ανώμαλη TSH, συνδεόμενη με φυσιολογικό εύρος FT4 επικρατεί σε πληθυσμούς κατά ~10% και 2% για υποκλινικό υπο-και υπερθυρεοειδισμό, αντίστοιχα (32,34). Παρά την κλινική ευαισθησία της, η TSH έχει δύο βασικούς περιορισμούς. Πρώτον, υποθέτει ότι η λειτουργία υποθαλάμου-υπόφυσης είναι άθικτη και φυσιολογική. Δεύτερον, θεωρεί ότι η θυρεοειδική κατάσταση των ασθενών είναι σταθερή, δηλαδή ο ασθενής δεν έχει λάβει καμία πρόσφατη θεραπεία για υπο-ή υπερθυρεοειδισμό (Εικόνα 11). Εάν κάποιο απ’ αυτά τα κριτήρια δεν πληρείται, τα αποτελέσματα μπορεί να είναι διαγνωστικά παραπλανητικά.
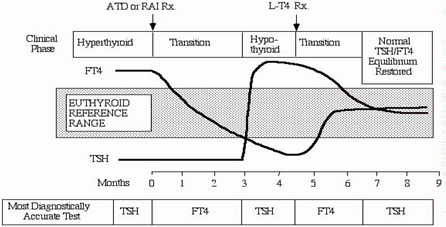
Εικόνα 11. Η υστέρηση στην επαναφορά της TSH υπόφυσης κατά τη μεταβατική περίοδο της ασταθούς κατάστασης του θυρεοειδούς μετά από θεραπεία για υπερ-ή υποθυρεοειδισμό.
Κατά τη διερεύνηση της αιτίας της μη φυσιολογικής TSH ορού υπό την παρουσία της κανονικής FT4 και FT3, είναι σημαντικό να αναγνωρίζεται ότι η TSH είναι μια ορμόνη ασταθής και υπόκειται σε μη θυρεοειδικές επιρροές υπόφυσης (γλυκοκορτικοειδή, σωματοστατίνη, ντοπαμίνη κλπ.) που μπορεί να διαταράξουν τη σχέση TSH/FT4. Είναι σημαντική η επιβεβαίωση ότι το δείγμα είναι φρέσκο, έως περίπου 3 εβδομάδων.
Μετά την επιβεβαίωση μιας ανώμαλης υψηλής TSH, μια μέτρηση TPOAb είναι χρήσιμο κριτήριο για την ύπαρξη αυτοανοσίας του θυρεοειδούς. Όσο υψηλότερη είναι η συγκέντρωση TPOAb, τόσο ταχύτερη είναι η ανάπτυξη βλάβης του θυρεοειδούς. Μετά την επιβεβαίωση μιας ανώμαλης χαμηλής TSH, είναι δύσκολο να καθοριστεί σαφώς η διάγνωση, ειδικά εάν ο ασθενής είναι ηλικιωμένος και δεν λαμβάνει L-T4 θεραπεία. Εάν υπάρχει αδένωμα, η αυτονομία του θυρεοειδούς είναι η πιθανή αιτία του ήπιου (υποκλινικού) υπερθυρεοειδισμού.
Δεν υπάρχει συναίνεση για τη βέλτιστη ηλικία αρχής του screening test. Οι κατευθυντήριες οδηγίες της American Thyroid Association συνιστούν έλεγχο από την ηλικία των 35 και κάθε 5 έτη (34). Ανάλυση αυτής της απόφασης φαίνεται να υποστηρίζει την αποτελεσματικότητα του κόστους που προκύπτει, ιδίως για τις γυναίκες. Η στρατηγική για τη χρήση TSH ως screening ήπιου (υποκλινικού) υπο-και υπερθυρεοειδισμού θα παραμένει σε διένεξη έως ότου υπάρξει μεγαλύτερη συμφωνία σχετικά με τις κλινικές συνέπειες και τα αποτελέσματα αυτών που έχουν χρονίως μη φυσιολογική TSH. Επίσης, πρέπει να υπάρχει συμφωνία ως προς το επίπεδο της ανωμαλίας της TSH που θα καθορίζει την ανάγκη για θεραπεία.
Υπάρχουν αρκετές μελέτες που δηλώνουν ότι ασθενείς με χρόνια ανωμαλία στην TSH εκτίθενται σε μεγαλύτερο κίνδυνο, αν αφεθούν χωρίς θεραπεία και άλλες που υποστηρίζουν την αποτελεσματικότητα του έγκαιρου θυρεοειδικού screening, ιδιαίτερα σε γυναίκες κατά τη διάρκεια της αναπαραγωγικής ηλικίας.
3.4.1. Προαναλυτικοί παράγοντες για τις εξετάσεις θυρεοειδούς
Ευτυχώς, οι περισσότεροι προαναλυτικοί παράγοντες έχουν μικρή επίδραση στη μέτρηση της TSH. Οι προαναλυτικές μεταβλητές και οι παρεμβαλλόμενες ουσίες που υπάρχουν στα δείγματα, μπορεί να επηρεάσουν την πρόσδεση των ορμονών του θυρεοειδούς με τις πρωτεΐνες του πλάσματος και κατά συνέπεια να μειώσουν τη διαγνωστική ακρίβεια του συνόλου και συχνότερα των μετρήσεων των ελεύθερων ορμονών του θυρεοειδούς.
Όπως αναφέρεται οι FT4 και TSH τιμές μπορεί να είναι διαγνωστικά παραπλανητικές κατά τη νόσο ΝΤΙ. στο νοσοκομείο. Οι ασθενείς συχνά είναι ευθυρεοειδικοί με ανώμαλες TSH και/ ή συγκεντρώσεις ολικών και ελεύθερων ορμονών του θυρεοειδούς ως αποτέλεσμα της ΝΤΙ, ή δευτεροπαθούς από φάρμακα που θα μπορούσαν να παρεμβαίνουν στην έκκριση ορμονών ή στη σύνθεση. Όταν υπάρχει έντονη υποψία ότι μία από αυτές τις μεταβλητές μπορεί να επηρεάσει τα αποτελέσματα των δοκιμών, η διαβούλευση με τον ιατρό εμπειρογνώμονα ή τον κλινικό βιοχημικό είναι συχνά απαραίτητη.
3.4.2. Η σχέση TSH/FT4
Η κατανόηση της φυσιολογικής σχέσης μεταξύ επιπέδων FT4 και TSH είναι απαραίτητη για την ερμηνεία των εξετάσεων θυρεοειδούς .Ένας ανέπαφος άξονας υποθαλάμου-υπόφυσης αποτελεί προϋπόθεση ότι η TSH πρέπει να χρησιμοποιηθεί για προσδιορισμό πρωτοπαθούς δυσλειτουργίας του θυρεοειδούς (35). Ένας αριθμός κλινικών καταστάσεων και φαρμακευτικών παραγόντων διαταράσσουν τη σχέση.αυτή. Έτσι είναι πιο σύνηθες να συναντήσει κανείς παραπλανητική FT4 παρά παραπλανητικές TSH.
Όταν η λειτουργία υποθαλάμου-υπόφυσης είναι φυσιολογική, η αντίστροφη λογαριθμική/ γραμμική σχέση μεταξύ συγκεντρώσεων TSH και FT4 παράγεται από την αναστολή της αρνητικής ανάδρασης της έκκρισης TSH της υπόφυσης από τις ορμόνες του θυρεοειδούς. Έτσι, η λειτουργία του θυρεοειδούς μπορεί να προσδιορισθεί είτε άμεσα, με τη μέτρηση της Τ4 (κατά προτίμηση FT4) ή έμμεσα, από την εκτίμηση της TSH, που αντανακλά αντίστροφα τη συγκέντρωση ορμονών του θυρεοειδούς που ανιχνεύονται από την υπόφυση. Έτσι προκύπτει η γνωστή ρήση υψηλή TSH και χαμηλή FT4 είναι χαρακτηριστικά του υποθυρεοειδισμού και χαμηλή TSH με υψηλή FT4 χαρακτηριστικά του υπερθυρεοειδισμού. Στην πραγματικότητα, επειδή η ευαισθησία και η ειδικότητα των αναλύσεων TSH έχουν βελτιωθεί, αναγνωρίζεται ότι η έμμεση προσέγγιση (μέτρηση TSH) προσφέρει καλύτερη ευαισθησία ανίχνευσης δυσλειτουργίας του θυρεοειδούς από την FT4 (34).
Υπάρχουν δύο λόγοι για την χρήση επικεντρωμένης σε TSH στρατηγικής:
- Οι TSH και FT4 συγκεντρώσεις εμφανίζουν αντίστροφη λογαριθμική/γραμμική σχέση τέτοια ώστε μικρές μεταβολές στην FT4 θα παράγουν μια πολύ μεγαλύτερη απόκριση TSH, (Εικόνα 10).
- Οι ατομικές διαφοροποιήσεις τιμών ελέγχου θυρεοειδικών ορμονών, μαζί με μελέτες διδύμων δείχνουν ότι κάθε άτομο έχει ένα γενετικά καθορισμένο FT4 set-point. Οποιαδήποτε ήπια περίσσεια ή ανεπάρκεια FT4 ανιχνεύεται από την υπόφυση, σχετιζόμενη με αυτό το set-point προκαλεί μια ενισχυμένη, αντίστροφη απόκριση της έκκρισης της TSH. Άρα, στα πρώτα στάδια της δυσλειτουργικής ανάπτυξης του θυρεοειδούς, μια ανώμαλη TSH θα προηγηθεί στην ανάπτυξη μιας ανώμαλης FT4, επειδή η TSH ανταποκρίνεται εκθετικά σε ανεπαίσθητες αλλαγές FT4 που βρίσκονται εντός των ορίων του πληθυσμού αναφοράς. Αυτό οφείλεται στο γεγονός ότι τα όρια αναφοράς του πληθυσμού είναι ευρεία, γεγονός που αντικατοπτρίζει τα διαφορετικά FT4 set-points των μελών της ομάδας των φυσιολογικών ατόμων που μελετήθηκαν.
Επί του παρόντος, η μέτρηση της συγκέντρωσης TSH είναι ο πιό αξιόπιστος δείκτης της κατάστασης του θυρεοειδούς σε επίπεδο ιστών. Μελέτες της ήπιας (υποκλινικής) περίσσειας ή ανεπάρκειας ορμόνης θυρεοειδούς (μη φυσιολογική TSH/ φυσιολογικές FT4 και FT3) βρίσκουν ανωμαλίες σε δείκτες δράσης των θυρεοειδικών ορμονών σε μια ποικιλία ιστών (καρδιά,εγκέφαλο, οστά ,ήπαρ και νεφρούς), που τυπικά αντιστρέφονται όταν ξεκινά η θεραπεία για την ομαλοποίηση TSH (36).
Οι κλινικές καταστάσεις, όπου οι TSH ή τα επίπεδα FT4 μπορεί να είναι παραπλανητικά διαγνωστικώς, είναι ανωμαλίες λειτουργίας υποθαλάμου ή υπόφυσης συμπεριλαμβανομένων των όγκων της υπόφυσης. Ειδικά για τις πρώτες συμβαίνουν σε περιόδους μετάβασης ασταθούς κατάστασης του θυρεοειδούς (Εικόνα 11), όπως κατά την πρώιμη φάση της θεραπείας υπερ-ή υποθυρεοειδισμού ή αλλαγής της δόσης L-T4, (1). Συγκεκριμένα, χρειάζονται 6-12 εβδομάδες, ώστε η έκκριση της TSH να ισορροπήσει τη νέα κατάσταση θυρεοειδικών ορμονών. Ο περίοδοι ασταθούς κατάστασης μπορεί επίσης να εμφανιστούν μετά από ένα επεισόδιο θυρεοειδίτιδας,συμπεριλαμβανομένης της θυρεοειδίτιδας μετά τον τοκετό.
Φάρμακα που επηρεάζουν την έκκριση της TSH (ντοπαμίνη και γλυκοκορτικοειδή) ή τη δέσμευση ορμόνης θυρεοειδούς με τις πρωτεΐνες πλάσματος, μπορεί επίσης να προκαλέσουν ασύμφωνες τιμές TSH.
3.4.3. Επιδράσεις της χρονολογικής ηλικίας στα πεδία αναφοράς του τεστ θυρεοειδούς
Ενήλικες. Παρά τις μελέτες που δείχνουν μικρές διαφορές μεταξύ γηραιότερων και νεότερων σε ηλικία ενηλίκων, η προσαρμογή εύρους αναφοράς για τις ορμόνες του θυρεοειδούς και την TSH είναι περιττή (32). Όσον αφορά τα ευθυρεοειδικά ηλικιωμένα άτομα, η μέση τιμή της TSH αυξάνεται κάθε δεκαετία, όπως και η επικράτηση σε χαμηλές και υψηλές συγκεντρώσεις TSH, σε σύγκριση με τα νεότερα άτομα. Παρά την ευρύτερη μεταβλητότητα της TSH που εμφανίζεται σε ηλικιωμένα άτομα, φαίνεται να μην υπάρχει καμία δικαιολογία για τη χρήση διευρημένου ή προσαρμοσμένου με την ηλικία εύρους τιμών αναφοράς.
Νεογνά, βρέφη και παιδιά. Στα παιδιά, ο άξονας υποθαλάμου / υπόφυσης / θυρεοειδούς υφίσταται προοδευτική ωρίμανση και διαφοροποίηση. Συγκεκριμένα, υπάρχει μια συνεχής μείωση της αναλογίας TSH/FT4 από τη στιγμή του μέσου της κύησης μέχρι μετά την ολοκλήρωση της εφηβείας (37). Ως αποτέλεσμα, υψηλότερες συγκεντρώσεις TSH παρατηρούνται στα παιδιά. Αυτό υπαγορεύει τη χρήση ειδικών ορίων αναφοράς με την ηλικία. Υπάρχουν όμως σημαντικές διαφορές μεταξύ FT4 και TSH μετρήσεων διαφορετικών μεθόδων. Δεδομένου ότι οι περισσότεροι κατασκευαστές δεν δίνουν ανεξάρτητα με την ηλικία τεκμηριωμένα διαστήματα αναφοράς, τα όρια αυτά μπορούν να υπολογιστούν στις διάφορες αναλύσεις με προσαρμογή άνω και κάτω ορίων του ενήλικου φάσματος.
Χαμηλότερα επίπεδα ΤT3 & FT3 παρατηρήθηκαν στην εγκυμοσύνη, κατά τη νεογνική περίοδο, σε ηλικιωμένους και κατά τη διάρκεια θερμιδικής στέρησης. Υψηλότερες ΤT3 και FT3 βλέπουμε συνήθως σε ευθυρεοειδικά παιδιά. Αυτό δηλώνει ότι το ανώτατο όριο της Τ3 σε νεαρούς ασθενείς (<20 ετών) θα πρέπει να οριστεί με κλίση μεταξύ 6,7 pmol/L (0,44ng/dL) για ενήλικες, έως 8,3 pmol/L(0,54ng/dL) για παιδιά<3ετών.
Εγκυμοσύνη. Κατά τη διάρκεια της εγκυμοσύνης, η παραγωγή οιστρογόνων αυξάνει προοδευτικά τη μέση συγκέντρωση TBG. Αυτό οδηγεί σε μετατόπιση του εύρους αναφοράς TT4 και ΤΤ3 περίπου 1,5 φορές έναντι του επιπέδου των μη εγκύων στις 16 εβδ.κύησης (38). Οι αλλαγές αυτές συνδέονται με πτώση της TSH κατά τη διάρκεια του1ου τριμήνου, τέτοια ώστε TSH κάτω του φυσιολογικού ορίου να υπάρχει σε 20% των φυσιολογικών κυήσεων (26). Αυτή η μείωση αποδίδεται στη διεγερτική θυρεοειδική δραστικότητα της hCG, που είναι δομικά ομόλογη με την TSH. Η μέγιστη αύξηση της hCG και το ναδίρ της TSH εμφανίζονται περίπου σε 10-12 εβδ.κύησης. Σε 10 % των περιπτώσεων αυτών (δηλ.2% συνόλου κυήσεων), η αύξηση της FΤ4 φθάνει τιμές άνω του φυσιολογικού και όταν παραταθεί, μπορεί να οδηγήσει σε σύνδρομο με τίτλο “παροδική θυρεοτοξίκωση κύησης” (GTT), που χαρακτηρίζεται από λιγότερο ή περισσότερο έντονα συμπτώματα, που μπορεί να οδηγήσει σε υπερέμεση στο 1ο τρίμηνο.
Η πτώση της TSH κατά το 1ο τρίμηνο κύησης σχετίζεται με μέτρια αύξηση στην FT4 (26). Στο 2ο και 3ο τρίμηνο υπάρχει πλέον συναίνεση ότι τα επίπεδα FT4 και FT3 μειώνονται περίπου 20-40% κάτω από το μέσο φυσιολογικό, μια μείωση που ενισχύεται περαιτέρω όταν η κατάσταση διατροφής της μητέρας με ιώδιο είναι περιορισμένη ή ανεπαρκής. Η κατάσταση του θυρεοειδούς τους πρέπει να ελέγχεται με TSH+FT4 κατά τη διάρκεια κάθε τριμήνου.
In vitro επιδράσεις. Ενδοφλέβια χορήγηση ηπαρίνης μπορεί να ανυψώνει ψευδώς FT4 (σ.18). Σε ορισμένες παθολογικές καταστάσεις, όπως ουραιμία, ανώμαλα συστατικά ορού, (ινδολοξεικό οξύ), μπορεί να συσσωρεύονται και να παρεμποδίζουν την πρόσδεση θυρεοειδικών ορμονών. Μέθοδοι που χρησιμοποιούν φθορίζοντα σήματα μπορεί να είναι ευαίσθητες στην παρουσία σχετιζόμενων με φθοροφόρους θεραπευτικούς ή διαγνωστικούς παράγοντες στο δείγμα.
Μη θυρεοειδική νόσος (ΝΤΙ). Οι ασθενείς που πάσχουν από μια σοβαρή ασθένεια συχνά έχουν ανωμαλίες στις εξετάσεις του θυρεοειδούς, χωρίς δυσλειτουργία του θυρεοειδούς. Οι ανωμαλίες αυτές που παρατηρούνται σε οξείες και χρόνιες κρίσιμες ασθένειες, προκύπτουν από απορρυθμισμένη κεντρική αναστολή του υποθαλάμου απελευθερώνοντας ορμόνες, συμπεριλαμβανομένης της TRH. Οι όροι “nonthyroidal ασθένεια» ή ΝΤΙ, όπως και “ευθυρεοειδικοί άρρωστοι” και ” σύνδρομο χαμηλής-T4» χρησιμοποιούνται συχνά για να περιγράψουν αυτό το υποσύνολο των ασθενών.Το φάσμα των αλλαγών στις εξετάσεις του θυρεοειδούς σχετίζεται με τη σοβαρότητα, και το στάδιο της ασθένειας, αλλά και με τεχνικούς παράγοντες που επηρεάζουν τις μεθόδους όπως τα φάρμακα που λαμβάνουν οι ασθενείς (1) (Εικόνα 12).
Όποτε είναι δυνατόν,οι διαγνωστικές εξετάσεις θα πρέπει να αναβάλλονται έως ότου η ασθένεια παρέλθει, εκτός εάν το ιστορικό του ασθενούς ή τα κλινικά χαρακτηριστικά υποδηλώνουν παρουσία της δυσλειτουργίας του θυρεοειδούς.
Οι γιατροί θα πρέπει να αναγνωρίσουν ότι κάποιες εξετάσεις θυρεοειδούς είναι εγγενώς μη ερμηνεύσιμες σε σοβαρά άρρωστους ασθενείς του, ή σε ασθενείς που λαμβάνουν πολλαπλά φάρμακα.
Η TSH απουσία χορήγησης ντοπαμίνης ή γλυκοκορτικοειδών, είναι το πιο αξιόπιστο τεστ για ΝΤΙ ασθενείς. Οι εκτιμήσεις της FT4 και TT4 σε NTI ασθενείς πρέπει να ερμηνεύονται με προσοχή, σε συνδυασμό με μέτρηση της TSH.
Ένα μη φυσιολογικό τεστ FT4 είναι αναξιόπιστο για καθορισμό σοβαρής νόσου. Πρέπει να επιβεβαιωθεί με μια μέτρηση TT4. Αν και οι δύο είναι ανώμαλες (προς την ίδια κατεύθυνση) μια θυρεοειδική κατάσταση είναι παρούσα. Όταν TT4 και FT4 είναι ασύμφωνες, η FT4 ανωμαλία είναι απίθανο να οφείλεται σε δυσλειτουργία του θυρεοειδούς αλλά αποτελεί συνέπεια των φαρμάκων της ασθένειας, ή τεχνητό προιόν του τεστ. Οι TT4 ανωμαλίες πρέπει να αξιολογούνται σε σχέση με την σοβαρότητα της ασθένειας, αφού χαμηλή TT4 σε ΝΤΙ εμφανίζεται μόνο σε σοβαρά άρρωστους ασθενείς με υψηλό ποσοστό θνησιμότητας. Χαμηλή TT4 σε ασθενή που δεν είναι σε μονάδα εντατικής, είναι ύποπτη για υποθυρεοειδισμό.
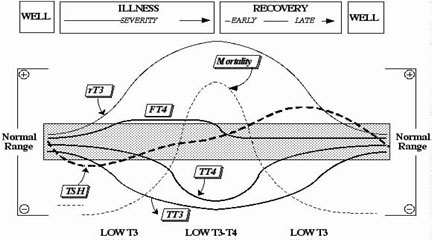
Εικόνα 12. Αλλαγές θυροειδικών εξετάσεων σε NTI ασθενείς.
Μια αυξημένη TT3 ή FT3 είναι χρήσιμος δείκτης υπερθυρεοειδισμού σε ασθενή νοσοκομείου, αλλά μια φυσιολογική ή χαμηλή Τ3 δεν το αποκλείει. Οι αναλύσεις αντίστροφης T3 είναι σπάνια χρήσιμες στο νοσοκομείο, γιατί κανονικές ή χαμηλές τιμές της μπορεί να προκληθούν από διαταραχές νεφρικής λειτουργίας και χαμηλής συγκέντρωσης πρωτεΐνης δέσμευσης. Επιπλέον, η ανάλυση δεν είναι άμεσα διαθέσιμη στα περισσότερα εργαστήρια.
3.5. Μεταβλητές δειγμάτων
3.5.1. Σταθερότητα
Λίγες μελέτες έχουν εξετάσει τις επιπτώσεις της αποθήκευσης δειγμάτων αίματος για συγκεντρώσεις ορού ολικών και ελεύθερων θυρεοειδικών ορμονών, TSH και Tg. Γενικά, υποστηρίζουν ότι οι θυρεοειδικές ορμόνες είναι σχετικά σταθερές είτε αποθηκευτούν σε θερμοκρασία δωματίου, ψύξη ή κατάψυξη. Μερικές μελέτες έχουν αναφέρει ότι η Τ4 στον ορό είναι σταθερή για μήνες, όταν αποθηκεύεται στους -4°C ή χρόνια, όταν καταψύχεται στους -10°C (39). Οι TSH και TT4 σε πλήρως αποξηραμένες κηλίδες αίματος, που χρησιμοποιούνται για screening νεογνικού υποθυρεοειδισμού, είναι σταθερές για μήνες όταν αποθηκεύονται με αποξηραντικό. Η TSH ορού φαίνεται να είναι ελαφρώς πιο σταθερή απ’ ότι η Τ4. Υπενθυμίζεται, ότι τα μη κατεψυγμένα δείγματα ασθενών που λαμβάνουν ηπαρίνη είναι επιρρεπή σε in-vitro παραγωγή FFA, άρα ψευδή ανύψωση της FT4.
3.5.2. Συστατικά ορού
Γενικά, η αιμόλυση, η λιπαιμία και η υπερχολερυθριναιμία δεν παρεμβαίνουν σημαντικά στις ανοσοαναλύσεις. Ωστόσο,τα FFA μπορεί να αντικαταστήσουν την Τ4 στις πρωτεΐνες δέσμευσης ορού, που εν μέρει εξηγεί τις χαμηλές τιμές TT4 συχνά εμφανιζόμενες σε ΝΤΙ.
3.5.3. Ετεροφυλικά αντισώματα (HAMA)
Μπορεί να υπάρχουν σε ορούς ασθενών. Τα HAMA εμπίπτουν σε δύο κατηγορίες. Είτε είναι σχετικά αδύναμα, πολυεξειδικευμένα, πολυαντιδραστικά αντισώματα, που είναι συχνά IgM ρευματοειδούς παράγοντα ή ευρέως αντιδραστικά που επάγονται από λοιμώξεις ή από έκθεση σε θεραπείες με μονοκλωνικά αντισώματα, (40). Αυτά μερικές φορές καλούνται ανθρώπινα anti-mouse αντισώματα (ΗΑΜΑ). Εναλλακτικά, μπορούν να είναι ειδικές ανθρώπινες anti-animal ανοσοσφαιρίνες (HAAA), που παράγονται έναντι καθορισμένων ειδικών αντιγόνων μετά από έκθεση σε θεραπευτικό παράγοντα που περιέχει αντιγόνα των ζώων ή με τυχαία ανοσοποίηση μέσω της έκθεσης στο χώρο εργασίας (π.χ. χειριστές ζώων).
Τα HAMA ή HAAA επηρεάζουν την IMA μεθοδολογία περισσότερο από τις ανταγωνιστικές ανοσοαναλύσεις σχηματίζοντας έτσι μια γέφυρα μεταξύ σύλληψης και αντισωμάτων σήματος, δημιουργώντας έτσι ένα ψεύτικο σήμα, που αποφέρει δυσανάλογα υψηλές τιμές. Το ακατάλληλο αποτέλεσμα μπορεί να μην είναι ανώμαλο, απλώς ακατάλληλα φυσιολογικό. Οι κατασκευαστές χρησιμοποιούν σήμερα διάφορες προσεγγίσεις για να συμφωνήσουν με την έκβαση HAMA σε κάποιο βαθμό, συμπεριλαμβάνοντας συνδυασμούς χιμαιρικών αντισωμάτων και παραγόντων ομαδοποίησης, ώστε να εξουδετερώσουν τις επιδράσεις.
3.5.4. Συλλογή δειγμάτων και επεξεργασία
Οι περισσότεροι κατασκευαστές συνιστούν τον ορό ως προτιμώμενο δείγμα, από το EDTA ή το πλάσμα με ηπαρίνη. Για βέλτιστα αποτελέσματα και μέγιστη απόδοση, συνιστάται όλα τα δείγματα αίματος να αφήνονται να πήξουν για τουλάχιστον 30 λεπτά πριν την φυγοκέντρηση και το διαχωρισμό.Ο ορός μπορεί να αποθηκεύεται στους 4-8°C για το πολύ μία εβδομάδα. Αποθήκευση στους -20°C, συνιστάται όταν η εξέταση πρόκειται να καθυστερήσει για περισσότερο από μία εβδομάδα. Η συγκέντρωση ορού σε σωληνάρια πήγματος δεν επηρεάζει τα αποτελέσματα των T3, T4 και TSH αναλύσεων.
3.5. Πρότυπα απόδοσης του θυρεοειδικού test
Βιολογική Μεταβολή. Τα επίπεδα ορού ορμονών του θυρεοειδούς και της πρόδρομης πρωτεΐνης, θυρεοσφαιρίνης (Tg) είναι αρκετά σταθερά για μια περίοδο 1-4 ετών και πάνω. Οι θυρεοειδικοί αναλυτές εμφανίζουν μεγαλύτερη αλληλο-διακύμανση (inter-individual) απ’ότι εσω-ατομική διακύμανση (intra-individual). Η σταθερότητα των εσωατομικών συγκεντρώσεων T4 αντανακλά το μεγάλο χρόνο ημιζωής της θυροξίνης (7 ημέρες) και του γενετικά επιβεβλημένου set point της FT4. Η σταθερότητα των εσωατομικών συγκεντρώσεων T3 αντανακλά την αυτορρύθμιση του ρυθμού μετατροπής Τ4 σε Τ3.
Η αλληλοδιακύμανση είναι ιδιαίτερα υψηλή στις συγκεντρώσεις Tg, λόγω των διαφορών της μάζας του θυρεοειδούς, της κατάστασης της TSH και των συνθηκών που σχετίζονται με βλάβη του θυρεοειδούς (π.χ. θυρεοειδίτιδα)-όλες οι συνθήκες που επηρεάζουν τις συγκεντρώσεις Tg.
Τα επίπεδα TSH εμφανίζουν επίσης υψηλή μεταβλητότητα, τόσο εντός όσο και μεταξύ των ατόμων. Αυτό αντανακλά κυρίως τη σύντομη ημιζωή της TSH (~60 min), μαζί με τον κιρκαδικό και τις ημερήσιες διακυμάνσεις της, Το πλάτος της μεταβλητότητας σε 24 ώρες είναι περίπου διπλάσιο. Ωστόσο, δεδομένου ότι το μέγεθος της αλλαγής βρίσκεται εντός κανονικού διαστήματος αναφοράς,ένα ενιαίο εύρος τιμών (~0,4 έως 4,0 mIU/L) για τον πληθυσμό δεν θέτει σε κίνδυνο τη διάγνωση. Επιπλέον, η TSH συνήθως μετράται κατά τη διάρκεια της ημέρας στα εξωτερικά ιατρεία, οπότε το μέγεθος της μεταβλητότητας είναι το μικρότερο.
Η απόδοση μιας εργαστηριακής εξέτασης μπορεί να αξιολογηθεί βιολογικά και αναλυτικά. Η αναλυτική απόδοση τυπικά αξιολογείται στο εργαστήριο με παραμέτρους όπως:
- Εντός και μεταξύ τρεξιμάτων ακρίβεια των μεθόδων, αξιολογημένες σε διαφορετικές συγκεντρώσεις αναλύτη.
- Κατώτατο όριο ανίχνευσης (αναλυτική ευαισθησία).
- Λειτουργική ευαισθησία (ορισμένη από CV%, σχετική με βιολογική και μεθοδολογική διακύμανση του ειδικού αναλύτη).
- Γραμμικότητα των μετρήσεων σ’όλο το αναφερόμενο εύρος τιμών.
- Ανάκτηση του αναλύτη που προστίθεται στην πρότυπη μήτρα.
- Κανονικό διάστημα αναφοράς (μέσος όρος +/-2 τυπικές αποκλίσεις τιμών ) για ομάδα ασθενών χωρίς νόσο.
- Συσχέτιση με μια μέθοδο αναφοράς.
Αν και οι παραπάνω παράμετροι είναι το θεμέλιο των προγραμμάτων ποιοτικού ελέγχου και διασφάλισης ποιότητας των περισσοτέρων εργαστηρίων, είναι ευρέως αποδεκτό ότι οι στόχοι αναλυτικής απόδοσης θα πρέπει να καθορίζονται με βιολογικές αρχές (εντός και μεταξύ των ατομικών διακυμάνσεων) και με την κλινική ανάγκη. Το ολικό αναλυτικό σφάλμα πρέπει ιδανικά να είναι λιγότερο από το μισό του βιολογικού συντελεστή διακύμανσης στο ίδιο άτομο (% CV).
Για διαγνωστικές εξετάσεις, τα αποτελέσματα των εξετάσεων του θυρεοειδούς αναφέρονται μαζί μ’ ένα φυσιολογικό διάστημα αναφοράς, που αντανακλά τη ενδοατομική διακύμανση και προβλέπει ένα σημείο αναφοράς για την εύρεση της κάθε περίπτωσης. Δεν μπορεί όμως να χρησιμοποιηθεί για τη διερεύνηση διαφορών μεταξύ 2 διαδοχικών αποτελεσμάτων εξετάσεων που έγιναν κατά την παρακολούθηση της θεραπείας του ασθενούς και αποτελούν κλινικά σημαντική αλλαγή, ή απλώς αντικατοπτρίζουν την τεχνική (ανακρίβεια μεταξύ κύκλων) και τη βιολογική μεταβλητότητα της μέτρησης (εσωατομική διακύμανση).
Το φυσιολογικό διάστημα αναφοράς είναι συνήθως μη σχετικό για τη μετεγχειρητική κλινική διαχείριση των καρκινικών δεικτών, όπως Tg. Σαφώς, η προτιμόμενη μέθοδος και οι στόχοι ακριβείας δεν χρειάζεται να είναι τόσο αυστηροί, όταν μια μέτρηση χρησιμοποιείται για τη διάγνωση, όσο για τη σύγκριση σειράς μετρήσεων για την παρακολούθηση των ασθενών. Αν και το φυσιολογικό διάστημα αναφοράς που αναγράφεται στην τυπική εργαστηριακή έκθεση βοηθά το γιατρό να κάνει μια πρώιμη διάγνωση, δεν δίνει τις σχετικές πληροφορίες που θα τον βοηθήσουν να εκτιμήσει τη σημασία των αλλαγών που προκύπτουν από τη θεραπεία.
4. Θυροειδικά αυτοαντισώματα (TPOAb, TgAb, TRAb)
4.1. Eισαγωγή
Η αυτοάνοση νόσος θυρεοειδούς (AITD) προκαλεί κυτταρική βλάβη και αλλάζει τη λειτουργία του θυρεοειδούς αδένα με μηχανισμούς χυμικής και κυτταρικής μεσολάβησης. Η κυτταρική βλάβη συμβαίνει όταν ευαισθητοποιημένα Τ-λεμφοκύτταρα και/ή αυτοαντισώματα δεσμεύονται στις κυτταρικές μεμβράνες προκαλώντας κυτταρική λύση και φλεγμονώδεις αντιδράσεις. Μεταβολές στη λειτουργία του θυρεοειδούς προκαλούνται από τη δράση της διέγερσης ή το μπλοκάρισμα των αυτοαντισωμάτων σε υποδοχείς κυτταρικής μεμβράνης.
Τρία βασικά αυτοαντιγόνα του θυρεοειδούς εμπλέκονται στην AITD: η θυρουπεροξειδάση (ΤΡΟ), η θυρεοσφαιρίνη (Tg) και ο υποδοχέας της TSH. Άλλα αυτοαντιγόνα, όπως το Sodium Iodide Symporter (NIS) έχουν περιγραφεί, αλλά ακόμη δεν φαίνεται να παίζουν διαγνωστικό ρόλο στην αυτοανοσία του θυρεοειδούς. Τα αυτοαντισώματα υποδοχέα της TSH (TRAb) είναι ετερογενή και είτε μιμούνται τη δράση της TSH και προκαλούν υπερθυρεοειδισμό (νόσος Graves) ή ανταγωνίζονται τη δράση της TSH και προκαλούν υποθυρεοειδισμό. Η τελευταία εμφανίζεται συνήθως σε νεογνά μητέρων με αντισώματα λόγω AITD. Τα TPO αντισώματα (TPOAb) έχουν εμπλακεί σε καταστροφικές διαδικασίες στον ιστό που συνδέονται με υποθυρεοειδισμό, στη νόσο Hashimoto και σε ατροφική θυρεοειδίτιδα. Η εμφάνιση των TPOAb συνήθως προηγείται της ανάπτυξης της δυσλειτουργίας του θυρεοειδούς. Ορισμένες μελέτες δείχνουν ότι τα TPOAb μπορεί να είναι κυτταροτοξικά για το θυρεοειδή (41).
Ο παθολογικός ρόλος των TgAb παραμένει ασαφής. Σε περιοχές επαρκείς ιωδίου, τα TgAb ορίζονται ως συμπληρωματική εξέταση σε μέτρηση Tg, γιατί η παρουσία τους μπορεί να παρεμποδίζει τις μεθόδους ποσοτικοποίησής της. Σε περιοχές με ανεπάρκεια ιωδίου, οι μετρήσεις TgAb μπορεί να είναι χρήσιμες για την ανίχνευση αυτοάνοσης νόσου του θυρεοειδούς σε ασθενείς με οζώδη βρογχοκήλη και για την παρακολούθηση της θεραπείας της ιωδιούχου ενδημικής βρογχοκήλης.
Αυτοαντισώματα του θυρεοειδούς, μπορεί να εκτιμηθούν στα περισσότερα κλινικά εργαστήρια. Δυστυχώς, η διαγνωστική και προγνωστική χρήση των μετρήσεών τους παρεμποδίζεται από τεχνικά προβλήματα. Παρά το γεγονός, ότι οι αναλύσεις τους έχουν εγγενή κλινική χρησιμότητα σ’ένα μεγάλο αριθμό κλινικών καταστάσεων, πρέπει να χρησιμοποιούνται επιλεκτικά.
4.2. Ονοματολογία των τεστ αντισωμάτων του θυρεοειδούς
Η ονοματολογία που χρησιμοποιείται για αυτοαντισώματα του θυρεοειδούς έχει πολλαπλασιαστεί, ιδιαίτερα στην περίπτωση των αντισωμάτων του υποδοχέα της TSH (LATS, TSI, TBII, TSH-R και TRAb). Οι όροι αυτοί αντιστοιχούν σε μοριακές οντότητες (ανοσοσφαιρίνες) που αντιδρούν με εξειδικευμένα αυτοαντιγόνα αναγνωριζόμενα από τα εργαστηριακά τεστ. Οι διαφορές των μεθόδων μπορεί να προέρχονται από τη μέτρηση αυτών των μοριακών οντοτήτων.
- αντι-θυροσφαιρίνης: TAB,TAK,<TG>
- αντι θυρεοειδικά έναντι υπεροξειδάσης : <TPO>
- μικροσωμιακά αντισώματα: MAB, MAK
- υποδοχείς αντι-TSH: TRAB,TRAK
- μακράς δράσης διέγερσης θυρεοειδούς: LATS
- αντι-Τ4
- αντι-Τ3
- άλλα
4.3. Κλινική σημασία των αυτοαντισωμάτων έναντι του θυρεοειδούς
Τα TPOAb ή/και TgAb είναι συχνά παρόντα σε ορούς ασθενών με AITD, αν και μερικές φορές ασθενείς με AITD έχουν αρνητικά αυτοαντισώματα. Τα TRAb είναι παρόντα σε περισσότερους ασθενείς με ιστορικό ή παρουσία νόσου Graves. Κατά τη διάρκεια της εγκυμοσύνης, η παρουσία των TRAb αποτελεί παράγοντα κινδύνου για την εμβρυϊκή ή νεογνική δυσλειτουργία, ως αποτέλεσμα του ενδοπλακουντιακού περάσματος των μητρικών TRAb. Η εμφάνιση των θυρεοειδικών αυτοαντισωμάτων αυξάνεται όταν οι ασθενείς έχουν μη θυρεοειδικές αυτοάνοσες νόσους, όπως διαβήτη τύπου 1 και κακοήθη αναιμία. Η γήρανση συνδέεται επίσης με την εμφάνισή τους, ενώ η κλινική σημασία των χαμηλών επιπέδων τους σε ευθυρεοειδικά άτομα είναι ακόμα άγνωστη.
Ωστόσο, μελέτες δείχνουν ότι τα TPOAb μπορεί να αποτελούν παράγοντα κινδύνου για μελλοντική θυρεοειδική δυσλειτουργία, όπως θυρεοειδίτιδας μετά τον τοκετό (ΡΡΤ) και ανάπτυξη αυτοάνοσων επιπλοκών από θεραπεία με διάφορους θεραπευτικούς παράγοντες (38). Τέτοιοι είναι θεραπεία με αμιωδαρόνη για καρδιακή νόσο, ιντερφερόνη-άλφα για χρόνια ηπατίτιδα C και λίθιο για θεραπεία ψυχιατρικών διαταραχών.
Η χρήση των μετρήσεων αυτοαντισωμάτων θυρεοειδούς για παρακολούθηση της θεραπείας AITD γενικά δεν συνιστάται, δεδομένου ότι η θεραπεία της AITD αντιμετωπίζει το αποτέλεσμα (δυσλειτουργία του θυρεοειδούς) και όχι την αιτία (αυτοανοσία) της νόσου. Εντούτοις, μεταβολές στις συγκεντρώσεις αυτοαντισωμάτων συχνά αντικατοπτρίζουν μια αλλαγή στην ενεργότητα της νόσου.
4.4. Εξειδίκευση των μεθόδων των αντισωμάτων του θυρεοειδούς
Η χρήση των μετρήσεων αυτοαντισωμάτων θυρεοειδούς παρεμποδίζεται από προβλήματα εξειδίκευσης. Οι μελέτες δείχνουν ότι τα αποτελέσματα ποικίλλουν ανάλογα με τη χρησιμοποιούμενη μέθοδο. Αυτό οφείλεται σε διαφορές τόσο στην ευαισθησία όσο και στην ειδικότητα των μεθόδων και στην απουσία επαρκούς τυποποίησης.
Τα τελευταία χρόνια, οι μελέτες σε μοριακό επίπεδο έδειξαν ότι τα αυτοαντισώματα αντιδρούν με αυτοαντιγόνα στόχους, συνδέοντας τις προς διαμόρφωση περιοχές ή επίτοπους. Ο όρος “προς διαμόρφωση” αναφέρεται στην απαίτηση για μια συγκεκριμένη τρισδιάστατη δομή για καθένα από τους επίτοπους που αναγνωρίζονται από τα αυτοαντισώματα. Κατά συνέπεια, τα αποτελέσματα του προσδιορισμού εξαρτώνται από τη μοριακή δομή του αντιγόνου που χρησιμοποιείται στο τεστ. Μικρές αλλαγές στη δομή ενός δεδομένου επίτοπου μπορεί να οδηγήσουν σε μείωση ή απώλεια αναγνώρισης του αυτοαντιγόνου από τα αντισώματα που απευθύνονται σ’ αυτό τον επίτοπο. Πρόσφατα, αντισώματα διπλής εξειδίκευσης TGPO, που αναγνωρίζουν Tg και TPO, βρέθηκαν στο αίμα ασθενών με AITD.
Έχει γίνει γνωστό εδώ και χρόνια ότι αυτοαντισώματα στρέφονται εναντίον λίγων επιτόπων σε σύγκριση με τα ετερόλογα αντισώματα. Οι τρέχουσες μέθοδοι διαφέρουν σε μεγάλο βαθμό στην αναγνώριση επιτόπου. Διαφορές εξειδίκευσης μπορεί να προκύψουν από παραγνώριση ενός επιτόπου, που οδηγεί σε μια τάση του πληθυσμού αυτοαντισωμάτων που ελέγχονται. Αυτό αποφέρει πολύ διαφορετικά διαστήματα αναφοράς, ακόμη και όταν οι μέθοδοι είναι τυποποιημένες με την ίδια διεθνή προετοιμασία αναφοράς. Όποια και αν είναι τα στοχευόμενα αυτοαντιγόνα, τα θυρεοειδικά αυτοαντισώματα σαφώς δεν είναι μοναδικές μοριακές οντότητες, αλλά μίγματα ανοσοσφαιρινών, που έχουν κοινή ικανότητα ν’ αλληλεπιδρούν με Tg, ΤΡΟ ή υποδοχέα της TSH.
Οι διαφορές στην ευαισθησία των αναλύσεων αυτοαντισωμάτων μπορούν να προκύψουν από τον σχεδιασμό της δοκιμασίας (π.χ. ανταγωνιστική RIA έναντι IMA δύο πλευρών), καθώς και τη φυσική μέθοδο που χρησιμοποιείται για το σήμα (π.χ. ραδιοϊσότοπο έναντι χημειοφωταύγειας). Οι διαφορές στην εξειδίκευση μπορεί να προκύψουν ως αποτέλεσμα της μόλυνσης του παρασκευάσματος αυτοαντιγόνου από άλλα αυτοαντιγόνα (π.χ. μικροσωμάτια θυρεοειδούς έναντι καθαρού ΤΡΟ). Η κακή αναγνώριση ενός επιτόπου μπορεί να οδηγήσει σε υποεκτίμηση του συνολικού ποσού των κυκλοφορούντων αυτοαντισωμάτων, με αποτέλεσμα μειωμένη ευαισθησία.
Η λειτουργική ευαισθησία θα πρέπει να προσδιορίζεται με pools ανθρώπινων ορών, που περιέχουν χαμηλή συγκέντρωση αυτοαντισωμάτων. Το πρωτόκολλο είναι το ίδιο που περιγράφηκε για την TSH. Η ακρίβεια μεταξύ τρεξιμάτων των αναλύσεων TgAb, που χρησιμοποιούνται για παρακολούθηση θετικών TgAb σε DTC ασθενείς, θα πρέπει ν’ αξιολογείται σε μεγαλύτερο χρονικό διάστημα (6-12 μήνες) σύμφωνα με τη σειριακή παρακολούθηση στην κλινική πρακτική.
4.5. Τυποποίηση των τεστ αντισωμάτων του θυρεοειδούς
Η τυποποίηση αυτοαντισωμάτων του θυρεοειδούς είναι σήμερα αναντίστοιχη. Διεθνείς προετοιμασίες αναφοράς, MRC 65/93 για TgAb, MRC 66/387 για TPOAb διατίθενται από το Εθνικό Συμβούλιο Βιολογικών Προτύπων και Ελέγχου στο Λονδίνο. Αυτά τα παρασκευάσματα έγιναν από ένα σύνολο ορών ασθενών με AITD και παρασκευάστηκαν και λυοφιλοποιήθηκαν πριν 35 χρόνια.
Είναι γνωστό ότι τα λυοφιλιοποιημένα αντισώματα είναι επιρρεπή στην αποικοδόμηση με την πάροδο του χρόνου. Η διάσπαση των αντισωμάτων μπορεί να έχει εισαγάγει μια τάση στη δεσμευτική δραστικότητα αυτών των παρασκευασμάτων αναφοράς προς πιο σταθερά αντισώματα άγνωστης κλινικής σημασίας. Λόγω της σπανιότητας αυτών των παρασκευασμάτων, χρησιμοποιούνται μόνο ως πρωταρχικά πρότυπα για τη βαθμονόμηση των μεθόδων ανάλυσης. Τα εμπορικά πακέτα περιέχουν δευτερεύοντα πρότυπα που διαφέρουν για κάθε μέθοδο.
Σήμερα, οι βαθμονομήσεις αναλύσεων ποικίλλουν ανάλογα με τις πειραματικές συνθήκες και με το παρασκεύασμα αντιγόνου που χρησιμοποιείται από τον κατασκευαστή που μπορεί να εισάγει μια άλλη κλίση στην ανίχνευση των ετερογενών αντισωμάτων των δειγμάτων των ασθενών. Στην περίπτωση των TRAb, το MRC 90/672 παρασκεύασμα αναφοράς (1990) χρησιμοποιείται από λίγους κατασκευαστές.
5. TPO Θυρεοειδική υπεροξειδάση και αυτοαντισώματα
Είναι αιμοπρωτεΐνη περιέχουσα γλυκοζυλιωμένη μεμβράνη με μοριακό βάρος 107.000D. Περιέχει μεγάλο υδρόφιλο τομέα με μια ενζυματικά ενεργή περιοχή και 2 μεγάλες διακριτές πλευρές σύνδεσης αυτοαντισώματος σ’αυτόν. Τα μικροσωμιακά θυρεοειδικά αντιγόνα αποτελούνται από πρωτεΐνες στην εξωκυτταρική μεμβράνη κυστιδίων που συμπεριλαμβάνουν νεοσυντιθέμενη TG. Τα TPO είναι τα κύρια αναγνωρισμένα μικροσωμιακά από τα αντιθυρεοειδικά μικροσωμιακά αντισώματα. Μπορεί να περιλαμβάνουν αντισώματα θυροσφαιρίνης αλλά και άλλων πρωτεϊνών. Εμπλέκονται στη σύνθεση θυρεοειδικών ορμονών στον ακραίο πόλο του κυττάρου θυλακιώδους. Αρκετές ισομορφές σχετίζονται με διαφορική σύνδεση του ΤΡΟ RNA. Τα TPO μόρια μπορεί να διαφέρουν αναφορικά με την τρισδιάστατη δομή τους, την έκταση της γλυκοζυλίωσής τους και τη δέσμευση αίμης. Τα περισσότερα μόρια TPO δεν φθάνουν στην κορυφαία μεμβράνη και διασπώνται ενδοκυτταρικά.
Τα ΤΡΟ αυτοαντισώματα είχαν αρχικά περιγραφεί ως αυτοαντισώματα αντι-μικροσωμιακά (ΑΜΑ), δεδομένου ότι βρέθηκαν να αντιδρούν με ακατέργαστα παρασκευάσματα των κυτταρικών μεμβρανών του θυρεοειδούς. Το μικροσωμιακό αντιγόνο αργότερα ταυτοποιήθηκε ως TPO. Εκτός από τις νεότερες, πιο ευαίσθητες ανταγωνιστικές και μη ανταγωνιστικές ανοσοδοκιμασίες TPOAb, παλαιότερες αναλύσεις ανοσοφθορισμού ΑΜΑ καθώς και παθητικά τεστ συγκόλλησης ερυθρών κυττάρων είναι ακόμη σήμερα σε χρήση.Οι νέες ανοσολογικές μέθοδοι αντικατέστησαν προς το παρόν τις παλαιότερες αναλύσεις συγκόλλησης, επειδή είναι ποσοτικοποιημένες, πιο ευαίσθητες και μπορούν εύκολα να αυτοματοποιηθούν.
Ωστόσο, υπάρχει μεγάλη μεταβλητότητα στην ευαισθησία και στην ειδικότητα των νέων μεθόδων. Ορισμένες από αυτές τις διαφοροποιήσεις απορρέουν από τις διαφορές στα παρασκευάσματα ΤΡΟ που χρησιμοποιούνται στα διάφορα κιτ. Όταν εκχυλίζονται από ανθρώπινο θυρεοειδικό ιστό, τα TPO μπορούν να χρησιμοποιηθούν ως ακατέργαστα παρασκευάσματα μεμβράνης ή μπορεί να καθαριστούν με διάφορες μεθόδους.
Η ειδικότητα της ανάλυσης μπορεί επίσης να διαφέρει λόγω της μόλυνσης από άλλα αντιγόνα του θυρεοειδούς, κυρίως Tg και/ή λόγω παραλλαγών στην τρισδιάστατη δομή της ΤΡΟ. Η χρήση της ανασυνδυασμένης ανθρώπινης ΤΡΟ (rhTPO) εξαλείφει τον κίνδυνο της μόλυνσης, αλλά δεν λύνει το πρόβλημα των διαφορών στη δομή ΤΡΟ, που εξαρτώνται από την τεχνική που χρησιμοποιείται για την απομόνωσή της.
Οι πιο πρόσφατες αναλύσεις TPOAb ποσοτικοποιούνται σε διεθνείς μονάδες χρησιμοποιώντας το παρασκεύασμα αναφοράς MRC 66/387. Δυστυχώς, η χρήση αυτού του πρωτογενούς προτύπου δεν έλυσε τα προβλήματα, όπως είναι προφανές από την ευρεία διακύμανση στα όρια ευαισθησίας διαφορετικών κατασκευαστών κιτ (εύρος <0,3 έως <20KIU/L) και τις διαφορές στα κανονικά διαστήματα αναφοράς.
5.1. Διαστήματα αναφοράς
Η εκτίμηση της επικράτησης των TPOAb εξαρτάται από την ευαισθησία και την εξειδίκευση της μεθόδου που χρησιμοποιείται. Σε έρευνα στις ΗΠΑ περίπου 17.000 ατόμων χωρίς εμφανή νόσο του θυρεοειδούς, αναφέρθηκαν ανιχνεύσιμα επίπεδα TPOAb σε 12% των ατόμων χρησιμοποιώντας μια ανταγωνιστική ανοσολογική μέθοδο (32). Εάν χαμηλά επίπεδα TPOAb που ανιχνεύθηκαν σε υγιή άτομα και/ή σε ασθενείς με μη-θυρεοειδικά αυτοάνοσα νοσήματα αντανακλούν κανονική φυσιολογία, πρόδρομη AITD, ή το πρόβλημα εξειδίκευσης μιας ανάλυσης, παραμένει ασαφές.
Οι κανονικές τιμές αναφοράς για TPOAb αναλύσεις είναι έντονα μεταβλητές και συχνά καθορίζονται αυθαίρετα, ώστε η μεγάλη πλειοψηφία των ασθενών με AITD να έχει θετικό τεστ και οι περισσότεροι ασθενείς χωρίς κλινικές ενδείξεις αρνητικό. Το κατώτερο φυσιολογικό όριο φαίνεται να σχετίζεται με τεχνικούς παράγοντες. Συγκεκριμένα, οι αναλύσεις με χαμηλό όριο ανίχνευσης (<10 KIU/L) αναφέρουν συνήθως μη ανιχνεύσιμα επίπεδα TPOAb σε επιλεγμένα φυσιολογικά άτομα, οπότε η παρουσία τους είναι ένα παθολογικό εύρημα. Αντίθετα, TPOAb αναλύσεις με υψηλότερα όρια ανίχνευσης (>10 KIU/L) αναφέρουν συνήθως ένα “φυσιολογικό εύρος αναφοράς” TPOAb. Δεδομένου ότι οι μέθοδοι αυτές δεν φαίνεται να έχουν αυξημένη ευαισθησία για την ανίχνευση AITD, οι τιμές “φυσιολογικού εύρους” μπορεί να αντιπροσωπεύουν μη εξειδικευμένο “θόρυβο” ανάλυσης και να μην έχουν παθολογική έννοια.
Πρόσφατη 20ετής μελέτη παρακολούθησης της κλάσης Whickham ανέφερε ότι ανιχνεύσιμοι τίτλοι TPOAb (μετρούμενοι ως AMA), δεν ήταν μόνο ένας παράγοντας κινδύνου για υποθυρεοειδισμό, αλλά προηγούνται της αύξησης TSH (Εικόνα 13). Δηλαδή ανιχνεύσιμα TPOAb αποτελούν παράγοντα κινδύνου για AITD. Η κλινική σημασία των χαμηλών επιπέδων TPOAb, που δεν είναι ανιχνεύσιμα από AMA, απομένει να καθοριστεί από διαχρονικές μελέτες. Έτσι, παραμένει το ερώτημα, αν άτομα με χαμηλά επίπεδα TPOAb ή/και TgAb θα πρέπει να θεωρούνται φυσιολογικά μέχρι μακροπρόθεσμες μελέτες παρακολούθησής τους να δείξουν ότι δεν έχουν αυξημένο κίνδυνο ανάπτυξης δυσλειτουργίας του θυρεοειδούς.
Τα κριτήρια που χρησιμοποιούνται, για την επιλογή κανονικών ατόμων για τη δημιουργία φυσιολογικού εύρους αναφοράς αυτοαντισωμάτων, είναι κρίσιμα. Μια τέτοια ομάδα θα πρέπει να αποτελείται από νέα, ευθυρεοειδικά (TSH 0,5-2,0 mIU/L) αρσενικά άτομα χωρίς βρογχοκήλη και χωρίς οικογενειακό ιστορικό AITD. Αυτή η αυστηρή διαδικασία επιλογής δεν θα περιλαμβάνει άτομα με προδιάθεση AITD.
5.2. Κλινική χρησιμότητα των μετρήσεων TPOAb
Είναι η πιο ευαίσθητη δοκιμασία για την ανίχνευση αυτοάνοσης νόσου του θυρεοειδούς. Όπως φαίνεται στην Εικόνα 13, τα TPOAb είναι συνήθως η πρώτη ανωμαλία κατά τη διάρκεια της ανάπτυξης δευτεροπαθούς υποθυρεοειδισμού σε θυρεοειδίτιδα Hashimoto. Στην πραγματικότητα ποσοστό > 95% των ασθενών με θυρεοειδίτιδα Hashimoto έχουν ανιχνεύσιμα επίπεδα TPOAb, όταν αυτά μετριώνται με μια ευαίσθητη ανοσοδοκιμασία. Τέτοιες μέθοδοι ανιχνεύουν επίσης TPOAb στους περισσότερους (85%) ασθενείς με νόσο Graves, (1). Ασθενείς με ανιχνεύσιμα TPOAb σε πρώιμα στάδια της κύησης έχουν κίνδυνο ανάπτυξης θυρεοειδίτιδας μετά τον τοκετό. Οι ασθενείς με σύνδρομο Down έχουν αυξημένο κίνδυνο δυσλειτουργίας του θυρεοειδούς που οφείλεται σε AITD και ο ετήσιος έλεγχος με TSH και TPOAb είναι σημαντικός.
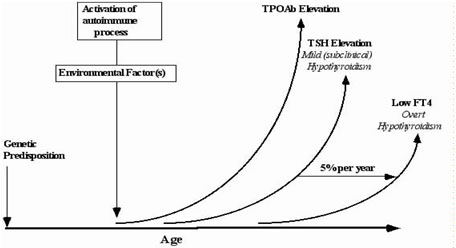
Εικόνα 13. Μεταβολές των TPO κατά την ανάπτυξη αυτοάνοσης θυροειδικής νόσου.
Πρόσφατες μελέτες έδειξαν ότι το IQ παιδιών, που γεννήθηκαν από μητέρες με αυξημένη TSH και/ή ανιχνεύσιμα TPOAb κατά τη διάρκεια της εγκυμοσύνης, μπορεί να τεθεί σε κίνδυνο. Αυτό έχει οδηγήσει σε συστάσεις, ότι όλες οι έγκυες γυναίκες πρέπει να μετρούν TSH και επίπεδα TPOAb κατά το 1o τρίμηνο κύησης. Τέλος, οι μετρήσεις TPOAb μπορεί να παίζουν ρόλο στην υπογονιμότητα, δεδομένου ότι υψηλά επίπεδά τους σχετίζονται με υψηλό κίνδυνο αποβολής και αποτυχία σύλληψης με in-vitro γονιμοποίηση. Η παρουσία τους έχει εδραιωθεί ως παράγοντας κινδύνου για δυσλειτουργία του θυρεοειδούς, όταν οι ασθενείς είναι υπό θεραπεία με λίθιο, αμιωδαρόνη, ιντερλευκίνη-2 ή ιντερφερόνη-α.
6. Μετρήσεις Αυτοαντισωμάτων Θυρεοσφαιρίνης (TgAb)
Η Θυρεοσφαιρίνη (Tg), είναι μια υψηλού μοριακού βάρους (660 kDa) διαλυτή γλυκοπρωτεΐνη που αποτελείται από δύο πανομοιότυπες υπομονάδες. Έχει ένα μεγάλο βαθμό ετερογένειας, που οφείλεται σε διαφορές στις μετα-μεταφραστικές τροποποιήσεις (γλυκοζυλίωση, ιωδίωση κλπ). Κατά τη διαδικασία σύνθεσης και απελευθέρωσης ορμονών του θυρεοειδούς, η Tg πολυμερίζεται και αποικοδομείται. Κατά συνέπεια, η ανοσολογική δομή της είναι εξαιρετικά πολύπλοκη. Τα χαρακτηριστικά των παρασκευασμάτων Tg μπορεί να ποικίλλουν ευρέως, ανάλογα με τους αρχικούς ανθρώπινους θυρεοειδικούς ιστούς που χρησιμοποιούνται και τη διαδικασία καθαρισμού. Αυτό αποτελεί πρώτη ένδειξη για ερμηνεία του γιατί οι TgAb και οι Tg προσδιορισμοί, τυποποιούνται τόσο δύσκολα.
6.1. Μεθοδολογία TgAb
Όπως και στις TPOAb μεθόδους, οι αναλύσεις των TgAb έχουν εξελιχθεί από ανοσοφθορισμό των τομών του ιστού του θυρεοειδούς, σε παθητικές μεθόδους συγκόλλησης ερυθρών κυττάρων και στις πιο τρέχουσες ανταγωνιστικές και μη-ανταγωνιστικές ανοσοδοκιμασίες. Αυτή η τεχνική εξέλιξη έχει βελτιώσει τόσο την ευαισθησία όσο και την εξειδίκευση των μετρήσεων TgAb. Ωστόσο, επειδή και οι παλαιότερες και οι νεότερες μέθοδοι εξακολουθούν να χρησιμοποιούνται ταυτόχρονα σε κλινικά εργαστήρια, υπάρχει ποικιλία στην ευαισθησία και την εξειδίκευση των διαθέσιμων μεθόδων ανάλογα με το εργαστήριο.
Οι δοκιμασίες βαθμονομούνται με καθαρά ή μη παρασκευάσματα TgAb, με συγκέντρωση ορών ασθενών ή αίματα δοτών. Αυτά τα δευτερεύοντα πρότυπα συχνά, αλλά όχι πάντα, έχουν βαθμονομηθεί έναντι του αρχικού προτύπου (MRC 65/93). Αυτό δεν εξασφαλίζει ότι οι διάφορες μέθοδοι είναι ποσοτικά ή ποιοτικά παρόμοιες.
Άλλοι λόγοι για τις διαφορές των μεθόδων σχετίζονται με την ετερογένεια των ίδιων των TgAb, που περιορίζεται σε ασθενείς με AITD συγκρινόμενη με αυτήν άλλων διαταραχών του θυρεοειδούς, όπως διαφοροποιημένα καρκινώματα του θυρεοειδούς (DTC) (42). Αυτό αντικατοπτρίζει διαφορές στην έκφραση των διαφόρων αυτοαντισωμάτων, που μπορεί να εκφράζονται κανονικά σε πολύ χαμηλά επίπεδα σε υγιή άτομα.
Η μεταβλητότητα των τιμών TgAb εντός-μεθόδου μπορεί επίσης να αντανακλά ποιοτικές διαφορές στη συγγένεια TgAb και στην εξειδίκευση του επιτόπου στα διάφορα δείγματα ορού ασθενών που υπόκεινται σε διαφορετικές θυρεοειδικές και ανοσολογικές συνθήκες, καθώς και σε παρεμποδίσεις υψηλών επιπέδων του κυκλοφορούντος αντιγόνου (Tg), όπως στη νόσο Graves και σε μεταστατικό DTC.
6.2. Διαστήματα αναφοράς
Όπως και στα αντισώματα TPO, η επικράτηση και οι φυσιολογικές τιμές cut-off των TgAb εξαρτώνται από την ευαισθησία και την εξειδίκευση της μεθόδου (43). Έρευνες αναφέρουν επικράτηση TgAb ~10% για το γενικό πληθυσμό μετρημένα με ανταγωνιστικές ανοσοδοκιμασίες (32). Φαίνεται να είναι δύο φορές υψηλότερα από το φυσιολογικό για ασθενείς με διάγνωση DTC (43).
Η κλινική σημασία των χαμηλών επιπέδων TgAb, που είναι ανιχνεύσιμα από τις παλαιότερες μεθόδους συγκόλλησης, παραμένει ασαφής. Έχει προταθεί ότι τα χαμηλά επίπεδα μπορεί να αντιπροσωπεύουν “φυσικό” αντίσωμα σε φυσιολογικά άτομα ή απόκριση σ’ έναν “καθαριστή” αντισώματος προς απελευθέρωση αντιγόνου μετά από χειρουργική επέμβαση θυρεοειδούς ή θεραπεία με ραδιενεργό ιώδιο. Εναλλακτικά, τα χαμηλά επίπεδα μπορεί ν’ αντιπροσωπεύουν σιωπηλή AITD.
Διαφορετικές μέθοδοι TgAb αναφέρουν διαφορετικές κανονικές τιμές cut-off, όπως και στα TPOAb. Συγκεκριμένα, κάποιες μέθοδοι αναφέρουν ότι τα φυσιολογικά άτομα θα πρέπει να έχουν τιμές κάτω από το όριο ανίχνευσης της ανάλυσης και άλλες αναφέρουν ένα φυσιολογικό εύρος. Όταν οι μετρήσεις TgAb χρησιμοποιούνται ως συμπληρωματικές, για μετρήσεις Tg ορού, η σημασία των χαμηλών επιπέδων τους σχετίζεται λιγότερο με την παθοφυσιολογία της παρουσίας τους και περισσότερο με το δυναμικό τους να παρεμβαίνουν στη μέθοδο της Tg.
6.3. Ευαισθησία και ακρίβεια της μέτρησης
Οι ευαίσθητες ποσοτικές μετρήσεις TgAb είναι κρίσιμες δοκιμασίες συμπληρωματικές για τη μέτρηση Tg. Οι ποιοτικές δοκιμές συγκόλλησης δεν είναι αρκετά ευαίσθητες ώστε να ανιχνεύουν χαμηλές συγκεντρώσεις TgAb που μπορεί να επηρεάσουν τις μετρήσεις Tg (43). Όπως και με τα TPOAb, οι απόλυτες τιμές που αναφέρονται από διάφορες ανοσοαναλύσεις TgAb είναι εξαιρετικά μεταβλητές, κάτι που απαγορεύει τη χρήση διαφορετικών τεστ κατασκευαστών για σειριακή παρακολούθηση DTC ασθενών.
Φαίνεται να υπάρχουν 2 κατηγορίες ανοσολογικών δοκιμασιών που χαρακτηρίζονται από:
- χαμηλό όριο ανίχνευσης (<10 KIU/L) και ένα μη ανιχνεύσιμο φυσιολογικό όριο αναφοράς, που δείχνει ότι η παρουσία των TgAb είναι ένα παθολογικό εύρημα.
- υψηλότερο όριο ανίχνευσης (>10 KIU/L) και φυσιολογικό εύρος αναφοράς. Υπάρχει πιθανότητα οι ανιχνεύσιμες τιμές φυσιολογικού εύρους ν’αποτελούν απλώς <θόρυβο> μιας μη εξειδικευμένης ανάλυσης, που προκλήθηκε από την έλλειψη ευαισθησίας ή εξειδίκευσης.
6.4. Η κλινική χρησιμότητα των μετρήσεων TgAb
Μελέτη στις ΗΠΑ ανέφερε ότι το 3% των ατόμων χωρίς παράγοντες κινδύνου για θυρεοειδική νόσο είχε ανιχνεύσιμα TgAb, μη συνδεόμενα με παρουσία TPOAb (32). Δεδομένου ότι αυτή η ομάδα δεν είχε καμία σχετική αύξηση στην TSH, οι TgAb μετρήσεις δεν φαίνεται να είναι χρήσιμο διαγνωστικό τεστ για AITD σε περιοχές με επάρκεια ιωδίου. Ωστόσο σε περιοχές με ανεπάρκεια ιωδίου, τα TgAb φαίνεται να είναι χρήσιμα για την ανίχνευση.
Η κλινική χρησιμότητα των μετρήσεων TgAb σε ασθενείς με DTC είναι διττή:
- η ευαίσθητη και εξειδικευμένη εξέταση των TgAb σ’ αυτούς τους ασθενείς είναι απαραίτητη, διότι ακόμη και οι χαμηλές συγκεντρώσεις τους μπορεί να παρεμβαίνουν στις μετρήσεις Tg που γίνονται με διάφορες μεθόδους (43).
- βοι σειριακές μετρήσεις TgAb μπορεί να χρησιμεύσουν ως παρένθετοι καρκινικοί δείκτες για TgAb-θετικούς ασθενείς στους οποίους η ανάλυση Tg μπορεί να είναι αναξιόπιστη (43). Συγκεκριμένα, τα θετικά TgAb ασθενών, που απαλλάσσονται από ασθένειες, συνήθως γίνονται αρνητικά μέσα σε 1-4 χρόνια. Αντίθετα, οι ασθενείς, που έχουν επίμονη νόσο, μετά τη θεραπεία διατηρούν ανιχνεύσιμες συγκεντρώσεις TgAb. Στην πραγματικότητα, η αύξηση των επιπέδων TgAb είναι συχνά η πρώτη ένδειξη υποτροπής σε τέτοιους ασθενείς.
7. Μετρήσεις αυτοαντισωμάτων υποδοχέων TSH (TRAb)
7.1 Εισαγωγή
Ο υποδοχέας TSH είναι ένα μέλος της υπεροικογένειας των υποδοχέων με επτά διαμεμβρανικές περιοχές που συνδέονται με G πρωτεΐνες. Το 60kb γονίδιο υποδοχέα TSH που βρίσκεται στο μακρύ σκέλος του χρωμοσώματος 14q31 έχει κλωνοποιηθεί και αλληλουχηθεί. Η ενεργοποίηση των G πρωτεϊνών από το μίγμα του υποδοχέα της ορμόνης προκαλεί τη διέγερση της παραγωγής cAMP από αδενυλική κυκλάση και φωσφορική ινοσιτόλη από φωσφολιπάσες
Πλευρικά κατευθυνόμενη μεταλλαξογένεση έχει δείξει, ότι η τρισδιάστατη δομή του υποδοχέα είναι σημαντική για την αλληλεπίδραση με TSH ή/και με TRAbs. Υπάρχουν τρεις γενικές κατηγορίες των TRAb που μετρώνται είτε με βιοανάλυση ή ανάλυση υποδοχέα:
- Αναλύσεις υποδοχέα, ή προσδεδεμένης ανασταλτικής ανοσοσφαιρίνης TSH (TBII), που δεν μετρούν άμεσα τη βιολογική δραστικότητα, αλλά εκτιμούν αν το δείγμα περιέχει ανοσοσφαιρίνες που μπορούν να μπλοκάρουν την πρόσδεση της TSH σε in vitro παρασκεύασμα του υποδοχέα.
- Τα αντισώματα διέγερσης TSH (TsAb) φαίνεται να δεσμεύουν το Ν-τερματικό τμήμα της εξωκυτταρικής περιοχής και να μιμούνται τις δράσεις της TSH, επάγοντας τη μεταγωγή σήματος μετά τον υποδοχέα και τη διέγερση των κυττάρων.
- Αντίθετα, η C-τερματική περιοχή είναι πιο σημαντική για τη δέσμευση αντισωμάτων του υποδοχέα TSH (ΤΒΑb ή TSBAb), τα οποία μπλοκάρουν τη διέγερση, προκαλώντας υποθυρεοειδισμό (44).
Όσον αφορά τις ανοσοσφαιρίνες διέγερσης ανάπτυξης του θυρεοειδούς (TGI) είναι λιγότερο καλά χαρακτηριζόμενες.
Η έλλειψη συσχέτισης μεταξύ επιπέδων TRAb και κλινικής κατάστασης των ασθενών υπάρχει σε μεγάλο βαθμό, λόγω της ετερογένειας των κυκλοφορούντων TRAb. Η ετερογένεια που μπορεί να συνυπάρχει σ’ έναν συγκεκριμένο ασθενή και ν’ αλλάζει με την πάροδο του χρόνου, είναι ένας λόγος για τον οποίο είναι δύσκολο ν’ αναπτυχθούν διαγνωστικά ακριβείς αναλύσεις TRAb. Πράγματι, η κλινική εικόνα των ασθενών με Graves που παρουσιάζουν τόσο TsAb όσο και ΤΒΑb / TSBAb πιθανότατα εξαρτάται από τη σχετική συγκέντρωση αλλά και από τη συνάφεια του επικρατούντος αντισώματος. Η στροφή από τη διέγερση στο κλείδωμα των TRAb μπορεί να εξηγήσει την αυτόματη υποχώρηση της νόσου Graves κατά τη διάρκεια της εγκυμοσύνης, αλλά και την επαγωγή (radioiodide) παροδικού υποθυρεοειδισμού (44).
Είναι σημαντικό να σημειωθεί ότι οι βιολογικές αναλύσεις, που χρησιμοποιούν παρασκευάσματα κυττάρων για να μετρήσουν τις βιολογικές δράσεις των TRAb (διέγερση, αναστολή της ενεργοποίησης TSH ή ανάπτυξης) μπορεί να ανιχνεύσουν λειτουργικές αλλαγές στην ετερογένεια των TRAb. Αντίθετα, οι αναλύσεις υποδοχέα, ή TSH Binding Ανασταλτικής ανοσοσφαιρίνης (TBII), που χρησιμοποιούνται από πολλά κλινικά εργαστήρια, μετρούν απλώς την ικανότητα του ορού ή του παρασκευάσματος IgG να εμποδίσει την πρόσδεση ενός παρασκευάσματος TSH και όχι τη βιολογική απόκριση. Αυτή η θεμελιώδης διαφορά στην ανάλυση ερμηνεύει την ασθενή συσχέτιση μεταξύ των κατηγοριών αναλύσεων (r = 0,31-0,65).
Με τη διαθεσιμότητα ανθρωπίνων μονοκλωνικών αντισωμάτων διέγερσης θυρεοειδούς (thyroid stimulating), γνωστά ως Μ22, αναπτύχθηκαν αυτοματοποιημένες δοκιμασίες TRAb, όπου τα αυτοαντισώματα στον ορό ασθενούς αναστέλλουν την πρόσδεση ιχνηθετημένου αντισώματος θυρεοειδικής διέγερσης (κι όχι ιχνηθετημένης TSH ) προς τους υποδοχείς TSH.
Βιοδοκιμασίες γνωστές ως TSI ή TBI: Μετρούν την ικανότητα των TRAb να δεσμεύονται σε υποδοχείς TSH, σε κύτταρα στα οποία έχουν ενσωματωθεί με γενετική μηχανική, ανθρώπινοι υποδοχείς TSH και να διεγείρουν ή να μπλοκάρουν την παραγωγή cAMP.
7.2. Μεθοδολογίες TRAb
Η πρώτη αναφορά ότι υπήρχε ένας διεγέρτης του θυρεοειδούς που διέφερε από την TSH σε σχέση με το μεγαλύτερο χρόνο ημίσειας ζωής της (Μακράς δράσης Διεγέρτης θυρεοειδούς ή LATS) δημοσιεύτηκε το 1956 χρησιμοποιώντας μια in vivo βιοδοκιμασία. Ο LATS αργότερα ταυτοποιήθηκε ως ανοσοσφαιρίνη. Όπως η TSH έτσι και τα TRAbs διεγείρουν τόσο το cAMP όσο και τα μονοπάτια φωσφορικής ινοσιτόλης των κυττάρων θυλακιώδους του θυρεοειδούς, και έτσι διεγείρουν και μπλοκάρουν τη σύνθεση των θυρεοειδικών ορμονών και την ανάπτυξη του αδένα.
Οι τύποι των μεθόδων που αναπτύχθηκαν για TRAb μετρήσεις ταξινομούνται σε σχέση με την λειτουργική τους δραστηριότητα. Μελέτες σε ποντίκια και FRTL-5 κυτταρικές σειρές, καθώς και ανθρώπους, έδειξαν ότι μια υψηλή συγκέντρωση της ανθρώπινης χοριακής γοναδοτροπίνης (hCG) είναι επίσης ένας ασθενής αγωνιστής TRAb και μπορεί να διεγείρει cAMP, τη μεταφορά ιωδίου και την ανάπτυξη των κυττάρων. Οι σημαντικές αυξήσεις hCG δευτεροπαθούς χοριοκαρκινώματος μπορεί σπανίως να προκαλέσουν ένα ψευδώς θετικό αποτέλεσμα TRAb. Ωστόσο, η αύξηση στην hCG που τυπικά παρατηρείται σε φυσιολογική κύηση, συνήθως δεν είναι αρκετά υψηλή για να αποσπάσει ένα ψευδώς θετικό αποτέλεσμα.
7.3. Βιοαναλύσεις (TsAb, ΤΒΑb/TsBab και TGI)
Οι πιο σύγχρονες βιολογικές δοκιμασίες βασίζονται στην ενεργοποίηση του υποδοχέα TSH της παραγωγής του δεύτερου μεταβιβαστή (cAMP) από ένα παρασκεύασμα κυττάρων, που εκτίθεται σε δείγμα ορού ή σε παρασκεύασμα IgG. Η πρόσφατη κλωνοποίησή του έχει ωφελήσει τις βιοαναλύσεις διευκολύνοντας την ανάπτυξη του υποδοχέα TSH σε επιμολυσμένες κυτταρικές γραμμές. Αν και αυτές οι βιολογικές δοκιμασίες είναι διαθέσιμες σε διάφορα ιδιωτικά εργαστήρια στις ΗΠΑ και στην Ασία, είναι λιγότερο διαθέσιμες στην Ευρώπη, λόγω των κανονισμών που επηρεάζουν τη χρήση των γενετικά τροποποιημένων οργανισμών.
Δυστυχώς, η συσχέτιση μεταξύ των αποτελεσμάτων της ανάλυσης TRAb και της κλινικής εικόνας εξακολουθεί να είναι κακή. Για παράδειγμα, η διαγνωστική ευαισθησία για τη νόσο Graves χρησιμοποιώντας TRAb κυμαίνεται από 62,5-81% (45). Νέες προσεγγίσεις που χρησιμοποιούν χιμαιρικές αναλύσεις μπορούν να στοχεύσουν τις περιοχές επιτόπων TRAb και τις δεσμευμένες πλευρές TSH, ώστε να παρέχουν καλύτερη συσχέτιση μεταξύ της απόκρισης της ανάλυσης και της κλινικής έκβασης (44,45).
7.4. Αναλύσεις υποδοχέα (TBII)
Οι αναλύσεις αναστέλλουσας θυροειδικής σύνδεσης ανοσοσφαιρίνης (TBII) είναι διαθέσιμες στο εμπόριο και χρησιμοποιούνται από πολλά κλινικά εργαστήρια. Αυτές οι μέθοδοι ποσοτικοποιούν την αναστολή της πρόσδεσης της επισημασμένης με 125I-TSH είτε με διαλυτοποιημένους υποδοχείς χοίρου, ή πιο πρόσφατα με ανασυνδυασμένους ανθρώπινους υποδοχείς TSH (46). Αυτός ο τύπος μεθόδου δεν κάνει διάκριση ανάμεσα στη διέγερση και στο μπλοκάρισμα των TRAbs. Η ενεργοποίηση των TBII τυπικά ποσοτικοποιείται έναντι θετικού για TRAb ορού καλιμπραρισμένου με βαθμονομητή αναφοράς.
Η εγγενής ετερογένεια των TRAb στον ορό του ασθενούς και η πηγή των υποδοχέων που χρησιμοποιήθηκαν (χοίρου έναντι ανασυνδυασμένου ανθρώπινου) είναι πιθανόν οι αιτίες για τη μεγάλη μεταβλητότητα που παρατηρείται μεταξύ των μεθόδων TBII, παρά τη χρήση του ίδιου προτύπου. Αν και τώρα είναι διαθέσιμες μέθοδοι TBII βασισμένες σε ανασυνδυασμένο ανθρώπινο υποδοχέα TSH και μπορούν να έχουν μια μεγαλύτερη διαγνωστική ευαισθησία για τη νόσο του Graves, δεν φαίνεται να προσφέρουν βελτιωμένη ειδικότητα ή ευαισθησία για την πρόβλεψη της ανταπόκρισης σε θεραπεία με αντιθυρεοειδικά φάρμακα.
Έτσι συγκεντρωτικά υπάρχουν:
Αναλύσεις Α’ γενιάς. Χρησιμοποιούν υποδοχείς TSH από χοίρο και κατακρήμνιση του ανοσοσυμπλόκου με PEG (πολυαιθυλενογλυκόλη).
Αναλύσεις Β’ γενιάς. Χρησιμοποιούν υποδοχείς TSH χοίριους ή ανθρώπινους προακινητοποιημένους σε στερεή φάση από μονοκλωνικά αντισώματα σύνδεσης από ποντικό. Τα αυτοαντισώματα του δείγματος αναστέλλουν τη σύνδεση των ιχνηθετημένων χοίριων ή βόειων υποδοχέων. Τα αντισώματα σύνδεσης πρέπει να έχουν υψηλή συγγένεια και να μην παρεμβάλλονται στις θέσεις δέσμευσης της TSH ή των TBII (TRAb).
Αναλύσεις Γ’ γενιάς. Αναπτύχθηκε διαδικασία μέτρησης TRAb ορού ασθενούς, στην οποία τα αυτοαντισώματα του ορού αναστέλλουν τη δέσμευση ιχνηθετημένων ανθρώπινων μονοκλωνικών αντισωμάτων θυρεοειδικής διέγερσης σε χοίριους υποδοχείς TSH.
7.5. Διαστήματα αναφοράς TRAb
Παρά την υιοθέτηση ενός διεθνούς παρασκευάσματος αναφοράς MRC 90/672, οι τιμές TRAb εξακολουθούν να εξαρτώνται από τη μέθοδο.Τα διαστήματα αναφοράς ποικίλλουν ανάλογα με την επιλογή του φυσιολογικού πληθυσμού που χρησιμοποιεί-ται για να καθορίσει το cut-off επίπεδο ενός θετικού αποτελέσματος, Αυτό γενικά ορίζεται ως δύο τυπικές αποκλίσεις από τον μέσο όρο των φυσιολογικών ατόμων.
7.6. Κλινικές χρήσεις των μετρήσεων TRAb – Μέλλον
Η κλινική χρήση των μετρήσεων TRAb για τη διάγνωση και το follow up της AITD παραμένει ένα αμφιλεγόμενο ζήτημα και διαφέρει γεωγραφικά. Η διαφορική διάγνωση του υπερθυρεοειδισμού είναι δυνατόν να επιλυθεί στους περισσότερους ασθενείς χωρίς να καταφεύγουν Οι μετρήσεις TRAb έχουν επίσης προταθεί ως μέσο για την πρόβλεψη της πορείας της ασθένειας Graves. Η μείωση των επιπέδων τους εμφανίζεται σε ασθενείς με υπερθυρεοειδισμό σε κλινική ύφεση μετά τη θεραπεία. Πολύ υψηλά επίπεδα συσχετίζονται με άμεση υποτροπή, αλλά αυτό αφορά πολύ λίγους ασθενείς. Αντίστροφα, ένας σημαντικός αριθμός ασθενών με μη ανιχνεύσιμα ή χαμηλά TRAb θα υποτροπιάσουν. Μια μετα-ανάλυση της σχέσης μεταξύ TRAb και κινδύνου υποτροπής έχει δείξει ότι το 25% των ασθενών έχουν ταξινομηθεί εσφαλμένα από αναλύσεις TRAb. Αυτό σημαίνει ότι μετά τη θεραπεία, η παρακολούθηση των ασθενών είναι απαραίτητη, ανεξάρτητα από τα επίπεδα TRAb, και για το σκοπό αυτό η μέτρηση TRAb δεν είναι οικονομικά αποδοτική.
Παρ’όλα αυτά, η παρουσία τους μπορεί να διακρίνει τη νόσο Graves από την πλασματική θυρεοτοξίκωση και άλλες εκδηλώσεις υπερθυρεοειδισμού, όπως την υποξεία ή μετά τον τοκετό θυρεοειδίτιδα και τοξική οζώδη βρογχοκήλη.
Υπάρχει γενική συμφωνία ότι οι μετρήσεις TRAb μπορούν να χρησιμοποιηθούν για να προβλέψουν εμβρυική ή/και νεογνική δυσλειτουργία του θυρεοειδούς σε έγκυες γυναίκες με προηγούμενο ιστορικό AITD. Τα υψηλά επίπεδα των TRAb στη μητέρα κατά τη διάρκεια του 3ου τριμήνου της κύησης αυξάνουν τον κίνδυνο δυσλειτουργίας του θυρεοειδούς στους απογόνους. Το 2-10% των εγκύων, με πολύ αυξημένα TRAb, γεννούν νεογνά με υπερθυρεοειδισμό. Ο κίνδυνος για νεογνικό υπερθυρεοειδισμό είναι αμελητέος μετά την επιτυχή θεραπεία του υπερθυρεοειδισμού με αντιθυρεοειδικά φάρμακα, αλλά μπορεί να μεγαλώσει μετά τη θεραπεία με ραδιοϊώδιο, αν τα TRAb παραμένουν αυξημένα. Ευθυρεοειδικές έγκυες γυναίκες, που είχαν λάβει θεραπεία με ραδιοϊώδιο για τη νόσο Graves πρέπει να έχουν μετρημένα TRAb τόσο σε πρώιμη κύηση-κίνδυνος εμβρυϊκού υπερθυρεοειδισμού, όσο και κατά το 3ο τρίμηνο για νεογνικό. Υψηλά TRAb πρέπει να οδηγήσουν σε πλήρη κλινική και βιοχημική αξιολόγηση του νεογνού για υπερθυρεοειδισμό, κατά τη γέννηση (αίμα ομφάλιου λώρου) και μετά 4-7 ημέρες.
Σημειωτέον, ότι οι δοκιμασίες υποδοχέα TBII συχνά χρησιμοποιούνται για το σκοπό αυτό, δεδομένου ότι ανιχνεύουν τη διέγερση (TsAb) αλλά και το μπλοκάρισμα αντισωμάτων (ΤΒΑb/TSBAb) που προκαλούν παροδικό υποθυρεοειδισμό σε 1:180,000 νεογέννητα. Πρέπει να εξετάζονται και τα δύο, γιατί η έκφραση της δυσλειτουργίας του θυρεοειδούς μπορεί να είναι διαφορετική στη μητέρα και στο βρέφος.
Ο ρόλος των TRAb στην οφθαλμοπάθεια που σχετίζεται με το θυρεοειδή είναι αβέβαιος. Φαίνεται να επιδεινώνεται με θεραπεία με ραδιοϊώδιο, αφού τα επίπεδα TRAb και άλλων θυρεοειδικών αντισωμάτων αυξάνονται σημαντικά μετά απ’αυτή. Αυτό υποδηλώνει ότι οι μετρήσεις TRAb πριν τη θεραπεία με ραδιοϊώδιο μπορεί να είναι χρήσιμες ώστε να προβλέψουν τον κίνδυνο της οφθαλμοπάθειας, αν και δεν υπάρχουν προοπτικές μελέτες.
Είναι σημαντικό να υπάρξει μια καλά δομημένη συγκριτική μελέτη των εμπορικά διαθέσιμων αναλύσεων αυτοαντισωμάτων θυρεοειδούς, που θα παρέχει αδιάσειστα αποδεικτικά στοιχεία για τις διαφορές της απόδοσης των σημερινών μεθόδων ανάλυσης. Θα πείσει έτσι τους επιστήμονες κλινικών εργαστηρίων να αποφεύγουν τη χρήση αναλύσεων με κακή κλινική απόδοση και θα ενθαρρύνει τους κατασκευαστές ή να βελτιώσουν τα προϊόντα τους ή ν’ αποσυρθούν από την αγορά.
8. Θυρεοσφαιρίνη (Tg)
Η Θυρεοσφαιρίνη (Tg), γλυκοπρωτεΐνη ΜΒ 660,000 D, πρόδρομος της σύνθεσης θυρεοειδικών ορμονών είναι ανιχνεύσιμη στον ορό των περισσοτέρων φυσιολογικών ατόμων με χρήση μιας ευαίσθητης μεθόδου. Αποτελείται από δύο υπομονάδες (300,000 και 330,000 D αντίστοιχα) συνδεδεμένες με δισουλφιδικές γέφυρες. Τα επίπεδα Tg ορού ενσωματώνουν 3 κύριους παράγοντες:
- τη μάζα παρόντος διαφοροποιημένου θυρεοειδικού ιστού
- οποιαδήποτε φλεγμονή ή τραυματισμό του θυρεοειδούς αδένα που προκαλεί απελευθέρωση της Tg
- το ποσό της διέγερσης του υποδοχέα της TSH (από TSH, hCG ή TRAb)
Η αυξημένη συγκέντρωση Tg στον ορό είναι ένας μη εξειδικευμένος δείκτης δυσλειτουργίας του θυρεοειδούς. Οι περισσότεροι ασθενείς με αυξημένη Tg έχουν καλοήθεις παθήσεις του θυρεοειδούς. Η κύρια χρήση των μετρήσεων Tg στον ορό είναι ως καρκινικός δείκτης για ασθενείς με διάγνωση του διαφοροποιημένου καρκίνου του θυρεοειδούς (DTC). Περίπου τα 2/3 των ασθενών αυτών έχουν αυξημένα επίπεδα Tg προεγχειρητικά, που επιβεβαιώνουν την ικανότητα του όγκου να εκκρίνει Tg, και επικυρώνει τη χρήση των μετρήσεων Tg ως μετεγχειρητικό δείκτη όγκου. Αντίθετα, όταν η συγκέντρωση Tg προεγχειρητικά δεν είναι υψηλή πάνω από την κανονική, δεν υπάρχει καμία απόδειξη ότι ο όγκος εκκρίνει Tg, και η αξία μιας ανιχνεύσιμης τιμής Tg μετεγχειρητικά είναι λιγότερο καθησυχαστική. Γενικά, οι αλλαγές στην Tg αντιπροσωπεύουν μετεγχειρητικά αλλαγές στη μάζα του όγκου, με την προϋπόθεση ότι τα επίπεδα της TSH διατηρούνται σταθερά με θεραπεία με L-T4.
Μια Tg μετρημένη κατά τη διάρκεια διέγερσης TSH (ενδογενούς TSH ή ανασυνδυασμένης ανθρώπινης (rhTSH)) είναι πιο ευαίσθητη για την ανίχνευση υπολειμματικού ή μεταστατικού DTC από μια βασική μέτρηση κατά τη διάρκεια της θεραπείας με L-Τ4. Το μέγεθος της αύξησης Tg παρέχει ένα μετρητή ευαισθησίας TSH του όγκου. Καλά διαφοροποιημένοι όγκοι εμφανίζουν συνήθως μια ~10πλάσια διέγερση της Tg σε απόκριση μιας υψηλής TSH (47). Κακώς διαφοροποιημένοι όγκοι, μπορεί να εμφανίσουν αμβλύτερη απόκριση στη διέγερση TSH.
8.1. Μέθοδοι Tg
Η Tg συνήθως μετριέται στον ορό, αλλά οι μετρήσεις μπορεί να γίνουν και στα θυρεοειδικά κυστικά υγρά και στο υλικό που λαμβάνεται με βιοψία από τα οζίδια του θυρεοειδούς. Η μέτρηση της Tg στον ορό αποτελεί τεχνικά πρόκληση. Οι ανοσομετρικές δοκιμασίες (IMA) κερδίζουν σε δημοτικότητα τις μεθόδους ραδιοανοσοαναλύσεων (RIA). Αυτό συμβαίνει επειδή οι IMA μέθοδοι προσφέρουν το πρακτικό πλεονέκτημα βραχύτερου χρόνου επώασης, ένα εκτεταμένο εύρος ανάλυσης και πιο σταθερό επισημασμένο αντιδραστήριο αντισώματος που είναι λιγότερο επιρρεπές σε ζημιά από την επισήμανση με RIA. Τα εργαστήρια μπορούν τώρα να επιλέξουν από μια σειρά ισοτοπικών (ανοσοραδιομετρική, IRMA) και μη ισοτοπικών IMA μεθόδων (χημειοφωταύγειας, ICMA).
Ωστόσο, οι ΙΜΑ μέθοδοι είναι πιο επιρρεπείς σε παρεμβολές από τα αυτοαντισώματα θυρεοσφαιρίνης (TgAb), που προκαλούν υποεκτίμηση των επιπέδων Tg. Αυτό έχει οδηγήσει κάποια εργαστήρια να επιλέξουν τις μεθόδους RIA για τη μέτρηση Tg σε ασθενείς με θετικά TgAb και να περιορίσουν τη χρήση των IMA μόνο σε ασθενείς με TgAb αρνητικά. Καμία μέθοδος δεν μπορεί βέβαια να ισχυριστεί ότι είναι εντελώς ανεπηρέαστη από παρεμβολές TgAb που μπορεί να προκαλέσουν είτε υπερεκτίμηση ή υποτίμηση των μετρήσεων Tg. Εκτός από τα προβλήματα των παρεμβολών, οι τρέχουσες μέθοδοι κινδυνεύουν από τις διαφορές στην τυποποίηση και στην εξειδίκευση και γενικά παρουσιάζουν μικρή ευαισθησία, ακρίβεια μεταξύ των τρεξιμάτων κάτω της βέλτιστης και δυνατότητα υψηλών “hook effects”.
8.1.1. Τυποποίηση
Οι συγκεντρώσεις Tg ορού μετρημένες είτε με RIA ή με IMA μεθόδους, ποικίλλουν σε μεγάλο βαθμό. Μια συλλογική προσπάθεια από την Ευρωπαϊκή Ένωση ανέπτυξε ένα διεθνές παρασκεύασμα αναφοράς Tg, CRM-457.
Η τάση μεταξύ διαφορετικών μεθόδων Tg μπορεί να προκύψει από τις διαφορές μεταξύ μήτρας χωρίς Tg, που χρησιμοποιείται για την αραίωση των προτύπων και του ορού του ασθενούς, ή από τις διαφορές στην αναγνώριση επιτόπου από διαφορετικά αντισώματα Tg που χρησιμοποιούνται από τους κατασκευαστές. Ιδανικά, το αραιωτικό που χρησιμοποιείται για τα πρότυπα πρέπει να είναι ανθρώπινου ορού χωρίς Tg/χωρίς TgAb ή εναλλακτικά, μια μήτρα μη-ορών που έχει επιλεγεί για να παράγει ένα σήμα (ραδιενεργείς μετρήσεις, σχετικές μονάδες φωτός κ.ά.) και είναι ταυτόσημη με ανθρώπινο ορό χωρίς Tg/χωρίς TgAb. Είναι σημαντικό, οι γιατροί να ενημερώνονται πριν το εργαστήριο αλλάξει τη μέθοδο της Tg για να καταστούν δυνατά εκ νέου τα κριτήρια ορισμού για DTC ασθενείς.
Η ευρεία υιοθέτηση του προτύπου έγινε για να μειωθεί, όχι να εξαλειφθεί η σημαντική μεταβλητότητα από μέθοδο σε μέθοδο που υπάρχει μ’ αυτή τη διαδικασία. Υπήρχε ελπίδα ότι η παγκόσμια τυποποίηση θα διευκόλυνε την καλύτερη συμφωνία στη βιβλιογραφία από διάφορες μελέτες, όπως και θα βελτίωνε την κλινική χρήση της σειριακής παρακολούθησης Tg των DTC ασθενών, που μερικές φορές οι μετρήσεις τους καθορίζονται από διαφορετικά εργαστήρια. Δυστυχώς αυτό δεν έγινε. Τα επίπεδα Tg, που μετρώνται έτσι, μπορεί να διαφέρουν έως και 4 φορές, αποκλείοντας έτσι τη δυνατότητα εναλλαγής των μεθόδων για μακροπρόθεσμη παρακολούθηση.
8.1.2. Ευαισθησία – Ακρίβεια
Ορισμένες από τις μεθόδους Tg είναι πολύ ευαίσθητες για την ανίχνευση του κατώτερου ευθυρεοειδικού ορίου αναφοράς, που είναι 1-3 μg/L (ng/mL) ανάλογα με τη μέθοδο. Αυτές που δεν μπορούν να ανιχνεύσουν Tg σε φυσιολογικούς ορούς δεν είναι καθόλου ευαίσθητες για την παρακολούθηση υποτροπής ασθενών με DTC. Όπως και στην TSH, η λειτουργική ευαισθησία της ανάλυσης Tg καθορίζεται από το 20% CV της ακρίβειας μεταξύ των τρεξιμάτων. Το πρωτόκολλο που χρησιμοποιείται για τον προσδιορισμό της είναι ίδιο με αυτό της TSH.
Η ακρίβεια τόσο εντός του κύκλου όσο και μεταξύ των τρεξιμάτων, που εκφράζεται ως ποσοστό % του συντελεστή μεταβλητότητας (CV%) είναι σημαντικές παράμετροι για την επικύρωση της αποτελεσματικότητας της μεθόδου. Θα πρέπει να συσταθεί ακρίβεια χρησιμοποιώντας pools ορού με αρνητικά TgAb και με τιμές Tg στόχους σε τρία διαφορετικά επίπεδα : low pool από 1,3-1,5 μg/l που προκύπτει από το 30-50%>1,0 μg/l (αναμενόμενο όριο λειτουργικής ευαισθησίας), medium pool~10 μg/l και high pool ~90% του ανώτερου ορίου αναφοράς που ορίζει ο κατασκευαστής.
Η ακρίβεια εντός του κύκλου στις ανοσολογικές μεθόδους είναι καλύτερη από την ακρίβεια μεταξύ τρεξιμάτων. Αυτό συμβαίνει γιατί οι μετρήσεις που γίνονται σ’ ένα τρέξιμο δεν υπόκεινται στη μεταβλητότητα λόγω χρήσης διαφορετικών παρτίδων των αντιδραστηρίων και διαφορετικών βαθμονομήσεων του οργάνου. Μπορεί να είναι η πιο σημαντική παράμετρος για την εκτίμηση της απάντησης της Tg σε διέγερση rhTSH. Έτσι, ένα βασικό και ένα rhTSH διεγερμένο δείγμα σχηματίζονται σε 3 έως 5 ημέρες και συνήθως μετρώνται στον ίδιο γύρο (47).
Αντίθετα, όταν χρησιμοποιούνται μετρήσεις Tg για σειριακή παρακολούθηση, όσο μεγαλύτερο είναι το διάστημα μεταξύ των τρεξιμάτων τόσο μεγαλύτερη είναι η μεταβλητότητα και τόσο χειρότερη η ακρίβεια τους. Μη ανθρώπινες μήτρες που χρησιμοποιούνται για να καθοριστεί η ακρίβεια χαμηλού εύρους μπορεί να παράγουν μη ρεαλιστικά όρια της ευαισθησίας συγκρινόμενα με τις μετρήσεις που έγιναν σε ανθρώπινο ορό χωρίς TgAb. Είναι σημαντικό να δημιουργηθεί λειτουργική ευαισθησία και ακρίβεια μεταξύ των τρεξιμάτων από τα δεδομένα μιας περιόδου 6-12 μηνών, δεδομένου ότι αυτή είναι το τυπικό κλινικό διάστημα που παρακολουθούνται οι ασθενείς με DTC.
Ο προτεινόμενος στόχος για μέγιστη ανακρίβεια των μετρήσεων Tg για την παρακολούθηση ασθενών θα πρέπει να είναι <5%. Είναι απίθανο οι τρέχουσες αναλύσεις Tg να μπορούν να διατηρήσουν τέτοια σφιχτή ακρίβεια πάνω από 6-12 μήνες. Αυτό το πρόβλημα ακρίβειας μπορεί να ξεπεραστεί με τη μέτρηση αρχειοθετημένων, αποθηκευμένων και καινούριων δειγμάτων από τον ίδιο ασθενή στο ίδιο τρέξιμο.
8.1.3. Φαινόμενο: High Dose Hook Effect
Επηρεάζει κυρίως τις μεθόδους IMA. Ψευδώς χαμηλές τιμές οφειλόμενες στο hook effect είναι ιδιαίτερα προβληματικές για τα τεστ δείκτη όγκου όπως Tg, επειδή δεν είναι σπάνιο να αντιμετωπίζονται πολύ υψηλές τιμές όταν οι ασθενείς προχωρούν σε μεταστατική νόσο. Το hook effect επέρχεται όταν μια υπερβολική ποσότητα αντιγόνου κατακλύζει την ικανότητα δέσμευσης του αιχμαλωτισμένου αντισώματος. Αυτό οδηγεί σε ένα ανάρμοστα χαμηλό σήμα που μεταφράζεται σ’ ένα ακατάλληλα χαμηλό ή παραδόξως φυσιολογικό εύρος αποτελεσμάτων ασθενούς με υπερβολικά αυξημένη συγκέντρωση Tg (>1000 μg/L (ng/mL)).
Οι κατασκευαστές των μεθόδων ΙΜΑ επιχειρούν να ξεπεραστεί το πρόβλημα με μία από τις παρακάτω προσεγγίσεις:
- Σχεδιασμός ανάλυσης Δύο-βημάτων : το δείγμα ορού αντιδρά πρώτα με το αιχμαλωτισμένο αντίσωμα πριν τα αδέσμευτα συστατικά εκπλυθούν και το επισημασμένο αντίσωμα εισάγεται, ακολουθούμενο από μία δεύτερη επώαση.
- Δύο αραιώσεις : (συνήθως μη αραιωμένο και 1/10) γίνονται για κάθε δείγμα ώστε να ανιχνευθεί οποιοδήποτε hook effect.
Υπάρχει υποψία hook effect, όταν το σωληνάριο με το αραιωμένο δείγμα έχει υψηλότερο αποτέλεσμα από το μη αραιωμένο. Γίνονται περαιτέρω αραιώσεις μέχρις ότου το αποτέλεσμα στο σωληνάριο της αραίωσης μειωθεί και οι συγκεντρώσεις των 2 αραιώσεων συμφωνήσουν.
8.1.4. Παρεμβολή αυτοαντισωμάτων Θυρεοσφαιρίνης (TgAb)
Τα αυτοαντισώματα θυρεοσφαιρίνης (TgAb) ανιχνεύθηκαν σε μεγαλύτερο ποσοστό ασθενών με DTC από το γενικό πληθυσμό (~20 έναντι 10 %, αντίστοιχα). Σειριακές μετρήσεις TgAb μπορούν να είναι ένας ανεξάρτητος προγνωστικός δείκτης της αποτελεσματικότητας της θεραπείας, ή της επανάληψής της, σε ασθενείς με θετικά TgAb (43,48). Κάθε παρόν TgAb στο δείγμα έχει τη δυνατότητα να παρεμποδίζει οποιαδήποτε μέθοδο Tg (48).
Επειδή τα TgAb είναι ετερογενή, ούτε η μετρούμενη συγκέντρωση TgAb ούτε ένα εξωγενές recovery test Tg είναι 100 % αξιόπιστη πρόβλεψη για το αν τα TgAb στο δείγμα θα προκαλέσουν παρεμβολές. Πιθανόν το πιο αξιόπιστο σημάδι της παρεμβολής TgAb είναι η ασυμφωνία RIA/IMA. Συγκεκριμένα, Tg μετρημένη με RIA είναι τυπικά υψηλότερη από Tg μετρημένη με ΙΜΑ εάν το δείγμα περιέχει παρεμποδίζοντα TgAb (43,47). Αποτελεί πλέον κοινή παραδοχή ότι οι δοκιμές ανάκτησης Tg είναι αναξιόπιστη προσέγγιση για την ανίχνευση TgAb και πρέπει να καταργηθούν (43,48). Πρώιμες μελέτες που ανέφεραν χαμηλές ανακτήσεις απουσία TgAb σε κάποιους ορούς πάσχουν από έλλειψη ευαισθησίας των μεθόδων. Όταν χρησιμοποιείται μια ευαίσθητη ανοσοανάλυση, τα TgAb ανιχνεύονται πάντα όταν η ανάκτηση είναι χαμηλή.
Μη-ανταγωνιστικές ανοσομετρικές (IMA) μέθοδοι φαίνονται να είναι πιο επιρρεπείς σε παρεμβολές TgAb από τις μεθόδους RIA, όπως αποδεικνύεται από τη διαπίστωση μη ανιχνεύσιμων τιμών Tg σε άτομα με νόσο Graves (48). Φαίνεται ότι οι ΙΜΑ αποτυγχάνουν να ποσοτικοποιήσουν την Tg που,σε ορισμένες περιπτώσεις, συμπλέκεται με TgAb και αυτό μπορεί να αποφέρει μια υποεκτίμηση της συνολικής συγκέντρωσης Tg. Αντίθετα, οι μέθοδοι RIA φαίνονται ικανές να προσδιορίζουν τόσο τις ελεύθερες όσο και τις δεσμευμένες με TgAb Tg στο δείγμα και συνήθως παράγουν υψηλότερες τιμές απ’ ό,τι οι μέθοδοι IMA όταν TgAb είναι παρόντα. Η ευαισθησία και η ειδικότητα των διαφόρων αναλύσεων TgAb είναι εξαιρετικά μεταβλητή. Είναι σημαντικό οι μετρήσεις TgAb και Tg να γίνονται από το ίδιο εργαστήριο, ώστε να είναι υπεύθυνο για τις παρεμβολές.
Όταν οι οροί που περιέχουν TgAb μετρώνται τόσο με RIA όσο και με IMA, παρατηρείται συχνά μια ασυμφωνία RIA-IMA (TgRIA= ≥2 μg/L(ng/mL): TgIMA= μη ανιχνεύσιμη) και χαρακτηρίζει την παρεμβολή TgAb κατά 1 ή 2 τάξεις μεθόδου. Δεδομένου ότι το τρέχον κατώτατο όριο για μια θετικά-διεγερμένη rhTSH απάντηση Tg είναι 2 μg/L, αυτός ο βαθμός διαφωνίας έχει τη δυνατότητα να επηρεάσει τη λήψη κλινικών αποφάσεων.
Ορισμένοι πιστεύουν ότι οι μετρήσεις RIA παράγουν αποτελέσματα Tg περισσότερο έγκυρα κλινικά για ασθενείς με TgAb-θετικά από τις μετρήσεις IMA, όπως κρίνεται από συσχετισμούς κλινικής κατάστασης και παραλληλισμό διαδοχικών μετρήσεων TgAb. Ωστόσο, θα πρέπει να τονιστεί ότι καμία μέθοδος RIA δεν είναι απρόσβλητη από παρεμβολές TgAb σε όλους τους TgAb-θετικούς και η επιρροή των TgAb σε διαφορετικές μεθόδους RIA είναι αρκετά μεταβλητή και σχετίζεται με τα συστατικά της ανάλυσης και τις συνθήκες επώασης. Ειδικότερα, η ποιότητα του ιχνηθέτη 125I-Tg, μαζί με την ειδικότητα του αντιδραστηρίου πολυκλωνικού αντισώματος Tg, καθορίζει την τάση του της μεθόδου για παρεμβολή TgAb. Η παρουσία μονοκλωνικών αντισωμάτων βελτίωσε την εξειδίκευση.
Παρά το γεγονός ότι δεν υπάρχει τρέχουσα μέθοδος Tg εγγυημένη για TgAb παρεμβάσεις, η υποτίμηση της συγκέντρωσης Tg, τυπική της παρέμβασης με IMA μεθοδολογία, είναι η πιο σοβαρή επίδραση της παρέμβασης, δεδομένου ότι υπάρχει η δυνατότητα να καλυφτεί μια μεταστατική νόσος. Άρα τα εργαστήρια δεν θα πρέπει να αναφέρουν μη ανιχνεύσιμες τιμές Tg σε ασθενείς με θετικά TgAb, εάν αυτή η μέθοδος παράγει τιμές ανάρμοστα χαμηλές ή μη ανιχνεύσιμες για DTC ασθενείς.
8.1.5. Αναλύσεις Tg αγγελιοφόρου RNA (mRNA)
Η κλινική αξία των μετρήσεων Tg mRNA στο περιφερικό αίμα δεν έχει ακόμη καθοριστεί πλήρως. Πριν χρησιμοποιηθεί για διευκόλυνση της λήψης θεραπευτικών αποφάσεων για DTC, πρέπει ν’ απαντηθούν ερωτήματα σχετικά με την ευαισθησία και την εξειδίκευση τους στο περιφερικό αίμα.
Η ενίσχυση της αλυσιδωτής αντίδρασης αντίστροφης μεταγραφάσης-πολυμεράσης (RT-PCR) του εξειδικευμένου mRNA ιστού έχει χρησιμοποιηθεί για ανίχνευση κυκλοφορούντων καρκινικών κυττάρων στο περιφερικό αίμα των ασθενών με μελάνωμα, προστάτη και κακοήθειες μαστού. Η διαθεσιμότητα των ειδικών εκκινητών Tg επιτρέπει την εφαρμογή αυτής της τεχνικής στην ανίχνευση στο αίμα μεταγραφών Tg mRNA. Η χρήση της RT-PCR για την ανίχνευση υποτροπιάζοντα καρκίνου του θυρεοειδούς αναφέρθηκε για πρώτη φορά το Στη συνέχεια, η τεχνική εφαρμόστηκε σε μεταστάσεις λεμφαδένων τραχήλου και βρέθηκε να είναι πιο ευαίσθητη από τη μέτρηση της Tg στην αναρρόφηση
Έχουν πλέον αναπτυχθεί ποσοτικές μέθοδοι RT-PCR για την ανίχνευση μεταγραφών Tg mRNA στο αίμα (49). Σε όλα τα φυσιολογικά άτομα διαπιστώνονται ανιχνεύσιμες Tg mRNA, αλλά με φτωχή συσχέτιση με Tg ορού που μετριέται με ανοσοανάλυση. Μερικές μελέτες αναφέρουν ότι η ποσότητά του συσχετίζεται με την παρουσία ή την απουσία μεταστάσεων, ενώ άλλες όχι. Αυτές οι αποκλίσεις αντικατοπτρίζουν πιθανόν διαφορές στην ευαισθησία και την ειδικότητα των εκκινητών Tg και στα συστήματα RT-PCR που χρησιμοποιήθηκαν, διαφορές στην ευαισθησία των τεχνικών απεικόνισης και στις ανοσοαναλύσεις Tg. Τα προβλήματα εξειδίκευσης (ψευδώς θετικά) είναι ένας αναγνωρισμένος περιορισμός της μεθοδολογίας RT-PCR. Απαιτούνται περαιτέρω μελέτες για να διαπιστωθεί αν τα ανιχνεύσιμα επίπεδα Tg mRNA που αναφέρθηκαν σε athyreotic ασθενείς χωρίς γνωστές μεταστάσεις, αντανακλούν κλινικά επερχόμενη νόσο, πρόβλημα στην ανάλυση ή παράνομη μεταγραφή.
Η συσχέτιση μεταξύ των αποτελεσμάτων των δοκιμών Tg mRNA και της κλινικής υποτροπής, ειδικά σε ασθενείς με θετικά Tg mRNA και μη ανιχνεύσιμα επίπεδα Tg, πρέπει να εμφανίζεται πριν χρησιμοποιηθεί ευρέως η δοκιμή Tg mRNA στην κλινική πρακτική. Δεδομένου ότι είναι πιο ακριβή από τη μέτρηση Tg, εάν αποδειχθεί κλινικά χρήσιμη θα προορίζεται για ασθενείς υψηλού κινδύνου ή με TgAb θετικά στους οποίους μετρήσεις Tg είναι διαγνωστικά αναξιόπιστες.
8.1.6. Τιμές αναφοράς Tg ορού
Φυσιολογικά ευθυρεοειδικά άτομα. Οι συγκεντρώσεις Tg ορού κατανέμονται λογαριθμικά σε ευθυρεοειδικά άτομα. Οι τιμές τείνουν να είναι ελαφρώς υψηλότερες στις γυναίκες, αλλά διακρίσεις τιμών με βάση το φύλο είναι περιττές. Το κάπνισμα είναι ένας παράγοντας που σχετίζεται με βρογχοκήλη και υψηλότερες τιμές Tg. Τα εύρη αναφοράς Tg είναι γεωγραφικά ευαίσθητα, επειδή η Tg επηρεάζεται από τη διαθεσιμότητα και την πρόσληψη του ιωδίου. Τα κριτήρια που θα πρέπει να λαμβάνονται υπόψη για τον καθορισμό των τιμών αναφοράς είναι η βρογχοκήλη, το κάπνισμα, ατομικό ή οικογενειακό ιστορικό νόσου του θυρεοειδούς, η παρουσία αυτοαντισωμάτων θυρεοειδούς (TgAb και/ή TPOAb) και τέλος τιμές TSH ορού <0,5 mU/L ή >2,0 mU/L.
Τιμές Tg ορού μετά από χειρουργική επέμβαση του θυρεοειδούς. Τα διαστήματα αναφοράς Tg που παρατίθενται στις εργαστηριακές αναφορές δεν εφαρμόζονται σε ασθενείς που έχουν υποβληθεί σε χειρουργική επέμβαση του θυρεοειδούς. Κατά τις πρώτες λίγες εβδομάδες μετά την επέμβαση, η Tg ορού θα καθοριστεί από την πληρότητα της χειρουργικής επέμβασης, το βαθμό διαρροής της από τα χειρουργικά περιθώρια και κυρίως από το αν η θυρεοειδική ορμόνη έχει παραχθεί για να αποτρέψει την αναμενόμενη αύξηση της TSH. Στην πραγματικότητα, η συγκέντρωση της TSH είναι ένας τέτοιος ισχυρός ρυθμιστής της Tg, που είναι συνήθως απαραίτητο να είναι γνωστή η TSH του ασθενούς πριν την εκτίμηση της σημασίας της κάθε μέτρησης Tg.
Στις πρώτες εβδομάδες μετά τη θυρεοειδεκτομή, οι συγκεντρώσεις Tg συνήθως πέφτουν με χρόνο ημιζωής προσεγγιστικά 2-4 ημέρες, οπότε η διαχείριση θυρεοειδικής ορμόνης αποτρέπει την αύξηση της TSH. Η σχέση μεταξύ προεγχειρητικών και μετεγχειρητικών τιμών Tg (6-8 εβδ.) παρέχει πληροφορίες που επηρεάζουν το σχέδιο θεραπείας. Κατά τη διάρκεια μακροχρόνιας παρακολούθησης, οι συγκεντρώσεις Tg μετρώνται και εκτός θεραπείας L-Τ4, παρέχοντας διαφορετικές πληροφορίες. Το μοτίβο της αλλαγής τιμών Tg είναι καλύτερος δείκτης της αλλαγής του βάρους του όγκου από τη μεμονωμένη Tg. Η συγκέντρωση Tg κατά τη διάρκεια της θεραπείας με L-Τ4 είναι πιο σταθερή ένδειξη της μάζας του όγκου από την Tg που μετράται, όταν η TSH είναι υψηλή πριν τη σάρωση με ραδιενεργό ιώδιο (RAI).
8.1.7. Κλινικές χρήσεις της μέτρησης Tg ορού
Η συγκέντρωση Tg αντανακλά τη μάζα του θυρεοειδούς, τη βλάβη του και τη διέγερση του υποδοχέα της TSH. Έτσι, μία ψηλή Tg είναι ένα μη ειδικό εύρημα που σχετίζεται με σχεδόν οποιαδήποτε παθολογία του θυρεοειδούς.
Μη νεοπλασματικές παθήσεις. Η Tg είναι αυξημένη σε ασθενείς με βρογχοκήλη ή σε συνθήκες υπερθυρεοειδισμού. Μια χαμηλή συγκέντρωση Tg μπορεί να είναι χρήσιμη παράμετρος για την επιβεβαίωση της διάγνωσης της φαρμακευτικής θυρεοτοξίκωσης (factitia) ή/και τη διερεύνηση της αιτιολογίας συγγενούς υποθυρεοειδισμού.
Οι μετρήσεις Tg μερικές φορές επιβεβαιώνουν ένα παρελθοντικό ιστορικό θυρεοειδίτιδας, στο οποίο η Tg είναι συνήθως η τελευταία βιοχημική παράμετρος για κανονικοποίηση (έως 2 έτη). Πρόσφατες μελέτες προτείνουν τη χρήση της ως παράμετρο για την εικόνα της κατάστασης ιωδίου σε δεδομένο πληθυσμό.
Διαφοροποιημένο Καρκίνωμα του Θυρεοειδούς (DTC). Στον καθορισμό των DTC, η συγκέντρωση Tg αντανακλά μάζα θυρεοειδούς (όγκου ή κανονικό υπόλειμμα), τραυματισμό του (χειρουργική ή FNA) και διέγερση του υποδοχέα της TSH (ενδογενή ή rhTSH). Δεδομένου ότι το επίπεδο της TSH είναι ο κύριος ρυθμιστής των συγκεντρώσεων Tg, είναι δύσκολο αυτές να ερμηνευθούν χωρίς να είναι γνωστή η TSH. Παρά το γεγονός ότι δεν υπάρχει κανονικό εύρος αναφοράς Tg για ασθενείς με DTC, η κανονική σχέση μεταξύ μάζας του θυρεοειδούς και Tg παρέχει ένα σημαντικό σημείο αναφοράς. Συγκεκριμένα, 1gr κανονικού θυρεοειδικού ιστού απελευθερώνει~1 μg/L(ng/mL) Tg στην κυκλοφορία, όταν η TSH είναι φυσιολογική και~0,5 μg/L(ng/mL) όταν η TSH καταστέλλεται κάτω 0,1 mU/L.
Προεγχειρητικά. Μερικοί όγκοι θυρεοειδούς δεν έχουν την ικανότητα να εκκρίνουν Tg. Αυξημένα επίπεδά της προεγχειρητικά παρατηρούνται στα 2/3 ασθενών με DTC, που δείχνει ότι οι όγκοι τους έχουν την ικανότητα έκκρισης Tg και κατά τεκμήριο, η παρακολούθηση Tg μετεγχειρητικά μπορεί να χρησιμοποιηθεί. Η πληροφορία αυτή είναι το κλειδί για την ερμηνεία των αποτελεσμάτων Tg μετεγχειρητικά.
Αν το επίπεδο Tg προεγχειρητικά είναι εντός των φυσιολογικών ορίων, μια μη ανιχνεύσιμη τιμή Tg μετεγχειρητικά είναι λιγότερο καθησυχαστική, διότι δεν είναι σαφές κατά πόσον ο όγκος είχε αρχικά εκκρίνει Tg.Η ευαισθησία της μετεγχειρητικής παρακολούθησης Tg για την ανίχνευση υποτροπής θα είναι υψηλότερη αν ο όγκος είναι σχετικά μικρός (≤2 εκ.) και η τιμή Tg προεγχειρητικά υψηλή.
Μετεγχειρητικά 1-2 μήνες μετά τη χειρουργική επέμβαση. Μετά από χειρουργική επέμβαση του θυρεοειδούς, οι συγκεντρώσεις Tg στον ορό πέφτουν γρήγορα με μια ημιζωή~2-4 ημέρες. Εντός των δύο μηνών μετά την επέμβαση η TSH θα είναι η κυρίαρχη επιρροή στα επίπεδα Tg. Εάν η θεραπεία θυρεοειδούς ορμόνης αρχίσει αμέσως μετά το χειρουργείο για την πρόληψη της αύξησης της TSH, η συγκέντρωση Tg θα μειωθεί σ’ ένα επίπεδο που αντανακλά το μέγεθος του κανονικού υπολοίπου του θυρεοειδούς συν οποιοδήποτε υπολειμματικό ή μεταστατικό όγκο. Δεδομένου ότι το υπόλοιπο του θυρεοειδούς μετά σχεδόν ολική θυρεοειδεκτομή ~2 γραμμάρια ιστού, αναμένεται μια συγκέντρωση Tg<2μg/L, όταν η ολική θυρεοειδεκτομή είναι επιτυχής και η TSH<0,1mU/L.
Μέτρηση Tg κατά τη μακρά διάρκεια L-T4 Rx. Όταν η TSH είναι σταθερή κατά τη διάρκεια της θεραπείας, οποιαδήποτε αλλαγή στα επίπεδα Tg, αντικατοπτρίζει αλλαγή στη μάζα του όγκου. Κλινική υποτροπή σε όγκους, που κρίνονται ότι είναι “φτωχοί εκκριτικά σε Tg” (φυσιολογική προεγχειρητική τιμή Tg), μπορεί να σχετίζεται με χαμηλές τιμές Tg ή μετεγχειρητικά μη ανιχνεύσιμες. Αντίθετα, η επανεμφάνιση των όγκων, που θεωρείται ως “καλή εκκριτικά Tg” (αυξημένη προεγχειρητικά Tg) συνήθως συνδέεται με μια προοδευτική αύξηση της Tg. Το πρότυπο σειριακών μετρήσεων Tg, που λαμβάνεται όταν ο ασθενής έχει σταθερή TSH είναι πιο χρήσιμο κλινικά από μια μεμονωμένη τιμή Tg.
Μπορεί να ερμηνευτεί η σημασία μιας μεμονωμένης τιμής Tg γνωρίζοντας το κανονικό εύρος αναφοράς του προσδιορισμού Tg, την έκταση της χειρουργικής επέμβασης του θυρεοειδούς και το επίπεδο της TSH σε σταθερή κατάσταση, (Εικόνα 14).

Εικόνα 14. Αναμενόμενες τιμές Tg σχετικά με τη μάζα του θυροειδούς και την κατάσταση της TSH.
Απαντήσεις Tg στη διέγερση της TSH. Το μέγεθος της ανόδου της Tg στην απόκριση χορήγησης ενδογενούς TSH ή rhTSH, παρέχει ένα μετρητή ευαισθησίας TSH του όγκου (47). Τυπικά, η διέγερση TSH των κανονικών υπολειμμάτων θυρεοειδούς ή ενός καλά διαφοροποιημένου όγκου παράγει μια αύξηση της Tg 3πλάσια από τη βασική (TSH-κατασταλμένη), σε ασθενείς με αρνητικά TgAb. Η απόκριση Tg σε μια ενδογενή αύξηση TSH είναι τυπικά μεγαλύτερη από ό,τι για rhTSH. Επιπλέον, σε φτωχά διαφοροποιημένα καρκινώματα, εμφανίζεται μια αμβλεία (<3πλάσια) αύξηση Tg ως απόκριση στη διέγερση της TSH. Τέλος, σε ασθενείς με θετικά TgAb εμφανίζεται μια τυπικά αμβλεία ή απούσα απόκριση στη διέγερση rhTSH από τις περισσότερες αναλύσεις, ακόμη και όταν η βασική συγκέντρωση Tg είναι ανιχνεύσιμη.
9. Καλσιτονίνη (CT) και Ογκογονίδιο RET
Μυελοειδές καρκίνωμα του θυρεοειδούς (MTC) προκύπτει από ένα κακοήθη μετασχηματισμό των παραθυλακιωδών κυττάρων C του θυρεοειδούς και αντιπροσωπεύει το 5-8% όλων των περιπτώσεων καρκίνου του θυρεοειδούς. Το 75% είναι σποραδικές περιπτώσεις και το 25% κληρονομικές. Σε μια μελέτη όζων του θυρεοειδούς, η επικράτηση των MTC αναφέρεται ως 0,57%. Η συμπεριφορά και η διαχείριση τους διαφέρουν από εκείνη των καλά διαφοροποιημένων θυλακιωδών θυρεοειδικών καρκινωμάτων. Οι κληρονομικές μορφές MTC υπάγονται υπό την πολλαπλή ενδοκρινική νεοπλασία (ΜΕΝ) τύπου 2Α και 2Β. Αυτά είναι σύνδρομα αυτοσωματικά επικρατούντα κληρονομικά πολυαδενικά με διεισδυτικότητα σχετιζόμενη με την ηλικία και με μεταβολική έκφραση. Η οικογενής MTC (FMTC) χαρακτηρίζεται από την εμφάνιση MTC χωρίς καμία σχετική ενδοκρινοπάθεια. Το 1993 ανακαλύφθηκαν οι γενετικές μεταλλάξεις στο ογκογονίδιο RET. Το γονίδιο, υπεύθυνο γι’ αυτές τις ασθένειες, βρίσκεται στην υποζώνη χρωμόσωμα 10q11.2.
9.1. Βιοσύνθεση της καλσιτονίνης
Το CALC-1 γονίδιο, που κωδικοποιεί την ανθρώπινη CT, βρίσκεται στην άκρη του βραχέος σκέλους του χρωμοσώματος 11. Μολονότι τα παραθυλακιώδη C κύτταρα του θυρεοειδούς είναι η κυρίαρχη πηγή της κυκλοφορούσας ώριμης CT, κι άλλες κατηγορίες νευροενδοκρινών κυττάρων πλην του θυρεοειδούς, περιέχουν και εκκρίνουν CT.
Η ώριμη CT είναι ένα πολυπεπτίδιο 32-αμινοξέων με μία δισουλφιδική γέφυρα και ένα καρβοξυτελικό αμίδιο προλίνης, που παίζουν λειτουργικά σημαντικό ρόλο. Η ώριμη CT προκύπτει από τη μετα-μεταφραστική τροποποίηση ενός, μεγαλύτερου από 141 αμινοξέα, προδρόμου (preprocalcitonin) στα παραθυλακιώδη κύτταρα C. Η pre προκαλσιτονίνη πρώτη υφίσταται διάσπαση ενός σηματοδοτικού πεπτιδίου για να σχηματίσει προκαλσιτονίνη (proCT), μια προορμόνη που αποτελείται από 116 υπολειμματικά αμινοξέα. Στο proCT αμινο-τελικό άκρο υπάρχει ένα πεπτίδιο 57-αμινοξέων, που ονομάζεται αμινοπροCT (ή PAS-57), και στο καρβοξυτελικό άκρο, ένα πεπτίδιο 21 αμινοξέων που ονομάζεται καρβοξυτελικό πεπτίδιο CT-1 (CCP-1 ή Katacalcin). Το ανώριμο πεπτίδιο CT που αποτελείται από 33 αμινοξέα βρίσκεται κεντρικά εντός του μορίου ProCT. Η ώριμη, ενεργός CT 32 αμινοξέων παράγεται από ανώριμη CT με τη βοήθεια ενός ενζύμου (ΡΑΜ).
9.2. Μέθοδοι μέτρησης της καλσιτονίνης (CT)-Τιμές
Μέχρι το 1988, οι μέθοδοι προσδιορισμού της CT ήταν κυρίως ραδιοανοσοανα-λύσεις που περιλάμβαναν τη χρήση πολυκλωνικών αντισωμάτων, που αναγνώριζαν το ώριμο μονομερές και άλλες μορφές (πρόδρομες ουσίες και προϊόντα αποδόμησης). Στις μεθόδους αυτές η ειδικότητα και η ευαισθησία ήταν μικρές. Από το 1988, οι βελτιώσεις με νέες ανοσομετρικές τεχνικές που βασίζονται στη χρήση μονοκλωνικών αντισωμάτων (μία από τις οποίες αναγνωρίζει την Ν-τελική περιοχή και η άλλη την Ο-τελική) επέτρεψε την ανάπτυξη πιο εξειδικευμένων και ευαίσθητων αναλύσεων που ανιχνεύουν την ώριμη μονομερή CT. Σήμερα οι ανοσομετρικές αναλύσεις 2 θέσεων ανιχνεύουν CT σε δείγματα πλάσματος νηστείας σε ποσοστό 83% υγιών ανδρών και 46% υγιών γυναικών. Οι παραγόμενες τιμές CT με διαφορετικές μεθόδους μπορεί να διαφέρουν, κάτι που οδηγεί σε δυσκολίες για την ερμηνεία των αποτελεσμάτων από τους γιατρούς και τη χρήση της για τη διάγνωση και διαχείριση των MCT.
Οι βασικές τιμές CT είναι ένας διαγνωστικά χρήσιμος δείκτης από το 1968. Σήμερα οι ΙΜΑ 2 θέσεων, ειδικές στην ώριμη CT, αναφέρουν επίπεδα <10 ng/L (pg/ml) για όλους τους φυσιολογικούς υγιείς μάρτυρες και για 90% των ασθενών με θυρεοειδικές ανωμαλίες, πλην MTC (50). Οι ασθενείς με μικρο-ή μακρο-μορφές MTC (σποραδική ή οικογενής μορφή) έχουν αυξημένα επίπεδα CT που συσχετίζονται με τη μάζα του όγκου. Η υπερπλασία των κυττάρων C (HCC) είναι το πρωθύστερο ιστολογικό εύρημα πριν την ανάπτυξη μικροκαρκινώματος, σε ασθενείς με MEN2, εμφανίζεται σύντομα μετά τη γέννηση και σ’ αυτό το στάδιο της νόσου, οι βασικές τιμές CT μπορεί να είναι φυσιολογικές. Έτσι το φυσιολογικό αποτέλεσμα CT δεν αποκλείει την παθολογία C-κυττάρων σε πρώιμα στάδια.
9.3. Τεστ που προκαλούν διέγερση CT (για διάγνωση MTC)
Το ασβέστιο και η πενταγαστρίνη (Pg ) ή ομεπραζόλη όταν η Pg δεν είναι διαθέσιμη, χρησιμοποιούνται για να δείξουν ανωμαλίες C-κυττάρων, δεδομένου ότι επάγουν μία αύξηση στα επίπεδα CT σε όλα τα στάδια MTC (51). Το πλεονέκτημά τους είναι ότι μπορούν να ανιχνεύσουν HCC πριν εμφανιστεί MTC. Σε χώρες όπως οι Η.Π.Α., όπου ο γενετικός έλεγχος είναι άμεσα διαθέσιμος, η χειρουργική επέμβαση σε φορείς του γονιδίου βασίζεται μόνο στο γενετικό έλεγχο και τα τεστ πρόκλησης διέγερσης χρησιμοποιούνται σπάνια. Οι λόγοι που χρησιμοποιούνται είναι:
- Για την επιβεβαίωση της διάγνωσης MTC προεγχειρητικά, όταν τα βασικά επίπεδα CT είναι μόνο ελαφρώς αυξημένα ( λιγότερο από 100 pg/ml)
- Για ανίχνευση της νόσου των C-κυττάρων σε RET-θετικούς φορείς γονιδίου
- Για προ-χειρουργική παρακολούθηση των RET θετικών παιδιών
- Για μετεγχειρητική παρακολούθηση υποτροπής του όγκου
- Όταν γενετικές εξετάσεις δεν είναι άμεσα διαθέσιμες.
9.3.1. Τεστ διέγερσης πενταγαστρίνης (Pg)
Χρησιμοποιείται ευρέως για τη διάγνωση MTC, αλλά δεν διατίθεται εύκολα σε πολλές χώρες. Αποτελείται από μια I.V. έγχυση Pg (0,5 μg/kg/βάρους σώματος) πάνω από 5sec. Η βραδεία χορήγησή του μειώνει τις παροδικές παρενέργειες και βελτιώνει την ανοχή του ασθενούς. Τα δείγματα αίματος λαμβάνονται κατά την έναρξη και 1, 2, 5 και ίσως 10 min μετά την έγχυση.
Η μετά διέγερση τιμή CT είναι <10ng/L (pg/ml) σε 80% των υγιών ενηλίκων, και <30ng/L σε 95% του γενικού πληθυσμού. Κανονικά οι άνδρες εμφανίζουν υψηλότερες τιμές από τις γυναίκες. Όταν οι ασθενείς έχουν οικογενή μετάλλαξη που ευθύνεται για MEN 2, η τιμή της CT είναι 30-100ng/L και υπονοεί HCC ή μικροκαρκίνωμα. Αν και είναι γνωστό ότι μία αύξηση της CT<100ng/L επέρχεται σε ενήλικες με θυρεοειδικές ανωμαλίες (άλλες από MTC), τέτοια αποτελέσματα δεν λαμβάνονται σε παιδιά <12 ετών, που δεν φέρουν τη μετάλλαξη RET. Η μη αύξηση της CT σε νεαρό άτομο που φέρει τη μετάλλαξη RET, δεν αποκλείει το ενδεχόμενο να συμβεί MTC σε μεγαλύτερη ηλικία.
Πίνακας 1.Ερμηνεία των τιμών της CT.
| CT ng/L(pg/ml) | Ερμηνεία |
| peak <10 | Φυσιολογική (80% ενηλίκων) |
| peak από 30 έως 50 | 5% φυσιολογικών ενηλίκων |
| peak από 50 έως 100 | Πιθανή CMT ή άλλες παθολογίες του θυρεοειδούς |
| peak >100 | Πιθανή CMT |
| Βασική ή μετά Pg>10 | Παθολογία C-κυττάρου ή υπολλειματικού ιστού σε MEN-2 ασθενείς και MTC μετά χειρουργείου |
Η καλύτερη ηλικία για να ελεγχθεί μια παθολογία C κυττάρων σε παιδιά που φέρουν τη μετάλλαξη RET για MEN-2 με το τεστ διέγερσης Pg δεν έχει ακόμη καθοριστεί. Ποικίλλει ανάλογα με τον τύπο της μετάλλαξης και το είδος MEN-2 σε αυτές τις οικογένειες. Ως εκ τούτου, οι νέοι φορείς της μετάλλαξης με κανονικά βασικά επίπεδα της CT θα πρέπει να κάνουν γενετικό ή έλεγχο διέγερσης αμέσως μετά τον τοκετό για MEN 2B, και κατά τα 2 έτη για MEN 2A.
Πρέπει να τονιστεί ότι τα υψηλά επίπεδα CT συνήθως βρίσκονται σε νεογνά που ακολουθούνται από μια πτώση λόγω ηλικίας μετά τη γέννηση μέχρι περίπου 1 έτους. Το τεστ θα πρέπει να επαναλαμβάνεται τουλάχιστον 1 φορά ετησίως μέχρι να γίνει θετικό, οπότε και θα πρέπει να πραγματοποιηθεί ολική θυρεοειδεκτομή. Με δεδομένη την πρόγνωση για MTC, τη χαμηλή ανοχή στο τεστ Pg και τις ψυχολογικές επιπτώσεις στην οικογένεια, μερικοί γιατροί προτιμούν να μην το επαναλαμβάνουν μέχρι να γίνει θετικό και επιλέγουν να εκτελεστεί μια θυρεοειδεκτομή σε όλους τους φορείς RET 4 έως 5 ετών.
9.3.2. Τεστ διέγερσης ασβεστίου
Περιλαμβάνει τη χορήγηση 2,5 mg/kg ενδοφλεβίως γλυκονικό ασβέστιο για πάνω από 30 sec. Τα δείγματα αίματος λαμβάνονται κατά την έναρξη και στα 1, 2 και 5 min μετά την έγχυση. Η υπερπλασία των κυττάρων C είναι ύποπτη άν τα επίπεδα CT αυξάνονται πάνω από 100ng/L. Δεν έχουν παρατηρηθεί σημαντικές ανεπιθύμητες επιδράσεις. Οι εγχύσεις ασβεστίου θεωρούνται λιγότερο ευαίσθητες από το τεστ Pg για τη διάγνωση MTC. Επιπλέον, δεν έχουν αξιολογηθεί με τη χρήση μιας ειδικής ανάλυσης για ώριμη μονομερή CT και άρα πρέπει να επαναξιολογηθούν. Η έγχυση ασβεστίου σε συνδυασμό με το τεστ Pg ενισχύει την ευαισθησία του δεύτερου.
9.3.3. Επίπεδα CT σε χειρουργημένους ή μη ασθενείς
Μετά από μια θυρεοειδεκτομή, οι μετρήσεις CT στον ορό είναι ο αποδεκτός καρκινικός δείκτης για την ανίχνευση υπολειμματικών ιστών του θυρεοειδούς ή μεταστάσεων. Μια ανιχνεύσιμη CT, βασική ή μετά Pg διέγερση, αποτελεί απόδειξη ότι υπάρχει υπολειμματικός καρκινικός ιστός.
Το πρώτο μετεγχειρητικό δείγμα ελέγχου θα πρέπει να λαμβάνεται τουλάχιστον 2 εβδομάδες μετά την επέμβαση. Πρέπει να σημειωθεί ότι και το καρκινοεμβρυϊκό αντιγόνο (CEA) μετριέται μαζί για ανίχνευση της υποτροπής MTC, είναι χρήσιμος δείκτης της de-διαφοροποίησης MTC και ενδεικτικός κακής πρόγνωσης. Αυξημένα επίπεδα CT έχουν παρατηρηθεί και σε άλλες παθολογίες πλην MTC και νευροενδοκρινών όγκων. Εμφανίζονται σε αυτοάνοσα νοσήματα του θυρεοειδούς (θυρεοειδίτιδα Hashimoto ή νόσο Graves), σε περιπτώσεις σοβαρής νεφρικής ανεπάρκειας, υπερασβεστιαιμίας και υπεργαστριναιμίας, οξείες φλεγμονώδεις παθήσεις των πνευμόνων και άλλες τοπικές ή γενικές μορφές σήψης.
Όταν τα αυξημένα επίπεδα CT ανιχνεύονται με πολυκλωνικά RIA, απαιτείται επιβεβαίωση χρησιμοποιώντας τρέχουσες αναλύσεις μονοκλωνικού αντισώματος, που είναι πιο εξειδικευμένες στην ώριμη CT. Μελέτες που χρησιμοποιούν ειδικούς αντιορούς έναντι άθικτης ProCT, CT και CCP-1, σε συνδυασμό με HPLC και διήθηση γέλης, έχουν δείξει ότι ασθενείς με αυξημένη CT σε μη θυρεοειδική κατάσταση, έχουν σημαντικά αυξημένα επίπεδα άθικτης ProCT, και σε μικρότερο βαθμό το μη διασπασμένο τύπο, CT-CCP-1. Αυτοί οι ασθενείς συνήθως έχουν φυσιολογική ή ελάχιστα αυξημένη την ώριμη CT.
Χρησιμοποιώντας αντιορό εξειδικευμένου επιτόπου και τεχνικές απομόνωσης, έχει δειχθεί ότι οι όγκοι πλην MTC μπορεί να εκκρίνουν μεγάλες ποσότητες ώριμης CT και πρόδρομες CT. Αυτό μπορεί να φανεί σε νευροενδοκρινείς όγκους, ιδιαίτερα μικροκυτταρικούς καρκίνους του πνεύμονα και καρκινοειδείς βρόγχους. Μόνο μια μικρή αύξηση CT, αν υπάρχει, παρατηρείται μετά το τεστ Pg, όταν ελέγχονται οι ασθενείς με νευροενδοκρινείς όγκους. Υπερπλασία των C κυττάρων εμφανίζεται σε σε ασθενείς με λεμφοκυτταρική θυρεοειδίτιδα και διαφοροποιημένους καρκίνους του θυρεοειδούς και μπορεί να είναι υπεύθυνη για ελαφρώς αυξημένη ώριμη CT ή για την αυξημένη απόκρισή της με το τεστ Pg.
9.4. Ανίχνευση MTC με μέτρηση της ογκογονιδίου RET
Μέχρι το 1987, η μόνη διαθέσιμη μέθοδος για την ανίχνευση ατόμων που διατρέχουν κίνδυνο για MTC ήταν να γίνουν επαναλαμβανόμενες μετρήσεις διέγερσης CT στα μέλη της οικογένειας των ασθενών MTC. Η επακόλουθη ταυτοποίηση του τόπου 10q11.2 στο χρωμόσωμα 10, υπεύθυνου για MEN 2, έκανε δυνατό τον εντοπισμό ατόμων υψηλού κινδύνου με γενετική επιλογή. Έχει πλέον αποδειχθεί ότι διάφοροι τύποι μεταλλάξεων στο χρωμόσωμα 10 μπορεί να ενεργοποιήσουν το πρώτο ογκογονίδιο RET, που είναι υπεύθυνο για MEN 2. Αυτό επιτρέπει στους γιατρούς να εκτελούν screening πριν εμφανιστούν τα πρώτα βιολογικά σημάδια. Επί του παρόντος σε πολλές ανεπτυγμένες χώρες, οι γενετικές μελέτες είναι η πρώτη γραμμή προσέγγισης γι’ αυτήν τη διάγνωση. Για την ακριβή πρόβλεψη της νόσου, ωστόσο, είναι αναγκαίο τα θετικά αποτελέσματα του γενετικού screening να ακολουθούνται από μια εξαντλητική έρευνα των υγιών και των επηρεαζόμενων μελών της οικογένειας.
Το γονίδιο RET είναι ένα 21 γονίδιο εξόνιο που κωδικοποιεί έναν υποδοχέα κινάσης τυροσίνης μεμβράνης. Αυτός ο συνδεδεμένος με μεμβράνη υποδοχέας χαρακτηρίζεται από μια περιοχή πλούσια σε κυστεΐνη στον εξωκυτταρικό τομέα της μεμβράνης και έναν ενδοκυτταρικό τομέα κινάσης τυροσίνης. Οι μεταλλάξεις που περιγράφηκαν ως τώρα σε MEN2 βρίσκονται στα εξόνια 8,10,11,13,14,15,16, (Εικόνα 15).
Εικόνα 15. Πιο κοινές μεταλλάξεις του πρωτο-ογκογονιδίου RET.
Γενετικός Έλεγχος για Διάγνωση MEN2. Η MEN2 είναι μια αυτοσωμική, κυρίαρχη οικογενής νόσος, που προκαλείται από την ενεργοποίηση των μεταλλάξεων απουσίας στο ογκογονίδιο RET. Περίπου το 75% του συνόλου των MTC είναι σποραδικό και μονήρους προέλευσης. Στο 44% αυτών των όγκων, είναι παρούσα μία μετάλλαξη στο κωδικόνιο 918. Το screening πρέπει να πραγματοποιείται σε όλα τα μέλη της οικογένειας, προγόνους και απογόνους και αργότερα σε όλους τους απογόνους των μελών που επηρεάζονται. Βασίζεται στην ταυτοποίηση της γονιδιωματικής μετάλλαξης του πρωτοογκογονιδίου RET χρησιμοποιώντας ανάλυση αλληλουχίας DNA και στη συστηματική έρευνα για τη μετάλλαξη αυτή σε όλα τα δυνητικά επηρεαζόμενα μέλη της οικογένειας.
Μέχρι σήμερα, 5 μεταλλάξεις του γονιδίου RET είναι παρούσες στο 97% όλων των περιπτώσεων MEN2, οι οποίες επηρεάζουν κυρίως την πλούσια σε κυστεΐνη εξωκυτταρική περιοχή, μετατρέποντας μια κυστεΐνη σ’ ένα αμινοξύ. Οι μεταλλάξεις συμβαίνουν στα κωδικόνια κυστεΐνης 609, 611, 618 και 620 του εξονίου 10 και στο 634. Το Οικογενές Μυελοειδές καρκίνωμα του θυρεοειδούς (FMTC) πιο συχνά συνδέεται με μεταλλάξεις στα κωδικόνια κυστεΐνης στο εξόνιο 10, καθώς και στα κωδικόνια 768, 804 στα εξόνια 13 και 14. Το 87% των μεταλλάξεων στο κωδικόνιο 634 στο εξόνιο 11 συνδέονται με πολλαπλές οργανικές εκδηλώσεις MEN2Α (MTC, φαιοχρωμοκύτωμα, και υπερπαραθυρεοειδισμό).
Οι όγκοι σχετιζόμενοι με MEN2Β προκαλούνται από μεταλλάξεις στον ενδοκυτταρικό τομέα TK2. Το 97% των MEN2Β περιπτώσεων περιλαμβάνουν αμινοξύ 918 στο εξόνιο 16 με μια μεθειονίνη μετατρεπόμενη σε θρεονίνη, που επιφέρουν συχνά νέες μεταλλάξεις βλαστικής σειράς. Μόνο το 5% των MEN2B μεταλλάξεων επηρεάζουν το αμινοξύ 883 στο εξόνιο 15 ή το 922. Μια συσχέτιση μεταξύ γονότυπου και φαινότυπου υποδηλώνει ότι σε FMTC ασθενείς με μεταλλάξεις RET μη-κυστεΐνης, η έναρξη της νόσου C κυττάρων καθυστερεί αργότερα στη ζωή σε σύγκριση με ασθενείς με κλασσικές μεταλλάξεις RET στο εξόνιο 10.
Όταν μια μετάλλαξη εντοπιστεί σε μια οικογένεια, μπορεί κανείς να είναι σίγουρος ότι τα μέλη της οικογένειας και οι απόγονοί τους που δεν φέρουν τη μετάλλαξη είναι απαλλαγμένες από την παθολογία. Αντιστρόφως, τα άτομα που φέρουν τη μετάλλαξη έχουν την παθολογία και απαιτείται χειρουργική επέμβαση για τη διαχείριση, ή την εμπόδιση της ανάπτυξης της νόσου. Εάν μη γονιδιωματική μετάλλαξη εντοπίζεται, (<3% των MEN2Α και <5% των FMTC), η ανάλυση σύνδεσης μπορεί να χρησιμοποιηθεί για να προβλέψει το επίπεδο κινδύνου για τα μέλη της οικογένειας. Αν υπάρχουν προβλέψεις αυτού του είδους λόγω της γενεαλογίας της οικογένειας, η ανίχνευση της ασθένειας πρέπει να διεξάγεται με επαναλαμβανόμενες κλινικές μελέτες και ειδικές βιολογικές δοκιμασίες σε κατάλληλα χρονικά διαστήματα.
10. Η σημασία της επικοινωνίας εργαστηρίου και ιατρού
Οι γιατροί απαιτούν ποιότητα στην εργαστηριακή υποστήριξη για την ακριβή διάγνωση και την οικονομικά αποδοτική διαχείριση των ασθενών με διαταραχές του θυρεοειδούς. Τα εργαστήρια θα πρέπει να προσφέρουν μεθόδους ανάλυσης που να είναι τόσο διαγνωστικά ακριβείς όσο και οικονομικά αποδοτικές. Οι ιδιότητες αυτές πολλές φορές βρίσκονται σε σύγκρουση. Η αποτελεσματικότητα κόστους και ποιότητας απαιτεί το εργαστήριο να εξυπηρετεί τις ανάγκες όχι μόνο της πλειοψηφίας αλλά και της μειονότητας των ασθενών με ασυνήθιστα προβλήματα του θυρεοειδούς, που αμφισβητούν τη διαγνωστική ακρίβεια σε διάφορες εξετάσεις του θυρεοειδούς.
Οι περισσότερες μελέτες για τη σχέση κόστους-αποτελεσματικότητας αποτυγχάνουν να λάβουν υπόψη το ανθρώπινο και οικονομικό κόστος που προκύπτει από την ακατάλληλη διαχείριση, την άχρηστη επανάληψη προσπαθειών και τις περιττές εξετάσεις ασθενών με ασυνήθιστες νόσους του θυρεοειδούς. Όλα αυτά ευθύνονται για ένα δυσανάλογα μεγάλο εύρος εργαστηριακών δαπανών προκειμένου να προκύψει η σωστή διάγνωση. Όπως ήδη έχει αναφερθεί στα αντίστοιχα κεφάλαια αυτά προέρχονται από:
- ανωμαλίες σύνδεσης πρωτεΐνης που επηρεάζουν τις αναλύσεις εκτίμησης FT4
- παρουσία αυτοαντισωμάτων Tg που παρεμβαίνουν στις μετρήσεις Tg στον ορό
- φάρμακα που θέτουν σε κίνδυνο τον in vivo και in vitro μεταβολισμό των ορμονών του θυρεοειδούς και
- σοβαρές μορφές της ΝΤΙ που έχουν πολλές επιπτώσεις στα αποτελέσματα των εξετάσεων του θυρεοειδούς.
Είναι σημαντικό οι επιστήμονες των κλινικών εργαστηρίων να αναπτύξουν ενεργό συνεργασία με τους γιατρούς χρησιμοποιώντας τις εργαστηριακές υπηρεσίες τους και επιλέγοντας εξετάσεις του θυρεοειδούς με τα κατάλληλα χαρακτηριστικά για να εξυπηρετήσουν τον πληθυσμό των ασθενών αυτών. Για παράδειγμα, η επίδραση της ΝΤΙ στη μέτρηση FT4 δεν είναι τόσο σημαντική, αν το εργαστήριο εξυπηρετεί πρωτίστως ένα συνήθη πληθυσμό ασθενών.
Αντίθετα, είναι πολύ σημαντικό για ένα εργαστήριο νοσοκομείου να αποκλείσει με ακρίβεια τη δυσλειτουργία του θυρεοειδούς σε νοσηλευόμενους ασθενείς. Γενικά, φάρμακα και άλλες παρεμβολές μπορούν να επιδράσουν στην ερμηνεία πάνω από το 10% των εργαστηριακών αποτελεσμάτων και ο θυρεοειδικός έλεγχος δεν αποτελεί εξαίρεση. Άρα ασύμφωνα θυρεοειδικά αποτελέσματα αντιμετωπίζονται συχνά στην κλινική πράξη και πρέπει να ερμηνεύονται με μεγάλη φροντίδα, χρησιμοποιώντας μια συνεργατική προσέγγιση μεταξύ κλινικού εργαστηριακού επιστήμονα που δημιουργεί το αποτέλεσμα της ανάλυσης του θυρεοειδούς και του γιατρού που διαχειρίζεται τον ασθενή με πιθανολογούμενη ή υπαρκτή θυρεοειδική νόσο.
Έχει σημασία εάν οι αναλύσεις εκτελούνται τοπικά ή από ένα εργαστήριο αναφοράς. Επίσης, είναι ιδιαίτερα σημαντικό το εργαστήριο να μπορεί να παρέχει εύκολα τα διαθέσιμα δεδομένα για τις αλληλεπιδράσεις με άλλα φάρμακα, τα διαστήματα αναφοράς, τις λειτουργικές ευαισθησίες και τα όρια ανίχνευσης, καθώς και τις παρεμβολές που επηρεάζουν τις μεθόδους που χρησιμοποιούνται.
Το εργαστήριο θα πρέπει να αποφεύγει τις συχνές ή αιφνιδιαστικές αλλαγές στις μεθόδους προσδιορισμού και να συνεννοείται στενά με τους γιατρούς πριν ξεκινήσει μια αλλαγή στη μέθοδο. Πρέπει επίσης να συνεργάζεται με τους γιατρούς και να υπάρχει αμφίδρομη ενημέρωση ώστε να προκύπτει κλινική επικύρωση δεδομένων με την εφαρμογή οποιασδήποτε νέας μεθόδου και να παρέχονται στοιχεία που να δείχνουν θετική σχέση μεταξύ της παλαιάς και της προτεινόμενης νέας μεθόδου, που παρέχει ένα συντελεστή μετατροπής, εάν απαιτείται. Η διαγνωστική αξία και η εξοικονόμηση δαπανών από τις αντανακλαστικές στρατηγικές αναλύσεων (για παράδειγμα προσθήκη FT3 όταν FT4 είναι υψηλή ή FT4 όταν η TSH είναι μη φυσιολογική) είναι συνήθως εξειδικευμένης θέσης. Στις Ηνωμένες Πολιτείες, τα εργαστήρια από το νόμο μπορεί να εφαρμόσουν μόνο αντανακλαστικές αναλύσεις μετά από συνεννόηση των γιατρών με το εργαστήριο.
Οι γιατροί θα πρέπει να αναμένουν από το κλινικό εργαστήριό τους να καθιερώσει μια σχέση μ’ ένα εργαστήριο αναφοράς ή/και άλλο τοπικό εργαστήριο που εκτελεί τις αναλύσεις του θυρεοειδούς με μεθόδους διαφορετικού κατασκευαστή. Επανάληψη της μέτρησης του δείγματος με μία εναλλακτική μέθοδο είναι ο ακρογωνιαίος λίθος της διερεύνησης κατά πόσον ένα ασύμφωνο αποτέλεσμα προκαλείται από ένα τεχνικό πρόβλημα, μια ουσία που παρεμβαίνει στο δείγμα ή μια σπάνια κλινική κατάσταση.
Το εργαστήριο πρέπει να καθιερώσει και να διατηρήσει μια ενεργό σχέση με εξειδικευμένα εργαστήρια αναφοράς για τη διασφάλιση διαθεσιμότητας υψηλής ποιότητας εξειδικευμένων εξετάσεων θυρεοειδούς. Αυτές μπορεί να περιλαμβάνουν αναλύσεις για Tg, TPOAb και TRAb. Επιπλέον, ένα εργαστήριο αναφοράς που προσφέρει FT4 μετρήσεις χρησιμοποιώντας μια φυσική τεχνική διαχωρισμού όπως ισορροπία διάλυσης θα πρέπει να είναι διαθέσιμο. Η χρήση της για την ανάλυση FT4 μπορεί να είναι αναγκαία υπό ειδικές συνθήκες για τη διάγνωση θυρεοειδικής νόσου σε επιλεγμένους ασθενείς με ανωμαλίες στη σύνδεση θυρεοειδικής ορμόνης-πρωτεΐνης, που παρεμβαίνουν στη διαγνωστική ακρίβεια της αυτοματοποιημένης ανάλυσης FT4, που πραγματοποιείται στα περισσότερα κλινικά εργαστήρια. Σε σπάνιες περιπτώσεις, μπορεί να είναι απαραίτητη η συνεργασία με μοριακό διαγνωστικό εργαστήριο που έχει την τεχνογνωσία να εντοπίσει γενετικές μεταλλάξεις χαρακτηριστικές της αντίστασης των θυρεοειδικών ορμονών ή της θυρεοειδικής νόσου του μυελοειδούς.
Οι κατασκευαστές έχουν την ευθύνη να αξιολογούν σε βάθος τις μεθόδους τους και να συνεργάζονται στενά με τα εργαστήρια που χρησιμοποιούν τα προϊόντα τους. Συγκεκριμένα, θα πρέπει να ενημερώνουν αμέσως τους χρήστες των αντιδραστηρίων που αναπτύσσουν προβλήματα ή παρεμβολές γνωστές στη μέθοδο και να κάνουν συστάσεις ως προς τον τρόπο ελαχιστοποίησης της κλινικής σημασίας του προβλήματος. Θα πρέπει να αποφεύγουν την αλλαγή σύνθεσης των κιτ, ακόμη και αν στόχος είναι η ελαχιστοποίηση των παρεμβολών, χωρίς να ενημερώσουν τους πελάτες και αφού δοθεί επαρκής χρόνος για την πραγματοποίηση μελετών συσχέτισης με την προηγούμενη μέθοδο. Εάν η διαδικασία επιβάλλεται να αλλάξει, αυτό πρέπει να αναγράφεται στην ετικέτα του kit, δηλαδή στον αριθμό έκδοσης (lot).
Οι επιστήμονες των κλινικών εργαστηρίων πρέπει ιδανικά να περιμένουν από τους γιατρούς να τους παρέχουν τις σχετικές κλινικές πληροφορίες με την υποβολή του δείγματος και να έχουν μια ρεαλιστική αντίληψη των περιορισμών των θυρεοειδικών τεστ. Για παράδειγμα, σε ορισμένες συνθήκες, ο ιατρός θα πρέπει να εκτιμήσει ότι η ανοσολογική και βιολογική δραστικότητα της TSH μπορεί να σταματήσει, όταν οι ασθενείς έχουν κεντρικό υποθυρεοειδισμό. Αυτό μπορεί να προκύψει από δυσλειτουργία της υπόφυσης στην οποία η ανοσοαντιδραστική μορφή της TSH έχει μειωμένη βιοδραστικότητα, (31).
Η Εικόνα 16 δείχνει έναν αριθμό κλινικών καταστάσεων, φαρμάκων και παρεμβολών στα δείγματα που μπορούν να οδηγήσουν σε διαγνωστικά ανακριβές αποτέλεσμα, το οποίο αναγκάζει να ζητηθούν επιπλέον εξετάσεις, ακατάλληλη θεραπεία, ή στην περίπτωση του κεντρικού υποθυρεοειδισμού συγκάληψη της ανάγκης για θεραπεία (1).

Εικόνα 16. Συνέπειες των διαγνωστικά ανακριβών θυρεοειδικών εξετάσεων.
Ο ιατρός θα πρέπει να καταλάβει ότι τα ανώμαλα αποτελέσματα των εργαστηριακών εξετάσεων του θυρεοειδούς μπορεί να προκύψουν από ορισμένες θεραπείες και ότι η διαγνωστική ακρίβεια των εξετάσεων του θυρεοειδούς για ασθενείς με NTI εξαρτάται από τη μέθοδο. Χωρίς κλινική ανάδραση, δεν είναι δυνατόν το εργαστήριο να εκτιμήσει τις συνέπειες ενός διαγνωστικού σφάλματος. Παρερμηνεία των αποτελεσμάτων των εξετάσεων ως συνέπεια παροδικής ανισορροπίας μεταξύ TSH και FT4 μετά την πρόσφατη θεραπεία για υπο-ή υπερθυρεοειδισμό μπορεί να έχει σημαντικές συνέπειες.
Χωρίς μια ισχυρή, συλλογική διασύνδεση εργαστηρίου-ιατρού, η ποιότητα της εργαστηριακής υποστήριξης αναμφίβολα είναι αναντίστοιχη. Αυτό ισχύει ιδιαίτερα σε χώρες όπως οι Η.Π.Α., όπου τα εργαστήρια σπάνια λαμβάνουν σχετικές κλινικές πληροφορίες και πληροφορίες φαρμακευτικής αγωγής στα γραφειοκρατικά στοιχεία που συνοδεύουν το δείγμα. Η αδυναμία του εργαστηρίου να εκτελέσει τον τελικό «έλεγχο ασφαλείας» στο αναφερόμενο αποτέλεσμα, με βάση αυτές τις πληροφορίες, μπορεί να οδηγήσει σε λάθη, ειδικά όταν οι γιατροί δεν είναι εξοικειωμένοι με τους τεχνικούς περιορισμούς και τις παρεμβολές που επηρεάζουν την εξέταση:
- Ακατάλληλη εκτομή θυρεοειδούς, επειδή υψηλά επίπεδα ορμονών του θυρεοειδούς αναφέρθηκαν ως αποτέλεσμα της FDH, της παρουσίας αυτοαντισωμάτων ορμόνης του θυρεοειδούς ή αντίστασης θυρεοειδικής ορμόνης
- Xαμένη διάγνωση Τ3-τοξίκωσης σ’ έναν αδύναμο ηλικιωμένο ασθενή με NTΙ
- Ακατάλληλη θεραπεία νοσηλευόμενου ασθενούς για υπο-,υπερ-θυρεοειδισμό, με βάση μη φυσιολογικές εξετάσεις του θυρεοειδούς που προκαλούνται από ΝΤΙ ή παρεμβολές φαρμάκων.
- Xαμένη διάγνωση κεντρικού υποθυρεοειδισμού, διότι το επίπεδο ανοσοαντιδραστικής TSH βρέθηκε φυσιολογικό, λόγω της μέτρησης των βιολογικά ανενεργών ισομορφών TSH.
- Η αποτυχία να αναγνωρίζεται υποτροπιάζουσα ή μεταστατική νόσος σε ασθενή με καρκίνο του θυρεοειδούς, επειδή η Tg ήταν ανάρμοστα χαμηλή ή μη ανιχνεύσιμη λόγω παρεμβολών TgAb ή παρουσίας hook effect με μία ΙΜΑ μέτρηση.
- Ανάρμοστη θεραπεία για DTC με βάση παθολογικά αυξημένη Tg που προκαλείται από TgAb παρεμβολές με τη μέθοδο RIA.
- Αδυναμία αναγνώρισης ότι η νεογνική θυρεοτοξίκωση μπορεί να επικαλυφθεί από διαπλακουντιακό πέρασμα των αντιθυρεοειδικών φαρμάκων που δίνονται στη μητέρα για τη νόσο του Graves.
Βιβλιογραφία
1. Laurence M. Demers and Carol Spencer, Laboratory Support for the Diagnosis and Monitoring of Thyroid Disease, NACB, Washington DC USA, 2002.
2. Piketty ML, D’Herbomez M, Le Guillouzic D, Lebtahi R, Cosson E, Dumont A et al. Clinical comparision of three labeled-antibody immunoassays of free triiodothyronine. Clin Chem 1996; 42:933-41.
3. Sapin R, Schlienger JL, Goichot B, Gasser F and Grucker D. Evaluation of the Elecsys free triiodothyronine assay; relevance of age-related reference ranges. Clin Biochem 1998; 31: 399-404.
4. Robbins J. Thyroid hormone transport proteins and the physiology of hormone binding. In “Hormones in Blood”. Academic Press, London 1996. Gray CH, James VHT, eds. pp 96-110.
5. Demers LM. Thyroid function testing and automation. J Clin Ligand Assay 1999; 22:38-41.
6. Werner and Ingbar’s “The Thyroid”. A Fundamental and Clinical Text. Lippincott- Raven, Philadelphia 2000. Braverman LE and Utiger RD eds.
7. Nelson JC and Wilcox RB . Analytical performance of free and total thyroxine assays. Clin Chem 1996; 42: 146-54.
8. Evans SE, Burr WA and Hogan TC. A reassessment of 8-anilino-1-napthalene sulphonic acid as a thyroxine binding inhibitor in the radioimmunoassay of thyroxine. Ann Clin Biochem 1977; 14: 330-4
9. De Brabandere VI, Hou P, Stockl D, Theinpont LM and De Leenheer AP. Isotope dilution-liquid chromatography/electrospray ionization-tandem mass spectrometry for the determination of serum thyroxine as a potential reference method. Rapid Commun Mass Spectrom 1998; 12: 1099-103.
10. Tai SSC, Sniegoski LT and Welch MJ. Candidate reference method for total thyroxine in human serum: Use of isotope-dilution liquid chromatography-mass spectrometry with electrospray ionization. Clin Chem 2002; 48:637-42.
11. Thienpont LM, Fierens C, De Leenheer AP and Przywara L. Isotope dilution-gas chromatography/mass spectrometry and liquid chromatography/electro-spray ionization-tandem mass spectrometry for the determination of triiodo-L-thyronine in serum. Rapid Commun Mass Spectrom 1999; 13: 1924-31.
12. Hay ID, Bayer MF, Kaplan MM, Klee GG, Larsen PR and Spencer CA. American Thyroid Association Assessment of Current Free Thyroid Hormone and Thyrotropin Measurements and Guidelines for Future Clinical Assays. Clin Chem 1991; 37: 2002-2008.
13. Despres N and Grant AM. Antibody interference in thyroid assays: a potential for clinical misinformation. Clin Chem 1998; 44: 440-54
14. . Wang R, Nelson JC, Weiss RM and Wilcox RB. Accuracy of free thyroxine measurements across natural ranges of thyroxine binding to serum proteins. Thyroid 2000; 10:31-9.
15. Nelson JC, Wilcox BR and Pandian MR. Dependence of free thyroxine estimates obtained with equilibrium tracer dialysis on the concentration of thyroxine-binding globulin. Clin Chem 1992; 38: 1294-1300.
16. Nusynowitz, M. L. Free-thyroxine index. JAMA 1975; 232 :1050
17. Larsen PR, Alexander NM, Chopra IJ, Hay ID, Hershman JM, Kaplan MM et al. Revised nomenclature for tests of thyroid hormones and thyroid-related proteins in serum. J Clin Endocrinol Metab 1987; 64: 1089-94.
18. Stockigt JR. Free thyroid hormone measurement: a critical appraisal. Endocrinol Metab Clin N Am 2001;30:265-89.
19. Mendel CM, Frost PH, Kunitake ST and Cavalieri RR. Mechanism of the heparin -induced increase in the concentration of free thyroxine in plasma. J Clin Endocrinol Metab 1987; 65:1259-64.
20. Docter R, van Toor H, Krenning EP, de Jong M and Hennemann G. Free thyroxine assessed with three assays in sera of patients with nonthyroidal illness and of subjects with abnormal concentrations of thyroxine-binding proteins. Clin Chem 1993; 39:1668-74
21. Jaume JC, Mendel CM, Frost PH,Greenspan FS, Laughton CW. Extremely low doses of heparin release lipase activity into the plasma and can thereby cause artifactual elevations in the serum-free thyroxine concentrations as measured by equilibrium dialysis. Thyroid 1996; 6:79-83.
22. Stevenson HP, Archbold GP, Johnston P,Young IS, Sheridan B.Misleading serum free thyroxine results during low molecular weight heparin treatment. Clin Chem 1998;44:1002-7.
23. Π.Μουτσάτσου-Λαδικού, Νικ.Θαλασσινός Βασικές αρχές της ραδιοανοσοανάλυσης και των μη ισοτοπικών ανοσοαναλύσεων,Αθήνα 1992.
24. Csako G, Zwieg MH, Glickman J, Ruddel M and K. J. Direct and indirect techniques for free thyroxin compared in patients with nonthyroidal illness. II. Effect of prealbumin, albumin and thyroxin-binding globulin. Clin Chem 1989; 35 :1655-62.
25. Ekins R. The science of free hormone measurement. Proc UKNEQAS Meeting 1998;3 :35-59.
26. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocrinol Rev 1997;18: 404-33.
27. Fisher DA. The hypothyroxinemia of prematurity. J Clin Endocrinol Metab 1997; 82:1701-3.
28. Nelson JC and Weiss RM. The effects of serum dilution on free thyroxine (T4) concentration in the low T4 syndrome of nonthyroidal illness. J Clin Endocrinol Metab 1985;61: 239-46.
29. Surks MI and Defesi CR. Normal free thyroxine concentrations in patients treated with phenytoin or carbamazepine: a paradox resolved. JAMA 1996;275: 1495-8.
30. Kricka LJ. Interferences in Immunoassay – still a threat. Clin Chem 2000;46 :1037-8.
31. Persani L, Ferretti E, Borgato S, Faglia G and Beck-Peccoz P. Circulating thyrotropin bioactivity in sporadic central hypothyroidism. J Clin Endocrinol Metab 2000;85:3631-5.
32. Rafferty B and Gaines Das R. Comparison of pituitary and recombinant humaN thyroid-stimulating hormone (rhTSH) in a multicenter collaborative study: establishment of the first World Health Organization reference reagent for rhTSH. Clin Chem 1999;45:2207-15.
33. Hollowell JG, Staehling NW, Hannon WH, Flanders WD, Gunter EW, Spencer CA et al. Serum thyrotropin, thyroxine and thyroid antibodies in the United States population (1988 to 1994): NHANES III. J Clin Endocrinol Metab 2002;87:489-99.
34. Ladenson PW, Singer PA, Ain KB, Bagchi N, Bigos ST, Levy EG et al. American Thyroid Association Guidelines for detection of thyroid dysfunction. Arch Intern Med 2000;160: 1573-5.
35. Wardle CA, Fraser WD and Squire CR. Pitfalls in the use of thyrotropin concentration as a first-line thyroid-function test. Lancet 2001;357:1013-4.
36. Michalopoulou G, Alevizaki M, Piperingos G, Mitsibounas D, Mantzos E, Adamopoulos P et al. High serum cholesterol levels in persons with ‘high-normal’ TSH levels: should one extend the definition of subclinical hypothyroidism? Eur J Endocrinol 1998;138:141-5.
37. Fisher DA, Schoen EJ, La Franchi S, Mandel SH, Nelson JC, Carlton EI and Goshi JH. The hypothalamic-pituitary-thyroid negative feedback control axis in children with treated congenital hypothyroidism. J Clin Endocrinol Metab 2000;85:2722-7.
38. Nohr SB, Jorgensen A, Pedersen KM and Laurberg P. Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-positive women living in an area with mild to moderate iodine deficiency: Is iodine supplementation safe? J Clin Endocrinol Metab 2000; 85:3191-8.
39. Oddie TH, Klein AH, Foley TP and Fisher DA. Variation in values for iodothyronine hormones, thyrotropin and thyroxine binding globulin in normal umbilical-cord serum with season and duration of storage. Clin Chem 1979;25:1251-3.
40. Martel J, Despres N, Ahnadi CE, Lachance JF, Monticello JE, Fink G, Ardemagni A, Banfi G, Tovey J, Dykes P, John R, Jeffery J and Grant AM. Comparative multicentre study of a panel of thyroid tests using different automated immunoassay platforms and specimens at high risk of antibody interference. Clin Chem Lab Med 2000;38:785-93.
41. Chiovato L, Bassi P, Santini F, Mammoli C, Lapi P, Carayon P and Pinchera A. Antibodies producing complement-mediated thyroid cytotoxicity in patients with atrophic or goitrous autoimmune thyroiditis. J Clin Endocrinol Metab 1993;77:1700-5.
42. Ruf J, Carayon P and Lissitzky S. Various expression of a unique anti-human thyroglobulin antibody repertoire in normal state and autoimmune disease. Eur J Immunol 1985; 15:268-72.
43. Spencer CA, Wang C, Fatemi S, Guttler RB, Takeuchi M and Kazarosyan M. Serum Thyroglobulin Autoantibodies: Prevalence, influence on serum thyroglobulin measurement and prognostic significance in patients with differentiated thyroid carcinoma. J Clin Endocrinol Metab 1998;83:1121-7.
44. Kung AWC, Lau KS and Kohn LD. Epitope mapping of TSH Receptor-blocking antibodies in Graves’ disease that appear during pregnancy. J Clin Endocrinol Metab 2001; 86:3647-53.
45. Gupta MK. Thyrotropin-receptor antibodies in thyroid diseases: advances in detection techniques and clinical application. Clin Chem Acta 2000; 293:1-29.
46. Schott M, Feldkamp J, Bathan C, Fritzen R, Scherbaum WA and Seissler J. Detecting TSH-Receptor antibodies with the recombinant TBII assay: Technical and Clinical evaluation. 32 2000;:429-35.
47. Spencer CA, LoPresti JS, Fatemi S and Nicoloff JT. Detection of residual and recurrent differentiated thyroid carcinoma by serum Tg measurement, Thyroid 1999;9:435-41.
48. Massart C and Maugendre D. Importance of the detection method for thyroglobulin antibodies for the validity of thyroglobulin measurements in sera from patients with Graves’ disease. Clin Chem 2002; 48:102-7.
49. Bugalho MJ, Domingues RS, Pinto AC, Garrao A, Catarino AL, Ferreira T, Limbert E and Sobrinho L. Detection of thyroglobulin mRNA transcripts in peripheral blood of individuals with and without thyroid glands: evidence for thyroglobulin expression by blood cells. Eur J Endocrinol 2001; 145:409- 13.
50. Engelbach M, Gorges R, Forst T, Pfutzner A, Dawood R, Heerdt S, Kunt T, Bockisch A and Beyer J. Improved diagnostic methods in the follow-up of medullary thyroid carcinoma by highly specific calcitonin measurements. J Clin Endocrinol Metab 2000; 85:1890-4.
51. Vieira AEF, Mello MP, Elias L LK et al. Molecular and biochemical screening for the diagnosis and management of medullary thyroid carcinoma in multiple endocrine neoplasia Type 2A. Horm Metab Res 2002; 34:202-651.
52. Με την ευγενική παραχώρηση της Roche Diagnostics Hellas.
Created: November 02, 2014
Last update: November 02, 2014

