Θεοδοσία Ζεγκινιάδου, Περσεφόνη – Δήμητρα Κανταρτζή
Μονάδα Ενδοκρινολογίας Αναπαραγωγής, Α’ Μαιευτική – Γυναικολογική Κλινική ΑΠΘ
1. Σπερμοδιάγραμμα
Η διερεύνηση της ανδρικής υπογονιμότητας περιλαμβάνει σειρά εργαστηριακών εξετάσεων, από τις οποίες σπουδαιότερη είναι το σπερμοδιάγραμμα. Ο όρος σπερμοδιάγραμμα έχει επικρατήσει στη ελληνική ορολογία, αν και θα ήταν πιο ακριβές να ονομάζεται εξέταση των χαρακτήρων ή των παραμέτρων του σπέρματος, αφού στην πραγματικότητα πρόκειται για ένα σύνολο υποεξετάσεων. Σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας (ΠΟΥ) το κλασικό σπερμοδιάγραμμα με ανάλυση των παραμέτρων του σπέρματος χρησιμοποιόντας οπτικό μικροσκόπιο με φακό αντίθεσης φάσης αποτελεί τη μέθοδο αναφοράς (1, 2) και υπερτερεί σε σχέση με τη χρήση αυτόματων αναλυτών. Ωστόσο η εκτίμηση των παραμέτρων του σπέρματος είναι υποκειμενική και εξαρτάται σε μεγάλο βαθμό από την εκπαίδευση και την εμπειρία του προσωπικού του εργαστηρίου. Γι αυτό και η σύγκριση αποτελεσμάτων που προέρχονται από διαφορετικά εργαστήρια είναι προβληματική. Προκειμένου να καθιερωθεί κοινός κώδικας αναφοράς και να τυποποιηθεί η μεθοδολογία στα ανδρολογικά εργαστήρια τόσο ο ΠΟΥ, όσο και η European Society of Human Reproduction and Embryology (ESHRE) έχουν προχωρήσει από ετών στην έκδοση εγχειριδίων με οδηγίες για τη διενέργεια των εξετάσεων του σπέρματος, τα οποία μάλιστα ανανεώνονται ανά διαστήματα με βάση τα βιβλιογραφικά δεδομένα (1, 2, 3). Παρόλα αυτά η εναρμόνιση της πρακτικής των περισσότερων εργαστηρίων με τις οδηγίες των εγχειριδίων ήταν και παραμένει φτωχή (4, 5).
1.1. Συλλογή του σπέρματος
Η λήψη του δείγματος του σπέρματος πρέπει να γίνεται μετά από περίοδο σεξουαλικής αποχής. Η διάρκεια της αποχής επηρεάζει τον όγκο του σπέρματος και την ποιότητά του και συστήνεται να κυμαίνεται από 2 ως 7 ημέρες (2, 6).
Πρόσφατη ασθένεια ιδιαίτερα εμπύρετη, καθώς και η συστηματική λήψη φαρμάκων είναι δυνατό να επηρεάσουν την ποιότητα του σπέρματος (2). Για το λόγο αυτό πρέπει να καταγράφονται και αν είναι δυνατό να αναβάλλεται η εξέταση μέχρι να ολοκληρωθεί ο συγκεκριμένος κύκλος της σπερματογένεσης, δηλαδή για 74 ημέρες.
Ιδανικά η λήψη του σπέρματος πρέπει να γίνεται σε ειδικό δωμάτιο εξοπλισμένο με οπτικοακουστικό υλικό εντός του ανδρολογικού εργαστηρίου προκειμένου να αποφεύγεται αφενός τυχόν καθυστέρηση στη εξέταση, αφεταίρου η αρνητική επίδραση του ψύχους, που ελαττώνει την κινητικότητα των σπερματοζωαρίων. Από την άλλη πλευρά ο βαθμός της σεξουαλικής διέγερσης, που εκφράζεται ως δυσκολία και καθυστέρηση στην εκσπερμάτιση, επίσης επηρεάζει σημαντικά την ποιότητα του σπέρματος (7). Επομένως δεν απαγορεύεται να γίνει η λήψη στο σπίτι εφόσον το δείγμα φθάσει εγκαίρως στο εργαστήριο προστατευμένο από την επίδραση του ψύχους. Σε κάθε περίπτωση η λήψη πρέπει να γίνεται με αυνανισμό και όχι με διακεκομμένη συνουσία.
Είναι σημαντικό να τονιστεί ότι η συλλογή της εκσπερμάτισης πρέπει να είναι πλήρης. Όλη η ποσότητα του σπέρματος πρέπει να συλλέγεται εντός του δοχείου συλλογής, το οποίο πρέπει να είναι μη τοξικό για τα σπερματοζωάρια. Ιδιαίτερα το πρώτο κλάσμα της εκσπερμάτισης είναι πολύ πλούσιο όσον αφορά τον αριθμό και την κινητικότητα των σπερματοζωαρίων και τυχόν απώλειά του επηρεάζει σημαντικά το αποτέλεσμα της εξέτασης. Για το λόγο αυτό πρέπει οπωσδήποτε να καταγράφεται και να επαναλαμβάνεται η εξέταση (2, 6, 8).
Παρόλο που κάποιοι συγγραφείς υποστηρίζουν ότι η εξέταση ενός δείγματος σπέρματος είναι αρκετή (9), η πραγματικότητα είναι ότι παρατηρείται μεγάλη διακύμανση στις παραμέτρους του σπέρματος στον ίδιο άνδρα κατά διαστήματα, η οποία οφείλεται σε παράγοντες που δεν είναι δυνατό να ελεγχθούν (10, 11) (Εικόνα 1, WHO). Επομένως είναι απαραίτητη η εξέταση τουλάχιστον δύο ή ακόμη και τριών δειγμάτων σπέρματος για να έχουμε ολοκληρωμένη εικόνα.
1.2. Αρχική μακροσκοπική εξέταση του σπέρματος
Η εξέταση του σπέρματος πρέπει να ξεκινά όσο το δυνατό νωρίτερα κατά προτίμηση εντός 30 λεπτών, αλλά το αργότερο εντός μίας ώρας από την εκσπερμάτιση. Στο μεταξύ το δείγμα μπορεί να διατηρείται σε θερμοκρασία δωματίου (20 oC – 37 oC), είναι όμως προτιμότερο να τοποθετείται σε επωαστικό κλίβανο στους 37oC, όπου διατηρείται η κινητικότητα των σπερματοζωαρίων.
1.2.1. Ρευστοποίηση
Αμέσως μετά την εκσπερμάτιση το δείγμα έχει τη μορφή ζελατινώδους μάζας και παρουσιάζει μεγάλη ετερογένεια. Μέσα σε λίγα λεπτά αρχίζει η ρευστοποίηση, η οποία συνήθως ολοκληρώνεται εντός 15 – 20 λεπτών, μπορεί όμως να χρειαστεί μέχρι και μία ώρα (2). Αν μετά την πρώτη ώρα δεν έχει ολοκληρωθεί η ρευστοποίηση και παραμένουν αρευστοποίητα τεμάχια, το γεγονός πρέπει να καταγράφεται. Μετά τη ρευστοποίηση το δείγμα εμφανίζει ομοιογένεια, αν και η παρουσία μικρών ζελατινωδών σωματιδίων δε φαίνεται να έχει κλινική σημασία (2). Σε περίπτωση που η λήψη γίνεται στο σπίτι συνήθως το δείγμα έχει ρευστοποιηθεί μέχρι να παραληφθεί από το εργαστήριο.
1.2.2. Χροιά
Φυσιολογικά η χροιά του ρευστοποιημένου σπέρματος είναι γκρι-οπαλίζουσα (2). Λευκωπή χροιά μπορεί να σημαίνει παρουσία πυοσφαιρίων (πυοσπερμία) ή απλά μεγάλο αριθμό σπερματοζωαρίων. Ερυθρόφαιη χροιά είναι ενδεικτική παρουσίας αιμοσφαιρίνης ή ερυθρών αιμοσφαιρίων (αιμοσπερμία). Κιτρινωπή χροιά και άσχημη οσμή ενδεχομένως υποδηλώνουν λοίμωξη (6).
1.2.3. Γλοιότητα
Ο έλεγχος της γλοιότητας γίνεται μετά τη ρευστοποίηση του δείγματος. Για το σκοπό αυτό μπορεί να χρησιμοποιηθεί ευρύστομη πλαστική πιπέτα μιας χρήσεως οπότε μετά από αναρρόφηση αφήνεται να πέσει το δείγμα με τη δύναμη της βαρύτητας. Φυσιολογικά το δείγμα πέφτει σε ξεχωριστές σταγόνες. Η γλοιότητα θεωρείται αυξημένη, όταν κατά την πτώση σχηματίζεται νήμα μήκους μεγαλύτερου από 2 cm (2). Εναλλακτικά μπορεί να χρησιμοποιηθεί γυάλινη ράβδος που εμβαπτίζεται στο δείγμα. Ο βαθμός της αύξησης της γλοιότητας καταγράφεται με σταυρούς .
1.2.4. Όγκος του δείγματος
Ο κύριος όγκος της εκσπερμάτισης αποτελείται από τις εκκρίσεις του προστάτη αδένα και των σπερματικών σωληναρίων και κατά δεύτερο λόγο από τις εκκρίσεις της επιδιδυμίδας και των βολβουρηθραίων αδένων. Ο προσδιορισμός του όγκου προτείνεται να γίνεται με ζύγιση του δοχείου πριν και μετά την εκσπερμάτιση (2). Σε αυτήν την περίπτωση γίνεται η παραδοχή ότι η πυκνότητα του σπέρματος είναι 1 g/mL (2). Στην πραγματικότητα βέβαια η πυκνότητα κυμαίνεται από 1,043 g/mL ως 1,102 g/mL (12). Εναλλακτικά μπορεί μετρηθεί απευθείας ο όγκος, αν η εκσπερμάτιση γίνει σε ειδικό γυάλινο ογκομετρικό δοχείο. Κατώτερο όριο αναφοράς για τον όγκο του σπέρματος σύμφωνα με το εγχειρίδιο του ΠΟΥ 2010 ορίζεται το 1,5 mL, ενώ δεν ορίζεται ανώτερο όριο. Χαμηλός όγκος δείγματος μπορεί να σημαίνει απόφραξη των εκφορητικών οδών του σπέρματος, συγγενή απλασία των εκσπερματιστικών πόρων (13, 14), μερική παλίνδρομη εκσπερμάτιση, ανδρογονική ανεπάρκεια, αλλά μπορεί να οφείλεται και σε απώλεια μέρους του δείγματος.
1.2.5. pH
Το pH του δείγματος αντανακλά την ισορροπία μεταξύ των εκκρίσεων των επικουρικών γεννητικών αδένων και κυρίως μεταξύ της όξινης προστατικής έκκρισης και της αλκαλικής έκκρισης των σπερματικών σωληναρίων. Η μέτρηση του pH γίνεται μετά τη ρευστοποίηση. Τα βιβλιογραφικά δεδομένα είναι φτωχά, ωστόσο κατώτερο όριο αναφοράς θεωρείται τιμή pH 7.2 (2). Τιμή pH μικρότερη από 7 με μικρό όγκο δείγματος και χαμηλό αριθμό σπερματοζωαρίων μπορεί να σημαίνει απόφραξη των εκφορητικών οδών του σπέρματος ή συγγενή απλασία των εκσπερματιστικών πόρων (13, 14). Το pH του δείγματος αυξάνει με την πάροδο του χρόνου γι αυτό η μέτρηση πρέπει να γίνεται εντός της πρώτης ώρας.
1.3. Αρχική μικροσκοπική εξέταση
Η αρχική μικροσκοπική εξέταση ξεκινά αμέσως μετά τη ρευστοποίηση και πραγματοποιείται μετά από καλή ανάμειξη και χωρίς προηγούμενη αραίωση του δείγματος. Απαραίτητη είναι η χρήση μικροσκοπίου αντίθεσης φάσης, καθώς τα σπερματοζωάρια δεν είναι καλά ορατά με το κοινό οπτικό μικροσκόπιο, διότι εμφανίζουν πολύ μικρή αντίθεση με το φόντο. Η αρχική μικροσκοπική εξέταση είναι χρήσιμη για:
- τη διαπίστωση της παρουσίας συσσωρεύσεων ή συγκολλήσεων
- τη διαπίστωση της παρουσίας άλλων κυττάρων πλην των σπερματοζωαρίων
- την εκτίμηση της αραίωσης που πρέπει να πραγματοποιηθεί για τον ακριβή προσδιορισμό της συγκέντρωσης των σπερματοζωαρίων
Οι συσσωρεύσεις είναι σχηματισμοί ποικίλου μεγέθους και μπορεί να περιλαμβάνουν κινητά ή/και ακίνητα σπερματοζωάρια, κυτταρικά υπολλείματα, τμήματα βλέννης, επιθηλιακά ή άλλα κύτταρα. Ο όρος συγκόλληση αναφέρεται αποκλειστικά σε κινητά σπερματοζωάρια που είναι ενωμένα μεταξύ τους με την κεφαλή, το μέσο τμήμα ή την ουρά τους και κινούνται μαζί. Υπάρχουν διάφορα είδη συγκόλλησης ανάλογα με τα τμήματα των σπερματοζωαρίων που ενώνονται, καθώς και διαφορετικοί βαθμοί ανάλογα με τον αριθμό των σπερματοζωαρίων που περιλαμβάνουν οι συγκολλήσεις. Οι συσσωρεύσεις δεν αξιολογούνται κλινικά εκτός αν είναι πολλές και μεγάλες. Η παρουσία συγκολλήσεων ωστόσο μπορεί να σημαίνει την παρουσία αντισπερμικών αντισωμάτων και πρέπει να εξετάζεται περαιτέρω.
Εκτός από τα σπερματοζωάρια κατά τη μικροσκοπική εξέταση μπορεί να διαπιστωθεί η παρουσία επιθηλιακών κυττάρων του ουρογεννητικού συστήματος, καθώς και στρογγυλών κυττάρων. Ο όρος στρογγυλά κύτταρα περιλαμβάνει τα πυοσφαίρια και τα πρόδρομα κύτταρα της σπερματικής σειράς, τα οποία μπορούν να διακριθούν μεταξύ τους μόνο με ειδική χρώση ή με βάση τις αντιγονικές τους ιδιότητες.
1.4. Κινητικότητα των σπερματοζωαρίων
Η κινητικότητα των σπερματοζωαρίων ελαττώνεται με την πάροδο του χρόνου μετά την εκσπερμάτιση και εξαρτάται από τη θερμοκρασία. Είναι πιο ζωηρή στους 37oC από ότι σε χαμηλότερες θερμοκρασίες. Η εξέταση της κινητικότητας πρέπει να εκτελείται αμέσως μετά τη ρευστοποίηση του δείγματος και οπωσδήποτε εντός της πρώτης ώρας. Επανειλημμένοι έλεγχοι της κινητικότητας μετά την πρώτη ώρα δεν προτείνονται. Για την εκτίμηση της κινητικότητας είναι απαραίτητη η χρήση μικροσκοπίου αντίθεσης φάσης. Προκειμένου να διατηρηθεί η θερμοκρασία υπάρχουν μικροσκόπια με θερμαινόμενη τράπεζα, που λόγω κόστους δεν χρησιμοποιούνται συνήθως, υπάρχουν όμως ειδικές θερμαινόμενες πλάκες που τοποθετούνται στο μικροσκόπιο, οι οποίες διατηρούν την θερμοκρασία και επιτρέπουν αξιόπιστη μέτρηση. Ωστόσο, αν και δεν εξασφαλίζουν απόλυτα την ενδεδειγμένη θερμοκρασία, είναι σύνηθες να χρησιμοποιούνται προθερμασμένες στον κλίβανο αντικειμενοφόρες πλάκες και καλυπτρίδες. Ανάλογα με το μέγεθος της καλυπτρίδας κατάλληλος όγκος καλά αναμεμειγμένου σπέρματος τοποθετείται σε αντικειμενοφόρο πλάκα, έτσι ώστε η κίνηση των σπερματοζωαρίων να είναι ανεμπόδιστη, αλλά να επιτρέπεται και η εστίαση. Τουλάχιστον 200 σπερματοζωάρια πρέπει να εκτιμώνται σε τουλάχιστον πέντε διαφορετικά οπτικά πεδία και η μέτρηση να επαναλαμβάνεται σε δεύτερη σταγόνα σπέρματος. Είναι εξαιρετικά σημαντικό η εκτίμηση της κινητικότητας να γίνεται ταχύτατα.
Η κινητικότητα σύμφωνα με το νεώτερο εγχειρίδιο του Π.Ο.Υ διακρίνεται σε τρεις κατηγορίες (2):
- Προωθητική κινητικότητα, η οποία αναφέρεται σε όλα τα σπερματοζωάρια που κινούνται στο χώρο είτε ευθύγραμμα είτε σε μεγάλους κύκλους ανεξάρτητα από την ταχύτητά τους.
- Μη προωθητική κινητικότητα,η οποία αναφέρεται σε σπερματοζωάρια που εμφανίζουν κάποια μορφή κινητικότητας, αλλά δεν προχωρούν στο χώρο, για παράδειγμα κίνηση μόνο της ουράς ή επιτόπια μικρή κίνηση ή κίνηση σε μικρούς κύκλους.
- Ακινητα σπερματοζωάρια, δηλαδή απουσία οποιασδήποτε κίνησης.
Η κινητικότητα κάθε κατηγορίας εκφράζεται σε εκατοστιαία αναλογία με ακέραιο αριθμό και κατώτερο όριο σύμφωνα με το νεώτερο εγχειρίδιο του Π.Ο.Υ θεωρείται για την προωθητική κινητικότητα το 32% και για την ολική κινητικότητα (προωθητική και μη προωθητική) το 40% (2). Σύμφωνα με το προηγούμενο εγχειρίδιο του ΠΟΥ (1) η κινητικότητα διακρινόταν σε τέσσερεις κατηγορίες, καθώς η προωθητική κινητικότητα διακρινόταν σε ζωηρή, όταν η ταχύτητα του σπερματοζωαρίου ήταν μεγαλύτερη από 25μm/sec και νωθρή, όταν ήταν μικρότερη από 25 μm/sec. Η διάκριση ανάμεσα στους δύο τύπους προωθητικής κινητικότητας είναι δύσκολη και για αυτό τον λόγο το νέο εγχειρίδιο του ΠΟΥ πρότεινε την διάκριση της κινητικότητας σε τρείς μόνο κατηγορίες. Είναι όμως γνωστό εδώ και χρόνια ότι τα σπερματοζωάρια με ζωηρή προωθητική κινητικότητα συνδέονται άμεσα τόσο με τη δυνατότητα φυσικής σύλληψης όσο και με το αποτέλεσμα της εξωσωματικής γονιμοποίησης, γαιυτό η κατηγοριοποίηση της κινητικότητας σε τέσσερεις τύπους έχει κλινική σημασία και πρέπει να προτιμάται. Η τιμή αναφοράς είναι 50% για τη συνολική προωθητική κινητικότητα (ζωηρή και νωθρή).
Είναι σημαντικό να τονιστεί ότι μόνο ακέραια σπερματοζωάρια πρέπει να εκτιμώνται. Τα λεγόμενα σπερματοζωάρια με κεφαλή «δίκην καρφίδος» (pinheads) είναι σπερματοζωάρια χωρίς κεφαλή και γενετικό υλικό, τα οποία παρουσιάζουν ταχύτατη κίνηση, αλλά δεν πρέπει να υπολογίζονται στην εκτίμηση της κινητικότητας, της συγκέντρωσης και της μορφολογίας των σπερματοζωαρίων.
Η κινητικότητα μπορεί να μετρηθεί επίσης με αυτόματο αναλυτή (CASA-Computer Aided Sperm Analyzer). Η μέτρηση με τον αναλυτή παρουσιάζει μεγαλύτερη επαναληψιμότητα στην μέτρηση των κινούμενων σπερματοζωαρίων από το ανθρώπινο μάτι και επίσης μπορούν να μετρηθούν παράμετροι όπως η μέση ταχύτητα της ελικοειδούς πορείας (VCL-curvilinear velocity), η μέση ταχύτητα της ευθύγραμμης κίνησης (VSL-straight line velocity), η μέση προωθητική ταχύτητα (VAP-average path velocity) και το εύρος της προς τα πλάγια κίνησης των κεφαλών (ALH-amplitude of lateral head displacement) (6), που δεν μπορούν να μετρηθούν με το μάτι. Η δημιουργία των αυτόματων αναλυτών όμως δεν βρήκε την θέση της στην ρουτίνα του ανδρολογικού εργαστηρίου, όχι λόγω του υψηλού κόστους αλλά λόγω προβλημάτων στην μέτρηση.
Η παρουσία μεμονωμένης χαμηλής κινητικότητας με φυσιολογικές τις υπόλοιπες παραμέτρους του σπέρματος αναφέρεται ως ασθενοσπερμία.
1.5. Ζωτικότητα των σπερματοζωαρίων
Η εκτίμηση της ζωτικότητας των σπερματοζωαρίων μπορεί να γίνεται σε όλα τα δείγματα, αλλά είναι ιδιαίτερα σημαντική όταν η προωθητική κινητικότητα είναι μικρότερη του 40% (2). Η αξία της εξέτασης έγκειται στο ότι μπορεί να διακρίνει αν τα ακίνητα σπερματοζωάρια είναι ζωντανά κύτταρα που έχουν χάσει την ικανότητα κίνησης ή είναι νεκρά. Η εξέταση της ζωτικότητας πρέπει να γίνεται εντός της πρώτης ώρας, στηρίζεται δε στο γεγονός ότι τα ζωντανά κύτταρα έχουν ακέραιη κυτταροπλασματική μεμβράνη. Συχνότερα χρησιμοποιείται η μέθοδος της χρωστικής εωσίνης, η οποία στηρίζεται στο γεγονός ότι η κυτταροπλασματική μεμβράνη των ζωντανών σπερματοζωαρίων εμποδίζει την είσοδο της χρωστικής, ενώ αυτό δε συμβαίνει στα νεκρά σπερματοζωάρια με αποτέλεσμα η κεφαλή τους να παίρνει ρόδινη χροιά. Η προσθήκη νιγκροσίνης δημιουργεί μαύρο φόντο και διευκολύνει τη διάκριση μεταξύ ρόδινων (νεκρών) και λευκών (ζωντανών) κεφαλών. Εναλλακτική μέθοδος είναι το υποωσμωτικό τεστ (HOS – Hypoosmotic Swelling test) που στηρίζεται στο ότι η ακέραιη μεμβράνη των ζωντανών σπερματοζωαρίων επιτρέπει την είσοδο του νερού και διογκώνεται, αντίθετα με ότι συμβαίνει στα νεκρά σπερματοζωάρια. Είναι σημαντικό ότι με αυτό το τεστ δεν καταστρέφονται τα σπερματοζωάρια και μπορούν να χρησιμοποιηθούν για ενδοωαριακή έγχυση (ICSI) (6, 8).
Τιμή αναφοράς για τη ζωτικότητα θεωρείται ποσοστό ζωντανών σπερματοζωαρίων ίσο ή μεγαλύτερο από 58% (2). Η παρουσία μεγάλου ποσοστού ακίνητων ζωντανών σπερματοζωαρίων είναι ενδεικτική της παρουσίας δομικών ή λειτουργικών ανωμαλιών του μέσου τμήματος και της ουράς (16), ενώ η παρουσία μεγάλου ποσοστού ακίνητων νεκρών σπερματοζωαρίων (νεκροζωοσπερμία) μπορεί να υποδηλώνει δυσλειτουργία της επιδιδυμίδας (17, 18).
Επιπλέον η εξέταση της ζωτικότητας χρησιμοποιείται για τον έλεγχο της ορθής εκτίμησης της κινητικότητας, αφού το ποσοστό των νεκρών σπερματοζωαρίων δεν μπορεί να υπερβαίνει το ποσοστό των ακίνητων.
1.6. Αριθμός των σπερματοζωαρίων
Στην έκθεση του αποτελέσματος του σπερμοδιαγράμματος ο αριθμός των σπερματοζωαρίων εκφράζεται με δύο παραμέτρους: τη συγκέντρωση (10^6/mL) και το συνολικό αριθμό των σπερματοζωαρίων στο δείγμα (10^6). Η παράμετρος που προσδιορίζεται άμεσα κατά τη διενέργεια του σπερμοδιαγράμματος είναι η συγκέντρωση. Ωστόσο η συγκέντρωση είναι συνάρτηση τόσο του αριθμού των σπερματοζωαρίων που παράγονται από τους όρχεις, όσο και του όγκου του σπερματικού υγρού που παράγεται από τους επικουρικούς γεννητικούς αδένες (19). Επομένως πιο ακριβής δείκτης της ορχικής παραγωγής είναι ο ολικός αριθμός των σπερματοζωαρίων στο δείγμα (20), ο οποίος συσχετίζεται και με τον όγκο των όρχεων (21, 22), εφόσον βέβαια δεν υπάρχει απόφραξη των εκφορητικών οδών. Υπολογίζεται με πολλαπλασιασμό της συγκέντρωσης των σπερματοζωαρίων επί τον όγκο του δείγματος.
Για τον προσδιορισμό της συγκέντρωσης απαιτείται κατάλληλη αραίωση του σπέρματος με ειδικό διάλυμα. Ο βαθμός της αραίωσης που πρέπει να γίνει, υπολογίζεται με βάση τον αριθμό των σπερματοζωαρίων που παρατηρούνται κ.ο.π. στην αρχική μικροσκόπηση. Στόχος είναι να μετρηθεί ικανός αριθμός σπερματοζωαρίων, ώστε να ελαχιστοποιηθεί η πιθανότητα τυχαίου λάθους (2). Επιπλέον για να μειωθεί η πιθανότητα λάθους δημιουργούνται δύο αραιωμένα δείγματα προς μέτρηση. Απαραίτητη προυπόθεση είναι η χρησιμοποίηση πιπέτας θετικής αναρρόφησης (2). Οι κοινές πιπέτες προορίζονται για υγρά με γλοιότητα παρόμοια με αυτή του νερού, ενώ είναι ακατάλληλες για το σπέρμα που έχει υψηλότερη γλοιότητα, αφού σε αυτήν την περίπτωση αναρροφούν μικρότερο όγκο και επομένως δεν είναι ακριβείς. Το μικροσκόπιο αντίθεσης φάσης είναι απαραίτητο για τη μέτρηση. Επίσης απαραίτητη είναι μία κυτταρομετρική πλάκα.
Από τον ΠΟΥ (2) προτείνεται η βελτιωμένη πλάκα Νeubauer, η οποία έχει δύο ξεχωριστούς θαλάμους στις δύο πλευρές της. Σε κάθε θάλαμο τοποθετείται ένα από τα δύο αραιωμένα διαλύματα προκειμένου να γίνει σύγκριση του αριθμού των σπερματοζωαρίων που μετρώνται σε κάθε πλευρά. Μόνο ακέραια σπερματοζωάρια με κεφαλή και ουρά προσμετρούνται.. Από το άθροισμα των σπερματοζωαρίων στους δύο θαλάμους με κατάλληλο υπολογισμό προκύπτει η συγκέντρωση των σπερματοζωαρίων στο δείγμα. Ακόμη και σήμερα είναι αρκετά διαδεδομένη η χρήση και άλλων κυτταρομετρικών πλακών, όπως η Makler, η οποία είναι εύκολη στη χρήση και δεν απαιτεί αραίωση. Ωστόσο η Makler παρουσιάζει μη αποδεκτή ακρίβεια και επαναληψιμότητα (1) με αποτέλεσμα να υποεκτιμά ή να υπερεκτιμά τη συγκέντρωση των σπερματοζωαρίων (23, 24) γι αυτό και επιβάλλεται να αντικατασταθεί από την πλάκα Neubauer.
Κατώτερο όριο για τη συγκέντρωση σύμφωνα με το νέο εγχειρίδιο του Π.Ο.Υ (2) ορίστηκαν τα 15×10^6/mL και για το συνολικό αριθμό σπερματοζωαρίων τα 39×10^6. Τα αντίστοιχα προηγούμενα όρια ήταν 20×10^6/mL και 40×10^6 (1).
Σε περίπτωση που στην αρχική μικροσκοπική εξέταση ο αριθμός των σπερματοζωαρίων είναι πολύ μικρός και επειδή η πιθανότητα λάθους σε αυτή την περίπτωση είναι σημαντική, τότε είναι αρκετό να αναφέρεται στην έκθεση του αποτελέσματος ότι η συγκέντρωση είναι < 2×106 και επιπλέον να καταγράφεται αν παρατηρήθηκαν κινητά σπερματοζωάρια (2). Αν απαιτείται μεγαλύτερη λεπτομέρεια, τότε μπορεί να γίνει αραίωση 1:1 του δείγματος και να προσδιοριστεί η συγκέντρωση σε πλάκα Neubauer. Στη μέτρηση αυτή όμως η πιθανότητα σφάλματος είναι μεγάλη. Αν μετρηθούν λιγότερα από 25 σπερματοζωάρια σε κάθε θάλαμο, σημαίνει ότι η συγκέντρωση είναι < 56.000/mL και έτσι πρέπει να καταγράφεται (2).
Σε περίπτωση που στην αρχική μικροσκοπική εξέταση δεν παρατηρούνται καθόλου σπερματοζωάρια, μπαίνει η υποψία της αζωοσπερμίας. Ποσότητα δείγματος 1 mL φυγοκεντρείται στα 3000g για 15 λεπτά και το ίζημα εξετάζεται με μικροσκόπιο αντίθεσης φάσης. Μία σταγόνα ιζήματος τοποθετείται σε αντικειμενοφόρο πλάκα και καλύπτεται με καλυπτρίδα. Όλη η έκταση της καλυπτρίδας πρέπει να εξεταστεί, δηλαδή περίπου 484 πεδία. Η διαδικασία επαναλαμβάνεται με δεύτερη σταγόνα ιζήματος. Αν δε βρεθούν σπερματοζωάρια στο ίζημα, μπορεί να χρησιμοποιηθεί ο όρος αζωοσπερμία. Ωστόσο η μη ανεύρεση σπερματοζωαρίων στο τμήμα του ιζήματος που εξετάστηκε δε σημαίνει ότι δεν υπάρχουν στο υπόλοιπο δείγμα (2). Αν στο ίζημα βρεθούν σπερματοζωάρια, τότε χρησιμοποιείται ο όρος κρυπτοζωοσπερμία και σε αυτήν την περίπτωση πρέπει να καταγράφεται τυχόν κινητικότητά τους (2).
1.7. Μέτρηση στρογγυλών κυττάρων
Στην πλάκα Neubauer μετρώνται και τα λεγόμενα στρογγυλά κύτταρα. Αυτά είναι είτε πρόδρομα κύτταρα της σπερματικής σειράς είτε λευκά αιμοσφαίρια και δεν μπορούν να διακριθούν μεταξύ τους χωρίς κατάλληλη χρώση. Τα λευκά είναι κυρίως ουδετερόφιλα πολυμορφοπύρηνα (πυοσφαίρια). Τα πρόδρομα κύτταρα της σπερματικής σειράς είναι κυρίως στρογγυλές σπερματίδες, σπερματοκύτταρα και σπάνια σπερματογόνια. Η παρουσία μεγάλου αριθμού λευκών αιμοσφαιρίων είναι ενδεικτική λοίμωξης των επικουρικών γεννητικών αδένων και έχει δυσμενή επίπτωση στην κινητικότητα, στην ακεραιότητα του DNA και γενικά στην ποιότητα του σπέρματος (25). H παρουσία μεγάλου αριθμού πρόδρομων κυττάρων της σπερματογένεσης μπορεί να υποδηλώνει ορχική βλάβη (2).
Εκτός από την πλάκα Neubauer ο αριθμός τους μπορεί να προσδιοριστεί έμμεσα κατά την εξέταση της μορφολογίας. Για το σκοπό αυτό καταγράφονται τα στρογγυλά κύτταρα που αντιστοιχούν σε ορισμένο αριθμό σπερματοζωαρίων και εφόσον είναι γνωστή η συγκέντρωση των σπερματοζωαρίων με τη μέθοδο των τριών υπολογίζεται η συγκέντρωση των στρογγυλών κυττάρων (2).
Αν η συγκέντρωση των στρογγυλών κυττάρων εκτιμάται ότι ξεπερνά το 1×10^6/mL πρέπει να προχωρήσουμε στη διάκρισή τους. Κυρίως χρησιμοποιείται η μέθοδος της υπεροξειδάσης (2, 26). Πρόκειται για κυτταροχημική μέθοδο που στηρίζεται στην ανίχνευση της υπεροξειδάσης, ενός ενζύμου που χαρακτηρίζει τα πολυμορφοπύρηνα και τα διακρίνει τόσο από τα άλλα κύτταρα της λευκής σειράς όσο και από τα κύτταρα της σπερματικής σειράς. Τα πολυμορφοπύρηνα χρωματίζονται ερυθρόφαια, ενώ τα κύτταρα της σπερματικής σειράς δε χρωματίζονται. H μέτρηση γίνεται σε πλάκα Neubauer και πρέπει το αποτέλεσμα να αναφέρεται σε 10^6/mL. Θεωρείται ότι συγκέντρωση πολυμορφοπύρηνων > 1×10^6/mL είναι ενδεικτική λοίμωξης (2).
Η διάκριση των στρογγυλών κυττάρων μπορεί να γίνει εναλλακτικά με τη χρήση μονοκλωνικών αντισώματων που αναγνωρίζουν ειδικά επιφανειακά αντιγόνα, όπως για παραδειγμα το CD45 που χαρακτηρίζει τα λευκά αιμοσφαίρια. Η μέθοδος παρουσιάζει μεγάλη ακρίβεια, αλλά δεν μπορεί να καθιερωθεί ως εξέταση ρουτίνας λόγω του υψηλού της κόστους.
1.8. Μορφολογία των σπερματοζωαρίων
Η εκτίμηση της μορφολογίας των σπερματοζωαρίων δεν είναι δυνατό να γίνει σε νωπό παρασκεύασμα. Είναι απαραίτητο να γίνει μονιμοποίηση του επιχρίσματος του σπέρματος και κατόπιν χρώση αυτού με ειδικές χρωστικές. Από τον ΠΟΥ προτείνεται η τροποποιημένη χρώση κατά Παπανικολάου, αλλά και η χρώση Shorr (2). Απαιτείται οπτικό μικροσκόπιο και η παρατήρηση γίνεται σε μεγέθυνση x1000 με καταδυτικό φακό. Τουλάχιστον 200 σπερματοζωάρια πρέπει να καταγράφονται και το αποτέλεσμα να επιβεβαιώνεται σε δεύτερο επίχρισμα.
Η καθιέρωση κριτηρίων φυσιολογικής μορφολογίας των σπερματοζωαρίων καθώς και τιμών αναφοράς είναι περίπλοκη υπόθεση. Ιδανικά ως φυσιολογικό πρέπει να καταγράφεται το σπερματοζωάριο που έχει δυνατότητα γονιμοποίησης. Για το σκοπό αυτό οι έρευνες στηρίχτηκαν σε σπερματοζωάρια που απομονώθηκαν από την τραχηλική βλέννη κατόπιν σεξουαλικής επαφής (27, 28) και επίσης σε σπερματοζωάρια προσκολλημένα στη διαφανή ζώνη (29, 30) θεωρώντας ότι αυτά προκρίθηκαν στον αγώνα για τη γονιμοποίηση του ωαρίου κατόπιν φυσικής επιλογής. Ετσι έχουν καθιερωθεί τα τελευταία χρόνια αυστηρά κριτήρια μορφολογίας (28, 31, 32), τα οποία έχει υιοθετήσει ο ΠΟΥ.
Τα σπερματοζωάρια αποτελούνται από κεφαλή, μέσο τμήμα και ουρά. Για να χαρακτηριστεί ένα σπερματοζωάριο ως φυσιολογικό πρέπει να έχει φυσιολογικά όλα τα τμήματά του. Κάθε οριακή μορφή θεωρείται παθολογική. Η κεφαλή πρέπει να έχει σχήμα ωοειδές, ομαλό περίγραμμα και συγκεκριμένες διαστάσεις. Η ακροσωμιακή περιοχή πρέπει να ορίζεται σαφώς και να καταλαμβάνει 40 – 70% της έκτασης της κεφαλής (2). Στην ακροσωμιακή περιοχή επιτέπεται να υπάρχουν μέχρι δύο μικρά κενοτόπια, ενώ δεν επιτρέπονται κενοτόπια στην περιοχή μετά το ακρόσωμα (2). Το μέσο τμήμα πρέπει να είναι ομαλό με ορισμένο πάχος και μήκος όσο περίπου η κεφαλή. Ο επιμήκης άξονάς του πρέπει να αποτελεί συνέχεια του επιμήκους άξονα της κεφαλής. Το κυτταροπλασματικό υπόλλειμα, όταν υπάρχει, θεωρείται παθολογικό αν ξεπερνά το 1/3 του μεγέθους της κεφαλής. Η ουρά πρέπει να είναι λεπτότερη από το μέσο τμήμα, ομαλή και να έχει μήκος περίπου 45 μm, δηλαδή σχεδόν 10 φορές το μήκος της κεφαλής. Δεν επιτρέπεται να εμφανίζει κάμψη μεγαλύτερη των 90o, γιατί είναι ενδεικτική θραύσης (2).
Από τον ΠΟΥ (2) συστήνεται απλή καταγραφή του ποσοστού των φυσιολογικών σπερματοζωαρίων με προαιρετική καταγραφή του ή των τμημάτων κάθε σπερματοζωαρίου που εμφανίζουν ανωμαλία. Οι παρακάτω κατηγορίες ανωμαλιών πρέπει να σημειώνονται:
- Aνωμαλίες κεφαλής, που περιλαμβάνουν μεγάλη, μικρή, άμορφη, στρογγυλή, απιοειδή, επιμήκη, διπλή κεφαλή, με κενοτόπια, μικρή ή μεγάλη ακροσωμιακή περιοχή ή συνδυασμό αυτών.
- Aνωμαλίες μέσου τμήματος, που περιλαμβάνουν έκκεντρη έκφυση, κάμψη, θραύση, παχύ ή λεπτό μέσο τμήμα ή συνδυασμό αυτών.
- Kυτταροπλασματικό υπόλλειμα, όταν ξεπερνά το 1/3 του μεγέθους της κεφαλής.
- Aνωμαλίες της ουράς, που περιλαμβάνουν διπλή, κοντή, κομμένη, λεπτή, παχιά, περιελιγμένη ουρά, με κάμψη άνω των 90o ή συνδυασμό αυτών.
Κατώτερο όριο αναφοράς για τη μορφολογία θεωρείται το 4% (2). Πρέπει να τονιστεί ότι το άθροισμα των ανωμαλίων των επιμέρους τμημάτων (κεφαλής, μέσου τμήματος, ουράς, κυτταροπλασματικό υπόλλειμμα) ξεπερνούν το 100%, γιατί κάθε σπερματοζωάριο συνήθως εμφανίζει ανωμαλίες σε περισσότερα τμήματα. Οι επιμέρους ανωμαλίες κάθε τμήματος δεν αναφέρονται χωριστά, εκτός αν κάποια παρουσιάζεται σε > 20% των σπερματοζωαρίων. Χρήσιμοι για την εκτίμηση της μορφολογίας είναι και οι δείκτες πολλαπλών ανωμαλίων, όπως ο Τ.Ζ.Ι. (Teratozoospermia Index), οι οποίοι υπολογίζονται με κατάλληλους μαθηματικούς τύπους και εκφράζουν τον αριθμό των ανωμαλιών σε σχέση με τον αριθμό των ανώμαλων σπερματοζωαρίων (33).
Τα σπερματοζωάρια με φυσιολογική μορφολογία είναι αυτά που γονιμοποιούν το ωάριο και μελέτες έχουν συσχετίσει το ποσοστό των σπερματοζωαρίων με φυσιολογική μορφολογία με τη γονιμοποίηση in vivo και το θετικό αποτέλεσμα της υποβοηθούμενης αναπαραγωγής (31). Ενώ λοιπόν η εκτίμηση του ποσοστού των φυσιολογικών σπερματοζωαρίων είναι κλινικά σημαντική, πολλές πληροφορίες παίρνουμε και από τις ανώμαλες μορφές που υπάρχουν στο δείγμα του σπέρματος. Υπάρχουν περιπτώσεις στις οποίες οι μορφολογικές ανωμαλίες υποδηλώνουν γενετική ανωμαλία, όπως είναι η μικρο-στρογγυλοκεφαλία (34, 35) ή το σύνδρομο short tail (36 , 37).
Στον Πίνακα 1 αναγράφονται τα κατώτερα όρια αναφοράς για τις βασικές παραμέτρους του σπέρματος με βάση τα τελευταία δύο εγχειρίδια του ΠΟΥ.
1.9. Οι τιμές αναφοράς του σπερμοδιαγράμματος
Στην κλινική αξιολόγηση του ασθενούς πάντοτε σημαντικό ρόλο παίζουν οι εργαστηριακές εξετάσεις. Συνήθως εξετάζονται το αίμα και τα ούρα και σε αρκετές περιπτώσεις τα αποτελέσματα των εξετάσεων διαχωρίζουν τα υγιή άτομα από αυτά που νοσούν. Η τιμή λοιπόν κάθε εργαστηριακής εξέτασης συγκρίνεται με μια φυσιολογική τιμή ή, όπως έχει επικρατήσει να αποκαλείται τελευταία, τιμή αναφοράς. Η τιμή αναφοράς εκφράζει το εύρος των τιμών που παρουσιάζει η συγκεκριμένη παράμετρος στον υγιή πληθυσμό και οι τιμές αναφοράς πάντοτε βασίζονται σε συγκεκριμένα στατιστικά μοντέλα (38). Συνήθως για να καθοριστεί η τιμή αναφοράς χρησιμοποιείται ο μέσος όρος των τιμών που παρουσιάζονται στον υγιή πληθυσμό και η τυπική τους απόκλιση. Διαφορετικά, καταγράφονται οι τιμές της παραμέτρου του υγιούς πληθυσμού, και από την κανονική κατανομή (κατανομή Gauss) που δημιουργείται, εξαιρείται το 2,5% από κάθε άκρο.
Όπως είναι λοιπόν αναμενόμενο, και στις εξετάσεις σπέρματος υπάρχουν τιμές για σύγκριση και από τις πρώτες βιβλιογραφικές αναφορές, ο αριθμός, η κινητικότητα και η μορφολογία συγκρίνονται, η κάθε μία, με μια ορισμένη «τιμή αναφοράς». Οι τιμές αναφοράς όμως για τις παραμέτρους του σπερμοδιαγράμματος δεν βασίστηκαν, όπως γίνεται συνήθως, στον μέσο όρο των τιμών που παρουσιάζονται στο γενικό πληθυσμό. Για παράδειγμα, αρχικά ως «φυσιολογική τιμή» του αριθμού των σπερματοζωαρίων ορίστηκαν από τον MacLeod τα 60×10^6/ml, τιμή που προήλθε από μετρήσεις του αριθμού των σπερματοζωαρίων σε δείγματα φοιτητών Iατρικής, ενώ αργότερα ο ίδιος ο MacLeod άλλαξε το όριο αυτό στα 20×10^6/ml (39, 40, 41). Ο ΠΟΥ στο πρώτο εγχειρίδιο με θέμα τις εργαστηριακές εξετάσεις σπέρματος, που εκδόθηκε το 1980, όρισε σαν φυσιολογική τιμή για τον αριθμό των σπερματοζωαρίων τα 20 εκατ/ml και η τιμή αυτή διατηρήθηκε μέχρι και το 4ο εγχειρίδιο του ΠΟY.
Το 5ο εγχειρίδιο όμως, που εκδόθηκε το 2010, δεν χρησιμοποίησε τις ίδιες τιμές αναφοράς (42). Αντίθετα, ο ΠΟΥ, στην προσπάθεια να ορίσει με ακρίβεια πλέον τις τιμές αναφοράς των παραμέτρων του σπερμοδιαγράμματος, εκπόνισε μια λεπτομερή μελέτη, ώστε να καθοριστούν με όσο το δυνατόν αντικειμενικά κριτήρια, τα όρια για τη γονιμότητα του άνδρα. Είναι γνωστό ότι υπογόνιμο θεωρείται ένα ζευγάρι που δεν έχει επιτύχει σύλληψη μετά από 12 μήνες προσπάθειας με ελεύθερες επαφές (43). Ως TTP (Time-To-Pregnancy) ορίζεται ο χρόνος μέχρι την επίτευξη κύησης με ελεύθερες επαφές και το ΤΤΡ είναι καταξιωμένος δείκτης σε επιδημιολογικές μελέτες (44). Έτσι, σαν πληθυσμό αναφοράς γόνιμων ανδρών, η μελέτη χρησιμοποίησε άνδρες σε ζευγάρια που πέτυχαν εγκυμοσύνη σε διάστημα το πολύ 12 μηνών από την διακοπή της αντισύλληψης. Τα δεδομένα που χρησιμοποιήθηκαν προήρθαν από 1950 άνδρες, από 30 χώρες και τρεις ηπείρους και φυσικά, τα εργαστήρια από τα οποία προήρθαν οι μετρήσεις ήταν πιστοποιημένα τόσο για τον εσωτερικό όσο και για τον εξωτερικό ποιοτικό τους έλεγχο.
Όπως αναφέρθηκε, στις εξετάσεις κλινικής χημείας η φυσιολογική τιμή βασίζεται στην κατανομή Gauss, που παρουσιάζουν οι τιμές της παραμέτρου που εξετάζεται, εξαιρώντας από τα δύο άκρα το ποσοστό του 2,5%, γιατί τόσο η μεγαλύτερη όσο και η μικρότερη τιμή της παραμέτρου έχουν αρνητική επίδραση στην υγεία του ατόμου. Στην προσπάθεια για αναπαραγωγή, ο υψηλός αριθμός των σπερματοζωαρίων δε δημιουργεί πρόβλημα στην γονιμότητα του ζευγαριού (45) και γι αυτό το λόγο στα δεδομένα των παραμέτρων του σπέρματος εφαρμόζεται η μονόπλευρη κατανομή Gauss (one-sided Gauss distribution), στην οποία εξαιρείται το κατώτερο 5% (fifth centile) (Πίνακας 1). Με αυτά τα στοιχεία λοιπόν η μελέτη του ΠΟΥ όρισε τις ακόλουθες τιμές αναφοράς: για τον αριθμό των σπερματοζωαρίων τα 15×10^6/ml, για την προωθητκή κινητικότητα το 32%, για την ζωτικότητα το 58% και για την φυσιολογική μορφολογία το 4%
hgjh
| Πίνακας 1. Η κατανομή των τιμών, η χαμηλότερη τιμή αναφοράς με 95% διάστημα εμπιστοσύνης για παραμέτρους του σπέρματος από γόνιμους άνδρες των οποίων οι σύζυγοι είχαν TTP < 12 μήνες. | ||||||||||||
| N | Εκατοστημόρια | |||||||||||
| 2.5 | (95% CI) | 5 | (95% CI) | 10 | 25 | 50 | 75 | 90 | 95 | 97,5 | ||
| Όγκος (ml) | 1941 | 1.2 | (1.0 – 1.3) | 1.5 | (1.4 – 1.7) | 2 | 2,7 | 3,7 | 4,8 | 6 | 6,8 | 7,6 |
| Συγκέντρωση (106/ml) | 1859 | 9 | (8 – 11) | 15 | (12 – 16) | 22 | 41 | 73 | 116 | 169 | 213 | 259 |
| Κινητικότητα συνολική (PR και NP, %)* | 1781 | 34 | (33 – 37) | 40 | (38 – 42) | 45 | 53 | 61 | 69 | 75 | 78 | 81 |
| Κινητικότητα προωθητική (PR, %)* | 1780 | 28 | (25 – 29) | 32 | (31 – 34) | 39 | 47 | 55 | 62 | 69 | 72 | 75 |
| Φυσιολογικές μορφές (%) | 1851 | 3 | (2.0 – 3.0) | 4 | (3.0 – 4.0) | 5,5 | 9 | 15 | 24,5 | 36 | 44 | 48 |
| Ζωτικότητα (%) | 428 | 53 | (48 – 56) | 58 | (55 – 63) | 64 | 72 | 79 | 84 | 88 | 91 | 92 |
*PR, προωθητική κινητικότητα (WHO, 1999 τύπος α και β); NP, μη προωθητική κινητικότητα (WHO, 1999 τύπος γ).
Οι τιμές των παραμέτρων του σπερμοδιαγράμματος, που παρουσιάζει ο πληθυσμός αναφοράς των γόνιμων ανδρών, συγκρίθηκαν στην ίδια εργασία με τις τιμές που παρουσιάζουν άλλες τρείς κατηγορίες ανδρών: άνδρες από τον γενικό πληθυσμό, που είχαν άγνωστη γονιμότητα, άνδρες με φυσιολογικές παραμέτρους με βάση τις τιμές αναφοράς του εγχειριδίου του ΠΟΥ του 1999 και τέλος άνδρες που είχαν αποκτήσει παιδί, μετά όμως από άγνωστο διάστημα προσπαθειών. Οπως φαίνεται στον ΠΙΝΑΚΑ 2, που παρουσιάζει τα ιστογράμματα συχνοτήτων (frequency histograms) των παραμέτρων όλων των κατηγοριών, υπάρχουν διαφορές ανάμεσα στις 4 ομάδες ανδρών. Η ομάδα όμως των ανδρών με ΤΤΡ < 12 μηνών είχε συνολικό αριθμό σπερματοζωαρίων με καλή κινητικότητα και μορφολογία υψηλότερο από των άλλων ομάδων. Το γεγονός αυτό, που μπορεί να θεωρηθεί αναμενόμενο για ένα «πλυθησμό αναφοράς», δείχνει με σαφή τρόπο τον ενδεδειγμένο τρόπο ανάγνωσης του σπερμοδιαγράμματος. Ο αριθμός των σπερματοζωαρίων, η κινητικότητα και η μορφολογία τους καθορίζουν από κοινού τη γονιμοποιητική ικανότητα του σπέρματος και κατά συνέπεια θα πρέπει να αξιολογούνται στο σύνολό τους και όχι ξεχωριστά.
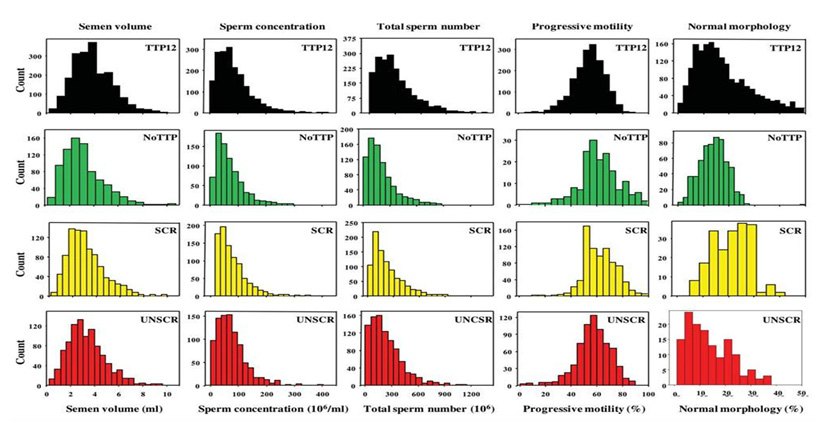 Σχήμα 1. Ιστογράμματα συχνοτήτων των παραμέτρων του σπερμοδιαγράμματος από άνδρες που έκαναν παιδί, άνδρες από τον γενικό πλυθησμό και άνδρες με φυσιολοφικές παραμέτρους σπερμοδιαγράμματος. Κατανομή του όγκου του σπέρματος (σε ml, πρώτη στήλη), συγκέντρωσης των σπερματοζωαρίων ( 106/ml, δεύτερη στήλη, ολικού αριθμού σπερματοζωαρίων ( 106,τρίτη στήλη), προωθητικής κινητικότητας (%, τέταρτη στήλη) και σπερματοζωαρίων με φυσιολογική μορφολογία (%, πέμπτη στήλη) στο δείγμα του σπέρματος σε άνδρες που έκαναν παιδί μετά από προσπάθειες το πολύ 12 μηνών (TTP12,πρώτη σειρά, μαύρο χρώμα), άνδρες που έκαναν παιδί χωρίς να είναι γνωστός ο χρόνος προσπαθειών (no TTP, δεύτερη σειρά, πράσινο χρώμα), άνδρες με φυσιολογικές παραμέτρους στο σπερμοδιάγραμμα (SRC, τρίτη σειρά, κίτρινο χρώμα) και άνδρες από τον γενικό πλυθησμό (UNSCR, τελευταία σειρά, κόκκινο)
Σχήμα 1. Ιστογράμματα συχνοτήτων των παραμέτρων του σπερμοδιαγράμματος από άνδρες που έκαναν παιδί, άνδρες από τον γενικό πλυθησμό και άνδρες με φυσιολοφικές παραμέτρους σπερμοδιαγράμματος. Κατανομή του όγκου του σπέρματος (σε ml, πρώτη στήλη), συγκέντρωσης των σπερματοζωαρίων ( 106/ml, δεύτερη στήλη, ολικού αριθμού σπερματοζωαρίων ( 106,τρίτη στήλη), προωθητικής κινητικότητας (%, τέταρτη στήλη) και σπερματοζωαρίων με φυσιολογική μορφολογία (%, πέμπτη στήλη) στο δείγμα του σπέρματος σε άνδρες που έκαναν παιδί μετά από προσπάθειες το πολύ 12 μηνών (TTP12,πρώτη σειρά, μαύρο χρώμα), άνδρες που έκαναν παιδί χωρίς να είναι γνωστός ο χρόνος προσπαθειών (no TTP, δεύτερη σειρά, πράσινο χρώμα), άνδρες με φυσιολογικές παραμέτρους στο σπερμοδιάγραμμα (SRC, τρίτη σειρά, κίτρινο χρώμα) και άνδρες από τον γενικό πλυθησμό (UNSCR, τελευταία σειρά, κόκκινο)
Οι τιμές αναφοράς που καθόρισε η εργασία των Cooper et al (42) και υιοθέτησε ο ΠΟΥ στο νέο εγχειρίδιο δεν έγιναν αποδεκτές από το σύνολο της επιστημονικής κοινότητας. Αντίθετα θεωρήθηκε ότι είναι πολύ χαμηλές και, όπως αναφέρει ο Skakkebaek υπάρχει ο κίνδυνος να μείνουν χωρίς θεραπευτική αντιμετώπιση ζευγάρια που ενδεχομένως τη χρειάζονται (46). Αναμένονται λοιπόν σύντομα αλλαγές από τον ΠΟΥ, που θα δώσουν πιθανά καινούργιες κατευθύνσεις και θα ξεκαθαρίσουν το θέμα. Και βέβαια, όπως αναφέρει ο Boyd, “στο μέλλον ένας πολυπαραγοντικός τρόπος αξιολόγησης του σπερμοδιαγράμματος πιθανά μαζί με στοιχεία της συζύγου θα παρουσιάζει ένα καλύτερο τρόπο αξιολόγησης της γονιμότητας του ζευγαριού” (47).
2. Μικροβιολογικές εξετάσεις του σπέρματος
Έλεγχος του σπέρματος για αναζήτηση παθογόνων μικροοργανισμών απαιτείται στις περιπτώσεις που υπάρχει υποψία οξείας λοίμωξης του γεννητικού συστήματος με αντίστοιχη συμπτωματολογία, όπως υψηλός πυρετός, ρίγος, άλγος περινέου, δυσουρία. Οι χρόνιες λοιμώξεις ωστόσο είναι κατά κανόνα ασυμπτωματικές και είναι δυνατό να επηρεάσουν τη γονιμότητα, καθώς επηρεάζουν την έκκριση των επικουρικών γεννητικών αδένων και κατ’επέκταση τη σύνθεση του σπερματικού υγρού. Επιπλέον η παρουσία πυοσφαιρίων και ελεύθερων ριζών οξυγόνου στο σπερματικό υγρό, που αποτελούν χαρακτηριστικά στοιχεία φλεγμονής, το καθιστούν εχθρικό προς τα σπερματοζωάρια (48, 49). Επομένως η μικροβιολογική εξέταση του σπέρματος εκτελείται συχνά ως ρουτίνα, αλλά ιδιαίτερα όταν προσδιορίζεται αριθμός λευκοκυττάρων > 1 x 10^6/mL στο σπέρμα, όταν παρατηρείται καθυστερημένη ρευστοποίηση, αυξημένη γλοιότητα, αιματοσπερμία, πολλές συσσωρεύσεις, ελαττωμένη κινητικότητα και ζωτικότητα ή τέλος όταν υπάρχει λοίμωξη του γεννητικού συστήματος της συντρόφου (50).
Οι κλασικές σεξουαλικώς μεταδιδόμενες λοιμώξεις, όπως η γονοκοκκική ουρηθρίτιδα και η σύφιλη είναι σπάνιες στη εποχή μας, δεν πρέπει όμως να διαφεύγουν από τη διαφοροδιάγνωση του κλινικού ιατρού όταν υπάρχει υποψία. Συνήθως στο σπέρμα ελέγχεται η παρουσία κοινών αερόβιων και αναερόβιων μικροοργανισμών και η παρουσία μυκοπλασματοειδών και χλαμυδίων. Για την απομόνωση κοινών μικροοργανισμών γίνεται καλλιέργεια του σπέρματος σε τρυβλία με αιματούχο άγαρ, άγαρ Mc Conkey και Sabouraud σε αερόβιες και αναερόβιες συνθήκες. Παθογόνα μικρόβια θεωρούνται τα Escherichia coli, Proteus, Pseudomonas, Klebsiella, Staphylococcus aureus. Οι εντερόκοκκοι και ο Staphylococcus epidermididis θεωρούνται δυνητικά παθογόνα εφόσον παρουσιάζουν μεγάλη ανάπτυξη στην καλλιέργεια (50). Σε περίπτωση θετικής καλλιέργειας το αντιβιόγραμμα προσδιορίζει την ευαισθησία του μικροβίου στους αντιμικροβιακούς παράγοντες, ωστόσο λόγω των ιδιαίτερων συνθηκών κυκλοφορίας του αίματος και των φραγμών στη διακίνηση των χημικών ουσιών στην ανατομική περιοχή του γεννητικού συστήματος, η θεραπεία είναι συνήθως εμπειρική.
H οικογένεια των μυκοπλασματοειδών περιλαμβάνει δύο γένη τα Mycoplasma και Ureaplasma. Είναι οι μικρότεροι σε μέγεθος μικροοργανισμοί που μπορούν να ζήσουν ελεύθερα στη φύση. Χαρακτηριστικό γνώρισμά τους είναι η πολυμορφία τους, δηλαδή η έλλειψη συγκεκριμένου σχήματος, που οφείλεται στο γεγονός ότι στερούνται κυτταρικού τοιχώματος (51). Λόγω της απουσίας κυτταρικού τοιχώματος δε χρωματίζονται κατά Gram. Στο γεννητικό σύστημα συνήθως αναζητούνται τα Mycoplasma hominis, Ureaplasma urealyticum και Mycoplasma genitalium. Τα μυκοπλασματοειδή μπορούν να αποικίσουν την ουρήθρα και να επιμολύνουν το σπέρμα κατά την εκσπερμάτιση. Οι φορείς είναι συνήθως ασυμπτωματικοί. Ωστόσο είναι δυνατό να εμφανίσουν μη γονοκοκκική ουρηθρίτιδα, προστατίτιδα ή επιδιδυμίτιδα. Παρόλο που υπάρχουν αρκετές αναφορές ότι τα μυκοπλασματοειδή εμφανίζουν αυξημένη επίπτωση σε ασυμπτωματικούς υπογόνιμους άνδρες (52 – 56), ωστόσο η αιτιολογική σχέση τους με την υπογονιμότητα δεν έχει διευκρινιστεί.
Τα μυκοπλασματοειδή απομονώνονται σε ειδικό θρεπτικό υλικό συνήθως άγαρ Α7, το οποίο δεν επιτρέπει την ανάπτυξη άλλων μικροοργανισμών (57). Απαιτείται καλλιέργεια για 24 – 48 ώρες. Οι αποικίες είναι μικροσκοπικές και δε φαίνονται με γυμνό οφθαλμό. Η παρατήρησή τους γίνεται στο μικροσκόπιο. Οι αποικίες του Mycoplasma hominis είναι χαρακτηριστικές και έχουν όψη “τηγανητού αβγού”, ενώ οι αποικίες του Ureaplasma urealyticum είναι εξαιρετικά μικρές γι αυτό αποκαλούνται αποικίες “Τ” (tiny) (57). Περισσότερο πρακτική μέθοδος για την απομόνωση των Mycoplasma hominis και Ureaplasma urealyticum είναι η χρήση ειδικών ζωμών (57), οι οποίοι περιέχουν για το μεν Mycoplasma hominis αργινίνη, για το δε Ureaplasma urealyticum ουρία. Η εξέταση βασίζεται στην ικανότητα των μικροοργανισμών να διασπούν την αργινίνη και την ουρία αντίστοιχα με αποτέλεσμα το pH του διαλύματος να γίνεται αλκαλικό. Με τη βοήθεια ενός δείκτη του pH που περιέχει ο ζωμός το χρώμα αλλάζει από πορτοκαλί σε κόκκινο. Απαιτείται επώαση στους 37οC για 24 – 48 ώρες και θετικό αποτέλεσμα σημαίνει συγκέντρωση > 10^4 CFU/mL. Το Mycoplasma genitalium αναζητείται σε ειδικές μόνο περιπτώσεις κυρίως σε εμμένουσα ουρηθρίτιδα. Μέθοδος εκλογής για την ανίχνευσή του είναι η PCR, γιατί η καλλιέργειά του καθυστερεί ένα μήνα.
Τα χλαμύδια είναι υποχρεωτικά ενδοκυττάριοι μικροοργανισμοί, οι οποίοι αναπτύσσονται στο πρωτόπλασμα ευκαρυωτικών κυττάρων (58). Στη διάρκεια του κύκλου της ανάπτυξής τους εμφανίζονται με δύο μορφές: ως «στοιχειώδη σωμάτια» και ως «δικτυωτά σωμάτια». Τα «στοιχειώδη σωμάτια» αποτελούν την εξωκυττάρια, μολυσματική μορφή. Εισέρχονται στα κύτταρα με φαγοκυττάρωση. Μετά τη φαγοκυττάρωση αποτελούν τα «δικτυωτά σωμάτια». Εντός του φαγοσώματος αρχίζουν να πολλαπλασιάζονται δημιουργώντας νέα «στοιχειώδη σωμάτια» έτοιμα να μολύνουν περισσότερα κύτταρα. Το φαγόσωμα που σχηματίζεται στα μολυσμένα κύτταρα είναι το χαρακτηριστικό έγκλειστο σωμάτιο της χλαμυδιακής λοίμωξης (58). Ορισμένοι ορότυποι του Chlamydia trachomatis είναι δυνατό να απομονωθούν από το γεννητικό σύστημα. Πιστεύεται ότι αποτελούν το πιο συχνό αίτιο μη γονοκοκκικής ουρηθρίτιδας (58), αλλά είναι δυνατό να προκαλέσουν επίσης επιδιδυμίτιδα και προστατίτιδα (59). Τις περισσότερες φορές βέβαια απομονώνονται από ασυμπτωματικούς άνδρες και η σχέση τους με την ανδρική υπογονιμότητα δεν έχει διευκρινιστεί. Κάποιες ερευνητικές εργασίες υποστηρίζουν τη βλαπτική επίδραση των χλαμυδίων στην ποιότητα του σπέρματος (60, 61), ενώ άλλες δε δείχνουν τέτοια επίδραση (56, 62, 63, 64, 65).
Καθώς τα χλαμύδια είναι υποχρεωτικά ενδοκυττάριοι μικροοργανισμοί για την απομόνωση τους απαιτείται κυτταροκαλλιέργεια. Η κυτταροκαλλιέργεια αίναι η πιο ευαίσθητη και ειδική εργαστηριακή μέθοδος, αλλά είναι ακριβή, χρονοβόρα, επίπονη και δεν αποτελεί εξέταση ρουτίνας. Τα τελευταία χρόνια μέθοδο αναφοράς αποτελεί η ανίχνευση των χλαμυδίων με PCR ή εναλλακτικά με κατάλληλους εμπορευματοποιημένους ιχνηθέτες (probes). Ωστόσο και αυτές οι μέθοδοι έχουν μεγάλο κόστος και δεν εφαρμόζονται στη ρουτίνα. Αξιόπιστη είναι η μέθοδος του άμεσου ανοσοφθορισμού με σημασμένα μονοκλωνικά αντισώματα έναντι αντιγόνων των χλαμυδίων, οπότε σε θετικό αποτέλεσμα παρατηρείται φθορισμός χρώματος «πράσινου μήλου». Τέλος υπάρχουν και συσκευές ταχείας εξέτασης για χλαμύδια που στηρίζονται στην ποιοτική ανίχνευση αντιγόνων των χλαμυδίων με χρωματογραφικό ανοσοπροσδιορισμό (57).
Στο σπέρμα κατά τη μικροσκοπική εξέταση είναι δυνατό να βρεθεί Trichomonas. Πρόκειται για μαστιγοφόρο πρωτόζωο που προκαλεί κολπίτιδα στις γυναίκες και είναι δυνατό να αποικίσει ασυμπτωματικά την ουρήθρα ή να προκαλέσει ουρηθρίτιδα στον άνδρα. Επίσης από το σπέρμα είναι δυνατό να απομονωθούν μύκητες κυρίως του γένους Candida συχνότερα μετά από παρατεταμένη χρήση αντιβιοτικών.
3. Ο ποιοτικός έλεγχος των εξετάσεων σπέρματος
Tα τελευταία χρόνια είναι σαφές πως υπάρχει ανάγκη για «περισσότερη ανδρολογία» στην αντιμετώπιση της υπογονιμότητας ενός ζευγαριού. Μόνο το σωστό αποτέλεσμα θα βοηθήσει το κλινικό γιατρό να καταλήξει στην σωστή διάγνωση και να αποφασίσει για την κατάλληλη θεραπεία (66) και αυτό αυτόματα υπαγορεύει την ανάγκη για άριστης ποιότητας εργαστηριακό αποτέλεσμα. Η έκδοση των εγχειριδίων από τον ΠΟΥ έχει βοηθήσει πολύ στην βελτίωση των μεθόδων ανάλυσης του σπέρματος, προτείνοντας συγκεκριμένες μεθόδους και τρόπους για τον προσδιορισμό των διαφόρων εργαστηριακών παραμέτρων. Αυτό από μόνο του θα έπρεπε να είχε κάνει τα αποτελέσματα διαφορετικών εργαστηρίων συγκρίσιμα, αλλά, όπως έδειξαν οι Riddell et al, δεν χρησιμοποιούν όλα τα εργαστήρια τις οδηγίες του ΠΟΥ (67). Tο 1983 οι Chong et al χαρακτήρισαν το σπερμοδιάγραμμα ως την «παραμελημένη» εξέταση (68).
Πρόσφατη εργασία, που είχε συμπεριλάβει 118 εργαστήρια έδειξε, ότι η ίδια εικόνα υπάρχει ακόμη και σήμερα και γι αυτό ίσως οι Hargreave και Elton αναρωτιούνται αν υπάρχει χρησιμότητα στην εξέταση του σπερμοδιαγράμματος (69).
Το δείγμα του σπέρματος αποτελείται από ζωντανά κύτταρα. Ο οποιοσδήποτε λάθος χειρισμός θα μπορούσε να προκαλέσει αλλοίωση στο δείγμα και να επηρεάσει τις μετρήσεις. Το συγκεκριμένο λοιπόν βιολογικό υγρό απαιτεί προσεκτικούς χειρισμούς και σαν συνέπεια η εξέταση του σπερμοδιαγράμματος παρουσιάζει αρκετές ιδιαιτερότητες και ιδιομορφίες. Η πιο σημαντική και καθοριστική είναι η υποκειμενικότητα των μετρήσεων. Όλες οι μετρήσεις γίνονται από το ανθρώπινο μάτι στο μικροσκόπιο και δεν υπάρχει αναλυτής που θα μπορούσε να καταλήξει σε αξιόπιστο αποτέλεσμα γιατί δεν υπάρχει πρότυπο για σύγκριση, όπως γίνεται, παραδείγματος χάριν, στις βιοχημικές εξετάσεις. Άλλο σημαντικό στοιχείο είναι το γεγονός ότι τα χαρακτηριστικά των πολλών εκατομμυρίων σπερματοζωαρίων ενός δείγματος σπέρματος θα καθοριστούν από τις μετρήσεις που γίνονται σε λίγες μόνο εκατοντάδες εξ αυτών (70). Κατά συνέπεια λάθη που οφείλονται σε μη καλή ανάδευση θα απομονώσουν μη αντιπροσωπευτικά τμήματα του με επακόλουθο λάθη στις μετρήσεις, λόγω της ανομοιογένειας του δείγματος. Επίσης, σε ορισμένες μετρήσεις, όπως της ζωτικότητας και της κινητικότητας, δεν υπάρχει η δυνατότητα να “επαναληφθούν” σε άλλο χρόνο δεδομένου, ότι αυτές πρέπει να γίνουν σε ορισμένη χρονική στιγμή. Τέλος απλοί χειρισμοί, όπως η επιλογή μη τοξικών δοχείων συλλογής σπέρματος και η μεταφορά του δείγματος στο εργαστήριο σε καθορισμένη θερμοκρασία, επηρεάζουν το τελικό αποτέλεσμα σε μεγάλο ποσοστό.
Δεν είναι μόνο τα χαρακτηριστικά στο δείγμα του σπέρματος που επηρεάζουν την αξιοπιστία της εξέτασης. Διαφορετικά εργαστήρια χρησιμοποιούν διαφορετικές μεθόδους για τον προσδιορισμό των παραμέτρων του. Ωστόσο, όπως ήδη αναφέρθηκε, δεν χρησιμοποιούν όλα τα εργαστήρια τις οδηγίες του ΠΟΥ, πράγμα που εξηγεί σε ένα ποσοστό τις διαφορές που παρατηρούνται (67).
Για να προβλεφτούν και να αποφευχθούν λοιπόν τα πιθανά λάθη και να παράγουμε ένα σωστό εργαστηριακό αποτέλεσμα είναι απαραίτητος ο ποιοτικός έλεγχος των εξετάσεων σπέρματος, με τα δύο σκέλη του: τον εσωτερικό και τον εξωτερικό ποιοτικό έλεγχο (71). Ο εσωτερικός ποιοτικός έλεγχος εξασφαλίζει την επαναληψιμότητα των μετρήσεων και μέσα από αυτή τη διαδικασία ο κάθε τεχνολόγος αξιολογεί τον “εαυτό του” (72). Πιο συγκεκριμένα ο τεχνολόγος μετράει πολλές φορές μία από τις παραμέτρους του σπερμοδιαγράμματος σε ένα δείγμα σπέρματος και οι τιμές, που προκύπτουν, πρέπει να παρουσιάζουν μικρή απόκλιση. Σε οποιοδήποτε εργαστήριο γίνονται σπερμοδιαγράμματα από διαφορετικά άτομα, πρέπει να υπάρχει συμφωνία ανάμεσα στις μετρήσεις τους. Από το 1971 ο Eliasson τόνισε, ότι είναι απαραίτητο να συγκρίνονται οι μετρήσεις της ίδιας παραμέτρου από διαφορετικούς τεχνολόγους ενώ το ίδιο επισημάνθηκε αργότερα και από άλλους ερευνητές (72). Με την σύγκριση των τιμών ανάμεσα σε διαφορετικούς τεχνολόγους μπορεί να διαπιστωθεί, εάν κάποιος δίνει συστηματικά χαμηλότερες ή υψηλότερες τιμές σε σχέση με άλλους. Είναι φυσικά δεδομένο ότι όλοι οι τεχνολόγοι χρησιμοποιούν την ίδια πλάκα μέτρησης, γιατί είναι γνωστή η επίδραση της επιλογής της πλάκας στην ακρίβεια και επαναληψιμότητα του αποτελέσματος (73, 74).
Είναι λοιπόν σαφές ότι με τον εσωτερικό ποιοτικό έλεγχο μπορούμε να αξιολογήσουμε την επαναληψιμότητα των μετρήσεων. Πρέπει όμως να αξιολογούμε και την ακρίβεια στις μετρήσεις και αυτό επιτυγχάνεται έμμεσα με την συμμετοχή του εργαστηρίου σε σύστημα εξωτερικού ποιοτικού ελέγχου (72, 75, 76). Όλα τα εργαστήρια που συμμετέχουν στο σύστημα του εξωτερικού ποιοτικού ελέγχου παραλαμβάνουν και μετρούν τις παραμέτρους του σπερμοδιαγράμματος – αριθμό, κινητικότητα, ζωτικότητα, μορφολογία – στο ίδιο δείγμα. Οι τιμές όλων των συμμετεχόντων εργαστηρίων συγκεντρώνονται και επεξεργάζονται και το κάθε εργαστήριο ξέρει πόσο κοντά ή μακριά βρίσκεται από τις τιμές των υπολοίπων εργαστηρίων. Το τμήμα Ανδρολογίας της ESHRE (SIGA-ESHRE) έχει οργανώσει από το 1999 ένα ιδιαίτερα αξιόπιστο σύστημα εξωτερικού ποιοτικού ελέγχου, στο οποίο μέχρι σήμερα συμμετέχει μεγάλος αριθμός εργαστηρίων από όλο τον κόσμο. Η συμμετοχή του Ανδρολογικού Εργαστηρίου σε σύστημα εξωτερικού ποιοτικού ελέγχου είναι επιβεβλημένη, γιατί μέσα από αυτό μπορεί να εξασφαλίσει την ακρίβεια των μετρήσεων, άρα να προσφέρει ένα αποτέλεσμα που βοηθάει ουσιαστικά τον κλινικό γιατρό. Πολλές χώρες έχουν αναπτύξει συστήματα εξωτερικού ποιοτικού ελέγχου σε εθνικό επίπεδο όπως η Αγγλία, η Γερμανία, η Ισπανία κ.α. (77,78,79).
Αφού λοιπόν ολοκληρωθούν οι διαδικασίες του ποιοτικού ελέγχου, που ελέγχουν το εργαστηριακό αποτέλεσμα, πρέπει η διαδικασία να ολοκληρωθεί με την διασφάλιση ποιότητας. Η διασφάλιση ποιότητας εξασφαλίζει την ποιότητα και αξιοπιστία της υπηρεσίας που παρέχεται από το συγκεκριμένο εργαστήριο (80). Θέματα όπως, η σωστή και αποτελεσματική διοίκηση του εργαστηρίου, η έγκαιρη συντήρηση των μηχανημάτων, οι σωστές οδηγίες προς τους ενδιαφερόμενους και τους παραπέμποντες γιατρούς, ο χρόνος παράδοσης των αποτελεσμάτων καλύπτονται από την διαδικασία της διασφάλισης ποιότητας (81). Η όλη διαδικασία της διασφάλισης ποιότητας περιγράφεται σε ειδικό «εγχειρίδιο ποιότητας» στο οποίο συμπεριλαμβάνεται όλη η δομή και λειτουργία του εργασηρίου, από τις οδηγίες για τις εργαστηριακές τεχνικές μέχρι την ιεραρχία των ατόμων που απασχολούνται στο εργαστήριο και την συνεχιζόμενη εκπαίδευση και ενημέρωσή τους. Η διασφάλιση ποιότητας λοιπόν αποτελεί το επιστέγασμα της προσπάθεια και κάνει ακόμη πιο αξιόπιστο το εργαστηριακό αποτέλεσμα.
Βιβλιογραφία
1. World Health Organization. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Cambridge University Press, Cambridge, 1999.
2. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed, WHO,Geneva, 2010.
3. KvistU, Björndahl L. Manual on Basic Semen Analysis. Oxford University Press, Oxford, 2002.
4. Keel BA, Stembridge TW, Pineda G, Serafy NT Sr. Lack of standardization in performance of the semen analysis among laboratories in the United States. Fertil Steril 2002; 78: 603-608.
5. Keel BA. How reliable are results from the semen analysis? Fertil Steril 2004; 82: 41-44.
6. Cooper TG. Semen analysis. In: Nieschlag E, Behre HM, Nieschlag S (eds) Andrology. 3rd ed, Springer-Verlag, Berlin, Heidelberg, 2010.
7. Pound N, Javed MH, Ruberto C, Shaikh MA, Del Valle AP. Duration of sexual arousal predicts semen parameters for masturbatory ejaculates. Physiol Behav 2002; 76: 685-689.
8. Björndahl L. Basic semen analysis and laboratory quality for clinicians. In: Björndahl L, Giwercman A, Tournaye H, Weidner W (eds) Clinical Andrology EAU/ESAU Course Guidelines. Informa Healthcare, London, New York, 2010.
9. Stokes-Riner A, Thurston SW, Brazil C, Guzick D, Liu F, Overstreet JW, et al. One semen sample or 2? Insights from a study of fertile men. J Androl 2007; 28 : 638-43.
10. Baker HW, Kovacs GT. Spontaneous improvement in semen quality: regression towards the mean. Int J Androl 1985; 8: 421-426.
11. Alvarez C, Castilla JA, Martínez L, Ramírez JP, Vergara F, Gaforio JJ. Biological variation of seminal parameters in healthy subjects. Hum Reprod 2003; 18: 2082-2088.
12. Cooper TG, Brazil C, Swan SH, Overstreet JW. Ejaculate volume is seriously underestimated when semen is pipetted or decanted into cylinders from the collection vessel. J Androl 2007; 28: 1-4.
13. Daudin M, Bieth E, Bujan L, Massat G, Pontonnier F, Mieusset R. Congenital bilateral absence of the vas deferens: clinical characteristics, biological parameters, cystic fibrosis transmembrane conductanceregulator gene mutations, and implications for genetic counseling. Fertil Steril 2000; 74: 1164-1174.
14. von Eckardstein S, Cooper TG, Rutscha K, Meschede D, Horst J, Nieschlag E. Seminal plasma characteristics as indicators of cystic fibrosis transmembrane conductance regulator (CFTR) gene mutations in men with obstructive azoospermia. Fertil Steril 2000; 73: 1226-1231.
15. Cooper TG, Yeung CH. Computer-aided evaluation of assessment of “grade a” spermatozoa by experienced technicians. Fertil Steril 2006; 85: 220–224.
16. Chemes HE, Rawe YV. Sperm pathology: a step beyond descriptive morphology. Origin, characterization and fertility potential of abnormal sperm phenotypes in infertile men. Hum Reprod Update 2003; 9: 405-428.
17. Wilton LJ, Temple-Smith PD, Baker HW, de Kretser DM. Human male infertility caused by degeneration and death of sperms in the epididymis. Fertil Steril 1988; 49: 1051-1058.
18. Correa-Pérez JR, Fernández-Pelegrina R, Aslanis P, Zavos PM. Clinical management of men producing ejaculates characterized by high levels of dead sperm and altered seminal plasma factors consistent with epididymal necrospermia. Fertil Steril 2004; 81: 1148-50.
19. Eliasson R. Analysis of semen. In: Behrman SJ, Kistner RW (eds) Progress in Infertility. 2nd ed, Little Brown, New York, 1975: 691-713.
20. MacLeod J, Wang Y. Male fertility potential in terms of semen quality: a review of the past, a study of the present. Fertil Steril, 1979; 31:103-116.
21. Andersen AG, Jensen TK, Carlsen E, Jørgensen N, Andersson AM, Krarup T, et al. High frequency of sub-optimal semen quality in an unselected population of young men. Hum Reprod 2000; 15: 366-372.
22. Behre HM , Yeung CH, Holstein AF, Weinbauer GF, Gassner P, Nieschlag E. Diagnosis of male infertility and hypogonadism. In: Nieschlag E, Behre HM (eds). Andrology, male reproductive health and dysfunction. Springer, Berlin, 2000: 92.
23. Coetzee K, Menkveld R. Validation of a new disposable counting chamber. Arch Androl 2001;47: 153-156.
24. Bailey E, Fenning N, Chamberlain S, Devlin L, Hopkisson J, Tomlinson M. Validation of sperm counting methods using limits of agreement. J Androl 2007; 28: 364-373.
25. Rossi AG, Aitken RJ. Interactions between leukocytes and the male reproductive system. The unanswered questions. Adv Exp Med Biol 1997; 424: 245-252.
26. Johanisson E, Campana A, Luthi R, de Agostini A. Evaluation of “round cells” in semen analysis: a comparative study. Hum Reprod Update 2000; 6: 404-412.
27. Fredricsson B, Björk G. Morphology of postcoital spermatozoa in the cervical secretion and its clinical signifi cance. Fertil Steril 1977; 28: 841-845.
28. Menkveld R, Stander FS, Kotze TJ, Kruger TF, van Zyl JA. The evaluation of morphological characteristics of human spermatozoa according to stricter criteria. Hum Reprod 1990; 5: 586-592.
29. Menkveld R, Franken DR, Kruger TF, Oehninger S, Hodgen GD. Sperm selection capacity of the human zona pellucida. Mol Reprod Dev 1991; 30: 346-352.
30. Liu DY, Baker HWG. Morphology of spermatozoa bound to the zona pellucida of
human oocytes that failed to fertilize in vitro. J Reprod Fertil 1992; 94:71-84.
31. Kruger TF, Menkveld R, Stander FS, Lombard CJ, Van der Merwe JP, van Zyl JA,et al. Sperm morphologic features as a prognostic factor in in-vitro fertilization. Fertil Steril 1986; 46: 1118-1123.
32. Coetzee K, Kruge TF, Lombard CJ. Predictive value of normal sperm morphology: a structured literature review. Hum Reprod Update 1998; 4: 73-82.
33. Menkveld R, Wong WY, Lombard CJ, Wetzels AM, Thomas CM, Merkus HM, et al. Semen parameters, including WHO and strict criteria morphology, in a fertile and subfertile population: an effort towards standardization of in-vivo thresholds. Hum Reprod 2001; 16:1165-1171.
34.Coetzee K, Windt ML, Menkveld R, Kruger TF, Kitshoff M. Short communication: an intracytoplasmic sperm injection with a globozoospermic male. J Assist Reprod Genet 2001; 18: 311–3.
35. Baccetti B, Capitani S, Collodel G, Di Cairano G, Gambera L, et al. Genetic sperm defects and consanguinity. Hum Reprod 2001; 16: 1365–71.
36. Chemes HE. Phenotypes of sperm pathology: genetic and acquired forms in infertile men. J Androl 2000; 21: 799–808.
37. Rawe VY, Terada Y, Nakamura S, Chillik CF, Brugo Olmedo S, et al. A pathology of sperm centriole responsible for defective sperm aster formation, syngamy and cleavage. Hum Reprod 2002; 17: 2344–9.
38. Horn PS, Pesce AJ. Reference intervals: A user’s guide. Washington DC. American Association 2006
39. MacLeod J, Heim LM. Characteristics and variations in semen specimens in 100 normal young men. J Urol 1945; 54: 474–82.
40. MacLeod J. The semen specimen. Laboratory examination.In: Engle ET, editor. Conference on Diagnosis in Sterility.Springfield: Charles C Thomas; 1946. P4–15.
41. MacLeod J, Wang Y. Male fertility potential in terms of semen quality: a review of the past, a study of the present. Fertil Steril 1979; 31: 103–16.
42. Cooper TG et al. (2010). World Health Organization reference values for human semen characteristics. Human Reproduction Update, 16:231-245.
43. Rowe PJ, Comhaire FH, Hargreave TB, Mahmoud AM. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press, 2000, 91 p.
44. Joffe M. Time trends in biological fertility in Britain. Lancet 2000; 355: 1961 – 1965.
45. Tournaye H, Staessen C, Camus M, Verheyen G, Devroey P, Van Steirteghem A. No evidence for a decreased fertilizing potential after in-vitro fertilization using spermatozoa from polyzoospermic men. Hum Reprod 1997;19:2183 – 2195.
46. Skakkebaek N.E. Normal reference ranges for semen quality and their relations to fecundity, Asian Journal of Andrology (2010) 12: 90–98
47. Boyd J.C. Laboratory reference values and decision limits: populations, intervals, and interpretations Asian Journal of Andrology 2010; Defining, 12: 83–90
48. Aitken RJ, Buckingham D, West K, Wu FC, Zikopoulos K, Richardson DW.
Differential contribution of leucocytes and spermatozoa to the generation of
reactive oxygen species in the ejaculates of oligozoospermic patients and fertile
donors. J Reprod Fertil 1992; 94: 451-462.
49. Comhaire FH, Mahmoud AM, Depuydt CE, Zalata AA, Christophe AB. Mechanisms and effects of male genital tract infection on sperm quality and fertilizing potential: the andrologist’s viewpoint. Hum Reprod Update 1999; 5: 393-398.
50. Παπαδήμας Ι, Μανταλενάκης Σ. Ενδοκρινολογία αναπαραγωγής στον άνδρα. University Studio Press, Θεσσαλονίκη, 1993: 83-85.
51. Παπαναγιώτου Ι, Κυριαζοπούλου – Δαλαϊνα Β. Ιατρική μικροβιολογία και ιολογία. 2η έκδοση, University Studio Press, Θεσσαλονίκη, 2004: 177 – 180.
52. Upadhyaya M, Hibbard BM, Walker SM. The effect of Ureaplasma urealyticum on semen characteristics. Fertil Steril 1984; 41:304-308.
53. de Jong Z, Pontonnier F, Plante P, Perie N, Talazac N, Mansat A, et al. Comparison of the incidence of Ureaplasma urealyticum in infertile men and in donors of semen. Eur Urol 1990; 18: 127-131.
54. Wang Y, Liang CL, Wu JQ, Xu C, Qin SX, Gao ES. Do Ureaplasma urealyticum infections in the genital tract affect semen quality? Asian J Androl 2006 ;8 :562-568.
55. Andrade-Rocha FT. Ureaplasma urealyticum and Mycoplasma hominis in men attending for routine semen analysis. Prevalence, incidence by age and clinical settings, influence on sperm characteristics, relationship with the leukocyte count and clinical value. Urol Int 2003; 71: 377-381.
56. Gdoura R, Kchaou W, Ammar-Keskes L, Chakroun N, Sellemi A, Znazen A, et al. Assessment of Chlamydia trachomatis, Ureaplasma urealyticum, Ureaplasma parvum, Mycoplasma hominis, and Mycoplasma genitalium in semen and first void urine specimens of asymptomatic male partners of infertile couples. J Androl 2008; 29: 198-206.
57. Χαρβάλου Α. Πρωτόκολλα κλινικής μικροβιολογίας. Σύνοψη εργαστηριακής προσπέλασης βακτηριακών λοιμώξεων. Ιατρικές εκδόσεις Π.Χ. Πασχαλίδης, Αθήνα, 2007: 107 – 130.
58. Παπαναγιώτου Ι, Κυριαζοπούλου – Δαλαϊνα Β. Ιατρική μικροβιολογία και ιολογία. 2η έκδοση, University Studio Press, Θεσσαλονίκη, 2004: 193 – 201.
59. Dan M, Samra Z, Siegel YI, Korczak D, Lindner A. Isolation of Chlamydia trachomatis from prostatic tissue of patients undergoing transurethral prostatectomy. Infection 1991; 19: 162-163.
60. Wolff H, Neubert U, Zebhauser M, Bezold G, Korting HC, Meurer M. Chlamydia trachomatis induces an inflammatory response in the male genital tract and is associated with altered semen quality. Fertil Steril 1991; 55: 1017-1019.
61. Cengiz T, Aydoğanli L, Baykam M, Mungan NA, Tunçbilek E, Dinçer M, et al. Chlamydial infections and male infertility. Int Urol Nephrol 1997; 29: 687-693.
62. Eggert-Kruse W, Buhlinger-Gopfarth N, Rohr G, Probst S, Aufenanger J, Naher H, et al. Antibodies to chlamydia trachomatis in semen and relationship with parameters of male fertility. Hum Reprod 1996l; 11: 1408-1417.
63. Eggert-Kruse W, Rohr G, Demirakca T, Rusu R, Näher H, Petzoldt D, et al. Chlamydial serology in 1303 asymptomatic subfertile couples. Hum Reprod 1997; 12: 1464-1475.
64. Soffer Y, Ron-El R, Golan A, Herman A, Caspi E, Samra Z. Male genital mycoplasmas and Chlamydia trachomatis culture: its relationship with accessory gland function, sperm quality, and autoimmunity. Fertil Steril 1990; 53: 331-336.
65. Habermann B, Krause W. Altered sperm function or sperm antibodies are not associated with chlamydial antibodies in infertile men with leucocytospermia. J Eur Acad Dermatol Venereol 1999; 12: 25-29.
66. Conhaire F. Guidelines for diagnosis and therapy. Hum Reprod 1995, 10:1949-1950
67. Riddel D, Passey A, Whittington K. Lack of compliance by UK andrology laboratories with World Health Organization recommendations for sperm morphology assessment. Hum Reprod 2005, 20:3441-3445
68. Chong AP, Walters CA, Weinrieb SA. The neglected laboratory test. The semen analysis. J Androl 1983, 4:280-282
69. Hargreave TB, Elton RA. Is conventional sperm analysis of any use? Br J Urol 1983, 55:774-779
70. Russel OD, Curtis GG. Standardization of semen preparation, staining and sampling methods improves automated sperm head morphometry analysis. Fertil Steril 1993, 59:412-7
71. Ζεγκινιάδου Θ., Βακαλόπουλος Ι., Ραδόπουλος Δ., Σοφικίτης Ν Ο ποιοτικός έλεγχος των εξετάσεων σπέρματος Αρχεία Ελληνικής Ιατρικής, 2011, 28(1):1-11
72. Auger J, Eustache F, Ducot B, Blandin T, Daudin M, Diaz I, Matribi SB, et al. Intra- and inter-individual variability in human sperm concentration, motility and vitality assessment during a workshop involving ten laboratories. Human Reproduction 2000, 15:2360-2368
73. Christensen P, Stryhn H, Hansen C. Discrepancies in the determination of sperm concentration using Bürker-Türk, Thoma and Makler counting chambers. Theriogenology. 2005;63(4):992-1003.
74. Ginsbur KA, Armant DR. The influence of chamber characteristics on the reliability of sperm concentration and movement measurements obtained by manual and video micrographic analysis. Fertil Steril. 1990, 53:882-887
75. Neuwinger J, Behre H, Nieschlag E. External quality control in the andrology laboratory: an experimental multicenter trial. Fertil Steril 1990, 54:308-314
76. Matson PL. External quality control assessment for semen analysis and sperm antibody detection: results of a pilot scheme. Hum Reprod 1995, 10:620-625
77. Alvarez C, Castilla JA, Ramirez JP, Vergara F, Yoldi A, Fernandez A, Gaforio JJ. External quality control program for semen analysis: Spanish experience. J Assist Reprod Genet. 2005, 22:379-387
78. Cooper TG, Atkinson AD, Nieschlag E. Experience with external quality control in spermatology. Hum Reprod 1999, 14:765 -769
79. Gandini L, Menditto A, Chiodo F, Lenzi A. From the European Academy of Andrology. Italian pilot study for an external quality control scheme analysis and antisperm antibodies detection. Int J Androl 2000, 23: 1-3
80. Keel BA. Quality control, Quality assurance, and proficiency testing in the andrology laboratory. Arch Androl 2002, 48:417-431
81. Byrd W. Quality assurance in the reproductive biology laboratory Arch Pathol Lab Med 1992, 116:418-422
Created: 28 September 2016
Last update: 28 September 2016

