Θεοδοσία Ζεγκινιάδου
Εργαστήριο Ιστολογίας-Εμβρυολογίας, Ιατρική Σχολή, Καποδιστριακό Πανεπιστήμιο Αθηνών
Μονάδα Ενδοκρινολογίας Αναπαραγωγής, Α’ Μαιευτική – Γυναικολογική Κλινική ΑΠΘ
1. Κρυοβιολογία – Ιστορικά στοιχεία
Η Κρυοβιολογία είναι ο κλάδος της Βιολογίας που μελετάει την ζωή στις χαμηλές θερμοκρασίες και την επίδραση που έχει η πτώση της θερμοκρασίας στην κυτταρική δομή και λειτουργία (Mazur, 2004). Στις χαμηλές αυτές θερμοκρασίες διατηρείται η βιωσιμότητα των κυττάρων και η τεχνική της κρυοσυντήρησης, όπως ονομάζεται η διατήρηση ζωντανών κυττάρων ή πολυκύτταρων οργανισμών, σε χαμηλές θερμοκρασίες, οδήγησε στην ανάπτυξη μεθόδων που αποτέλεσαν σημαντικό κομμάτι των τεχνικών της Υποβοηθούμενης Αναπαραγωγής. Η κρυοσυντήρηση έδωσε επίσης την δυνατότητα να διασωθούν είδη που κινδυνεύουν από εξαφάνιση με την συντήρηση γαμετών ή ιστών τους, διατηρώντας έτσι την βιοποικιλότητα των ειδών (Lermen, et al., 2009, Trinidad, et al., 2010).
Η ιστορία της κρυοσυντήρησης σπέρματος ξεκινά από τα τέλη του 16ου αιώνα (Sherman, 1964). Tο 1776, ο Lazzaro Spallazani διατύπωσε την παρατήρηση ότι το σπέρμα διατηρείται στο χιόνι, αν και χάνει την κινητικότητά του όταν ψύχεται. Αρκετά χρόνια μετά, το 1866, ο Montegazza, ήταν ο πρώτος που πρότεινε την κρυοσυντήρηση ανθρώπινου σπέρματος, για τους στρατιώτες που θα πήγαιναν στη μάχη (Walters, et al., 2009). Οι πρώτες απόπειρες κρυοσυντήρησης σπέρματος για θεραπευτικούς σκοπούς, ξεκίνησαν με απλή ψύξη και αποθήκευση σε ξηρό πάγο στους -75οC. Η κινητικότητα των σπερματοζωαρίων όμως παρουσίαζε συνεχή πτώση κάτω από αυτές τις συνθήκες, κατά συνέπεια η τεχνική αυτή δεν μπορούσε να χρησιμοποιηθεί, αφού το δείγμα μπορούσε να διατηρηθεί μόνο για μικρά χρονικά διαστήματα. Τον ξηρό πάγο αντικατέστησε το υγρό άζωτο, που διατηρούσε τα κύτταρα στους -190oC, χωρίς να τα καταστρέφει. Έτσι, η ενδεδειγμένη θερμοκρασία κρυοσυντήρησης καθορίστηκε ανάμεσα στους -140oC και τους -190oC και σε αυτές τις θερμοκρασίες, με δεδομένο ότι η βιολογική δραστηριότητα αναστέλλεται, τα κύτταρα μπορούν να διατηρηθούν για μεγάλα χρονικά διαστήματα. Συγκεκριμένα για το δείγμα σπέρματος το μεγαλύτερο διάστημα διατήρησης που έχει αναφερθεί είναι τα 21 έτη (Sharma, 2001).
Στις μέρες μας η κρυοσυντήρηση σπέρματος έχει εξελιχθεί σε ένα απαραίτητο θεραπευτικό εργαλείο για περιστατικά στα οποία η φαρμακευτική αγωγή πιθανολογείται ότι θα πλήξει την αναπαραγωγική ικανότητα του ατόμου. Ο καρκίνος του όρχι, τα λεμφώματα ή άλλες μορφές καρκίνου και οι ανοσοκατασταλτικές θεραπείες για μεταμοσχεύσεις είναι ορισμένες από τις περιπτώσεις που απαιτούν την κατάψυξη σπέρματος. Ειδικά τώρα που, με την εξέλιξη της επιστήμης και τα καινούργια φαρμακευτικά σχήματα, πολλές νόσοι θεραπεύονται μέχρι σημείου πλήρους ίασης, η διατήρηση της ικανότητας για αναπαραγωγή εξασφαλίζει ποιότητα ζωής. Το κρυοσυντηρημένο δείγμα μπορεί να χρησιμοποιηθεί στην υποβοηθούμενη αναπαραγωγή, συνήθως με την τεχνική της εξωσωματικής γονιμοποίησης. Εκτός όμως από αυτές τις περιπτώσεις, κρυοσυντήρηση σπέρματος μπορεί να είναι χρήσιμη όταν στο χώρος εργασίας υπάρχουν τοξικές ουσίες ή όταν ο σύζυγος απουσιάζει στις γόνιμες μέρες της συζύγου. Η πρώτη επιτυχής εγκυμοσύνη με χρήση κατεψυγμένου ανδρικού σπέρματος χρονολογείται το 1953 από τον Sherman και η πρώτη γέννηση φυσιολογικού παιδιού με κρυοσυντηρημένο σπέρμα επετεύχθη το 1973. Οι πρώτες οργανωμένες τράπεζες σπέρματος δημιουργήθηκαν στις αρχές του 1970 με δεδομένο ότι η διατήρηση των κυττάρων στους -190oC δεν προκαλεί γενετική αλλοίωση ή χρωμοσωμικές αλλαγές (Aswood-Smith, et al., 1979).
2. Μεταβολές κατά την κρυοσυντήρηση και ρυθμός κατάψυξης
Τα σπερματοζωάρια μπορούν να παραμείνουν αναλλοίωτα στην κρυοσυντήρηση για μεγάλο διάστημα (Yogev, et al., 2010), γιατί στην θερμοκρασία των -190oC δεν υπάρχει αρκετή θερμική ενέργια για χημικές αντιδράσεις (McGee, et al., 1962). Οι μεγάλες αλλαγές συμβαίνουν καθώς τα κύτταρα μεταφέρονται από την θερμοκρασία περιβάλλοντος στους -190oC και κατόπιν επανέρχονται σε θερμοκρασία περιβάλλοντος για να ξαναγίνουν βιολογικά ενεργά
Είναι γνωστό ότι, μετά την απόψυξη, το δείγμα σπέρματος θα έχει μειωμένη κινητικότητα και ζωτικότητα και μάλιστα η κατάψυξη θεωρείται επιτυχής εαν η πτώση της κινητικότητας είναι της τάξης του 50% (David, et al., 1980). Ακόμη όμως και μοριακοί μηχανισμοί παρουσιάζουν ελάττωση, όπως για παράδειγμα η συμπύκνωση της χρωματίνης στον πυρήνα (Hammadeh, et al., 2010, Boitrelle, et al. 2012). Η κινητική της αφυδάτωσης σε συνάρτηση των αλλαγών της θερμοκρασίας περιγράφτηκε με ακρίβεια από θεωρητικά μοντέλα, από το 1963 και οι αλλαγές που θα προκληθούν στα κύτταρα μπορούν όχι μόνο να περιγραφούν αλλά και να προβλεφτούν (Σχήμα 1) (Mazur, 1963). Ακόμη και σήμερα, περισσότερο από 50 χρόνια μετά, οι επιστήμονες βασιζονται στους νόμους της θερμοδυναμικής και της φυσικοχημείας για να δημιουργήσουν μοντέλα που πειγράφουν την συμπεριφορά των κυττάρων κατά την κρυοσυντήρηση με σκοπό να βελτιώσουν το αποτέλεσμα της διαδικασίας (Mazur, 2010).
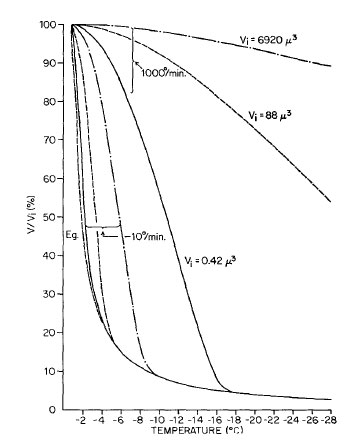
Σχήμα 1. Υπολογισμένα ποσοστά εναπομείναντος ύδατος ενδοκυτταρικά, σε ενδεικτικές θερμοκρασίες, σε κύτταρα διαφορετικών μεγεθών, που καταψύχονται με ρυθμό από 10 – 1000οC/min. Πηγή: Mazur, 1963.
Αρχικά, καθώς ελαττώνεται η θερμοκρασία, πυρήνες πάγου σχηματίζονται στον εξωκυττάριο χώρο, προκαλώντας μετακίνηση του νερού λόγω της οσμωτικής διαφοράς κατά μήκος της μεμβράνης και επακόλουθη αφυδάτωση των κυττάρων (Mazur, 1963). Αν ο ρυθμός ψύξης (cooling rate) είναι υψηλότερος από τον ενδεδειγμένο, τότε ορισμένη ποσότητα νερού θα παραμείνει στο εσωτερικό του σπερματοζωαρίου. Καθώς η θερμοκρασία ελαττώνεται, αυτή η ποσότητα νερού θα δημιουργήσει κρυστάλλους ενδοκυτταρικά, καταστρέφοντας την κυτταρική λειτουργία, όπως φαίνεται από μελέτες με την τεχνική της κρυο-μικροσκοπίας. Αντίθετα αν ο ρυθμός ψύξης είναι χαμηλότερος από τον ενδεδειγμένο, τότε η μεγαλύτερη ποσότητα ενδοκυττάριου νερού θα κινηθεί έξω από το κύτταρο και έτσι δεν θα δημιουργηθούν κρύσταλλοι ενδοκυτταρικά. Σε αυτή την περίπτωση όμως, η συγκέντρωση των διαλυμένων ουσιών στο κυτταρόπλασμα αυξάνεται σημαντικά με επακόλουθη μη-αναστρέψιμη καταστροφή στην μεμβράνη του κυττάρου, όπως έδειξε ο Meryman ήδη από το 1968. Αυτά τα δύο αντικρουόμενα φαινόμενα, που παρουσίασε ο Mazur (Mazur, et al., 1972) στη θεωρία του (“two factor hypothesis”), καθορίζουν την επιτυχία της κατάψυξης των κυττάρων.
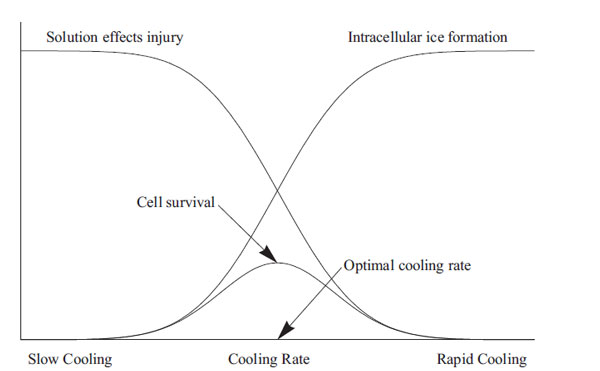
Σχήμα 2. Διάγραμμα συσχέτισης ανάμεσα στο ρυθμό ψύξης, την δημιουργία κρυστάλλων, την επίδραση των διαλυμένων ουσιών και την επιβίωση των κυττάρων. Πηγή: Benson, et al., 2012.
Είναι λοιπόν βέβαιο ότι ο ρυθμός κατάψυξης αποτελεί μια καθοριστική παράμετρο στην έκβαση της κρυοσυντήρησης. Μελέτες σε διαφορετικά είδη κυττάρων έδειξαν ότι ο ρυθμός κατάψυξης σε συνάρτηση με την βιωσιμότητα των κυττάρων μετά την απόψυξη παρουσιάζει πάντα την εικόνα του ανεστραμμένου U, όπως φαίνεται στο σχ. 3. Αρχικά ο ρυθμός κατάψυξης ήταν γραμμικός, αργότερα όμως αντικαταστάθηκε από μη γραμμικούς που φαίνεται πως εξασφάλιζαν καλύτερο αποτέλεσμα (Woelders, et al., 2004).
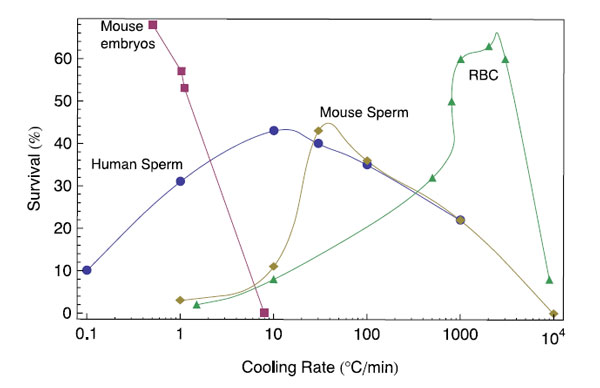 Σχήμα 3. Ρυθμοί επιβίωσης διάφορων κυτταρικών τύπων που έχουν ψυχθεί με διαφορετικό ρυθμό. Πηγή: Mazur and Miller, 1976.
Σχήμα 3. Ρυθμοί επιβίωσης διάφορων κυτταρικών τύπων που έχουν ψυχθεί με διαφορετικό ρυθμό. Πηγή: Mazur and Miller, 1976.
Όταν τα κύτταρα καταψύχονται είναι δυνατόν να καθοριστεί ο ρυθμός αφυδάτωσης και η δημιουργία ενδοκυττάριου πάγου, αν μετρηθεί η διαπερατότητα της πλασματικής τους μεμβράνης. Τα σπερματοζωάρια διαφέρουν από τα άλλα κύτταρα γιατί έχουν μικρό μέγεθος και ανώμαλο σχήμα και οι Divireddy και συν προσπάθησαν να καθορίσουν τη διαπερατότητα της πλασματικής μεμβράνης αυτής της κατηγορίας κυττάρων, με ειδικές τεχνικές και μαθηματικά μοντέλα (Devireddy, et al., 2000).
Είναι γενικά απόδεκτό ότι κατά την διαδικασία της κατάψυξη των κυττάρων η δημιουργία ενδοκυττάριου πάγου προκαλεί τον κυτταρικό θάνατο και χαμηλώνει τα ποσοστά της βιωσιμότητας των κυττάρων μετά την απόψυξη (Mazur, 1984).
Πρόσφατα δεδομένα διαφοροποιούν τα σπερματοζωάρια από τα άλλα κύτταρα. Ο Morris κατέψυξε σπερματοζωάρια με ρυθμούς από 0,3 – 3.000oC/min και κάτω από αυτές τις συνθήκες δεν κατάφερε να ανιχνεύσει κρυστάλλους στο εσωτερικό τους (Morris, 2006). Είναι πιθανό λοιπόν η αρνητική επίδραση της κρυοσυντήρησης στα σπερματοζωάρια να οφείλεται σε άλλους λόγους και μελέτες της δομής της μεμβράνης βασισμένες στην μικροσκοπία κατάψυξης-θραύσης μας δίνουν μια διαφορετική πιθανή εξήγηση. Oι δύο στιβάδες των φωσφολιπιδίων της μεμβράνης, απομακρύνονται η μία από την άλλη κατά την κατάψυξη, πιθανά στην θερμοκρασία 5 – 15oC (Drobnis, et al., 1993) και δεν είναι δυνατόν να επανέλθουν τελείως στην αρχική τους θέση μετά την απόψυξη (Holt, et al., 1990). Η αλλαγή αυτή στην διάταξη των φωσφολιπιδίων επηρεάζει και τις πρωτείνες που βρίσκονται στην μεμβράνη, οι οποίες με την μετακίνηση συσσωρεύονται και καταστρέφεται η λειτουργικότητά τους. Με αυτό τον μηχανισμό καταστρέφονται τα κανάλια των ιόντων που προκαλούν αύξηση της διαπερατότητας της μεμβράνης μετά την ψύξη – απόψυξη (Robertson, et al., 1988).
Σε όλα τα κύτταρα ο γλυκοκάλυκας, δηλαδή τα σάκχαρα που βρίσκονται συνδεδεμένα με τις πρωτείνες ή τα φωσφολιπίδια, παίζουν σημαντικό ρόλο στην λειτουργικότητα της μεμβράνης που τα περιβάλει. Και στην περίπτωση του σπερματοζωαρίου το σύνολο των υδατανδράκων που βρίσκεται στην εξωτερική πλευρά της πλασματικής του μεμβράνης, έχει ενεργό συμμετοχή σε διάφορες λειτουργίες, όπως η ακροσωμιακή αντίδραση ή η αλληλεπίδραση των γαμετών για την δημιουργία του ζυγωτού (Benoff, 1997, Cross, 1987). Η διαδικασία της κρυοσυντήρησης επιδρά στο γλυκοκάλυκα και με την αλλοίωση που προκαλείται στις πρωτείνες επηρεάζονται τόσο τα μεταβολικά μονοπάτια όσο και η γονιμοποιητική ικανότητα του σπερματοζωαρίου (Lassalle, 1994).
3. Οι κρυοπροστατευτικές ουσίες
Το πρόβλημα του σχηματισμού κρυστάλλων άρχισε να λύνεται το 1949, όταν ο Polge ανέδειξε τον προστατευτικό ρόλο που είχε η γλυκερόλη στα κύτταρα που βρίσκονται σε χαμηλές θερμοκρασίες (Polge, et al., 1949). Από τότε, μία ποικιλία ουσιών με κρυοπροστατευτική δράση έχουν αναφερθεί, που εξασφαλίζουν με επιτυχία την κρυοσυντήρηση των κυττάρων. Τα κρυοπροστατευτικά (cryoprotectants, CPA), είναι χημικές ουσίες, μικρού η μεγάλου μοριακού βάρους, οι οποίες όταν διαλύονται στο νερό, χαμηλώνουν το σημείο τήξεως του διαλύματος (Wowk, 2007). Χωρίς την παρουσία του κρυοπροστατευτικού, και με υψηλούς ρυθμούς κατάψυξης, σχεδόν το σύνολο του όγκου του νερού παγώνει. Με την προσθήκη του κρυοποροστατευτικού ο πάγος καταλαμβάνει μικρότερο μέρος του όγκου του διαλύματος και τα κύτταρα έτσι έχουν περισσότερο χώρο διαθέσιμο για να επιβιώσουν μεταξύ των κρυστάλλων (Wowk, 2007). Μία συγκέντρωση 5 – 10% του κρυοπροστατευτικού συνήθως απαιτείται για να επιτραπεί η επιβίωση ενός σημαντικού κλάσματος των απομονωμένων κυττάρων μετά από ψύξη – απόψυξη σε υγρό άζωτο στους -196οC.
Φυσικά, για να χρησιμοποιηθεί μια ουσία σαν κρυοπροστατευτικό, πρέπει να μην παρουσιάζει τοξικότητα στα κύτταρα (Fahy, 1986) και η τοξικότητα των κυττάρων, όταν αυτά βρίσκονται σε χαμηλή θερμοκρασία και χωρίς την συνηθισμένη ποσότητα νερού στο εσωτερικό τους, διέπεται από διαφορετικούς κανόνες. Αρχικά, τα κρυοπροστατευτικά που χρησιμοποιήθηκαν στην συντήρηση σπέρματος περιείχαν κρόκο αυγού, που εξασφάλιζε μεγαλύτερα ποσοστά βιωσιμότητας κατά την απόψυξη. Ο κρόκος όμως προέρχεται από ζώα και μπορεί να μεταφέρει μικροοργανισμούς και για αυτό τον λόγο δεν χρησιμοποιείται πλέον (Stacey, 2004). Στις μέρες μας το πιο συχνά χρησιμοποιούμενο κρυοπροστατευτικό για την κρυοσυντήρηση ανθρώπινου σπέρματος είναι η γλυκερόλη γιατί παρουσιάζει υψηλή διαλυτότητα στο νερό και χαμηλή τοξικότητα στα κύτταρα κατά την έκθεσή τους σε αυτήν για μεγάλα χρονικά διαστήματα.
Τόσο η γλυκερόλη, όσο και το DMSO, είναι ουσίες μικρού μοριακού βάρους που έχουν την ικανότητα να διαπερνούν την κυτταρική μεμβράνη, ανήκουν δηλαδή στην κατηγορία των διεισδυτικών κρυοπροστατευτικών. Kρυοπροστασία μπορούν επίσης να παρέχουν και ουσίες μεγάλου μοριακού βάρους, που δεν έχουν τη δυνατότητα να διαπερνούν την κυτταρική μεμβράνη. Ο κρυοπροστατευτικός ρόλος των ουσιών αυτών οφείλεται στο γεγονός ότι αναστέλλουν την ανάπτυξη κρυστάλλων πάγου ενδοκυτταρικά, απομακρύνοντας το νερό από το κυτταρόπλασμα, προκαλώντας δηλαδή αφυδάτωση. Στην κατηγορία αυτή ανήκουν η σουκρόζη, η γλυκόζη, το polyvinylpyrrolidone (PVP) κ.α. Στα διαλύματα που χρησιμοποιούνται για την κρυοπροστασία των κυττάρων συνυπάρχουν και άλλες ουσίες, όπως παράγοντες που σταθεροποιούν την πλασματική μεμβράνη, EDTA ή κιτρικό που δεσμεύει το ασβέστιο και ελαττώνει τις διαφορές της συγκέντρωσής κατά μήκος της μεμβράνης και ρυθμιστικά διαλύματα, για την ρύθμιση του pH (Keel, et al., 1993).
4. Ο ρυθμός προσθήκης του κρυοπροστατευτικού
Μία ακόμη παράμετρος κριτικής σημασίας για την επιτυχία της κρυοσυντήρησης, είναι ο ρυθμός προσθήκης και αφαίρεσης του κρυοπροστατευτικού. Καθώς προστίθεται το κρυοπροστατευτικό στο διάλυμα συμβαίνουν αλλαγές που επηρεάζουν τα κύτταρα (Σχήμα 4). Πιο συγκεκριμένα, καθώς προστίθεται το κρυοπροστατευτικό αυξάνεται η οσμωμοριακότητα του διαλύματος στον εξωκυττάριο χώρο και αυτό έχει ως αποτέλεσμα τη συρρίκνωση του κυττάρου, αφού μεγάλη ποσότητα νερού διαπερνά την κυτταρική μεμβράνη προς τον εξωκυττάριο χώρο. Στη συνέχεια, όταν το κρυοπροστατευτικό αρχίσει να εισέρχεται στο εσωτερικό του κυττάρου, το νερό ακολουθεί αντίθετη πορεία, προκαλώντας τη διόγκωση του κυττάρου. Όταν η συγκέντρωση του κρυοπροστατευτικού εξισώνεται εντός και εκτός του κυττάρου, τα κύτταρα επιστρέφουν στον επιθυμητό όγκο.
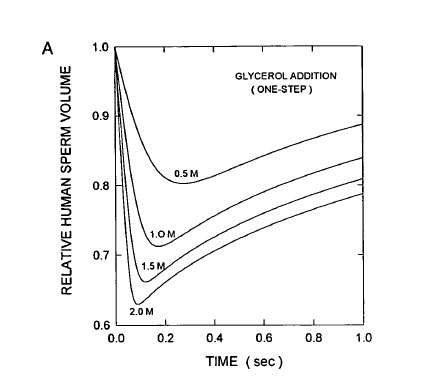
Σχήμα 4. Αλλαγές στον όγκο του σπερματοζωαρίου μετά την έκθεσή τους σε υπέρτονα διαλύματα γλυκερόλης (Gao, et al., 1995).
Η προσθήκη των κρυοπροστατευτικών μπορεί να γίνει σε ένα βήμα ή σταδιακά (Vidiasih, et al., 2009). Στην πρώτη περίπτωση το κρυοπροστατευτικό προστίθεται απότομα και αμέσως μετά τα κύτταρα καταψύχονται, οπότε ελαττώνεται ο χρόνος κατά τον οποίο τα κύτταρα εκτίθενται στο κρυοπροστατευτικό. Αντίθετα, στην περίπτωση που το κρυοπροστατευτικό προστεθεί σταδιακά, τα κύτταρα δεν υφίστανται οσμωτικό στρες και αυτό έχει ως αποτέλεσμα να διατηρείται ο όγκος των κυττάρων εντός των επιτρεπτών τους ορίων (Gao, et al., 1997). Γενικά, αν η αυξομείωση στο μέγεθος του κυττάρου είναι απότομη, το κύτταρο ξεπερνάει τα επιτρεπτά όρια του και προκαλείται μη αντιστρεπτή βλάβη (Merryman, 1970). Τα σπερματοζωάρια μπορούν να αυξήσουν το μέγεθός τους κατά 110% και μπορούν να συρρικνωθούν στο 75% του όγκου τους χωρίς αλλοίωση της κινητικότητάς τους (Gao, et al., 1997). Επομένως, ο ρυθμός προσθήκης του κρυοπροστατευτικού θα πρέπει να είναι τέτοιος ώστε να μην μεταβάλλεται δραματικά ο όγκος του κυττάρου και το εσωτερικό και το εξωτερικό του κυττάρου να βρίσκεται συνεχώς σε μία διαρκή ισορροπία. Η αυξομείωση του μεγέθους επίσης επηρεάζει τον κυτταροσκελετό και το πλέγμα των νηματίων ακτίνης που συγκρατεί το κυτταρόπλασμα (Hall, 1999).
Με βάση δεδομένα από τις εργασίες του Devismita, ο ιδανικός ρυθμός κατάψυξης των σπερματοζωαρίων υπολογίζεται κοντά στους 17oC/min (Devismita, et al., 2012). Στην πράξη η θερμοκρασία πέφτει από την θερμοκρασία περιβάλλοντος στους 5oC με ρυθμό 0,5 – 1,0oC/min, κατόπιν το δείγμα καταψύχεται από τους 5oC στους −80oC με ρυθμό 1 – 10oC/min και μετά τοποθετείται στο υγρό άζωτο (Di Santo, et al., 2012).
5. Τρόποι κρυοσυντήρησης
Οι τεχνικές κατάψυξης που εφαρμόζονται στην εργαστηριακή ρουτίνα βασίζονται σε συγκεκριμένα πρωτόκολλα, ανάλογα με την κατηγορία των κυττάρων που πρόκειται να κρυοσυντηρηθεί. Τα πρωτόκολλα αυτά ικανοποιούν τις ανάγκες των κυττάρων ώστε μετά την απόψυξη η λειτουργικότητα τους να διατηρείται σε υψηλό ποσοστό. Όπως ήδη αναφέρθηκε για την κρυοσυντήρηση σπέρματος, αρχικά το δείγμα αναμιγνύεται με το κρυοπροστατευτικό και στη συνέχεια μεταφέρεται στους ειδικούς φορείς μικρού όγκου για την διατήρηση. Αυτοί μπορεί να είναι αμπούλες (cryovials), που συνήθως έχουν όγκο 1,8 ml ή παγέτες (straws) που έχουν όγκο 0,5 ml (Εικόνα 1).

Εικόνα 1. Αμπούλες και παγέτες για την κρυοσυντήρηση σπέρματος.
Η επιλογή του κατάλληλου φορέα εξαρτάται από τις ανάγκες της κρυοσυντήρησης. Οι παγέτες, λόγω του μικρού όγκου και των λεπτών τοιχωμάτων, επιτυγχάνουν ομοιόμορφη θερμοκρασία κατά την κατάψυξη σε όλο το δείγμα. Αποτελούν επίσης ασφαλέστερο τρόπο διατήρησης λόγω του τρόπου που κλείνουν και από τις 2 πλευρές, που ελαχιστοποιεί τον κίνδυνο μεταφοράς ιών ανάμεσα στα δείγματα που συνυπάρχουν στην κατάψυξη (Morris, et al., 1949). Οι αμπούλες, όπως αναφέρθηκε, έχουν όγκο μεγαλύτερο από τις παγέτες. Αυτό είναι ένα βολικό χαρακτηρηστικό για δείγματα μεγάλου όγκου ή για την κατάψυξη ιστοτεμαχίων από τον όρχι μετά από βιοψία, πρέπει όμως να σημειωθεί ότι η θερμοκρασία μπορεί να μην είναι η ίδια σε όλα τα σημεία μέσα στην αμπούλα.
Ειδικά για τα σπερματοζωάρια η διαδικασία της κατάψυξης, που περιγράφηκε αρχικά από τον Sherman (Sharma, 2001), γίνεται στους ατμούς του υγρού αζώτου αρχικά για ~ 10 min. Τα δείγματα τοποθετούνται σε απόσταση 15 – 20 cm από την ελεύθερη επιφάνεια του υγρού αζώτου, που έχει θερμοκρασία περίπου -80oC και κατόπιν βυθίζονται στο υγρό άζωτο, στους -196oC, στα ειδικά δοχεία κρυοσυντήρησης (Εικόνα 2).

Εικόνα 2. Δοχεία κρυοσυντήρησης σπέρματος.
Η μέθοδος αυτή είναι εύκολη και χωρίς υψηλό κόστος, γιαυτό και αποτελεί την μέθοδο επιλογής για την ρουτίνα της κρυοσυντήρησης των δειγμάτων σπέρματος. Το μειονέκτημά της είναι η χαμηλή επαναληψιμότητα λόγω του ότι η καμπύλη πτώσης της θερμοκρασίας δεν είναι ελεγχόμενη και διαφοροποιείται από φορά σε φορά (Sherman, et al, 1953). Το μειονέκτημα αυτό μπορεί να ξεπεραστεί με την χρήση αυτοματοποιημένων συστημάτων βαθειάς κατάψυξης, που πραγματοποιούν βαθμιαία κατάψυξη και πάλι μέσω των ατμών του υγρού αζώτου. Η κατάψυξη όμως έτσι βασίζεται σε ελεγχόμενα πρωτόκολλα, χωρίς παρέμβαση χειριστή, που εξασφαλίζει υψηλή επαναληψιμότητα (Woods, et al., 2004). Έχουν όμως υψηλό κόστος και για αυτό δεν χρησιμοποιούνται ευρέως.
6. Κατάψυξη σπερμάτος με χαμηλό αριθμό σπερματοζωαρίων και κατάψυξη ορχικού ιστού
Ένα ποσοστό 10% των ανδρών με υπογονιμότητα δεν έχει σπερματοζωάρια στην εκσπερμάτιση, παρουσιάζει δηλαδή αζωοσπερμία. Σε αυτές τις περιπτώσεις η τεκνοποίηση είναι εφικτή μόνο αν βρεθούν σπερματοζωάρια στην επιδιδυμίδα ή στον όρχι. Τα ιστοτεμάχια από τον όρχι πρέπει να κατεργαστούν με σκοπό την απομόνωση σπερματοζωαρίων, που μετέπειτα θα γονιμοποιήσουν το ωάριο με την μέθοδο της μικρογονιμοποίησης (ICSI). Συνήθως, η βιοψία προηγείται της προσπάθειας εξωσωματικής και τα τμήματα του ορχικού ιστού καταψύχονται σε πολλά τμήματα, ώστε να υπάρχουν σπερματοζωάρια διαθέσιμα για επόμενες προσπάθειες εξωσωματικής γονιμοποίησης χωρίς την ανάγκη να επαναληφθεί η βιοψία του όρχι. Η κατάψυξη λοιπόν αποτελεί σε αυτές τις περιπτώσεις ένα απαραίτητο θεραπευτικό στάδιο.
Γενικά η κρυοσυντήρηση ορχικού ιστού έχει ιδιαιτερότητες που οφείλονται στα χαρακτηριστικά του ιστού (David, et al., 1980). Ενώ το δείγμα του σπέρματος αποτελεί ένα εναιώρημα, τα τεμάχια του όρχι αποτελούνται από ένα σύνολο διαφορετικών κυτταρικών τύπων, όπως τα κύτταρα της σπερματικής σειράς, τα κύτταρα Sertoli ή τα κύτταρα Leydig, που συνεργάζονται για την σωστή λειτουργία του όρχι. Τα ιστοτεμάχια όμως αποτελούν μια συμπαγή μάζα, στην οποία η μετακίνηση του κρυοπροστατευτικού και η πτώση της θερμοκρασίας κατά την διαδικασία της κατάψυξης γίνεται πιο δύσκολα. Ακόμη, στην περίπτωση που παγιδευτεί νερό στο εσωτερικό των σπερματικών σωληναρίων αυτό θα μετατραπεί σε πάγο που θα επηρεάσει αρνητικά τον ιστό (de Leeuw, et al., 1990). Η κατάψυξη των ιστοτεμαχίων γίνεται μόνο σε αμπούλες, λόγω του όγκου τους και έχουν προταθεί διάφορα κρυοπροστατευτικά για την καλύτερη βιωσιμότητα των κυττάρων (Pacchiarotti, et al., 2013).
Στις περιπτώσεις που βρεθούν σπερματοζωάρια στην επιδιδυμίδα πρέπει να γίνει κατάψυξη ενός πολύ μικρού πληθυσμού και μας ενδιαφέρει όχι μόνο να διατηρηθεί η βιωσιμότητα των σπερματοζωαρίων μετά την απόψυξή τους αλλά και να υπάρχει η δυνατότητα να χωριστεί ο μικρός αυτός αριθμός και να καταψυχθεί σε τμήματα για να εξασφαλίσει το ζευγάρι και άλλες προσπάθειες εξωσωματικής γονιμοποίησης. Την ίδια πρόκληση έχουμε και σε περιπτώσεις κατάψυξης σπέρματος, που όμως έχει πολύ χαμηλή συγκέντρωση. Τότε η κατάψυξη ακολουθεί διαφορετική διαδικασία. Πολύ μικροί πληθυσμοί σπερματοζωαρίων, ακόμη και μεμονομένα σπερματοζωάρια, καταψύχονται σε ειδικούς φορείς μικρού όγκου (AbdelHafez, et al., 2009). Τέτοιοι φορείς μπορεί να είναι κενές διαφανείς ζώνες από ωάρια, σφαιρίδια φυτικής προέλευσης, μιρκοσταγόνες κ.ά., όπως φαίνεται στον πίνακα (Πίνακας 1). Με αυτόν τον τρόπο και σε αυτόν τον χαμηλό όγκο εξασφαλίζεται όχι μόνο η βιωσιμότητα αλλά και η δυνατότητα πολλαπλής κατάψυξης για μελλοντική χρήση.
Πίνακας 1. Τρόποι κρυοσυντήρησης δείγματος σπέρματος με χαμηλό αριθμό σπερματοζωαρίων.
| Κενές διαφανείς ζώνες | Cohen, et al., 1997; Walmsley, et al., 1998; Montag, et al., 1999; Borini, et al., 2000; Hsieh, et al., 2000a; Fusi, et al., 2001; Cesana, et al., 2003; Levi-Setti, et al., 2003; Hassa, et al., 2006 |
| Παγέτες | Desai, et al., 1998; Isachenko, et al., 2005; Koscinski, et al., 2007 |
| Μικροσταγόνες | Gil-Salom, et al., 2000;Bouamama, et al., 2003; Isachenko, et al., 2005; Sereni, et al., 2008 |
| Πιπέτα ICSI | Gvakharia and Adamson, 2001; Sohn, et al., 2003 |
| Σφαίρες Volvox globator | Just, et al., 2004 |
| Σφαιρίδια φυτικής προέλευσης | Herrler, et al., 2006 |
| Κρυοδακτύλιοι | Nawroth et al., 2002; Isachenko et al., 2004, 2005; Schuster, et al., 2003 |
Όσο σημαντική είναι η σωστή κατάψυξη του δείγματος τόσο σημαντική είναι και η σωστή απόψυξη. Η επαναφορά των κυττάρων από τους -196oC στην θερμοκρασία δωματίου πρέπει να γίνει με τρόπο που να έχει την μικρότερη δυνατή επίδραση στην κινητικότητα, ζωτικότητα και γονιμοποιητική ικανότητα των σπερματοζωαρίων. Συνήθως για την απόψυξη, τα δείγματα τοποθετούνται σε υδατόλουτρο ή κλίβανο με θερμοκρασία 37oC για 10 min και όχι μεγαλύτερες θερμοκρασίες, που θα ολοκλήρωναν την απόψυξη σε λιγότερο χρόνο (Woods, et al., 2004). Σε αυτό το διάστημα διαλυτοποιείται ο πάγος και αμέσως απομακρύνεται το κρυοπροστατευτικό από τα σπερματοζωάρια για την αποφυγή κυτταρικής βλάβης.
7. Συμπεράσματα
Αν και η κρυοσυντήρηση σπέρματος είναι μια συνήθης θεραπευτική διαδικασία η έρευνα από επιστήμονες είναι συνηχής, τόσο για το θεωρητικό υπόβαθρο της κρυοσυντήρησης μέσω των αρχών της φυσικοχημείας, όσο και για τη βελτίωση των μεθόδων για την επιτυχή διατήρηση του σπέρματος με καλύτερα κρυοπροστατετικά υλικά και αυτόματες συσκευές βαθμιαίας κατάψυξης. Η ανάγκη λοιπόν για την κρυοσυντήρη του σπέρματος έδωσε την ώθηση για τη δημιουργία και ανάπτυξη οργανωμένων τραπεζών σπέρματος που εξυπηρετούν τις ανάγκες των ενδιαφερόμενων.
Τα τελευταία χρόνια γίνονται προσπάθειες μεγιστοποίησης του αποτελέσματος της κρυοσυντήρησης με την μέθοδο τη υαλοποίησης (vitrification). Με την υαλοποίηση επιτυγχάνεται η κρυοσυντήρηση των σπερματοζωαρίων, όπως και άλλων κυττάρων ή εμβρύων, χωρίς την χρήση των κρυοπροστατευτικών ουσιών. Η κατάψυξη και η απόψυξη γίνονται με εξαιρετικά γρήγορους ρυθμούς και έτσι επιτυγχάνεται υψηλή βιωσιμότητα και λειτουργικότητα των σπερματοζωαρίων, χωρίς την αρνητική επίδραση του κρυοπροστατευτικού, που χρησιμοποιείται στην ρουτίνα (Isachenko, et al., 2011).
Παράλληλα, με τις καινούργιες εργαστηριακές τεχνικές, καινούργια πεδία της επιστήμης βασίζονται στην δυνατότητα διατήρησης των κυττάρων για μεγάλα χρονικά διαστήματα. Η μελέτη των βλαστοκυττάρων του ομφαλοπλακουντιακού αίματος άνοιξε καινούργιους ορίζοντες στην θεραπεία ασθενιών και η μελέτη των βλαστοκυττάρων που προέρχονται από τον ορχικό ιστό ακολουθεί τις εξελίξεις, και πιστεύουμε ότι οι επιστήμονες θα φτάσουν σύντομα στο σημείο να δημιουργούν σπερματοζωάρια από τα πρόδρομα βλαστικά κύτταρα του όρχι, δίνοντας έτσι οριστική λύση σε πολλά περιστατικά ανδρικής γονιμότητας (Aponte et al., 2012). Αυτή η διαδικασία είναι ακόμη ένας τρόπος με τον οποίο η κρυοσυντήρηση των κυττάρων προάγει την ιατρική πρακτική.
Βιβλιογραφία
1. Aponte PM, Schlatt S, de FrancaI LR. Biotechnological approaches to the treatment of aspermatogenic men. Clinics 2013;68(S1):157-67.
2. Ashwood-Smith MJ, Friedmann GB. Lethal and chromosomal effects of freezing, thawing, storage time, and Xirradiationon mammalian cells preserved at -196οC in dimethyl sulfoxide. Cryobiology 1979;16:132-40.
3. Benoff S. Carbohydrates and fertilization: an overview”. Mol Hum Reprod 1997;3:599-637.
4. Borini A, Sereni E, Bonu MA, Flamigni C. Freezing a few testicular spermatozoa retrieved by TESA. Mol Cell Endocrinol 2000;169:27-32.
5. Bouamama N, Briot P, Testart J. Comparison of two methods of cryoconservation of sperm when in very small numbers. Gynecol Obstet Fertil 2003;31:132-5.
6. Cesana A, Novara P, Bianchi S, Marras A, Albani E, Negri L, Levi-Setti PE. Sperm cryopreservation in oligo-asthenospermic patients. Hum Reprod 2003;18:76 (abstract).
7. Cohen J, Garrisi GJ, Congedo-Ferrara TA, Kieck KA, Schimmel TW, Scott RT. Cryopreservation of single human spermatozoa. Hum Reprod 1997;12:994-1001.
8. Cross NL, Overstreet JW. Glycoconjugates of the human sperm surface: distribution and alterations that accompany capacitation in vitro. Gamete Res 1987;16:23-35.
9. David G, Czyglik F, Mayaux MJ, et al. Artificial insemination with frozen sperm: prolocol,method of analysis and results for 1188 women. Br J Obstet Gynaecol 1980; 87:1022-8.
10. De Leeuw FE, Chen HC, Colenbrander B, Verkleij AJ. Cold-induced ultrastructural changes in bull and boar sperm plasma membranes. Cryobiology 1990; 27:171-83.
11. Desai NN, Blackmon H, Goldfarb J. Single sperm cryopreservation on cryoloops: an alternative to hamster zona for freezing individual spermatozoa. Reprod Biomed Online 2004;9:47-53.
12. Devireddy RV, Swanlund DJ, Roberts KP,Pryor JL, Bischof JC. The effect ofextracellular ice and cryoprotective agents on the water permeability parameters of human sperm plasma membrane during freezing. Hum Reprod 2000;15:1125-35.
13. Devismita D, Kumar A, Krishna Kumar R. Cryopreservation of human sperm: effect of cooling rate on intracellular ice formation. Int J Sci Engin Res 2012;3:60-63.
14. Di Santo M, Tarozzi N, Nadalini M, Borini A. Human sperm cryopreservation: update on techniques, effect on DNA integrity, and implications for ART. Adv Urol 2012;854837.
15. Drobnis EZ, Crowe LM, Berger T, Anchordoguy T, Overstreet JW, Crowe JH. Cold shock damage is due to lipid phase transitions in cell membranes: a demonstration using sperm as a model. J Exp Zool 1993;265:432-37.
16. Fahy GM. The relevence of of cryoprotectant toxicity to cryobiology. Cryobiology 1986;23:1-13.
17. AbdelHavez F, Bedaiwy M, El-Nashar SA, Sabanegh E, Desai N. Techniques for cryopreservation of individual or small numbers of human spermatozoa: a systematic review. Hum Reprod 2009;15:153-64.
18. Boitrelle F, Albert M. Cryopreservation of human spermatozoa decreases the number of motile normal spermatozoa, induces nuclear vacuolization and chromatin decondensation. J Androl 2012; 33:1371-1378.
19. Fusi F, Calzi F, Rabellotti E, Papaleo E, Gonfiantini C, Bonzi V, Santis LD, Ferrari A. Fertilizing capability of frozen-thawed spermatozoa recovered from microsurgical epidydimal sperm aspiration and cryopreserved in oocyte-free human zona pellucida. Hum Reprod 2001;16:117-121.
20. Gao D, Liu J, Liu C, et al. Prevention of osmotic injury to human spermatozoa during addition and removal of glycerol. Hum Reprod 1995;10:1109-22.
21. Gilmore JA, Liu J, Gao DY, et al. Determination of optical cryoprotectants for their addition and removal from human spermatozoa. Hum Reprod 1997;12:112-8.
22. Gil-Salom M, Romero J, Rubio C, Ruiz A, Remohi J, Pellicer A. Intracytoplasmic sperm injection with cryopreserved testicular spermatozoa. Mol Cell Endocrinol 2000;169:15-9.
23. Gvakharia M, Adamson GD. A method of successful cryopreservation of small numbers of human spermatozoa. Fertil Steril 2001;76:S101.
24. Hall SM, Evans J, Haworth SG. Influence of cold preservation on the cytoskeleton of cultured pulmonary arterial endothelial cells. Am J Respir Cell Mol. Biol 1993;9:106-14.
25. Hassa H, Gurer F, Yildirm A, Can C, Sahinturk V, Tekin B. A new protection solution for freezing small numbers of sperm inside empty zona pellucida: Osmangazi-Turk solution. Cell Preserv Technol 2006;4:199-208.
26. Holt WV, North RD. Partially irreversible cold induced lipid phase transitions in mammalian sperm plasma membrane domains: freezefracture study. J Exp Zool 1984;230:473-83.
27. Hammadeh M, Sarvasy ED, Zeginiadou T, Rosenbaum P, Georg T, Schmidt W. Evaluation of cryoinjury of spermatozoa after slow programmed (biological freezer) or rapid (liquid nitrogen vapour) freeze–thawing techniques. J Assist Reprod Gen 2001;18(7):364-370.
28. Herrler A, Eisner S, Bach V, Weissenborn U, Beier HM. Cryopreservation of spermatozoa in alginic acid capsules. Fertil Steril 2006;85:208-13.
29. Hsieh Y, Tsai H, Chang C, Lo H. Cryopreservation of human spermatozoa within human or mouse empty zona pellucidae. Fertil Steril 2000;73:694-8.
30. Isachenko V, Maettner R, Petrunkina AM, et al. Vitrification of human ICSI/IVF spermatozoa without cryoprotectants: new capillary technology. J Androl 2012;33:462-8.
31. Isachenko V, Isachenko E, Katkov II, Montag M, Dessole S, Nawroth F, Van Der Ven H. Cryoprotectant-free cryopreservation of human spermatozoa by vitrification and freezing in vapor: effect on motility, DNA integrity, and fertilization ability. Biol Reprod 2004;71:1167-73.
32. Just A, Gruber I, Wober M, Lahodny J, Obruca A, Strohmer H. Novel method for the cryopreservation of testicular sperm and ejaculated spermatozoa from patients with severe oligospermia: a pilot study. Fertil Steril 2004;82:445-7.
33. Keel BA, Webster BW. Semen cryopreservation methodology and results. In: Barrat C, Cooke ID (eds). Donor Insemination. Cambridge. Cambridge University Press 1993:96-71.
34. Koscinski I, Wittemer C, Lefebvre-Khalil V, Marcelli F, Defossez A, Rigot JM. Optimal management of extreme oligozoospermia by an appropriate cryopreservation programme. Hum Reprod 2007;22:2679-84.
35. Lassalle A, Testart J. Human zona pellucida recognition associated with removal of sialic acid from human spermsurface. J Reprod Fertil 1994;101:703-11.
36. Lermen D, Blomeke B. Cryobanking of viable biomaterials: implementation of newstrategies for conservation purposes. Mol Ecol 2009;18:1030-3.
37. Levi-Setti PE, Albani E, Negri L, Cesana A, Novara P, Bianchi S. Cryopreservation of a small number of spermatozoa in yolk-filled human zonae pellucidae. Arch Ital Urol Androl 2003;75:195-8.
38. Lovelock JE. The haemolysisof human red blood-cells by freezing and thawing. Biochim Biophys Acta 1953;10:414-26.
39. Mazur P. Freezing of living cells: mechanisms and implications. Am J Physiol 1984;247:125-42.
40. Mazur P, Miller RH. Permeability of the human erythrocyte to glycerol in 1 and 2 M solutions at 0 or 20 degrees C. Cryobiology 1976;13:507-22.
41. Mazur P. A biologist’s view of the relevance of thermodynamics and physical chemistry to cryobiology. Cryobiology 2010;60:4-10.
42. Mazur P. Principles of cryobiology. In: Life in the frozen state, Fuller BJ, Lane N, Benson EE (eds). CRC Press, Boca Raton, FL, 2004:3-65.
43. Mazur P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. J Gen Physiol 1963;47:347-69.
44. Mazur P, Koshimoto C. Is intracellular ice formation the cause of death of mouse sperm frozen at high cooling rates? Biol Reprod 2002;66:1485-90.
45. Mazur P, Leibo SP, Chu EH. A two-factor hypothesis of freezing injury. Eidence fromChinese hamster tissue-culture cells. Exp Cell Res 1972;71:345-55.
46. McGee HA, Jr, Martin WJ. Cryochemistry. Cryogenics 1962;2:l-11.
47. Merryman HT. Modified modek for the mechanism of freezing injury in erythrocytes. Nature 1968;218:333-6.
48. Merryman HT. The exceeding of a minimum tolerable cell volume in hypertonic suspensionas a cuase of freezing injury. In: The frozen cell, Wolstenholme GE, O’ Connor M (eds). London:Churchill Press, 1970:565-9.
49. Morris GJ. Rapidly cooled human sperm: no evidence of intracellular ice formation. Hum Reprod 2006;21:2075-83.
50. Montag M, Rink K, Dieckmann U, Delacretaz G, van der Ven H. Laser-assisted cryopreservation of single human spermatozoa in cell-free zona pellucida. Andrologia 1999;31:49-53.
51. Nawroth F, Isachenko V, Dessole S, Rahimi G, Farina M, Vargiu N, Mallmann P, Dattena M, Capobianco G, Peters D et al. Vitrification of human spermatozoa without cryoprotectants. Cryo Letters 2002;23:93-102.
52. PacchiarottiJ, Ramos T, Howerton K, Greilach S, Zaragoza K, Olmstead M, Izadyar F. Developing a clinical-grade cryopreservation protocol for human testicular tissue and cells. Biomed Res Inst 2013;2013:930-62.
53. Parks JE, Graham JK. Effects of cryopreservation procedures on sperm membranes. Theriogenology 1992;38:209-22.
54. Polge C, Smith A, Parkes A. Revival of spermatozoa after virtification and dehydration at low temperatures. Nature 1949;164:666.
55. Robertson L, Watson PF. Calcium transport in diluted or cooled ram semen. J. Reprod. Fertil. 1986;77:177-85.
56. Robertson L, Watson PF, Plummer JM. Prior incubation reduces calcium uptake and membrane disruption in boar spermatozoa subjected to cold shock. Cryo Letters 1988;9:286-93.
57. Saunders KM, Parks JE. Effects of cryopreservation procedures on the cytology and fertilization rate of in vitro-matured bovine oocytes. Biol Reprod 1999;61:178-87.
58. Schuster G. Timothy, Laura M. Keller, Rodney L. Dunn, Dana A. Ohl and Gary D. Smith. Ultra rapid freezing of very low numbers of sperm using cryoloops. Hum Reprod 2003;18:778-95.
59. Sereni E, Bonu MA, Fava L, Sciajno R, Serrao L, Preti S, Distratis V, Borini A. Freezing spermatozoa obtained by testicular fine needle aspiration: a new technique. Reprod Biomed Online 2008;16:89-95.
60. Sohn JO, Jun SH, Park LS, Kim EK, Chung TG, Lee DR. Comparison of recovery and viability of sperm in ICSI pipette after ultra rapid freezing or slow freezing. Fertil Steril 2003;80:S128.
61. Sharma V. Sperm storage for cancer patients in the UK: a review of current practice. Hum Reprod 2001;26:2935-43.
62. Sherman JK. Research on frozen human sperm. In: 20th Annual Meeting of the American Society for the Study of Sterility. Bal Harbour, 1964, 29:2865-73 (abstract).
63. Sherman JK, Bunge RG. Observations on preservation of human spermatozoa at low temperatures. Proceedings of the Society for Experimental Biology and Medicine. Soc Exp Biol Med 1953;82:686-8.
64. Stacey G. Validation of cell culture media components. Hum Fertil 2004;7:113-8.
65. Leon-Quinto T, Simon MA, Sanchez A, Martin F, Soria B. Cryobanking the genetic diversity in the critically endangered Iberian lynx (Lynxpardinus) from skin biopsies. Investigating the cryopreservation and cultureability of highly valuable explants and cells. Cryobiology 2011;62:145-51.
66. Walmsley R, Cohen J, Ferrara-Congedo T, Reing A, Garrisi J. The first births and ongoing pregnancies associated with sperm cryopreservation within evacuated egg zonae. Hum Reprod 1998;13(suppl. 4):61-70.
67. Walters E, Benson J, Woods E, Critser J. The history o f sperm cryopreservation. In: Sperm Banking: Theory and Practice, Pacey AA, Tomilson MJ (eds), Cambridge University Press, 2009:1-17.
68. Dyah W, Yeung C-H, Junaidi A, Cooper TG. Multistep and single-step treatment of human spermatozoa with cryoprotectants. Biomed Res Inst 2009;92:382-9.
69. Woods EJ, Benson JD, Aqca Y, Critser JK. Fundamental cryobiology of reproductive cells and tissues. Cryobiology 2004;48:146-56.
70. Wowk B. How cryoprotectats work. Cryonics 2007;28:6-7.
71. Yogev L, Kleiman SE, Shabtai E, Botchan A, Paz G, Hauser R, Lehavi O, Yavetz H, Gamzu R. Long-term cryostorage of sperm in a human sperm bank does not damage progressive motility concentration. Hum Reprod 2010;25:1097-1103.
Created: September 27, 2015
Last update: September 27, 2015

