Δ.Ι. Αποστολόπουλος
Αναπληρωτής Καθηγητής Πυρηνικής Ιατρικής
Πανεπιστημίου Πατρών
Εισαγωγή
Σκοπός του παρόντος πονήματος είναι να αποτελέσει ένα σύγχρονο και πλήρες, στο μέτρο του δυνατού, βοήθημα για τους ειδικευόμενους στην Ενδοκρινολογία και την Πυρηνική Ιατρική αλλά και για ειδικευμένους ιατρούς, όσον αφορά στις ραδιοϊσοτοπικές εξετάσεις και τις ενδείξεις τους στις παθήσεις του θυρεοειδούς αδένα. Βάση για την σύνταξη του κειμένου απετέλεσε κύρια η εμπειρία από τη μακρόχρονη ενασχόληση του γράφοντος με το αντικείμενο, συνεπικουρουμένη από αρκετές έγκυρες βιβλιογραφικές πηγές.
Θεωρώ ότι το κοινό σπινθηρογράφημα του θυρεοειδούς, από τις παλαιότερες και συνηθέστερες εξετάσεις της Πυρηνικής Ιατρικής, είναι αυτό με τις συχνότερες, ίσως, διαγνωστικές αστοχίες και παρεξηγήσεις. Πρόκειται για μια λειτουργική εξέταση με αδρή μόνο ανατομική πληροφορία, της οποίας η λανθασμένη ερμηνεία πολλές φορές οφείλεται στην έλλειψη επαρκών στοιχείων για την κλινική εικόνα και τα ευρήματα του εργαστηριακού και λοιπού απεικονιστικού ελέγχου, στη χρησιμοποίηση όχι κατάλληλης τεχνικής και στην παράλειψη της ψηλάφησης του αδένα για τη σύγκριση ψηλαφητικών και σπινθηρογραφικών ευρημάτων. Το πρόβλημα δεν περιορίζεται στα όρια της πατρίδας μας. Χαρακτηριστικά αναφέρω μια έρευνα σε 350 κέντρα Πυρηνικής Ιατρικής 11 πολιτειών των ΗΠΑ το 2009, όπου διαπιστώθηκε ότι σε 25% δεν χρησιμοποιείται κατευθυντήρας pinhole, σε 23% η εξέταση περιορίζεται σε μόνο μία πρόσθια λήψη του τραχήλου χωρίς βοηθητικούς ραδιενεργούς δείκτες και μόνο σε 40% συμπεριλαμβάνεται η ψηλάφηση του θυρεοειδούς ως μέρος της εξέτασης (1).
Ενίοτε η χρησιμοποιουμένη ορολογία για τον χαρακτηρισμό ορισμένων ευρημάτων προκαλεί σύγχυση. Ως παράδειγμα αναφέρω τη συχνή περίπτωση «χλιαρών» , «αδιαφοροποίητων» ή ακόμα και «θερμών» όζων στο σπινθηρογράφημα , που συνοδεύονται από φυσιολογική TSH. Έχουν χαρακτηριστεί σωστά ή μήπως η επιπροβολή όζου και υγιούς παρεγχύματος δημιουργεί λανθασμένη εντύπωση; είναι πράγματι αυτοί οι όζοι λειτουργικοί; είναι «ολίγον» λειτουργικοί ή μήπως τελικά είναι μη λειτουργικοί; αποδίδεται σωστά η λειτουργικότητά τους με το υπερτεχνητικό ανιόν που χρησιμοποιείται συνήθως; πως πρέπει να αντιμετωπιστούν; Για τις ενδείξεις του σπινθηρογραφήματος δεν υπάρχει πλήρης συμφωνία, όχι μόνο μεταξύ των κλινικών που χειρίζονται ασθενείς με θυρεοειδοπάθεια, αλλά και μεταξύ των επίσημων κατευθυντήριων οδηγιών διαφόρων επιστημονικών Εταιρειών.
Όσον αφορά στη μέτρηση της θυρεοειδικής πρόσληψης του ιωδίου και στο ολόσωμο scan με Ι-131, επίσης κλασσικές και πολύ συχνές εξετάσεις, υπάρχουν και εδώ αντικρουόμενες απόψεις για τις ενδείξεις, τη χρησιμότητα και την αξιοποίηση των ευρημάτων. Η αξιολόγηση των ευρημάτων του ολόσωμου scan θέλει προσοχή, διότι, παρά την υψηλή ειδικότητα των ισοτόπων του ιωδίου για την ανίχνευση θυρεοειδικού ιστού (ορθότοπου, έκτοπου ή μεταστατικού) τα ψευδώς θετικά ευρήματα δεν ελλείπουν. Η χρήση της υβριδικής τεχνολογίας SPECT/CT (single photon emission computed tomography/computed tomography) έχει πολλές φορές καθοριστική σημασία για την ερμηνεία των ευρημάτων. Η αξία της SPECT/CT έχει τονιστεί στη βιβλιογραφία, ωστόσο η έλλειψη τέτοιων συστημάτων στην εγχώρια και σε μικρότερο βαθμό στην διεθνή αγορά, μπορεί να οδηγήσει σε άγνοια από τον κλινικό των πλεονεκτημάτων της εφαρμογής της.
Τέλος, η εξέταση βασισμένη στην τεχνολογία ανίχνευσης της ποζιτρονιακής εκπομπής (positron emission tomography, PET) με διάφορους ραδιενεργούς ιχνηθέτες, παρ’ όλο που η εξάπλωσή της έχει καθυστερήσει πολύ στη χώρα μας, έχει θέση στη διερεύνηση του καρκίνου του θυρεοειδούς, διαφοροποιημένου, αδιαφοροποίητου και μυελοειδούς. Οι ενδείξεις και η επιλογή της κατάλληλης μεθόδου πρέπει να είναι σε γνώση των ιατρών που χειρίζονται τέτοιους ασθενείς.
Με την προσδοκία ότι τα παραπάνω, αλλά και πολλά άλλα θέματα προσεγγίζονται εύληπτα και διεξοδικά στο κείμενο που ακολουθεί, παρουσιάζεται μια ανάλυση των ραδιοϊσοτοπικών τεχνικών στις παθήσεις του θυρεοειδούς αδένα. Ως βοηθητικές του κειμένου παρατίθενται αρκετές εικόνες, τυπικές, λιγότερο τυπικές αλλά συνήθεις, καθώς και μερικές ασυνήθεις. Όλες οι εικόνες προέρχονται από το εργαστήριο Πυρηνικής Ιατρικής του Πανεπιστημιακού Νοσοκομείου Πατρών, εκτός από δύο τελευταίες εξετάσεις PET, οι οποίες είναι ευγενική προσφορά συνεργαζόμενου εργαστηρίου του εξωτερικού.
1. Σπινθηρογράφημα θυρεοειδούς αδένα
1.1. Ραδιοφάρμακα απεικόνισης θυρεοειδούς αδένα. Μηχανισμοί πρόσληψης.
1.1.1. Υπερτεχνητικό ανιόν (Tc-O4-, pertechnetate) επισημασμένο με Tc-99m
Το συνηθέστερα χρησιμοποιούμενο ραδιοφάρμακο για την απεικόνιση του θυρεοειδούς είναι το υπερτεχνητικό νάτριο (NaTcO4), επισημασμένο με το ραδιοϊσότοπο τεχνήτιο-99m (Tc-99m). Είναι φτηνό, ανά πάσα στιγμή διαθέσιμο στο εργαστήριο Πυρηνικής Ιατρικής. Είναι το προϊόν έκλουσης της στήλης μολυβδενίου-τεχνητίου (Mo99àTc99m), η οποία τροφοδοτεί καθημερινά το εργαστήριο με Tc-99m για ποικίλες απεικονιστικές εφαρμογές. Πέραν της έκλουσης δεν απαιτείται καμία άλλη διαδικασία παρασκευής του ραδιοφαρμάκου. Το Tc-99m εκπέμπει, σχεδόν αποκλειστικά, φωτόνια γ-ακτινοβολίας, με ενέργεια 140 KeV. Έχει φυσικό χρόνο ημίσειας ζωής 6,02 ώρες. Το 99mTcO4 χορηγείται ενδοφλέβια στον ασθενή σε δόση 37-185 MBq (1-5 mCi) και η απεικόνιση λαμβάνει χώρα μετά από 15-20 min. Η χορηγούμενη δόση που αναφέρθηκε έχει σαν αποτέλεσμα την υψηλή ροή φωτονίων στη μονάδα του χρόνου, η οποία επιτρέπει την ολοκλήρωση της απεικόνισης σε λίγα μόνο λεπτά. Η ενέργεια της γ-ακτινοβολίας που εκπέμπει το Tc-99m είναι ιδανική για τον κρύσταλλο της γ-camera, το οποίο συνεπάγεται υψηλή ποιότητα απεικόνισης. Ο μηχανισμός πρόσληψης του υπερτεχνητικού ανιόντος (TcO4–) από τα θυρεοειδικά κύτταρα είναι κοινός για μονοσθενή ανιόντα παρόμοιου μοριακού βάρους, όπως Ι–, ClΟ3–, NO3–, CN– και επιτελείται μέσω του συμμεταφορέα νατρίου-ιωδίου (sodium-iodide symporter, NIS). Με τον τρόπο αυτό, τα παραπάνω ανιόντα μεταφέρονται στο εσωτερικό του κυττάρου (2). Στη συνέχεια όμως, μόνο το ιόν του ιωδίου (ιωδίδιο) αποτελεί υπόστρωμα για τη δράση της υπεροξειδάσης και μετά την οξείδωσή του συμμετέχει στο σχηματισμό των θυρεοειδικών ορμονών, ενώ το TcO4– (όπως και τα άλλα ιόντα που προαναφέρθηκαν) μετά από ένα χρονικό διάστημα αποβάλλεται από το θυρεοειδικό κύτταρο (Eικόνα 1.1). Η πρόσληψη του TcO4– και η κατανομή του στο θυρεοειδικό παρέγχυμα αποδίδει μόνο το μηχανισμό παγίδευσης (trapping) των μονοσθενών ανιόντων. Η διαφορά αυτή ευθύνεται για τις ασυμφωνίες απεικόνισης μεταξύ των ισοτόπων τεχνητίου και ιωδίου, που θα δούμε παρακάτω. Η πρόσληψη του υπερτεχνητικού ανιόντοςαπό το θυρεοειδικό κύτταρο είναι ταχεία και μεγιστοποιείται σε περίπου 15 min από την ενδοφλέβια χορήγηση, παραμένει περίπου σταθερή μεταξύ 15-30 min, ενώ μετά τα 30 min μειώνεται σταδιακά. Φυσιολογικά ο θυρεοειδής προσλαμβάνει ένα μικρό μόνο ποσοστό της χορηγούμενης δόσης (0,3-3% και έως 7% σε περιοχές ένδειας ιωδίου) (3). Η ακτινική επιβάρυνση του ασθενούς είναι μικρή (δόση στο θυρεοειδή 2.4-12 mGy, ενεργός δόση 0,48-2,4 mSv) (4). Το υπερτεχνητικό ανιόν προσλαμβάνεται φυσιολογικά και από άλλους ιστούς που εκφράζουν τον NIS, όπως οι σιελογόνοι αδένες, ο στόμαχος, ο θύμος, ο μαζικός αδένας (ιδιαίτερα σε γαλουχία) και τα χοριοειδή πλέγματα του εγκεφάλου (2). Αποβάλλεται από τους νεφρούς και το έντερο.
1.1.2. Ισότοπο του ιωδίου I-123
Το ιωδιούχο νάτριο, επισημασμένο με ιώδιο-123 (Na123Ι) αποτελεί θεωρητικά το ιδανικό ραδιοφάρμακο για την απεικόνιση του θυρεοειδούς αδένα. Η κύρια ακτινοβολία που εκπέμπει το Ι-123 είναι γ-φωτόνια ενέργειας 159 KeV. Ο μεταβολισμός του I-123 είναι ταυτόσημος με αυτόν του φυσικού – μη ραδιενεργού – ισοτόπου (Ι-127) και τα απεικονιστικά χαρακτηριστικά του ευνοϊκά για το ανιχνευτικό σύστημα (γ-camera). To I-123 είναι επίσης κατάλληλο για μέτρηση της θυρεοειδικής πρόσληψης (uptake) του ιωδίου 4 και 24 h από τη χορήγηση, καθώς και για τη διενέργεια ολόσωμου σπινθηρογραφήματος για την παρακολούθηση του διαφοροποιημένου καρκίνου του θυρεοειδούς. Ωστόσο, είναι ακριβό (παράγεται σε κύκλοτρο) και διαθέσιμο στο εργαστήριο μόνο κατόπιν παραγγελίας. Η δόση ακτινοβολίας στον θυρεοειδή είναι 1,9 mGy/MBq, υψηλότερη του Tc-99m (0,06 mGy/ MBq) (4). Προκειμένου να διατηρηθεί σε λογικά επίπεδα η ακτινοβόληση του θυρεοειδούς, η χορηγούμενη δόση είναι μικρή (7,4-14,8 MBq ή 200-400 μCi), με αποτέλεσμα η ροή φωτονίων να είναι χαμηλή και ως εκ τούτου η απεικόνιση να απαιτεί πολύ μεγαλύτερο χρόνο (20-30 min) από αυτόν του Tc-99m (περίπου 5 min) για να ολοκληρωθεί. Ο χρόνος παραμονής του ασθενούς στο εργαστήριο είναι μακρός (ή απαιτούνται δύο επισκέψεις), καθώς μεταξύ χορήγησης και απεικόνισης μεσολαβεί χρονικό διάστημα 4-6 ωρών (ή εναλλακτικά 24 ωρών). Το Ι-123 υπερτερεί του Tc-99m διότι αποδίδει τον μηχανισμό παγίδευσης αλλά και οργανοποίησης του ιωδίου, έχει εντονότερη πρόσληψη από τον αδένα και επιτυγχάνει καλύτερη απεικονιστική αντίθεση (contrast) μεταξύ θυρεοειδούς και ιστών που τον περιβάλλουν. Όμως, για τους λόγους που προαναφέρθηκαν, η χρήση του στην καθ’ ημέρα πράξη είναι πολύ περιορισμένη και οι ενδείξεις του αφορούν κυρίως σε περιπτώσεις καταδυόμενης βρογχοκήλης ή έκτοπου θυρεοειδικού ιστού (π.χ. struma ovarii) και όταν υπάρχει η υποψία ότι ο χαρακτηρισμός ενός όζου βάσει της εικόνας του Tc-99m είναι εσφαλμένος (3,4).

Εικόνα 1.1. Μηχανισμός πρόσληψης των μονοσθενών ανιόντων από το θυρεοειδικό κύτταρο. TcO4-: υπερτεχνητικό ανιόν, TSHR: υποδοχέας της TSH, NIS: συμμεταφορέας νατρίου/ιωδίου, TPO: θυρεοειδική υπεροξειδάση.
1.1.3. Ισότοπο του ιωδίου I-131
Το Ι-131 χρησιμοποιείται σπάνια πια για την απεικόνιση του θυρεοειδούς, λόγω της απαράδεκτα υψηλής ακτινικής επιβάρυνσης (δόση στο θυρεοειδή 220 mGy/MBq) που συνεπάγεται (πίνακας 1.1). Η απεικόνιση λαμβάνει χώρα 24-48 ώρες από τη χορήγηση. Η ποιότητα της απεικόνισης είναι μέτρια έως πτωχή, λόγω της υψηλής ενέργειας (364 KeV) και της χαμηλής ροής των φωτονίων γ-ακτινοβολίας που εκπέμπονται. Η παράλληλη εκπομπή β-ακτινοβολίας (ηλεκρόνια) είναι άχρηστη για την απεικόνιση, ενώ συμβάλλει σημαντικά στην υψηλή ακτινική επιβάρυνση του ασθενούς. Λόγω ευρύτερης διαθεσιμότητας και σημαντικά χαμηλότερου κόστους σε σχέση με το Ι-123, το Ι-131 χρησιμοποιείται σε δόσεις ολίγων μCi (5-50) per os για τη μέτρηση του uptake και σε δόση 50-100 μCi per os για την επιβεβαίωση καταδυόμενης βρογχοκήλης, όταν οι εικόνες του Tc-99m δεν είναι διαγνωστικές. Στην καταδυόμενη βρογχοκήλη, η μεγαλύτερη διεισδυτικότητα των γ-φωτονίων υψηλής ενέργειας του Ι-131 αποτελεί πλεονέκτημα έναντι του Tc-99m και του Ι-123, διότι έτσι η απορρόφηση της ακτινοβολίας από την παρεμβολή του στέρνου είναι μικρότερη (Eικόνα 1.2).
Εικόνα 1.2. Καταδυόμενη βρογχοκήλη. Παρουσιάζεται ο ίδιος ασθενής με 99mTc-pertechnetate και 131Ι. Το καταδυόμενο τμήμα όχι μόνο απεικονίζεται ευκρινέστερα με το 131Ι, αλλά επίσης αναδεικνύεται λειτουργικός όζος, ο οποίος δεν είναι εμφανής στην εικόνα του 99mTc
Τα χαρακτηριστικά των τριών ραδιοφαρμάκων που αναφέρθηκαν συνοψίζονται και αντιπαραβάλλονται στον πίνακα 1.1.
1.1.4. Άλλα ραδιοφάρμακα
Το 99mTc-Sestamibi χρησιμοποιείται στις μελέτες αιμάτωσης του μυοκαρδίου και στην προεγχειρητική εντόπιση διογκωμένων παραθυρεοειδών αδένων. Στη διερεύνηση των παθήσεων του θυρεοειδούς η χρήση του είναι περιορισμένη και αμφιλεγόμενη. Σε επόμενη ενότητα (1.4. Ενδείξεις, τυπικές εικόνες) αναφέρονται , κάποιες πιθανές ενδείξεις. Το 99mTc-Sestamibi είναι ένα λιπόφιλο μόριο με θετικό φορτίο. Εισέρχεται στα κύτταρα διαφόρων ιστών παθητικά μέσω της κυτταρικής μεμβράνης (με την προϋπόθεση ότι αυτή είναι ακέραια, δηλαδή ότι το κύτταρο είναι ζωντανό), ελκόμενο από το υπάρχον αρνητικό ενδοκυττάριο ηλεκτρικό δυναμικό (ηλεκτρικό πρανές). Εντός του κυττάρου μέρος του εγκλωβίζεται στα μιτοχόνδρια, λόγω του αρνητικού ηλεκτρικού φορτίου που υφίσταται στο εσωτερικό τους. Η απομάκρυνσή του από το κύτταρο γίνεται όχι μόνο παθητικά (όταν δηλαδή ελαττωθεί η συγκέντρωσή του στο αίμα), αλλά και μέσω πρωτεϊνών της κυτταρικής μεμβράνης που σχετίζονται με τους μηχανισμούς αντίστασης στα χημειοθεραπευτικά (multidrug resistance, MDR) (5). Ο βαθμός αρχικής πρόσληψης και κατακράτησής του σε ένα όργανο ή ιστό εξαρτάται από την αιμάτωσή του, την κυτταροβρίθεια, τη λειτουργικότητα (δηλ. με την πυκνότητα και τη δραστηριότητα των μιτοχονδρίων) και την έκφραση πρωτεϊνών MDR στη μεμβράνη. Η πρόσληψη του Sestamibi από τα θυρεοειδικά κύτταρα δεν εξαρτάται από τα επίπεδα ιωδίου στο αίμα, το βαθμό έκφρασης του NIS και την TSH και δεν επηρεάζεται ιδιαίτερα από τη θεραπεία υποκατάστασης με LT4 ή από τη λήψη αντιθεοειδικών. Το 99mTc-Sestamibi δεν έχει ιστική ειδικότητα (όπως το ιωδίδιο για τους ιστούς που εκφράζουν τον NIS) και δεν διακρίνει αξιόπιστα τις κακοήθεις από τις καλοήθεις εξεργασίες.
Πίνακας 1. 1. Σπινθηρογράφημα θυρεοειδούς. Σύγκριση ραδιοφαρμάκων.
| 99mTcO4 | 123I | 131I | |
| Τρόπος παραγωγής | Στήλη μολυβδενίου-τεχνητίου | Κύκλοτρο | Πυρηνικός αντιδραστήρας |
| Είδος ακτινοβολίας | γ | γ | β– και γ |
| Ενέργεια γ-φωτονίων | 140 KeV | 159 KeV | 364 KeV |
| Φυσικός χρόνος ημίσειας ζωής | 6,03 ώρες | 13,3 ώρες | 8.06 ημέρες |
| Χορηγούμενη δόση | 1-5 mCi (37-185 MBq) | 200-400 μCi (7,4-14,8 MBq) | 50-100 μCi (1,8-3,7 MBq) |
| Οδός χορήγησης | ενδοφλέβια | per os | per os |
| Χρόνος μέχρι την απεικόνιση | 15-20 λεπτά | 4-24 ώρες | 24-48 ώρες |
| Απορροφούμενη δόση (θυρεοειδής) | 2,4-12 mGy | 14-28 mGy | 400-800 mGy |
| Ενεργός δόση (Effective dose) | 0,48-2,4 mSv | 0,8-1,6 mSv | 20-40 mSv |
| Όργανο που ακτινοβολείται περισσότερ | Αριστερό κόλον | θυρεοειδής | θυρεοειδής |
| Μηχανισμός πρόσληψης | NIS (trapping) | NIS+οργανοποίηση | NIS+οργανοποίηση |
| Ποιότητα απεικόνισης | Καλή | Υψηλή | Μέτρια έως πτωχή |
| Βαθμός πρόσληψης (uptake) | 0,3% – 3% (στα 20 λεπτά) | 10 – 35% (στις 24 ώρες) | 10 – 35% (στις 24 ώρες |
| Κόστος | Πολύ χαμηλό | Πολύ υψηλό | Χαμηλό |
| Διαθεσιμότητα | Καθημερινή και άμεση | Κατόπιν παραγγελίας | Κατόπιν παραγγελίας |
1.2. Προετοιμασία του ασθενούς
Πριν το σπινθηρογράφημα απαιτείται η διακοπή ορισμένων φαρμάκων ή η αναμονή μετά τη λήψη συγκεκριμένων ιωδιούχων σκευασμάτων για συγκεκριμένο χρονικό διάστημα, όπως φαίνεται στον πίνακα 1.2 (4). Αυξημένη συγκέντρωση ιωδίου στην κυκλοφορία μπορεί να προκύψει από πολλές εξωγενείς πηγές, οι οποίες δεν είναι πάντα εύκολο να αποκαλυφθούν κατά τη λήψη του ιστορικού. Η περίσσεια ιωδίου προκαλεί ελάττωση της πρόσληψης των ραδιοεπισημασμένων ανιόντων (τεχνητίου και ιωδίου) από τον θυρεοειδή, όχι μόνο λόγω του ανταγωνισμού «ψυχρού» και ραδιενεργού ανιόντος για τις θέσεις σύνδεσης στον NIS, αλλά και λόγω της ταχέως επαγόμενης ελάττωσης της έκφρασης του NIS στα θυρεοειδικά κύτταρα. Σε απότομη και υψηλή φόρτιση με ιώδιο προκαλείται παροδικά το γνωστό φαινόμενο Wolf-Chaikoff, κατά το οποίο εκτός της ελάττωσης του NIS προκαλείται αναστολή της οργανοποίησης του ιωδίου αλλά και της απελευθέρωσης θυρεοειδικών ορμονών στην κυκλοφορία (6).
Εάν διερευνάται η ύπαρξη αυτονομίας (διάχυτης ή εστιακής) σε ασθενή που είναι ήδη σε αγωγή με LT4, τότε η εξέταση πραγματοποιείται χωρίς διακοπή του φαρμάκου.
Η συνεχιζόμενη λήψη αντιθυρεοειδικών φαρμάκων δεν εμποδίζει την απεικόνιση του αδένα με 99mTcO4, διότι η δράση τους δεν εμπλέκεται άμεσα με το μηχανισμό πρόσληψης (trapping) των μονοσθενών ανιόντων από τον θυρεοειδή. Ωστόσο, σε περίπτωση εστιακής αυτονομίας (μονήρες αυτόνομο αδένωμα ή πολυοζώδης αυτόνομη βρογχοκήλη) η σπινθηρογραφική εικόνα θα είναι παραπλανητική ως προς την λειτουργικότητα των όζων, διότι θα ελλείπει η καταστολή του υπολοίπου παρεγχύματος, εφ’ όσον έχει φυσιολογικοποιηθεί η TSH. Ένα τέτοιο παράδειγμα δίνεται σε επόμενη ενότητα (1.5. Ερμηνεία, ερμηνευτικές παγίδες).
Πίνακας 1.2. Απαιτούμενος χρόνος διακοπής φαρμάκων ή ιωδιούχων σκευασμάτων, πριν από το σπινθηρογράφημα θυρεοειδούς.
| Φάρμακα ή άλλα σκευάσματα | Χρόνος διακοπής |
| Αντιθυρεοειδικά | 3-7 ημέρες |
| Τριιωδοθυρονίνη | 2 εβδομάδες |
| Θυροξίνη | 4 εβδομάδες |
| Σκευάσματα που περιέχουν ιώδιο (αποχρεμπτικά σιρόπια, βιταμινες, σκευάσματα διαιτητικών τροφών | 1-2 εβδομάδες |
| Τοπική χρήση ιωδίου | 1-2 εβδομάδες |
| Αμιοδαρόνη | 6 μήνες |
| Ιωδιούχα σκιαστικά | |
| – τα συνήθη υδατοδιαλυτά ενδοφλέβιας χορήγησης – λιποδιαλυτά per os (πχ. για χολοκυστογραφία) – σκιαστικά για βρογχογραφία – σκιαστικά για μυελογραφία |
3-4 εβδομάδες 3 μήνες 6-12 μήνες 2-10 έτη |
1.3. Σπινθηρογραφική τεχνική
Για την απεικονιστική μελέτη του θυρεοειδούς απαιτείται κατευθυντήρας οπής καρφίδας (pinhole), διότι έτσι επιτυγχάνεται μεγαλύτερη διακριτική ικανότητα (resolution) σε σύγκριση με τον κατευθυντήρα παραλλήλων οπών (parallel hole), ο οποίος χρησιμοποιείται στις υπόλοιπες απεικονιστικές εφαρμογές της Πυρηνικής Ιατρικής ή τουλάχιστον στη συντριπτική πλειοψηφία τους. Το άνοιγμα (aperture) του κατευθυντήρα pinhole πρέπει να είναι 5 mm ή μικρότερο. Όσο μικρότερη είναι η απόσταση του pinhole από το εξεταζόμενο όργανο, τόσο μεγαλύτερη είναι η διακριτική ικανότητα. Ωστόσο, ο ρυθμός συλλογής σημάτων (κρούσεων) είναι χαμηλότερος από αυτόν του parallel hole, με αποτέλεσμα η ολοκλήρωση της απεικόνισης να επιβραδύνεται. Επί πλέον, με τον pinhole η γεωμετρία της εικόνας είναι σχετικά παραμορφωμένη, καθώς τα σημεία που βρίσκονται πλησιέστερα στο άνοιγμα του κατευθυντήρα προβάλλονται στην εικόνα με μεγαλύτερο μέγεθος και διακριτική ικανότητα σε σύγκριση με αυτά που είναι πιο απομακρυσμένα. Οι βασικές διαφορές pinhole και parallel hole φαίνονται στην Εικόνα 1.3.
Ακόμα και με τη χρήση του κατευθυντήρα pinhole η διακριτική ικανότητα του σπινθηρογραφήματος είναι περιορισμένη. Μη λειτουργικοί όζοι μικρότεροι από 10 mm δεν απεικονίζονται. Ενίοτε, όζοι μεγαλύτεροι από 10 mm επίσης διαφεύγουν, ιδιαίτερα όταν είναι σε οπίσθια θέση, αλλά και όταν παρουσιάζουν πρόσληψη του ραδιοφαρμάκου που δεν υπολείπεται κατά πολύ από το γειτονικό υγιές παρέγχυμα. Οι λειτουργικοί όζοι ανιχνεύονται ευκολότερα, ακόμα και με διαστάσεις μικρότερες των 10 mm (έως και 5 mm).
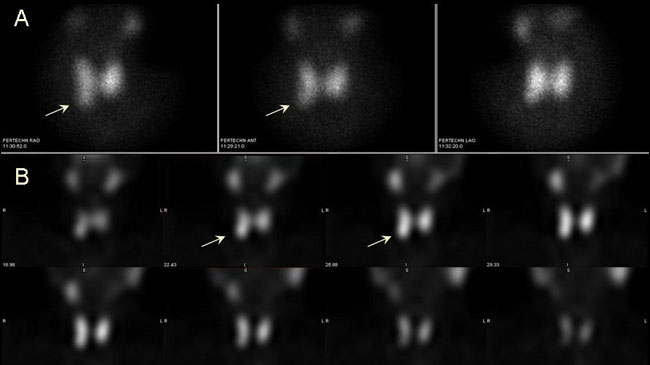
Συνήθως λαμβάνονται εικόνες σε πρόσθια (anterior, ANT) και πρόσθιες λοξές προβολές (right anterior oblique, RAO και left anterior oblique, LAO) με τον κατευθυντήρα σε απόσταση 5-7 cm από την επιφάνεια του τραχήλου. Οι λοξές λήψεις είναι χρήσιμες για την ευκρινέστερη διαγραφή ορισμένων όζων, την πληρέστερη εκτίμηση του μεγέθους τους και την αδρή εντόπισή τους στο χώρο, όπως φαίνεται στην Εικόνα 1.4. Λαμβάνεται επίσης μια μακρινή λήψη, σε απόσταση 15-20 cm από τον τράχηλο, προκειμένου να περιληφθεί στο απεικονιστικό πεδίο όλος ο τράχηλος και μέρος του θώρακα και να είναι καλύτερα αντιληπτές οι διαστάσεις του θυρεοειδούς και ο βαθμός πρόσληψης σε σχέση με τους σιελογόνους αδένες (Εικόνα 1.5). Τέλος, σε υποψία οπισθοστερνικής κατάδυσης τοποθετείται ένας μικρός (σημειακός) ραδιενεργός δείκτης (κοβαλτίου-57 ή αυτοσχέδιος Tc-99m) στη σφαγή (Εικόνα 1.6). Σε ορισμένες περιπτώσεις (όταν π.χ. διερευνάται το ενδεχόμενο υποξείας θυρεοειδίτιδας ή προκειμένου να επιβεβαιωθεί η νόσος Graves ή να εξεταστεί η λειτουργικότητα μεγάλων θυρεοειδικών όζων) η χρησιμοποίηση του κατευθυντήρα παραλλήλων οπών είναι αποδεκτή επιλογή. Για τη διερεύνηση της καταδυόμενης βρογχοκήλης προτιμάται ο κατευθυντήρας παραλλήλων οπών.
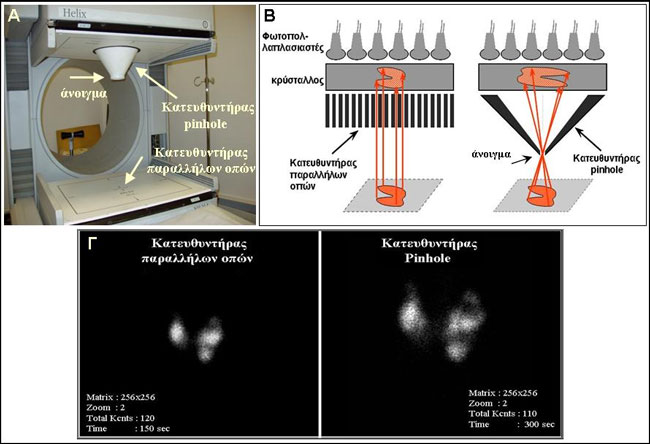
Εικόνα 1.3. Κατευθυντήρας παραλλήλων οπών και pinhole. Διαφορές στην απεικόνιση του θυρεοειδούς. Α) Δικέφαλη γ-κάμερα στην οποία η μία κεφαλή φέρει κατευθυντήρα pinhole και η άλλη κατευθυντήρα παραλλήλων οπών. Β) Σχηματική παρουσίαση της παραγωγής της σπινθηρογραφικής εικόνας με τους δύο κατευθυντήρες. Στην περίπτωση του pinhole, το είδωλο του οργάνου σχηματίζεται ανεστραμμένο, με μέγεθος (και ανάλογη χωρική διακριτική ικανότητα) τόσο μεγαλύτερο, όσο πλησιέστερα προς το όργανο τοποθετείται ο κατευθυντήρας. Γ) Είναι εμφανές το πλεονέκτημα της μεγαλύτερης διακριτικής ικανότητας που προσφέρει ο κατευθυντήρας pinhole.
Η τομογραφική σπινθηρογράφηση (single photon emission tomography, SPECT) δεν εκτελείται ως τεχνική ρουτίνας για τον έλεγχο του θυρεοειδούς. Σε επιλεγμένα περιστατικά μπορεί να παρέχει χρήσιμες επιπρόσθετες πληροφορίες. Μερικά παραδείγματα δίνονται σε επόμενη ενότητα (1.5. Ερμηνεία. Ερμηνευτικές παγίδες). Η SPECT και ακόμα περισσότερο η υβριδική SPECT/CT απεικόνιση είναι χρήσιμες τεχνικές στη διερεύνηση της καταδυόμενης βρογχοκήλης. Το θέμα αναπτύσσεται περισσότερο στην αντίστοιχη ενότητα.
Η ψηλάφηση του θυρεοειδούς αποτελεί μέρος της εξέτασης και δεν πρέπει να παραλείπεται (7). Επί παρουσίας ψηλαφητών όζων, η τοποθέτηση του σημειακού ραδιενεργού δείκτη στη θέση του ψηλαφητικού ευρήματος είναι χρήσιμη για την ερμηνεία των ευρημάτων, όπως φαίνεται στην Eικόνα 1.7. Η σημασία της ψηλάφησης τονίζεται και σε επόμενη ενότητα (1.5. Ερμηνεία, ερμηνευτικές παγίδες).
Το υπερτεχνητικό ανιόν και το ιόν του ιωδίου (ιωδίδιο) προσλαμβάνονται από τους σιελογόνους αδένες και μέρος τους εκκρίνεται στο σίελο. Ενίοτε, η παρουσία ραδιενεργού σιέλου στον οισοφάγο μπορεί να δημιουργήσει ερμηνευτικά προβλήματα (Εικόνα 1.8Α). Συνιστάται χορήγηση ύδατος per os είτε εκ συστήματος πριν το σπινθηρογράφημα ή όταν υπάρχουν ανάλογα ευρήματα. Σε αμφίβολες περιπτώσεις, μπορεί να βοηθήσει η υβριδική τομογραφική (SPECT/CT) μελέτη, όπως φαίνεται στην Eικόνα 1.8Β.
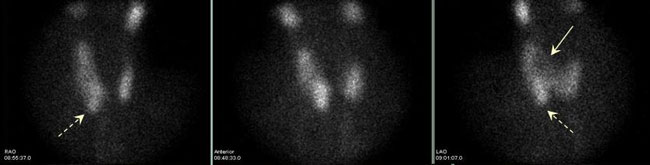
Εικόνα 1.4. Πρόσθια και λοξές λήψεις με κατευθυντήρα pinhole. Οι λοξές λήψεις βοηθούν στην ευκρινέστερη διαγραφή μερικών όζων αλλά και στην αδρή εντόπισή τους στο χώρο, όπως ο «ψυχρός» όζος κατά τον άνω πόλο του δεξιού λοβού που φαίνεται καλύτερα στη αριστερή λοξή λήψη και είναι σε οπίσθια θέση (βέλος) και ο «θερμός όζος στον κάτω πόλο του δεξιού λοβού, ο οποίος στις λοξές λήψεις φαίνεται να είναι σε πρόσθια θέση (διακεκομμένα βέλη).

Εικόνα 1.5. Μακρινή και κοντινή λήψη με κατευθυντήρα pinhole. Στην μακρινή λήψη γίνονται καλύτερα αντιληπτές οι διαστάσεις του θυρεοειδούς και συγκρίνεται η πρόσληψη με αυτή των σιελογόνων. Η κοντινή λήψη προσφέρει μεγαλύτερη διακριτική ικανότητα. Εδώ απεικονίζεται μια μεγάλη πολυοζώδης βρογχοκήλη.
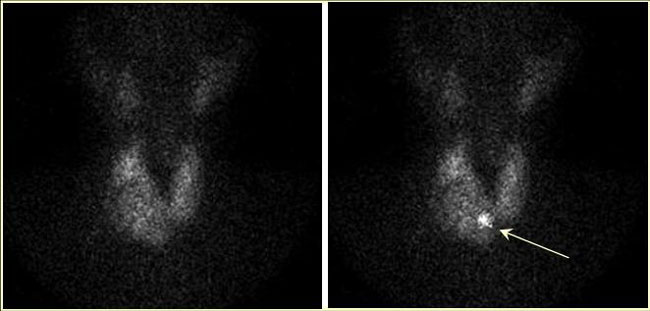
Εικόνα 1.6. Ο ίδιος ασθενής της προηγούμενης εικόνας, πριν μετά την τοποθέτηση μικρού αυτοσχέδιου ραδιενεργού δείκτη στη σφαγή (βέλος). Φαίνεται ότι τα κάτω όρια του θυρεοειδούς καταδύονται οπισθοστερνικά.
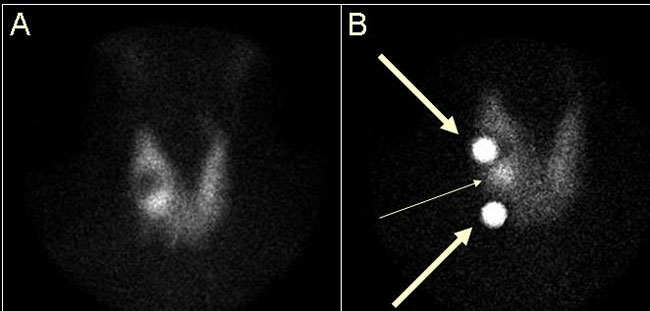
Εικόνα 1.7. Η αξία της χρήσης ραδιενεργού δείκτη σε συνδυασμό με την ψηλάφηση. Στην παρούσα περίπτωση οι δείκτες έχουν τοποθετηθεί στη θέση δύο ψηλαφητών όζων του δεξιού λοβού (παχέα βέλη). Πρόκειται για δύο μη λειτουργικούς όζους. Μεταξύ αυτών υπάρχει αψηλάφητος λειτουργικός όζος (λεπτό βέλος).

Εικόνα 1.8. Παρουσία ραδιοεπισημασμένου σιέλου στον οισοφάγο. Α) Πρόσθια λήψη του τραχήλου και του θώρακα, με κατευθυντήρα παραλλήλων οπών. Διακρίνεται έντονη γραμμοειδής συγκέντρωση του ραδιοφαρμάκου στον οισοφάγο (μακρύ οριζόντιο βέλος). Β) SPECT/CT μελέτη στο θώρακα. Επιβεβαιώνεται η εντόπιση του ευρήματος στην ανατομική θέση του οισοφάγου (κοντά λοξά βέλη).
1.4. Ενδείξεις. Τυπικές εικόνες
Οι ενδείξεις του σπινθηρογραφήματος συνοψίζονται στον πίνακα 1.3.
1.4.1. Διαφορική διάγνωση της θυρεοτοξίκωσης
Εδώ ο ρόλος του σπινθηρογραφήματος συνίσταται κατ’ αρχήν στη διάκριση μεταξύ θυρεοτοξίκωσης με υψηλή (ή φυσιολογική) πρόσληψη (uptake) και θυρεοτοξίκωσης με χαμηλή (ή μηδενική) πρόσληψη (8). Σύμφωνα με τις πρόσφατες κατευθυντήριες οδηγίες της Αμερικανικής Εταιρείας Θυρεοειδούς (American Thyroid Association, ATA) και της Αμερικανικής Εταιρείας Κλινικών Ενδοκρινολόγων (American Association of Clinical Endocrinologists, AACE), το uptake ιωδίου είναι απαραίτητο, όταν η διάγνωση της νόσου Graves δεν είναι προφανής (9). Εναλλακτικά του uptake μπορεί να χρησιμοποιηθεί το σπινθηρογράφημα με Tc-99m pertechnetate. Στην Eικόνα 1.9 παρουσιάζονται δύο χαρακτηριστικές εικόνες και παρατίθενται τα αίτια σε κάθε περίπτωση.
Πίνακας 1.3. Ενδείξεις σπινθηρογραφήματος θυρεοειδούς.
| Ενδείξεις |
| • Διαφορική διάγνωση θυρεοτοξίκωσης • Χαρακτηρισμός της λειτουργικότητας θυρεοειδικών όζων • Διερεύνηση οπισθοστερνικής μάζας – επιβεβαίωση καταδυόμενης βρογχοκήλης • Διερεύνηση του νεογνικού υποθυρεοειδισμού |
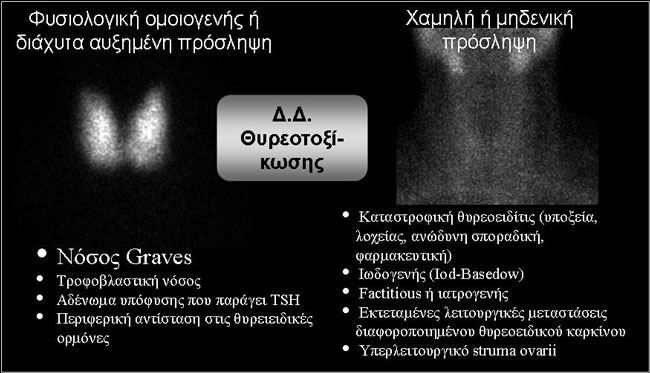
Εικόνα 1.9. Σπινθηρογραφικά πρότυπα και τα αίτιά τους σε θυρεοειδοτοξίκωση, επί απουσίας όζων.
Η διαφορική διάγνωση της νόσου Graves από την υπερθυρεοειδική φάση της χρόνιας θυρεοειδίτιδας (Hashitoxicosis) δεν είναι εύκολη από σπινθηρογραφική και μόνο εικόνα. Γενικά, το uptake ιωδίου (και του τεχνητίου) είναι υψηλότερο στη πρώτη σε σύγκριση με τη δεύτερη περίπτωση (3), υπάρχει όμως επικάλυψη των τιμών. Η διαφορική διάγνωση θα στηριχθεί κυρίως σε κλινικά, υπερηχογραφικά και εργαστηριακά ευρήματα.
Στην υποξεία θυρεοειδίτιδα (de Quervain) τυπικά η πρόσληψη ιωδίου και τεχνητίου είναι πολύ χαμηλή, πρακτικά μηδενική. Ωστόσο, τα σπινθηρογραφικά πρότυπα μπορεί να διαφέρουν, ανάλογα με την έκταση της φλεγμονής και το χρόνο διενέργειας της εξέτασης σε σχέση με την έναρξη των συμπτωμάτων. Έτσι, μπορεί να διαγράφεται ο θυρεοειδής με διάχυτα ασθενή (όχι όμως πλήρως καταργημένη) πρόσληψη, ενίοτε η απεικόνιση των λοβών είναι ασύμμετρη (απουσία πρόσληψης στην πλευρά που άρχισαν τα συμπτώματα) και στη σπανιότερη περίπτωση εστιακής θυρεοειδίτιδας η εικόνα μπορεί να υποδύεται την παρουσία μη λειτουργικού όζου (Eικόνα 1.10).

Εικόνα 1.10. Σπινθηρογραφικά πρότυπα σε υποξεία θυρεοειδίτιδα. Στο κέντρο και δεξιά παρουσιάζονται δυο λιγότερο συχνές περιπτώσεις με ετερόπλευρη και εστιακή θυρεοειδίτιδα, αντίστοιχα. Η συνολική πάντως πρόσληψη είναι και σε αυτές τις περιπτώσεις ασθενής, λόγω της (μερικής) καταστολής του υγιούς παρεγχύματος (είσοδος θυρεοειδικών ορμονών στην κυκλοφορία από την πάσχουσα περιοχή -> καταστολή της TSH).
Ασθενής ή μηδενική πρόσληψη ιωδίου και τεχνητίου παρατηρείται στη θυρεοειδίτιδα της λοχείας, στην ανώδυνη σποραδική θυρεοειδίτιδα, καθώς και στην τεχνητή (facticious) ή την ιατρογενή θυρεοτοξίκωση. Στον ιωδογενή υπερθυρεοειδισμό (Iod-Basedow) η πρόσληψη ποικίλει. Μπορεί να είναι υψηλή, φυσιολογική ή ασθενής (7).
Το συχνότερο αίτιο φαρμακευτικής θυρεοειδίτιδας είναι η αμιοδαρόνη, ενώ λιγότερο συχνά η ιντερφερόνη-α, το λίθιο και η ιντερκευκίνη-2. Τα ίδια φάρμακα, λιγότερο ή περισσότερο συχνά, μπορούν να προκαλέσουν υποθυρεοειδισμό ή υπερθυρεοειδισμό (10). Η διάκριση μεταξύ υπερθυρεοειδισμού και θυρεοτοξίκωσης λόγω καταστροφικής θυρεοειδίτιδας, είναι ευχερής βάσει της πρόσληψης ιωδίου/τεχνητίου στις άλλες, πλην της αμιοδαρόνης, περιπτώσεις (10). Στη θυρεοτοξίκωση εξ αμιοδαρόνης το φυσιολογικό ή το υψηλό uptake υποδηλώνει ιωδογενή υπερθυρεοειδισμό (θυρεοτοξίκωση εξ αμιοδαρόνης τύπου Ι), όμως το χαμηλό uptake δεν είναι διαγνωστικό, διότι μπορεί να σχετίζεται είτε με καταστροφική θυρεοειδίτιδα (θυρεοτοξίκωση εξ αμιοδαρόνης τύπου ΙI) ή με ιωδογενή υπερθυρεοειδισμό (τύπου I, όπως αναφέρθηκε και στην περίπτωση Iod-Basedow). Οι δύο τύποι μπορεί να συνυπάρχουν, δημιουργώντας έτσι επιπρόσθετες διαγνωστικές δυσκολίες. Το υπερηχογράφημα color-flow doppler μπορεί να βοηθήσει στη διαφορική διάγνωση, όταν εκτελείται από έμπειρο ακτινολόγο (11). Η αυξημένη αιμάτωση του θυρεοειδούς είτε διάχυτα ή σε υπάρχοντες όζους υποδηλώνει θυρεοτοξίκωση εξ ιωδιούχων (τύπος I), ενώ η ελαττωμένη καταστροφική θυρεοειδίτιδα. Όμως, συχνά στην καθημερινή πράξη, σύμφωνα τουλάχιστον με την τοπική εμπειρία, το υπερηχογράφημα δεν βοηθά ουσιαστικά. Έχει υποστηριχθεί ότι το σπινθηρογράφημα με 99mTc-Sestamibi μπορεί να προσφέρει στη διαφορική διάγνωση. Η πρόσληψη του 99mTc-Sestamibi και η κατακράτησή του από το θυρεοειδικό κύτταρο συντελείται μέσω άλλου μηχανισμού, ο οποίος δεν έχει σχέση με την υπερεφόρτιση της αιματικής δεξαμενής με ιώδιο, αλλά με τη μιτοχονδριακή δραστηριότητα, η οποία αντανακλά τη λειτουργική κατάσταση του κυττάρου. Στην καταστροφική θυρεοειδίτιδα η πρόσληψη του Sestamibi είναι ελάχιστη η μηδενική, λόγω δυσλειτουργίας του θυρεοειδικού κυττάρου, ενώ στον ιωδογενή υπερθυρεοειδισμό είναι φυσιολογική ή αυξημένη (12). Σύμφωνα με τη δική μας εμπειρία, ο συνδυασμός των δύο ραδιοφαρμάκων μπορεί να βοηθήσει σε μερικές περιπτώσεις, όπως φαίνεται στην εικόνα 1.11, όμως συχνά το διαγνωστικό πρόβλημα παραμένει. Σημαντική δυσκολία στην αξιολόγηση των απεικονιστικών ευρημάτων προκύπτει από την έλλειψη μεθόδου αναφοράς, καθώς κανένα κλινικό, απεικονιστικό, βιοχημικό ή παθολογοανατομικό κριτήριο δεν είναι ασφαλές για την τελική διάγνωση. Το θεραπευτικό κριτήριο (δηλ. η έκβαση, εάν ο ασθενής λάβει μόνο αντιθυρεοειδικά φάρμακα ή μόνο κορτικοειδή) είναι ισχυρά ενδεικτικό, όμως πολλές φορές δεν είναι αξιοποιήσιμο στην πράξη, διότι συχνά οι ασθενείς αντιμετωπίζονται με συνδυασμό αντιθυρεοειδικών και κορτικοειδών. Προφανώς, η συνύπαρξη των δύο μηχανισμών, με άγνωστη συχνότητα και άγνωστο βαθμό συμμετοχής τους κάθε φορά, δυσκολεύει την εξαγωγή συμπερασμάτων.
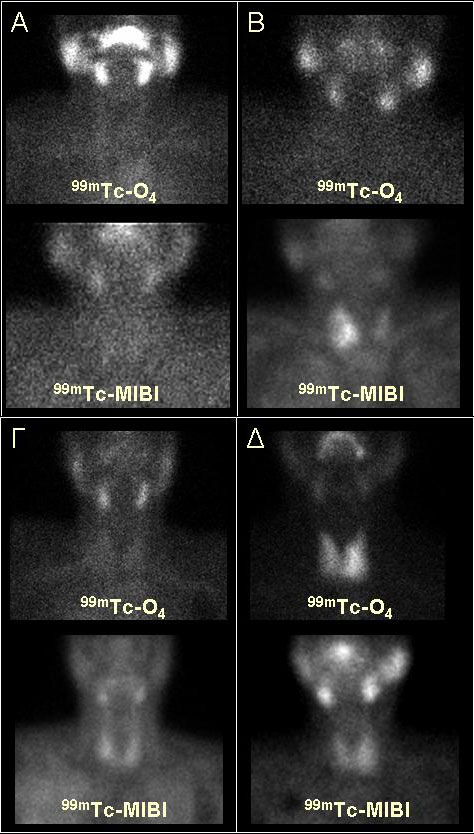
Εικόνα 1.11. Συνδυασμένη απεικόνιση με 99mTc-pertecnetate (πάνω σειρά) και 99mTc-Sestamibi (κάτω σειρά) σε 4 περιστατικά με θυρεοτοξίκωση εξ αμιοδαρόνης. Α) απουσία πρόσληψης και των δύο ραδιοφαρμάκων, ενδεικτικό αμιγώς καταστροφικής θυρεοειδίτιδας (τύπος II). Β) Μηδενική πρόσληψη του υπερτεχνητικού ανιόντος, με ασύμμετρα αυξημένη πρόσληψη του Sestamibi από τον δεξιό λοβό. Πιθανότερα πρόκειται για υπερθυρεοειδισμό εξ ιωδιούχων, σε έδαφος πολυοζώδους βρογχοκήλης (τύπος I). Γ) Μηδενική πρόσληψη του 99mTcO4– και ήπια/μέτρια πρόσληψη του Sestamibi. Μη διαγνωστική εξέταση, ίσως λόγω συνύπαρξης και των δύο μηχανισμών πρόκλησης της θυρεοτιξίκωσης. Δ) Φυσιολογική πρόσληψη 99mTcO4–, καθ’ υπεροχήν στον αριστερό λοβό. Ανεξαρτήτως της πρόσληψης του Sestamibi (η οποία πάντως στη συγκεκριμένη περίπτωση είναι φυσιολογική) το εύρημα υποδηλώνει υπερθυρεοειδισμό εξ ιωδιούχων (τύπος I).
Επί παρουσίας θυρεοειδικών όζων, το σπινθηρογράφημα μπορεί να διακρίνει εάν ο υπερθυρεοειδισμός οφείλεται σε εστιακή (τοξικό αδένωμα/τοξική πολυοζώδης βρογχοκήλη, δηλ. σε νόσο Plummer) ή διάχυτη υπερλειτουργία του αδένα (συνύπαρξη νόσου Graves με μη λειτουργικούς όζους), όπως φαίνεται στην Eικόνα 1.12.

Εικόνα 1.12. Τυπικές σπινθηρογραφικές εικόνες σε περιπτώσεις υπερθυρεοειδισμού επί παρουσίας θυρεοειδικών όζων. Τα βέλη στην κάτω σειρά δείχνουν τις θέσεις μη λειτουργικών όζων.
Επί μονήρους όζου, η διάκριση μεταξύ τοξικού αδενώματος και μη λειτουργικού όζου σε έδαφος νόσου Graves είναι εύκολη. Σε πολυοζώδη βρογχοκήλη όμως, η διαφορική διάγνωση μεταξύ τοξικής πολυοζώδους και νόσου Graves με συνύπαρξη μη λειτουργικών όζων δεν είναι πάντα εύκολη. Η δυσκολία έγκειται στη διάκριση μεταξύ μη λειτουργικών όζων και περιοχών φυσιολογικού παρεγχύματος με κατεσταλμένη πρόσληψη. Η αντιστοίχιση απεικονιστικών και ψηλαφητικών ευρημάτων μπορεί να βοηθήσει σε μερικές περιπτώσεις. Απαιτείται όμως συναξιολόγηση με την κλινική εικόνα (κλινική πιθανότητα της μιας ή της άλλης οντότητας) και τα εργαστηριακά ευρήματα (παρουσία αντισωμάτων AbTPO, TRAB). Στην Εικόνα 1.13 παρουσιάζονται δύο χαρακτηριστικές περιπτώσεις πολυοζώδους βρογχοκήλης, μια σε υπόβαθρο νόσου Graves και μια κλασσική τοξική πολυοζώδης.
Ως σύνδρομο Marine-Lenhart ορίζεται η συνύπαρξη αυτονόμου λειτουργικού όζου (συνήθως μονήρους ή και πολλαπλών όζων, δηλ. νόσου Plummer) και νόσου Graves. Η συνύπαρξη μπορεί να είναι σύγχρονη, όμως σε αρκετά περιστατικά στη βιβλιογραφία αναφέρεται μετάχρονη εμφάνιση της νόσου Graves, μήνες μετά από θεραπεία της νόσου Plummer με ραδιενεργό ιώδιο (13). Το σύνδρομο είναι σχετικά σπάνιο (1-2,5% των περιπτώσεων νόσου Graves με συνύπαρξη μονήρους ή πολλαπλών όζων). Μερικές φορές, ως σύνδρομο Marine-Lenhart αναφέρεται στη βιβλιογραφία καταχρηστικά, η παρουσία πολλαπλών μη λειτουργικών όζων σε έδαφος νόσου Graves. Παλαιότερα είχαν αναφερθεί και περιστατικά με «ψυχρό» όζο σε έδαφος Graves, ο οποίος στη συνέχεια, μετά τη θεραπεία της Graves με Ι-131 αναδείχθηκε ως λειτουργικός (προφανώς ήταν εξ αρχής λειτουργικός, αλλά TSH-εξαρτώμενος, δηλαδή καταστάλσιμος, βλ. επόμενη ενότητα) (14).
 Εικόνα 1.13. Σπινθηρογράφημα σε πρόσθια (στο κέντρο) και λοξές προβολές σε δύο υπερθυρεοειδικούς ασθενείς με πολλαπλούς όζους και στους δύο λοβούς. Α) Διάχυτα αυξημένη πρόσληψη του ραδιοφαρμάκου. Διακρίνονται οι προέχοντες μη λειτουργικοί όζοι (βέλη). Πρόκειται για τυπική περίπτωση νόσου Graves επί πολυοζώδους βρογχοκήλης. Β) Παρατηρείται εστιακά αυξημένη πρόσληψη σε προέχοντες όζους (βέλη), με καταστολή του υπολοίπου παρεγχύματος. Τυπική εικόνα πολυοζώδους τοξικής βρογχοκήλης.
Εικόνα 1.13. Σπινθηρογράφημα σε πρόσθια (στο κέντρο) και λοξές προβολές σε δύο υπερθυρεοειδικούς ασθενείς με πολλαπλούς όζους και στους δύο λοβούς. Α) Διάχυτα αυξημένη πρόσληψη του ραδιοφαρμάκου. Διακρίνονται οι προέχοντες μη λειτουργικοί όζοι (βέλη). Πρόκειται για τυπική περίπτωση νόσου Graves επί πολυοζώδους βρογχοκήλης. Β) Παρατηρείται εστιακά αυξημένη πρόσληψη σε προέχοντες όζους (βέλη), με καταστολή του υπολοίπου παρεγχύματος. Τυπική εικόνα πολυοζώδους τοξικής βρογχοκήλης.
1.4.2. Χαρακτηρισμός της λειτουργικότητας των θυρεοειδικών όζων
1.4.2.1. Ιωδίδιο (123/131Ι–) και υπερτεχνητικό ανιόν (99mTc–O4–)
Οι όζοι χαρακτηρίζονται ως λειτουργικοί («θερμοί»), αδιαφοροποίητοι («χλιαροί») ή μη λειτουργικοί («ψυχροί»), ανάλογα με το βαθμό πρόσληψης του ιωδίου (123Ι ή 131Ι), εάν δηλαδή παρουσιάζουν πρόσληψη εντονότερη, περίπου ίση ή ασθενέστερη αντίστοιχα, σε σύγκριση με το παρακείμενο φυσιολογικό παρέγχυμα (Εικόνα 1.14). Οι λειτουργικοί όζοι μπορεί να συνδυάζονται με χαμηλή TSH και εμφανή καταστολή της πρόσληψης από το υπόλοιπο παρέγχυμα (αυτόνομοι) ή με φυσιολογική (ή και υψηλή ενίοτε TSH) και χωρίς καταστολή του υγιούς παρεγχύματος (Εικόνα 1.14 Γ και Δ). Στη περίπτωση φυσιολογικής TSH, οι λειτουργικοί και οι αδιαφοροποίητοι διακρίνονται περαιτέρω βάσει της καταστολής τους ή όχι μετά χορήγηση τριιωδοθυρονίνης (scan καταστολής) σε καταστάλσιμους (TSH-εξαρτώμενους) και μη καταστάλσιμους (αυτόνομους), όπως φαίνεται στην Εικόνα 1.15. Η κακοήθεια σε αυτόνομους όζους είναι πολύ σπάνια, γι’ αυτό δεν χρειάζεται περαιτέρω διερεύνηση με αναρρόφηση δια λεπτής βελόνης (fine needle aspiration, FNA). Πολύ μικρή (<5%) είναι επίσης είναι η πιθανότητα κακοήθειας σε καταστάλσιμους «χλιαρούς» ή «θερμούς» όζους. «Χλιαροί» ή «θερμοί» όζοι με χαμηλή TSH απαντώνται συχνά σε θυρεοειδίτιδα Hashimoto και είναι συνηθέστατα καταστάλσιμοι. Η πιθανότητα κακοήθειας σε μη λειτουργικούς όζους είναι γενικά 5-20%, ποσοστό που κυμαίνεται ανάλογα με την ηλικία, το φύλο, την γεωγραφική περιοχή, το ιστορικό προηγούμενης ακτινοβόλησης του τραχήλου κλπ. Η ειδικότητα και η θετική προγνωστική αξία του «ψυχρού» σπινθηρογραφικά όζου για κακοήθεια είναι δηλαδή πολύ μικρή. Ορισμένα υπερηχογραφικά χαρακτηριστικά των όζων (υπερηχογένεια, ύπαρξη μικρο-αποτιτανώσεων, ανώμαλα όρια, αυξημένη ή/και χαοτική αιμάτωση κλπ) συνοδεύονται από σαφώς μεγαλύτερη ειδικότητα (40-95%), αλλά από μικρή ευαισθησία και δεν μπορούν να υποκαταστήσουν την FNA (15). Όταν συνάρχουν περισσότερα του ενός ύποπτα χαρακτηριστικά η πιθανότητα κακοήθειας αυξάνει σημαντικά. Η πιθανότητα κακοήθειας μη λειτουργικών όζων σε πολυοζώδη βρογχοκήλη δεν διαφέρει από αυτή του μονήρους όζου (η πιθανότητα ανά όζο είναι μικρότερη, αλλά αθροιστικά ίδια) (15). Ο προέχων σε μέγεθος όζος δεν είναι αναγκαστικά ο πλέον ύποπτος. Έτσι, σε πολυοζώδη βρογχοκήλη η επιλογή του όζου(ων) που θα πρέπει να παρακεντηθεί(ούν) βασίζεται στα ύποπτα υπερηχογραφικά χαρακτηριστικά και όχι μόνο στο μέγεθος. Ο χαρακτηρισμός των όζων όπως αναφέρθηκε παραπάνω και η πιθανότητα κακοήθειας που τον συνοδεύει ισχύει για την πρόσληψη του ιωδίου. Στην πράξη όμως χρησιμοποιείται το 99mTcΟ4, του οποίου η πρόσληψη από τους όζους δεν είναι ταυτόσημη με αυτή του ιωδίου και επί πλέον, το scan καταστολής σήμερα δεν διενεργείται συχνά, λόγω του φόβου επιπλοκών σε περίπτωση αυτονομίας. Πάντως, εάν ασθενής με οζώδη βρογχοκήλη είναι ήδη σε αγωγή με LT4, είναι προτιμότερο το σπινθηρογράφημα να γίνει υπό αγωγή. Τυχόν αυτόνομοι όζοι θα αναδειχθούν εύκολα, ενώ οι όζοι που δεν θα απεικονισθούν στο scan καταστολής είναι μη λειτουργικοί (ή λειτουργικοί καταστάλσιμοι). Στην Εικόνα 1.16 παρουσιάζονται τρία τέτοια περιστατικά.
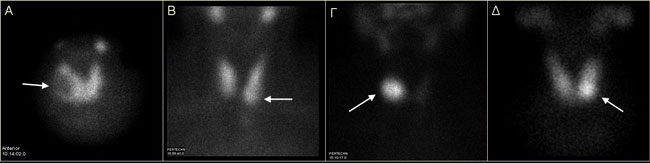
Εικόνα 1.14. Χαρακτηρισμός των θυρεοειδικών όζων (βέλη) στο σπινθηρογράφημα. Α) μη λειτουργικός («ψυχρός») όζος. Β) Αδιαφοροποίητος («χλιαρός») όζος. Γ) Λειτουργικός («θερμός») όζος, με καταστολή της πρόσληψης από το υπόλοιπο παρέγχυμα (αυτόνομος). Δ) Λειτουργικός («θερμός») όζος, χωρίς καταστολή της πρόσληψης από το υπόλοιπο παρέγχυμα.
Παλαιότερα είχε δοθεί αρκετή σημασία στις ασυμφωνίες ιωδίου-τεχνητίου, οι οποίες σε διάφορες σειρές στη βιβλιογραφία αναφέρονται με συχνότητα από 2,5% έως 31% (16). Στη μεγαλύτερη σειρά 316 ασθενών (17) η συχνότητα ήταν 10% και οι περισσότερες ασυμφωνίες αφορούσαν όζους στους οποίους η πρόσληψη του Tc-99m ήταν υψηλότερη από αυτή του Ι-123. Το εύρημα ήταν συχνότερο σε πολυοζώδεις βρογχοκήλες. Ένα ποσοστό αυτών των ασυμφωνιών αφορούσε σε θυρεοειδίτιδα Hashimoto, στην οποία παραβλάπτεται κυρίως η οργανοποίηση του ιωδίου και σε μικρότερο βαθμό η είσοδος των μονοσθενών ανιόντων στο θυρεοειδικό κύτταρο (trapping). Περιπτώσεις όζων «ψυχρών» στο Tc-99m αλλά «θερμών» στο Ι-123 ήταν σπάνιες (0,9%). Η συχνότητα κακοήθειας σε όζους με ασυμφωνία πρόσληψης ποικίλει στη βιβλιογραφία, γενικά όμως θεωρείται ότι δεν διαφέρει ουσιαστικά από αυτή των μη λειτουργικών όζων. Το πραγματικό πρόβλημα τίθεται όταν ανιχνεύονται όζοι «θερμοί» ή «χλιαροί» στο Tc-99m και η TSH είναι φυσιολογική (ή αλλιώς όταν δεν υπάρχει σαφής καταστολή του υπολοίπου παρεγχύματος στο σπινθηρογράφημα), διότι σε αντίθετη περίπτωση η διάγνωση του αυτονόμου αδενώματος είναι προφανής. Σε πρόσφατη σειρά 140 ασθενών με φυσιολογική TSH και «θερμούς» ή «χλιαρούς» όζους στο Tc-99m, μείζων ασυμφωνία (όζοι «ψυχροί» στο I-123) σημειώθηκε στο 5% (7/140) των περιπτώσεων. Η συχνότητα κακοήθειας στο σύνολο αυτού του πληθυσμού ήταν 1,4% (2/140), σε όζους «θερμούς» ή «χλιαρούς» στο Ι-123 (με ταυτόσημη εικόνα στο Tc-99m ή με ήσσονα ασυμφωνία, δηλαδή μόνο ως προς το βαθμό πρόσληψης) ήταν 0%, ενώ στα περιστατικά μείζονος ασυμφωνίας των δύο ραδιοφαρμάκων 28% (2/7) (16).
Στο διάγραμμα της Εικόνας 1.17 παρουσιάζεται η πιθανότητα κακοήθειας των όζων σε διάφορους τύπους πρόσληψης τεχνητίου και ιωδίου. Πολλοί συγγραφείς σήμερα θεωρούν ότι όλοι οι όζοι οι οποίοι δεν είναι προφανώς αυτόνομοι (με καταστολή του υπολοίπου παρεγχύματος ή/και με χαμηλή TSH) θα πρέπει να αντιμετωπίζονται ως μη λειτουργικοί. Με την τακτική αυτή όμως, ένα ποσοστό πραγματικά αυτόνομων όζων θα οδηγηθεί σε αναίτια FNA, και πιθανώς σε αναίτιο χειρουργείο εάν η κυτταρολογική εξέταση αποφανθεί ότι πρόκειται για θυλακιώδες νεόπλασμα. Θα πρέπει να σημειωθεί επί πλέον, ότι ένα ποσοστό των «λειτουργικών» όζων δεν έχει χαρακτηριστεί σωστά από το σπινθηρογράφημα, διότι η επιπροβολή του όζου με το υγιές παρέγχυμα έχει οδηγήσει σε εσφαλμένη αντίληψη για τη λειτουργικότητα του όζου. Εναλλακτικά, το ενδεχόμενο αυτονομίας «θερμών» όζων με φυσιολογική TSH μπορεί να διερευνηθεί περαιτέρω με scan καταστολής (Εικόνα 1.15), εφ’ όσον βέβαια η χορήγηση Τ3 (75 μg ημερησίως) επί μια εβδομάδα κρίνεται ασφαλής για τον συγκεκριμένο ασθενή. Σύμφωνα με τις κατευθυντήριες οδηγίες της Αμερικανικής Εταιρείας Θυρεοειδούς (ATA) το 2009, το σπινθηρογράφημα για τον χαρακτηρισμό των θυρεοειδικών όζων (είτε με Tc-99m ή με I-123) έχει ένδειξη μόνο σε ασθενείς με χαμηλή TSH (18). Ένδειξη επίσης έχει το σπινθηρογράφημα με Ι-123, όταν το πόρισμα της κυτταρολογικής εξέτασης μετά από FNA αναφέρει θυλακιώδες νεόπλασμα. Σε αυτή την περίπτωση εάν αναδεικνύεται λειτουργικός όζος τότε δεν χρειάζεται περαιτέρω διερεύνηση (πρόκειται για θυλακιώδες αδένωμα), ενώ εάν ο όζος είναι μη λειτουργικός, συνιστάται χειρουργική αντιμετώπιση για την πιθανότητα θυλακιώδους καρκινώματος (18). Ωστόσο, σε γεωγραφικές περιοχές με ένδεια ιωδίου, είναι δυνατόν να υπάρχουν αυτόνομοι όζοι με φυσιολογική TSH (ή με τιμές TSH πλησίον των κατωτέρων φυσιολογικών ορίων). Στην Εικόνα 1.18 παρουσιάζεται μια τέτοια περίπτωση. Ενδεικτικά, σε μία πολυκεντρική μελέτη από τη Γερμανία επί 514 ασθενών με «θερμούς» όζους στο Tc-99m scan, η TSH ήταν κατεσταλμένη (< 0,33 mU/ml) μόνο στο 20% των ασθενών, το 50% είχε τιμές TSH 0,33-1,00 mIU/ml, ενώ 30% είχαν > 1 mΙU/ml (19). Στις νεότερες κοινές κατευθυντήριες οδηγίες Αμερικανικών και Ευρωπαϊκών Εταιρειών Ενδοκρινολόγων το 2010, σημειώνεται ότι ο αποκλεισμός της παρουσίας αυτόνομων όζων επεκτείνεται και στους ασθενείς με φυσιολογική TSH (15).
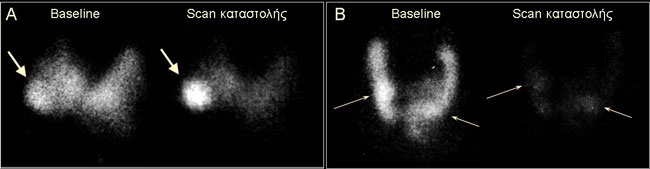
Εικόνα 1.15. Scan καταστολής σε δύο περιστατικά με «θερμούς» όζους στο αρχικό σπινθηρογράφημα και με φυσιολογική TSH. Α) Αυτόνομος όζος (βέλη). Β) καταστάλσιμοι «θερμοί’ όζοι. Το scan καταστολής διενεργείται μια εβδομάδα μετά την χορήγηση Τ3 σε δόση 75 μg ημερησίως. Φυσιολογικά με την καταστολή το συνολικό uptake I-131/Ι-123 ελαττώνεται πάνω από 50% της αρχικής. Όταν χρησιμοποιείται 99mTcO4, είτε ποσοτικοποιείται η συνολική του πρόσληψη, ή/και εξετάζεται η μεταβολή της σχέσης πρόσληψης μεταξύ όζου και φυσιολογικού παρεγχύματος.

Εικόνα 1.16. Εικονίζονται τρεις ασθενείς με πολυοζώδη βρογχοκήλη, οι οποίοι είναι υπό αγωγή με LT4. Α) Σχεδόν πλήρης καταστολή της πρόσληψης του 99mTcO4. Έστω και εάν δεν απεικονίζονται, οι υφιστάμενοι όζοι χαρακτηρίζονται ως μη λειτουργικοί. Β) Μονήρης αυτόνομος όζος αριστερού λοβού. Γ) Οι δύο εστίες πρόσληψης του 99mTcO4 αντιστοιχούν σε ψηλαφητούς όζους, ενώ το υπόλοιπο παρέγχυμα είναι κατεσταλμένο και δεν απεικονίζεται. Πρόκειται για αυτόνομους όζους σε έδαφος πολυοζώδους βρογχοκήλης.
1.4.2.2. 99mTc–Sestamibi για τον χαρακτηρισμό των μη λειτουργικών όζων
Αρκετές μελέτες στο παρελθόν διερεύνησαν τη χρησιμότητα του 99mTc-Sestamibi στον χαρακτηρισμό των μη λειτουργικών θυρεοειδικών όζων. Τα αποτελέσματα έδειξαν πτωχή θετική προγνωστική αξία για κακοήθεια, που κυμαίνεται μεταξύ 20-40% (δηλ. η πρόσληψη του Sestamibi από έναν «ψυχρό» όζο δεν προδικάζει κακοήθεια) (20,21), αλλά πολύ καλή αρνητική προγνωστική αξία (δηλ. η απουσία πρόσληψης απομακρύνει το ενδεχόμενο κακοήθειας). Στις περισσότερες σειρές στη βιβλιογραφία η αρνητική προγνωστική αξία ήταν 100% (20), αν και σποραδικά αναφέρονται και χαμηλότερα ποσοστά (22). Τα στοιχεία αυτά ωστόσο δεν θεωρούνται επαρκή για να μεταβάλλουν την ένδειξη για FNA. Νεότερες μελέτες έχουν εστιάσει σε περιστατικά με μη διαγνωστική FNA και με κυτταρολογική εξέταση ενδεικτική θυλακιώδους νεοπλάσματος. Τα αποτελέσματα είναι ενθαρρυντικά όσον αφορά στην αρνητική προγνωστική αξία του 99mTc-Sestamibi (23,24) και υπογραμμίζουν την ανάγκη περαιτέρω διερεύνησης του θέματος. Στην Εικόνα 1.19 παρουσιάζονται δυο περιστατικά με έντονη και ήπια πρόσληψη του 99mTc-Sestamibi αντίστοιχα, σε ευμεγέθεις μη λειτουργικού όζους.
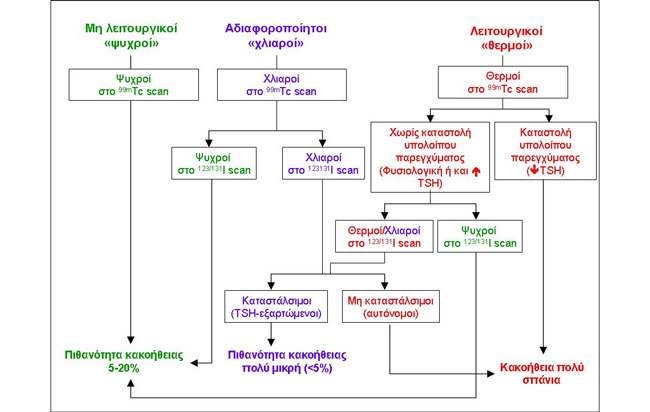
Εικόνα 1.17. Χαρακτηρισμός των όζων ως προς την πιθανότητα κακοήθειας σύμφωνα με την πρόσληψη τεχνητίου και ιωδίου, καθώς και τα επίπεδα TSH. Για τους «ψυχρούς» και τους σαφώς αυτόνομους «θερμούς» όζους (δηλ. αυτούς που συνοδεύονται από χαμηλή TSH και καταστολή του υπολοίπου παρεγχύματος) δεν υπάρχουν αμφιβολίες. Επί φυσιολογικής TSH, οι θερμοί ή χλιαροί όζοι στο scan με ιώδιο έχουν πολύ μικρή πιθανότητα κακοήθειας (<5%), έστω και αν δεν είναι αυτόνομοι (δηλαδή καταστέλλονται μετά την εξωγενή χορήγηση Τ3). Πρόβλημα αποτελούν οι θερμοί ή χλιαροί όζοι στο scan με τεχνήτιο που συνδυάζονται με φυσιολογική TSH, διότι ένα ποσοστό έως 30% είναι στην πραγματικότητα μη λειτουργικοί (είναι δηλαδή ψυχροί στο scan με ιώδιο), ενώ από την άλλη πλευρά μερικοί αυτόνομοι όζοι, είτε επειδή είναι μικρού μεγέθους ή επειδή υπάρχει διατροφική ένδεια ιωδίου, δεν συνοδεύονται από καταστολή της TSH.

Εικόνα 1.18. Σπινθηρογράφημα σε ευθυρεοειδικό ασθενή (TSH = 0.9 IU/L) με πολυοζώδη βρογχοκήλη. Αναδεικνύεται έντονη πρόσληψη του ραδιοφαρμάκου στον άνω πόλο του δεξιού λοβού, αντίστοιχα προς το ψηλαφητικό εύρημα παρουσίας όζου στη θέση αυτή, ενώ το υπόλοιπο παρέγχυμα έχει πρόσληψη ίση περίπου με αυτή των σιελογόνων αδένων. Παρά τη φυσιολογική TSH, πιθανότατα πρόκειται για αυτόνομο όζο.

Εικόνα 1.19. Πρόσληψη του 99mTc-Sestamibi σε μη λειτουργικούς θυρεοειδικούς όζους. Α) Ευμεγέθης «ψυχρός» όζος στο 99mTc-O4 scan (αριστερά), ο οποίος παρουσιάζει έντονη πρόσληψη του 99mTc-Sestamibi (λευκά βέλη). Η ιστολογική έδειξε θηλώδες καρκίνωμα. Β) Ήπια μόνο πρόσληψη του 99mTc-Sestamibi σε ευμεγέθη «ψυχρό» όζο (γαλάζια βέλη), ο οποίος στην ιστολογική εξέταση απεδείχθη καλοήθης.
1.4.3. Διερεύνηση οπισθοστερνικής μάζας – επιβεβαίωση καταδυόμενης βρογχοκήλης
Όπως αναφέρθηκε, το Tc-99m δεν είναι η καλύτερη επιλογή γι’ αυτή την ένδειξη, λόγω της όχι έντονης πρόσληψής του από το θυρεοειδικό ιστό και της σημαντικής απορρόφησης που υφίσταται η γ-ακτινοβολία κατά τη διέλευσή της μέσω του στέρνου. Μπορεί να δοκιμαστεί ως αρχική προσέγγιση στο διαγνωστικό πρόβλημα, όμως σε αμφίβολο αποτέλεσμα πρέπει να επιχειρηθεί η ιχνηθέτηση με Ι-123 ή Ι-131. Το Ι-131 προκαλεί μεγαλύτερη ακτινική επιβάρυνση του ασθενούς, όμως η διεισδυτικότητα των υψηλής ενέργειας φωτονίων του αποτελούν πλεονέκτημα έναντι του Ι-123. Η τομογραφική (SPECT) και ιδιαίτερα η υβριδική SPECT/CT τεχνική προσφέρουν πολύτιμες πληροφορίες όσον αφορά στην ακριβή ανατομική εντόπιση των ευρημάτων, όπως φαίνεται στην Εικόνα 1.20.
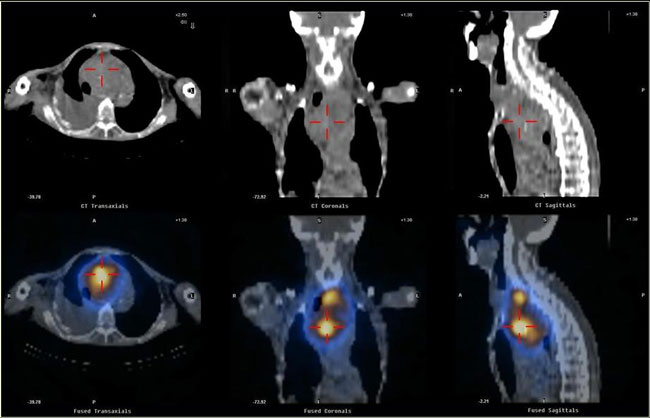
Εικόνα 1.20. Μελέτη SPECT/CT με Ι-131 στη διερεύνηση οπισθοστερνικής μάζας, ύποπτης για καταδυόμενη βρογχοκήλη. Παρουσιάζονται επιλεγμένες τομές στο μεσοθωράκιο, σε τρία επίπεδα. Στην πάνω σειρά είναι οι εικόνες της CT και στην κάτω οι εικόνες επιπροβολής-μείξης (fusion) των σπινθηρογραφικών και των αντίστοιχων ακτινολογικών τομών.
1.4.4. Διερεύνηση του πρωτοπαθούς, μόνιμου, νεογνικού υποθυρεοειδισμού
Το σπινθηρογράφημα με 99mTc-pertechnetate ή 123Ι χρησιμοποιείται για τη διερεύνηση των αιτίων του πρωτοπαθούς, μόνιμου, νεογνικού υποθυρεοειδισμού. Τα αποτελέσματα ερμηνεύονται σε συνδυασμό με τα ευρήματα του υπερηχογραφήματος, καθώς και με τα επίπεδα της θυρεοσφαιρίνης (Tg).
Η δυσγενεσία (απλασία, υποπλασία, εκτοπία) αποτελεί το συχνότερο αίτιο (~75%), έπεται η δυσορμονογένεση (~20%), ενώ άλλα αίτια είναι σπάνια (~5%) (25). Η μεγαλύτερη συμβολή του σπινθηρογραφήματος είναι για την ανάδειξη της εκτοπίας, συνήθως σε υπογλώσσια ή υπογνάθια θέση, η οποία ευθύνεται για το ~35% των περιπτώσεων δυσγενεσίας. Σε μερικά περιστατικά μικρός υπογλώσσιος θυρεοειδής μπορεί να διαφύγει, λόγω επιπροβολής του με ραδιοεπισημασμένο σίελο στη στοματική κοιλότητα. Το Ι-123, εάν είναι διαθέσιμο, είναι προτιμότερο από το Τc-99m, λόγω εντονότερης πρόσληψης από το θυρεοειδή (26). Η ευαισθησία του υπερηχογραφήματος στην ανάδειξη της εκτοπίας είναι πολύ μικρότερη.
Η δυσορμονογένεση οφείλεται σε ατέλειες των μηχανισμών πρόσληψης (τύπου 1) ή οργανοποίησης (τύπου 2) του ιωδίου, ή σε διαταραχές μετά τη φάση της οργανοποίησης (τύπου 3), που αφορούν στη θυρεοσφαιρίνη, στη δεαλογονάση της ιωδοτυροσίνης (DEHL1) ή σε περιφερική αντίσταση στις θυρεοειδικές ορμόνες. Συχνότερα πρόκειται για γενετικές βλάβες της οργανοποίησης, που αφορούν την θυρεοειδική υπεροξειδάση ή την πεντρίνη (σύνδρομο Pendred). Σε αυτές τις περιπτώσεις η πρόσληψη του ραδιοφαρμάκου στο σπινθηρογράφημα είναι υψηλή και ο θυρεοειδής είναι διογκωμένος. Η δοκιμασία εκφόρτισης με υπερχλωρικό κάλιο (perchlorate discharge test), αν και σπάνια διενεργείται στην πράξη, αναδεικνύει παθολογικά αυξημένη απομάκρυνση του ιωδίου από το θυρεοειδή (πτώση του uptake I-123 μετά τη χορήγηση υπερχλωρικού μεγαλύτερη από 50% της αρχικής τιμής). Η δοκιμασία μπορεί να διακρίνει διαταραχές τύπου 2 και τύπου 3, αφού στη δεύτερη περίπτωση το test είναι αρνητικό. Σε διαταραχή τύπου 1, που αφορά σε γενετικές βλάβες είτε στον υποδοχέα της TSH (TSH-R) ή στον συμμεταφορέα νατρίου-ιωδίου (NIS), το σπινθηρογράφημα θυρεοειδούς δείχνει απουσία πρόσληψης ή πολύ χαμηλή πρόσληψη. Στην περίπτωση ανωμαλιών του NIS, χαρακτηριστικά δεν απεικονίζονται ούτε οι σιελογόνοι αδένες ούτε ο στόμαχος. Η απουσία πρόσληψης στο scan δεν σημαίνει επομένως πάντα αγενεσία του θυρεοειδούς, αλλά μπορεί να οφείλεται σε σημαντική υποπλασία, σε δυσορμονογένεση τύπου 1, όπως αναφέρθηκε ή σε ύπαρξη μητρικών αντισωμάτων έναντι του υποδοχέα TSH-R (TRB-Ab) (27).
Στην Eικόνα 1.21 απεικονίζονται δύο περιστατικά με θυρεοειδική εκτοπία και δυσορμονογένεση αντίστοιχα, ενώ στην Εικόνα 1.22 συνοψίζονται τα σπινθηρογραφικά ευρήματα στον πρωτοπαθή νεογνικό υποθυρεοειδισμό.

Εικόνα 1.21. Παρουσιάζονται δυο περιπτώσεις μόνιμου, πρωτοπαθούς, νεογνικού υποθυρεοειδισμού. Α) Έκτοπος υπογλώσσιος θυρεοειδής. Β) Δυσορμονογένεση, τύπου 2 ή 3. Σημειώνεται έντονη πρόσληψη του 99mTc-O4 σε ορθότοπη θέση.

Εικόνα 1.22. Παρουσιάζονται συνοπτικά τα σπινθηρογραφικά ευρήματα στα διάφορα αίτια του πρωτοπαθούς νεογνικού υποθυρεοειδισμού. TPO: θυρεοειδική υπεροξειδάση, DEHAL: δεαλογονάση της ιωδοτυροσίνης, TSH-R: υποδοχέας της TSH, TRB-Ab: αντισώματα συνδεόμενα με τον υποδοχέα της TSH.
1.5. Ερμηνεία, ερμηνευτικές παγίδες
Στο σπινθηρογράφημα θυρεοειδούς εκτιμάται αδρά το μέγεθος του αδένα, η συνολική πρόσληψη του ραδιοφαρμάκου και η παρουσία εστιακών διαταραχών της πρόσληψης (εστιακά αυξημένη ή ελαττωμένη πρόσληψη σε σύγκριση με το γειτονικό παρέγχυμα). Η συνολική πρόσληψη του 99mTcO4 μπορεί να ποσοτικοποιηθεί (όπως η πρόσληψη του 131I/123I), αλλά τα περισσότερα εργαστήρια χρησιμοποιούν μόνο την ποιοτική (οπτική) εκτίμηση, συγκρίνοντας την πρόσληψη του θυρεοειδούς με αυτή των σιελογόνων αδένων και με το background του τραχήλου. Τα ευρήματα πάντα συνεκτιμώνται με την ψηλάφηση του αδένα, τα υπερηχογραφικά ευρήματα, και τα αποτελέσματα του ορμονικού ελέγχου. Η ανάγνωση της σπινθηρογραφικής εικόνας μόνης πολύ συχνά οδηγεί σε εσφαλμένη διάγνωση. Χαρακτηριστική είναι η περίπτωση της χρόνιας θυρεοειδίτιδας Hashimoto, η οποία υποδύεται όλες τις πιθανές σπινθηρογραφικές εικόνες (28): φυσιολογικό scan, εικόνα πολυοζώδους βρογχοκήλης, scan με υψηλή, φυσιολογική ή ελαττωμένη πρόσληψη, εικόνα μονήρους ή πολλαπλών μη λειτουργικών όζων , καθώς επίσης και εικόνα «θερμού» όζου.
Παρακάτω δίνονται διάφορα παραδείγματα με εικόνες σε πιθανές ερμηνευτικές αστοχίες, που αναφέρονται είτε στη λειτουργικότητα του αδένα ή συχνότερα στον χαρακτηρισμό των όζων και σχετίζονται με την σπινθηρογραφική τεχνική και την απουσία συσχέτισης με κλινικά και εργαστηριακά ευρήματα.
1.5.1. Ερμηνεία της συνολικής πρόσληψης του 99mTcO4 από τον θυρεοειδή

Εικόνα 1.23. Σπινθηρογραφικές εικόνες σε ευθυρεοειδικούς ασθενείς χωρίς όζους. Η πρόσληψη του 99mTcO4 ποικίλει: Α) φυσιολογική, Β) ελαττωμένη, Γ) αυξημένη. Επίσης, η ασυμμετρία μεγέθους και πρόσληψης μεταξύ των λοβών (Γ και Δ) είναι συνήθης, Δεν πρέπει να επιχειρείται εκτίμηση της λειτουργικότητας του αδένα από το βαθμό πρόσληψης του ισοτόπου, χωρίς τη γνώση των ευρημάτων του ορμονικού ελέγχου. Επίσης, η ασύμμετρη απεικόνιση των λοβών επί απουσίας ψηλαφητών όζων δεν θα πρέπει να ερμηνεύεται ως παθολογική.
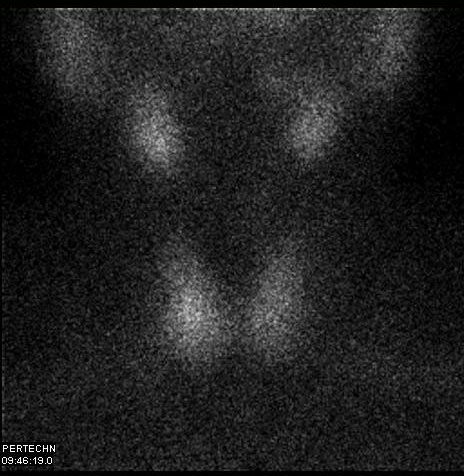
Εικόνα 1.24. Ασθενής με υποκλινικό υπερθυρεοειδισμό (TSH = 0.08 IU/L). Στο υπερηχογράφημα ο αδένας έχει μικροοζώδη υφή, με διάσπαρτους όζους που δεν υπερβαίνουν τα 7 mm. Στο scan δεν υπάρχουν ευρήματα εστιακής αυτονομίας. Η ήπια επίταση της πρόσληψης στο κέντρο του δεξιού λοβού δεν αντιστοιχεί στην παρουσία όζου στη θέση αυτή και πιθανότερα οφείλεται σε πάχυνση του λοβού. Παρά τη φυσιολογική ή και ήπια ελαττωμένη συνολική πρόσληψη του υπερτεχνητικού ανιόντος (πιθανά λόγω προηγούμενης έκθεσης του ασθενούς σε ιωδιούχα) η εξέταση θα πρέπει να ερμηνευθεί ως ενδεικτική διάχυτης αυτονομίας.

Εικόνα 1.25. Παρουσιάζεται ένα επί πλέον παράδειγμα ασθενούς με υπερθυρεοειδισμό (TSH = 0.003 IU/L) και φυσιολογική πρόσληψη του 99mTcO4– από τον θυρεοειδή, για να υπογραμμίσει την ανάγκη συνεκτίμησης της σπινθηρογραφικής εικόνας με τα ευρήματα του ορμονικού ελέγχου. Αριστερά είναι η μακρινή λήψη με κατευθυντήρα pinhole, στην οποία φαίνεται η σχέση πρόσληψης θυρεοειδούς/σιελογόνων, ενώ δεξιά η κοντινή λήψη.
1.5.2. Συσχέτιση των σπινθηρογραφικών ευρημάτων με ψηλαφητικά και κλινικοεργαστηριακά ευρήματα

Εικόνα 1.26. Στο σπινθηρογράφημα εμφανίζεται περιοχή συγκριτικά ελαττωμένης πρόσληψης στον κάτω πόλο του δεξιού λοβού. Το εύρημα μπορεί να εκληφθεί ως δηλωτικό παρουσίας μη λειτουργικού όζου. Ωστόσο, στην ψηλάφηση δεν υπήρχαν ευρήματα, ενώ το υπερηχογράφημα ανέδειξε ολιγάριθμους πολύ μικρούς διάσπαρτους όζους όχι μεγαλύτερους από 6 mm. Προφανώς το σπινθηρογραφικό εύρημα οφείλεται σε λέπτυνση του κάτω πόλου του ΔΕ λοβού.

Εικόνα 1.27. Στο σπινθηρογράφημα (εικόνες με κατευθυντήρα παραλλήλων οπών με zoom 1 αριστερά και zoom 3 δεξιά) αναδεικνύεται εστιακά αυξημένη πρόσληψη στον άνω πόλο του δεξιού λοβού (βέλος). Ο αδένας είναι αψηλάφητος. Η ερμηνεία του ευρήματος ως ενδεικτική ύπαρξη λειτουργικού όζου είναι τελείως εσφαλμένη, διότι πρόκειται για υποθυρεοειδικό ασθενή με χρόνια θυρεοειδίτιδα Hashimoto. Προφανώς το σπινθηρογράφημα απεικονίζει «θερμή» την περιοχή που είναι λιγότερο προσβεβλημένη από τη νόσο. Ο ψευδής «θερμός» όζος αναφέρεται στο 15% των περιπτώσεων θυρεοειδίτιδας Hashimoto (3).
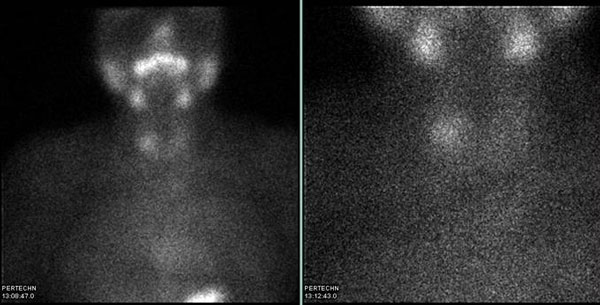
Εικόνα 1.28. Σπινθηρογραφική εικόνα παρόμοια με την προηγούμενη. Στον άνω πόλο του δεξιού λοβού, αντίστοιχα προς ψηλαφητό όζο, αναδεικνύεται περιοχή αυξημένης πρόσληψης του ραδιοφαρμάκου σε σύγκριση με το υπόλοιπο παρέγχυμα, το οποίο μόλις απεικονίζεται. Εδώ όμως πρόκειται για ασθενή με υποκλινικό υπερθυρεοειδισμό και το εύρημα θα πρέπει να ερμηνευθεί ως αυτόνομος όζος. Η συνολική πρόσληψη είναι ασθενής, πιθανά λόγω προηγούμενης έκθεσης του ασθενούς σε ιωδιούχα.

Εικόνα 1.29. Σπινθηρογραφική εικόνα ευθυρεοειδικού ασθενούς με όζο 1.2 cm στον κάτω πόλο του αριστερού λοβού προς τον ισθμό (υπερηχογραφικό εύρημα). Στο σπινθηρογράφημα (Α) δεν αναδεικνύεται αυτός ο όζος (θα πρέπει να θεωρηθεί μη λειτουργικός). Αντίθετα, στην πρόσθια προβολή φαίνεται εστιακά αυξημένη πρόσληψη στη μεσότητα του δεξιού λοβού (βέλος), χωρίς αντίστοιχο ψηλαφητικό ή υπερηχογραφικό εύρημα στη θέση αυτή. Σε διαδοχικές εγκάρσιες τομές της SPECT μελέτης (Β) φαίνεται πάχυνση του δεξιού λοβού, η οποία πιθανότατα ευθύνεται για το εύρημα της μονοεπίπεδης απεικόνισης.
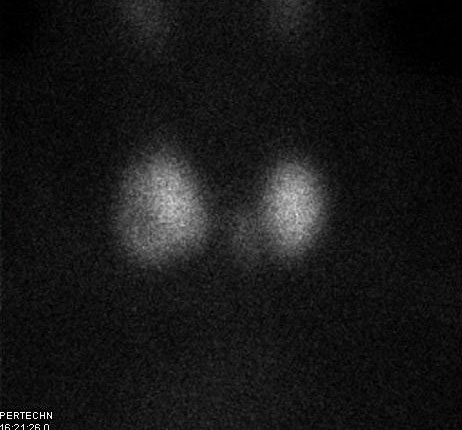
Εικόνα 1.30. Σε πρώτη ανάγνωση η σπινθηρογραφική εικόνα δείχνει ασυνήθης. Πρόκειται για υπερθυρεοειδικό ασθενή με μεγάλη πολυοζώδη βρογχοκήλη. Προέχουν σε μέγεθος όζος 5 cm στο δεξιό και 3 cm στον αριστερό λοβό. Οι εικονιζόμενες περιοχές έντονης πρόσληψης του ραδιοφαρμάκου αντιστοιχούν τοπογραφικά στους ψηλαφητούς όζους, ενώ το υπόλοιπο παρέγχυμα είναι κατεσταλμένο και δεν απεικονίζεται. Εικόνα τοξικής πολυοζώδους βρογχοκήλης.
1.5.3. Εσφαλμένος χαρακτηρισμός της λειτουργικότητας θυρεοειδικών όζων
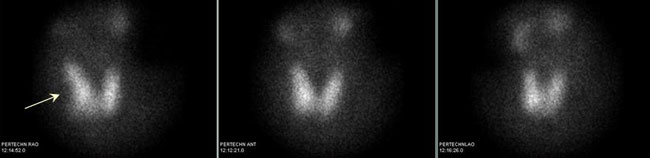
Εικόνα 1.31. Ασθενής ευθυρεοειδικός με μονήρη όζο 1.7 cm ΔΕ λοβού στο υπερηχογράφημα. Εάν βασιστεί κανείς στην πρόσθια σπινθηρογραφική λήψη μόνο, ο όζος χαρακτηρίζεται ως αδιαφοροποίητος (ίσως και ως λειτουργικός, αν ληφθεί υπ’ όψη η ελαφρά αυξημένη πρόσληψη στη μεσότητα του ΔΕ λοβού). Ωστόσο, στη δεξιά λοξή προβολή καθίσταται εμφανές ότι πρόκειται για μη λειτουργικό («ψυχρό») όζο (βέλος).
Εικόνα 1.32. Ασθενής ευθυρεοειδικός (TSH = 1.7 IU/L) με πολυοζώδη βρογχοκήλη. Προέχει όζος 2.5 cm στον άνω πόλο του δεξιού λοβού. Εάν η διάγνωση βασιστεί στην πρόσθια μόνο λήψη (κεντρική εικόνα), τότε το εύρημα (βέλος) θα ερμηνευθεί ως λειτουργικός όζος που δεν καταστέλλει το υπόλοιπο παρέγχυμα . Ωστόσο στη αριστερή λοξή λήψη (δεξιά εικόνα) καθίσταται εμφανές ότι πρόκειται για όζο σε οπίσθια θέση (βέλος και κύκλος με διακεκομμένη γραμμή), ο οποίος παρουσιάζει πρόσληψη ασθενέστερη από το γειτονικό παρέγχυμα και επομένως είναι μη λειτουργικός. Η εσφαλμένη αρχική εντύπωση οφείλεται σε επιπροβολή του όζου με το υπερκείμενο φυσιολογικό παρέγχυμα.
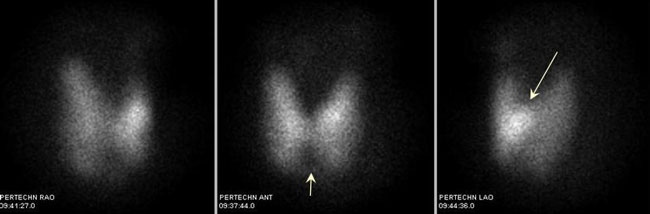
Εικόνα 1.33. Ασθενής με υποκλινικό υπερθυρεοειδισμό (TSH 0,05 IU/l) και πολυοζώδη βρογχοκήλη. Ο μεγαλύτερος όζος, 1,8 cm, βρίσκεται στον αριστερό λοβό. Στην πρόσθια προβολή ο προέχων όζος εμφανίζεται μάλλον ως «αδιαφοροποίητος». Εικονίζεται ένας μικρότερος μη λειτουργικός όζος στον ισθμό (κοντό κάθετο βέλος), ενώ οι υπόλοιποι όζοι δεν διακρίνονται. Η περίπτωση μπορεί εσφαλμένα να ερμηνευτεί ως νόσος Graves με μη λειτουργικούς όζους. Στις λοξές λήψεις και κυρίως στην αριστερή λοξή είναι εμφανές ότι ό όζος του αριστερού λοβού είναι λειτουργικός (μακρύ λοξό βέλος).

Εικόνα 1.34. Ασθενής ευθυρεοειδικός με όζο 15 mm δεξιού λοβού. Στη μονοεπίπεδη απεικόνιση (Α) ο όζος (βέλος) χαρακτηρίζεται ως αδιαφοροποίητος (εμφανίζει ελαφρά ίσως αυξημένη πρόσληψη στην πρόσθια προβολή, αυτό όμως δεν επιβεβαιώνεται στις λοξές λήψεις). Στη SPECT μελέτη και σε διαδοχικές μετωπιαίες τομές που παρουσιάζονται εδώ (Β) χαρακτηρίζεται σαφώς ως λειτουργικός, αν και δεν καταστέλλει το υπόλοιπο παρέγχυμα.
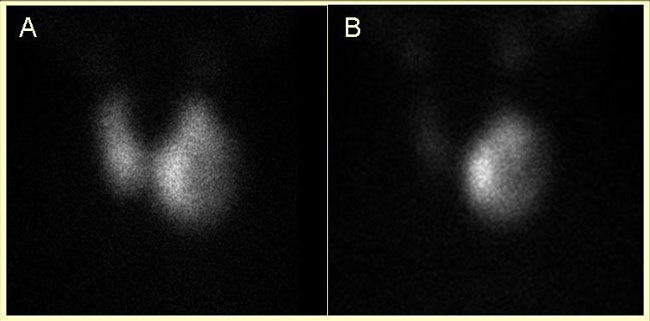
Εικόνα 1.35. Υπερθυρεοειδικός ασθενής με ευμεγέθη όζο του αριστερού λοβού. Α) Το σπινθηρογράφημα το οποίο έλαβε χώρα υπό αντιθυρεοειδικά (unimazole), με την TSH σε φυσιολογικά επίπεδα, ερμηνεύθηκε λανθασμένα ως μη λειτουργικός όζος σε έδαφος Graves. Β) Σε επανάληψη μετά τη διακοπή του unimazole (και την πτώση της TSH) κατέστη εμφανές ότι πρόκειται για τοξικό αδένωμα, μερικά εκφυλισμένο.
Εικόνα 1.36. Ασθενής ευθυρεοειδικός (TSH 2,3 IU/L) με πολυοζώδη βρογχοκήλη. Σε U/S μελέτη ανεδείχθησαν δύο συρρέοντες συμπαγείς και υποηχογενείς όζοι μέγιστης διαμέτρου 1,20 και 1,35 cm στον κάτω πόλο του δεξιού λοβού, ενώ στον αριστερό λοβό, στα όρια με τον ισθμό, κυστικός καθ’ υπεροχήν όζος 1,5 cm. Στο scan θυρεοειδούς, σε πρόσθια και λοξές προβολές (Α), το ψηλαφητό μόρφωμα του κάτω πόλου του δεξιού λοβού (προφανώς το σύμπλεγμα των δύο όζων), εμφανίζει πρόσληψη του 99mTc-O4 ίση περίπου με το υπόλοιπο παρέγχυμα (βέλη), όπως επιβεβαιώνεται και στις μετωπιαίες τομές (Β) της SPECT μελέτης (βέλη). Πρόκειται για «χλιαρό» όζο (ο ένας εξ αυτών ή και οι δύο). Ο όζος του αριστερού λοβού δεν απεικονίζεται (θεωρείται μη λειτουργικός). Δεδομένης και της φυσιολογικής TSH, όλοι οι όζοι θα πρέπει να αντιμετωπισθούν ως μη λειτουργικοί.
1.6. Επιγραμματικά – ενότητα 1
- Οι ενδείξεις του scan θυρεοειδούς είναι: α) η διαφορική διάγνωση της θυρεοτοξίκωσης, όταν το αίτιο δεν είναι προφανές, β) ο χαρακτηρισμός της λειτουργικότητας θυρεοειδικών όζων ≥1 cm, γ) η επιβεβαίωση της καταδυόμενης βρογχοκήλης και δ) η πληρέστερη διερεύνηση του πρωτοπαθούς, μόνιμου νεογνικού υποθυρεοειδισμού.
- Η σπινθηρογραφική τεχνική (κατευθυντήρας pinhole, λοξές λήψεις, χρήση ραδιερεργού εντοπιστικού δείκτη) έχουν σημασία για τη ορθή διάγνωση.
- Τα σπινθηρογραφικά ευρήματα από μόνα τους είναι ανεπαρκή για τη διάγνωση. Απαιτείται συσχέτιση με το ιστορικό, την κλινική εικόνα και τα ευρήματα του λοιπού παρακλινικού ελέγχου. Η ψηλάφηση του θυρεοειδούς αποτελεί μέρος της εξέτασης και δεν πρέπει να παραλείπεται.
- Σε γεωγραφικές περιοχές με ένδεια ιωδίου το scan θυρεοειδούς μπορεί να αποκαλύψει αυτόνομους όζους παρά τις φυσιολογικές τιμές TSH.
- Η θυρεοειδίτιδα Hashimoto μπορεί να υποδυθεί όλες τις παθολογικές σπινθηρογραφικές παραλλαγές.
- Η πρόσληψη του 99mTcO4 από τον θυρεοειδή δεν είναι ταυτόσημη με αυτή του ιόντος ιωδίου και δεν συμφωνεί πάντα με τη λειτουργική κατάσταση του παρεγχύματος. Η πολυοζώδης τοξική βρογχοκήλη, ενίοτε δε και η διάχυτη αυτονομία, μπορεί να παρουσιάζουν φυσιολογική ή και χαμηλή συνολική πρόσληψη 99mTcO4. Επί φυσιολογικής TSH, ένα μικρό ποσοστό «θερμών» όζων στο scan με 99mTcO4 είναι στην πραγματικότητα μη λειτουργικοί. Οι «χλιαροί» ή «αδιαφοροποίητοι» σπινθηρογραφικά όζοι πρέπει να αντιμετωπίζονται ως μη λειτουργικοί.
2. Πρόσληψη (uptake) I-131/I-123 (RAIU)
2.1. Τεχνική
Χορηγείται από το στόμα μια κάψουλα που περιέχει μικρή ποσότητα (10-50 μCi ή 0.37-1.85 MBq) I-131. Εάν είναι διαθέσιμο μπορεί να χρησιμοποιηθεί το Ι-123 σε δόση 100-200 μCi (3.7-7.4 MBq) per os. Μετά από 24 ώρες συνήθως, μετράται το ποσοστό της χορηγηθείσας δόσης ραδιοϊωδίου (RAI) που έχει προσληφθεί από τον θυρεοειδή αδένα (24ωρο uptake, RAIU). Μπορεί επίσης να μετρηθεί το 4ωρο ή 6ωρο RAIU. Οι μετρήσεις γίνονται με μια απλή και ευαίσθητη συσκευή, το θυρεοειδόμετρο (Εικόνα 2.1). Δίνοντας 50 μCi Ι-131 και υποθέτοντας ένα RAIU 25%, η χορηγούμενη δόση ακτινοβολίας στον θυρεοειδή είναι 670 mGy και η ενεργός δόση (effective dose) 11 mSv. Συγκριτικά, 200 μCi I-123 δίνουν 24 mGy στο θυρεοειδή και ενεργό δόση 0,8 mSv (29). Με τις δόσεις I-131 που χρησιμοποιούνται για τη μέτρηση του uptake η απεικόνιση του θυρεοειδούς είναι πολύ χρονοβόρα και συνηθέστατα παραλείπεται. Το θυρεοειδόμετρο δεν μπορεί να χρησιμοποιηθεί εάν χορηγηθούν μεγάλες δόσεις Ι-131 (π.χ. 5 mCi για ολόσωμο scan) διότι ο μεγάλος ρυθμός των παλμών (κρούσεων) υπερβαίνει τις δυνατότητές του. Εναλλακτικά τότε, οι μετρήσεις μπορούν να γίνουν στη γ-camera, με μικρότερη όμως ακρίβεια.
Οι φυσιολογικές τιμές RAIU διαφέρουν ανά γεωγραφική περιοχή. Σε περιοχές με διατροφική επάρκεια ιωδίου αναφέρονται RAIU 6ωρών = 5-15% και RAIU 24 ωρών = 8-35% (8, 30). Στην Ελλάδα τα εργαστήρια παλαιότερα ανέφεραν ως φυσιολογικά όρια 24ωρου RAIU τιμές 25-55%, ωστόσο τα δεδομένα έχουν αλλάξει από τότε. Ούτως ή άλλως η μέθοδος δεν χρησιμοποιείται για διάγνωση των διαταραχών της θυρεοειδικής λειτουργίας και επομένως η γνώση των φυσιολογικών τιμών δεν έχει ιδιαίτερη σημασία.
Η πρόσληψη του 99mTc-pertechnetate (TCTU) από τον θυρεοειδή μπορεί να ποσοτικοποιηθεί με μετρήσεις στη γ-camera, αλλά όπως αναφέρθηκε αντανακλούν μόνο τη δέσμευση (trapping) και όχι την οργανοποίηση του ιωδίου. Η μέτρηση της θυρεοειδικής πρόσληψης από τη σπινθηρογραφική εικόνα του θυρεοειδούς λαμβάνει χώρα 15-30 min μετά τη χορήγηση του ραδιοφαρμάκου. Φυσιολογικές τιμές TCTU είναι 0,3-3% (1,2-7% σε περιοχές ένδειας ιωδίου) (3). Η χρησιμότητα του TCTU είναι αμφίβολη.
2.2. Ενδείξεις RAIU
2.2.1. Πριν τη θεραπευτική χορήγηση RAI για νόσο Graves και πολυοζώδη τοξική βρογχοκήλη
Ορισμένοι βασίζονται σε δοσιμετρικούς υπολογισμούς για τον καθορισμό της θεραπευτικής δόσης RAI, στους οποίους η τιμή RAIU είναι απαραίτητη. Οι περισσότεροι όμως χρησιμοποιούν εμπειρικές δόσεις. Ακόμα και σε αυτήν τη περίπτωση, η γνώση της τιμής του RAIU είναι χρήσιμη για την εμπειρική αυξομείωση της δόσης. Αρκετές περιπτώσεις τοξικής πολυοζώδους βρογχοκήλης έχουν φυσιολογικές τιμές RAIU, ενώ μερικές ακόμα και χαμηλό. Στην Εικόνα 2.2 παρουσιάζεται υπερθυρεοειδική ασθενής με πολύ χαμηλό uptake, στην οποία επιχειρήθηκε θεραπεία με RAI μετά από ενδογενή διέγερση της TSH με ανασυνδυασμένη ανθρώπινη θυρεοτροπίνη (rhTSH).
2.2.2. Επιβεβαίωση θυρεοειδίτιδας De Quervain και διαφορική διάγνωση θυρεοτοξίκωσης.
Σύμφωνα με τις κατευθυντήριες οδηγίες (ATA/AACE 2011), μέτρηση του RAIU (με Ι-123 ή Ι-131) επιβάλλεται σε όλες τις περιπτώσεις θυρεοτοξίκωσης, όταν η διάγνωση της νόσου Graves δεν είναι κλινικά προφανής. Επί παρουσίας όζων τότε απαιτείται και σπινθηρογράφημα θυρεοειδούς. Σε θυρεοειδίτιδα της λοχείας προτείνεται μόνο η χρήση του Ι-123 ή του Tc-99m (9).
Όταν δεν είναι άμεσα διαθέσιμες στο εργαστήριο κάψουλες Ι-131, μπορεί να χρησιμοποιηθεί εναλλακτικά η ποιοτική εκτίμηση του σπινθηρογραφήματος με 99mTcO4. Βάσει της εμπειρίας μας, όλες οι περιπτώσεις θυρεοειδίτιδας De Quervain παρουσιάζουν πλήρως καταργημένη (ή ενίοτε ασθενέστατη) πρόσληψη του υπερτεχνητικού ανιόντος. Η διαδικασία είναι σύντομη (15 min), δεν απαιτεί κατευθυντήρα pinhole και η απάντηση στο κλινικό ερώτημα άμεση. Επί πλέον με την απεικόνιση του θυρεοειδούς μπορούν να διαγνωσθούν περιπτώσεις ετερόπλευρης ή εστιακής θυρεοειδίτιδας. Απαιτείται λήψη ακριβούς ιστορικού για να αποκλεισθεί προηγούμενη έκθεση του ασθενούς σε ιωδιούχα (π.χ. σκιαγραφικά). Το 99mTc-O4 μπορεί επίσης να χρησιμεύσει και στις περιπτώσεις διαφορικής διάγνωσης της θυρεοτοξίκωσης (βλ. προηγούμενη ενότητα), έτσι ώστε η ανάγκη υπολογισμού RAIU να περιοριστεί μόνο σε αμφίβολες περιπτώσεις.

Εικόνα 2.1. Πάνω αριστερά παρουσιάζεται σχηματικά το σύστημα μέτρησης της θυρεοειδικής πρόσληψης (θυρεοειδόμετρο). Αποτελείται από ένα κρύσταλλο ιωδιούχου νατρίου (κρύσταλλο σπινθηρισμών) και ένα φωτοπολλαπλασιαστή σε επαφή, για την ενίσχυση των φωτεινών σημάτων που παράγονται στον κρύσταλλο, όταν προσπίπτουν φωτόνια γ-ακτινοβολίας. Το σύστημα είναι θωρακισμένο με μολύβδινο περίβλημα, το οποίο λειτουργεί και ως κατευθυντήρας (collimator) και συνδέεται με ένα καταγραφικό ή με οθόνη στην οποία παρουσιάζονται οι καταγραφόμενοι παλμοί (κρούσεις) και γίνονται κατάλληλες ρυθμίσεις (κάτω αριστερά). Το σύστημα επικεντρώνεται στον τράχηλο του ασθενούς, σε σταθερή απόσταση για τη μέτρηση της πρόσληψη (δεξιά). Από τους καταγραφόμενους παλμούς αφαιρείται το background του ασθενούς, μετά από μια μέτρηση στο μηρό του. Τέλος μετράται μια δόση (κάψουλα), Ι-131 ίδια με αυτή που πήρε ο ασθενής, τοποθετημένη μέσα σε ένα ομοίωμα (phantom) του τραχήλου. Από αυτήν αφαιρείται το background του εργαστηρίου μετά από μια μέτρηση στον αέρα. Η πρόσληψη υπολογίζεται ως εξής: Uptake % = (κρούσεις τραχήλου – κρούσεις μηρού)/(κρούσεις δόσης – κρούσεις background εργαστηρίου) x 100.

Εικόνα 2.2. Ασθενής με πολύ μεγάλη, τοξική πολυοζώδη βρογχοκήλη. Α) Σπινθηρογράφημα με 99mTcO4, στο οποίο η συνολική πρόσληψη του ραδιοφαρμάκου από τον αδένα είναι πολύ χαμηλή. Αναδεικνύεται μόνο μικρή περιοχή σχετικά αυξημένης πρόσληψης στον ισθμό. Λόγω αυξημένου εγχειρητικού κινδύνου, επιχειρήθηκε θεραπευτική χορήγηση RAI, αλλά μετά από τo εύρημα του scan δοκιμάστηκε αύξηση της πρόσληψης, μέσω εξωγενούς διέγερσης με rhTSH . Β) Εδώ εικονίζεται ο θυρεοειδής 5 ημέρες μετά το θεραπευτικό RAI. Είναι εμφανής η διαφορά πρόσληψης σε σύγκριση με το αρχικό scan, τόσο στο βαθμό όσο και στην κατανομή των δύο ραδιοϊσοτόπων.
2.3. Επιγραμματικά – ενότητα 2
- Η μέτρηση της θυρεοειδικής πρόσληψης του ραδιοϊωδίου (RAIU) είναι ιδιαίτερα χρήσιμη πριν από τη θεραπευτική χορήγηση RAI για τη νόσο Graves και την πολυοζώδη τοξική βρογχοκήλη, ακόμη και όταν οι θεραπευτικές δόσεις είναι εμπειρικές.
- Για τη διαφορική διάγνωση της θυρεοτοξίκωσης το RAIU μπορεί, στην πλειοψηφία των περιπτώσεων, να υποκατασταθεί από την οπτική εκτίμηση της θυρεοειδικής πρόσληψης του υπερτεχνητικού ανιόντος (99mTcO4–).
3. Ολόσωμο σπινθηρογράφημα με Ι-131/Ι-123 στη διερεύνηση του διαφοροποιημένου θυρεοειδικού καρκίνου
3.1. Προετοιμασία ασθενούς
Η προετοιμασία του ασθενούς πριν τη χορήγηση του Ι-131 (ή Ι-123) είναι σε γενικές γραμμές η ίδια, όπως αναφέρθηκε παραπάνω για το σπινθηρογράφημα του θυρεοειδούς. Η τήρηση των κανόνων προετοιμασίας είναι προφανώς αυστηρότερη. Συνιστάται επί πλέον δίαιτα πτωχή σε ιώδιο και αυστηρή αποφυγή ιωδιούχων σκευασμάτων, για 2-3 εβδομάδες πριν το scan (31). Για ενδογενή διέγερση του θυρεοειδούς, η θυροξίνη διακόπτεται για 4 και η τριιωδοθυρονίνη για 2 εβδομάδες. Σε περίπτωση που χρησιμοποιείται εξωγενής διέγερση με ανασυνδυασμένη ανθρώπινη TSH (rhTSH), το ραδιοϊώδιο δίνεται την τρίτη ημέρα από την έναρξη της δοκιμασίας διέγερσης (ενδομυϊκές ενέσεις 0.9 mg rhTSH την πρώτη και τη δεύτερη ημέρα). Για την ερμηνεία των ευρημάτων της εξέτασης είναι απαραίτητη η γνώση των επιπέδων της TSH, καθώς και της θυρεοεσφαιρίνης (Tg). Η TSH μετράται την ημέρα χορήγησης του ραδιοϊωδίου και θα πρέπει να είναι μεγαλύτερη των 30 mIU/L. Το δείγμα για τη μέτρηση της Tg και των anti-Tg αντισωμάτων λαμβάνεται την 5η ημέρα. Η περίπτωση εγκυμοσύνης πρέπει να αποκλεισθεί από το ιστορικό και με test κυήσεως, ιδιαίτερα όταν πρόκειται να χορηγηθούν θεραπευτικές δόσεις Ι-131 (32).
3.2. Τεχνικές
3.2.1. Ολόσωμο σπινθηρογράφημα με μικρή (διαγνωστική) δόση Ι-131 (I-131 Dx–WBS)
Το ολόσωμο σπινθηρογράφημα με Ι-131 (Dx–WBS) διενεργείται 48 (ή και 72) ώρες μετά τη χορήγηση 2-5 mCi (185 MBq) Ι-131. Η χορήγηση μεγαλύτερης δόσης (π.χ. 10 mCi) θεωρητικά προσφέρει το πλεονέκτημα συλλογής περισσότερου σήματος στον ίδιο χρόνο εξέτασης (και ενδεχομένως περισσότερης πληροφορίας), αλλά αυτό δεν είναι τεκμηριωμένο (33), ενώ συνεπάγεται μεγαλύτερη ακτινοβόληση του ασθενούς. Χρησιμοποιείται κατευθυντήρας παραλλήλων οπών, υψηλής κατά προτίμηση ή έστω μέσης ενέργειας (φέρει μακρύτερα και παχύτερα μολύβδινα διαφράγματα μεταξύ των οπών, κατάλληλα για την υψηλή ενέργεια των φωτονίων του I-131). Γίνεται σάρωση του σώματος από την κεφαλή μέχρι το άνω τριτημόριο των μηρών σε πρόσθια και οπίσθια προβολή, είτε με διαδοχικές στατικές λήψεις ή με συνεχή καταγραφή κατά τη διάρκεια μετακίνησης της εξεταστικής κλίνης με σταθερή ταχύτητα. Λόγω της χαμηλής ροής φωτονίων, η διάρκεια της εξέτασης είναι μακρά, συνήθως 30-40 min όταν χρησιμοποιείται δικέφαλη γ-camera για ταυτόχρονη πρόσθια και οπίσθια λήψη και ~60 min με camera μιας κεφαλής. Η χρήση ραδιενεργών δεικτών σε συγκεκριμένα ανατομικά σημεία (στη στερνική εντομή, τον πώγωνα, στα πλάγια του τραχήλου κλπ) βοηθά στην ανατομική εντόπιση των ευρημάτων. Για τον ίδιο λόγο, μπορεί να χρησιμοποιηθεί εάν είναι διαθέσιμη μια επίπεδη πηγή κοβαλτίου-57, προκειμένου να απεικονισθεί το περίγραμμα του σώματος, όπως φαίνεται στην Εικόνα 3.1. Ενδεχομένως απαιτηθούν πρόσθετες λοξές ή πλάγιες λήψεις για τη διευκρίνιση μερικών ευρημάτων ή και πλέον καθυστερημένες εικόνες 72 ή και 96 ωρών ιδιαίτερα στην κοιλιακή χώρα, μετά την αποβολή ραδιοεπισημασμένων κοπράνων. Για την περιοχή του τραχήλου, μερικοί συγγραφείς προτείνουν τη χρήση κατευθυντήρα pinhole, λόγω της υψηλότερης διακριτικής ικανότητας που προσφέρει (34). Ωστόσο, η διάρκεια της εξέτασης παρατείνεται έτσι σημαντικά.

Εικόνα 3.1. Στατική λήψη (στα πλαίσιαα Ι-131 WBS) στην περιοχή της κεφαλής, του τραχήλου και του άνω τμήματος του σώματος. Αριστερά διακρίνονται εστίες καθήλωσης του Ι-131, ελλείπουν όμως πλήρως τα ανατομικά οδηγά σημεία για να προσδιοριστεί η θέση των εστιών. Δεξιά έχει επαναληφθεί η λήψη, μετά από τοποθέτηση επίπεδης πηγής Co-57 πίσω από τον ασθενή. Καθίσταται έτσι εμφανές ότι τα εστιακά ευρήματα εντοπίζονται στη θυρεοειδική κοίτη και στη δεξιά υπογνάθιο χώρα.
3.2.2. Ολόσωμο σπινθηρογράφημα με Ι-123 (I-123 Dx–WBS)
Το Ι-123 έχει καλύτερα απεικονιστικά χαρακτηριστικά από το Ι-131 (παράγει καλύτερης ποιότητας εικόνες), όπως αναφέρθηκε, αλλά συνεπάγεται και πολύ χαμηλότερη ακτινική επιβάρυνση του ασθενούς (5 mCi I-123 συνεπάγονται ενεργό δόση 2,4 mSv, ενώ 5 mCi Ι-131 13.3 mSv) (31). Επειδή δεν εκπέμπει β-ακτινοβολία, δεν προκαλεί αποπληξία (stunning) του θυρεοειδικού ιστού και έτσι επιτρέπει τη σύντομη χορήγηση θεραπευτικής δόσης Ι-131, μετά το διαγνωστικό ολόσωμο scan. Χορηγείται ενδοφλέβια σε δόση 2-5 mCi (74-185 MBq) και η ολόσωμη απεικόνιση λαμβάνει χώρα 6 και 24 ώρες αργότερα. Χρησιμοποιείται κατευθυντήρας παραλλήλων οπών χαμηλής ενέργειας, ενώ ο τράχηλος μπορεί να εξεταστεί και με κατευθυντήρα pinhole. Το κύριο μειονέκτημα είναι το υψηλό κόστος. Επί πλέον, λόγω του μικρού σχετικά χρόνου ημισείας ζωής του ισοτόπου (13,3 ώρες), η καθυστερημένη απεικόνιση πέραν των 24 ωρών είναι σχεδόν απαγορευτική. Επειδή η πρόσληψη ιωδίου από τις μεταστάσεις του διαφοροποιημένου θυρεοειδικού καρκίνου είναι συνήθως χαμηλή και συντελείται με βραδύ ρυθμό, ενίοτε απαιτούνται λίαν καθυστερημένες λήψεις (48 ωρών και πλέον) προκειμένου να βελτιστοποιηθεί η σχέση πρόσληψης στόχου-περιβάλλοντος και να γίνουν ορατές οι λειτουργικές μεταστάσεις. Το Ι-131 προσφέρεται για καθυστερημένες λήψεις (χρόνος ημιζωής 8,02 ημέρες) και σε αυτό πλεονεκτεί έναντι του Ι-123. Αρκετοί συγγραφείς προτείνουν την αντικατάσταση του Ι-131 από το Ι-123 (35,36), άλλοι όμως διατηρούν επιφυλάξεις για τη διαγνωστική του αξία (37). Σύμφωνα με τη δική μας μικρή εμπειρία, το Ι-123 WBS (με δόση 5 mCi) δίνει συγκρίσιμα αποτελέσματα με το Ι-131 Dx-WBS (με δόση επίσης 5 mCi), αλλά υπολείπεται του μεταθεραπευτικού Ι-131 WBS (Rx-WBS) που θα δούμε στη συνέχεια. Στην Εικόνα 3.2 σε δύο διαφορετικούς ασθενείς φαίνονται οι ομοιότητες της βιοκατανομής των δύο ισοτόπων, αλλά και μερικές διαφορές.
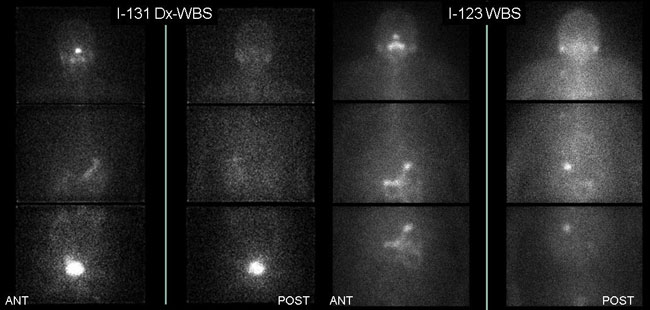
Εικόνα 3.2. Ολόσωμο scan με 5 mCi I-131 48 ώρες μετά τη χορήγηση (αριστερά) και 5 mCi Ι-123 24 ώρες μετά τη χορήγηση (δεξιά), σε δύο διαφορετικούς ασθενείς μετά από πλήρη εκρίζωση (ablation) του μετεγχειρητικού θυρεοειδικού υπολείμματος. Παρατηρείται φυσιολογική καθήλωση του ραδιοφαρμάκου στο ρινικό βλεννογόνο, τη στοματική κοιλότητα, τους σιελογόνους αδένες, το στόμαχο, το έντερο και την ουροδόχο κύστη, ομοίως και με τα δύο ραδιοϊσότοπα του ιωδίου. Ωστόσο, η ενεργότητα του περιβάλλοντος (backgrund), καθώς και η πρόσληψη στο στόμαχο και τις εντερικές έλικες είναι υψηλότερη στις εικόνες του Ι-123.
3.2.3 Μεταθεραπευτικό ολόσωμο σπινθηρογράφημα με Ι-131 (Rx–WBS)
Το μεταθεραπευτικό ολόσωμο scan (I-131 Rx-WBS) εκτελείται 3-8 ημέρες μετά τη χορήγηση θεραπευτικής δόσης Ι-131, είτε για την εκκρίζωση του μετεγχειρητικού θυρεοειδικού υπολείμματος ή για την θεραπευτική αντιμετώπιση των μεταστάσεων. Λόγω της μεγάλης δόσης Ι-131, η ποιότητα της απεικόνισης είναι καλύτερη από αυτήν του Dx-WBS (συλλέγονται περισσότερες κρούσεις στη μονάδα του χρόνου) και επιτρέπεται η καθυστερημένη απεικόνιση πολλές ημέρες μετά τη χορήγηση, με τα πλεονεκτήματα που αυτή έχει όπως αναφέρθηκε στην προηγούμενη παράγραφο. Ωστόσο μερικοί υποστηρίζουν ότι οι πρώιμες λήψεις 3-4 ημέρες από τη χορήγηση είναι προτιμότερες, διότι ορισμένες μεταστάσεις παρουσιάζουν ταχεία απομάκρυνση του Ι-131(38). Για τους παραπάνω λόγους η ευαισθησία του Rx-WBS είναι υψηλότερη του Dx-WBS, αφού αναδεικνύει περίπου 20% περισσότερες μεταστάσεις από το τελευταίο (39). Τα ευρήματα μπορεί να αλλάξουν την θεραπευτική στρατηγική (40), για αυτό και η συστηματική διενέργεια του Rx-WBS είναι εκ των ων ουκ άνευ, όπως τονίζεται και στις Ευρωπαϊκές και Αμερικανικές κατευθυντήριες οδηγίες (18,41). Στην Εικόνα 3.3 παρουσιάζεται το Ι-131 Rx-WBS μιας ασθενούς με πολλαπλές λεμμφαδενικές και πνευμονικές μεταστάσεις διαφοροποιημένου θυρεοειδικού καρκίνου (ΔΘΚ). Στις εικόνες 3.4 και 3.5 αναδεικνύεται η μεγαλύτερη ευαισθησία του Rx-WBS έναντι του Dx-WBS.
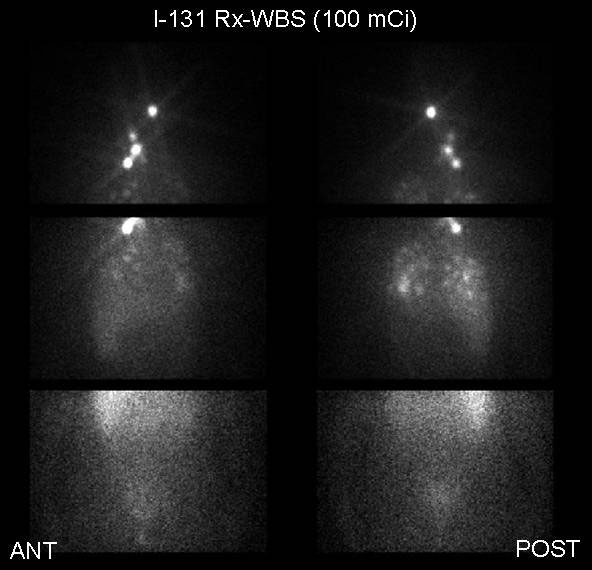
Εικόνα 3.3. Ολόσωμο μεταθεραπευτικό scan με Ι-131 (Rx-WBS) σε πρόσθια (ANT) και οπίσθια (POST) προβολή, σε ασθενή με ΔΘΚ, 2 έτη μετά τη θεραπεία την εκρίζωση (ablation) του θυρεοειδικού υπολείμματος. Αναδεικνύονται πολλαπλές εστιακές συγκεντρώσεις του Ι-131 σε τραχηλικούς και μεσοθωράκιους λεμφαδένες, καθώς και πολλές λειτουργικές πνευμονικές μεταστάσεις.
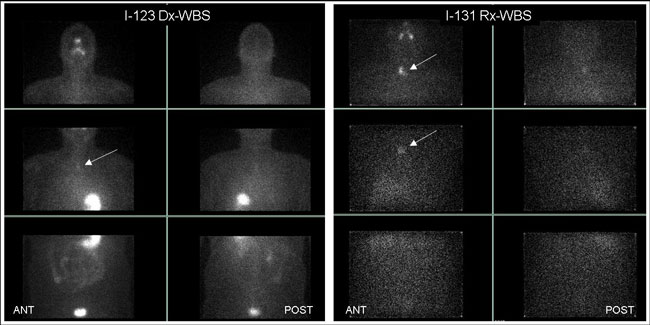
Εικόνα 3.4. Ασθενής με ΔΘΚ μετά τη θεραπεία την εκρίζωση (ablation) του θυρεοειδικού υπολείμματος. Ολόσωμο διαγνωστικό scan με Ι-123 (Dx-WBS) σε πρόσθια (ANT) και οπίσθια (POST) προβολή αριστερά και μεταθεραπευτικό scan με Ι-131 (Rx-WBS) 8 ημέρες από τη χορήγηση 100 mCi I-131 δεξιά. Η εστία νόσου πλησίον της σφαγής (βέλη) αναδεικνύεται ευκρινέστερα στο μεταθεραπευτικό scan.
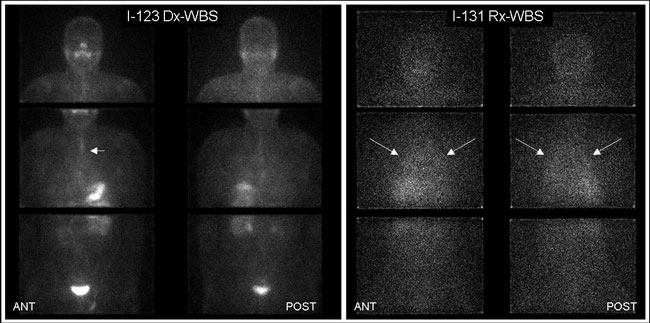
Εικόνα 3.5. Ασθενής με ΔΘΚ μετά τη θεραπεία την εκρίζωση (ablation) του θυρεοειδικού υπολείμματος. Αριστερά εικονίζεται το ολόσωμο διαγνωστικό scan με Ι-123 (Dx-WBS) σε πρόσθια (ANT) και οπίσθια (POST) προβολή και δεξιά, στον ίδιο ασθενή, το μεταθεραπευτικό scan με Ι-131 (Rx-WBS) 8 ημέρες από τη χορήγηση 100 mCi I-131. Το Ι-123 Dx-WBS είναι φυσιολογικό. Η γραμμοιειδής πρόσληψη στο θώρακα (βέλος) οφείλεται σε παραμονή ραδιενεργού σιέλου στον οισοφάγο. Στο Ι-131 Rx-WBS διακρίνεται ήπια, διάχυτα αυξημένη πρόσληψη σε αμφότερους τους πνεύμονες (βέλη), εύρημα το οποίο υποδηλώνει την παρουσία διάχυτων μικρο-μεταστάσεων.
3.2.4. Υβριδική απεικόνιση SPECT/CT
Ένα σημαντικό πρόβλημα στην ανάγνωση των σπινθηρογραφικών εικόνων του WBS είναι η αδυναμία ακριβούς εντόπισης των ευρημάτων, διότι ελλείπουν τα ανατομικά στοιχεία. Έτσι, η εντόπιση γίνεται αδρά με τη χρήση ραδιενεργών δεικτών ή επίπεδων πηγών Co-57, όπως αναφέρθηκε.
Η τομογραφική απεικόνιση SPECT (single photon emission computed tomography) δεν βοηθά ουσιαστικά, διότι επίσης στερείται οδηγού ανατομικής πληροφορίας. Η ανάπτυξη των υβριδικών συστημάτων από έτος 2000 και μετά, επέφερε επαναστατικές αλλαγές στην απεικόνιση. Κυρίως προωθήθηκαν τα υβριδικά PET/CT συστήματα, ενώ η εξάπλωση του SPECT/CT έμεινε σχετικά πίσω.
Στο εργαστήριό μας έχουμε την τύχη να διαθέτουμε ένα πρώτης γενιάς SPECT/CT σύστημα από το 2004, ενώ πρόσφατα αποκτήσαμε και δεύτερο, πιο σύγχρονο. Στην Eικόνα 3.6 παρουσιάζεται σχηματικά η διάταξη των υβριδικών συστημάτων και τα δύο SPECT/CT του εργαστηρίου μας. Η λυχνία ακτίνων-Χ και οι ανιχνευτές είναι τοποθετημένα πάνω στο ίδιο ικρίωμα στήριξης (gantry) με τις κεφαλές της γ-camera. Με τον τρόπο αυτό η CT είναι αργή, έστω και αν αντί για μία υπάρχουν πολλαπλές σειρές ανιχνευτών (Εικόνα 3.6, δεξιά κάτω). Η λήψη της SPECT και της CT μελέτης είναι διαδοχική και όχι ταυτόχρονη. Η CT είναι ηθελημένα χαμηλής δόσης και άρα χαμηλής ευκρίνειας, διότι στοχεύει στην εντόπιση ευρημάτων (και σε διορθώσεις για την εξασθένηση της γ-ακτινοβολίας κατά τη διέλευσή της μέσω των ιστών) και όχι στην απόκτηση μιας διαγνωστικής αξονικής τομογραφίας. Η δόση στον ασθενή από αυτή τη CT είναι 0.5-1 mSv. Τα νεότερα SPECT/CT συστήματα φέρουν πολυτομικούς αξονικούς τομογράφους σε ξεχωριστό gantry και μπορούν να παράγουν διαγνωστικές εικόνες CT, όμως η ακτινοβόληση του ασθενούς είναι μεγαλύτερη.
Η εμπειρία μας από τη χρήση του SPECT/CT σε διάφορες κλινικές εφαρμογές είναι απόλυτα θετική και σύμφωνη με τη διεθνή βιβλιογραφία (42). Ειδικότερα στην περίπτωση του σπινθηρογραφήματος με Ι-123 ή Ι-131, η δυνατότητα ακριβούς εντόπισης των ευρημάτων επιλύει πολλά προβλήματα και ενίοτε αλλάζει δραματικά την αρχική εντύπωση. Μειονέκτημα αποτελεί η παράταση του χρόνου της εξέτασης, η οποία στην περίπτωση μικρών διαγνωστικών δόσεων Ι-131 (πχ. 5 mCi) είναι σημαντική (40-45 λεπτά ανά πεδίο, επί πλέον του WBS). Ο τράχηλος και ο θώρακας περιλαμβάνονται σε ένα πεδίο της γ-camera, ενώ σπάνια χρειάζεται δεύτερο πεδίο για τομογραφική εξέταση της κοιλιακής χώρας. Σε μεταθεραπευτικά σπινθηρογραφήματα (με χορηγούμενες δόσεις Ι-131 50-150 mCi) ο χρόνος εξέτασης είναι πολύ μικρότερος και η ποιότητα της απεικόνισης ανώτερη. Σε πολλές βιβλιογραφικές αναφορές τονίζεται η αξία της μεθόδου στα περιστατικά ΔΘΚ (42-46). Σε πολύ πρόσφατη αναδρομική ανάλυση 14 δημοσιευμένων μελετών επί συνόλου 1066 ασθενών, το SPECT/CT επέδειξε προσθετική διαγνωστική αξία έναντι του I-131 WBS στο 48-88% των περιπτώσεων και είχε ως αποτέλεσμα την αλλαγή της θεραπευτικής στρατηγικής στο 23-25% των ασθενών (47). Η μέθοδος μπορεί ακόμα να χρησιμεύσει για ακριβέστερους δοσιμετρικούς υπολογισμούς, προκειμένου να προσαρμοστεί ανάλογα η θεραπευτική δόση (48,49).
Στις Eικόνες 3.7 -3.11 δίνονται παραδείγματα για την χρησιμότητα της SPECT/CT. Επί πλέον, σε επόμενη ενότητα που αναφέρεται στις διαγνωστικές παγίδες του I-131/I-123 WBS, φαίνεται ο τρόπος με τον οποίο μπορούν να αποφευχθούν αρκετές λανθασμένες ερμηνείες.

Εικόνα 3.6. Αριστερά εικονίζεται η SPECT/CT διάταξη, στα συστήματα που η ακτινολογική λυχνία και οι ανιχνευτές είναι τοποθετημένη στο ίδιο σύστημα στήριξης-περιστροφής με αυτό των κεφαλών της γ-camera. Γίνεται πρώτα η τομογραφική SPECT απεικόνιση και ακολουθεί η λήψη της CT, μετά από αυτόματη μετακίνηση της εξεταστικής κλίνης στην κατάλληλη θέση (μπορεί να ακολουθηθεί και η αντίστροφη σειρά). Δεξιά εικονίζονται τα δύο SPECT/CT συστήματα που διατίθενται στο εργαστήριό μας. Πάνω, το σύστημα με μονή σειρά ανιχνευτών (Hawkey, GE Healthcare) και κάτω με 4-τομικό CT (Hawkey-4, GE Healthcare).
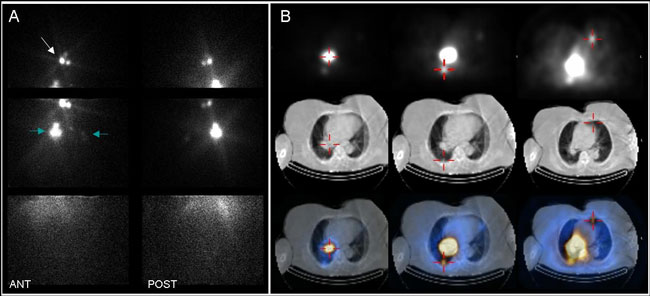
Εικόνα 3.7. A) I-131 Rx-WBS (σε πρόσθια και οπίσθια προβολή) μετά λήψη 100 mCi για εκρίζωση του μετεγχειρητικού υπολείμματος, σε γυναίκα 80 ετών με θηλώδες Ca θυρεοειδούς. Απεικονίζεται το θυρεοειδικό υπόλειμμα (λευκό βέλος), καθώς και εστιακές συγκεντρώσεις στο θώρακα (γαλάζια βέλη). Η ακριβής εντόπιση της ευμεγέθους και έντονης εστίας στο δεξιό ημιθωράκιο δεν είναι δυνατή. Β) SPECT/CT μελέτη στο θώρακα. Παρουσιάζονται επιλεγμένες τομές σε 3 εγκάρσια επίπεδα (το SPECT στην πάνω σειρά, το CT στη μέση και η μείξη (fusion) των δύο στην κάτω σειρά. Η εντονότερη εστία καθήλωσης του Ι-131 εντοπίζεται στη δεξιά πνευμονική πύλη. Εικονίζονται επίσης 2 από τις πολλές πνευμονικές μεταστάσεις.
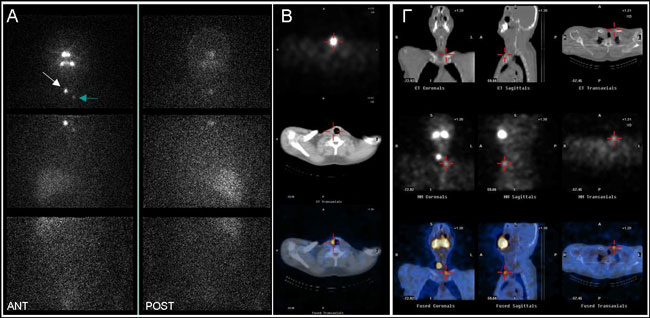
Εικόνα 3.8. Άνδρας 46 ετών με θηλώδες Ca θυρεοειδούς. Υπεβλήθη σε σχεδόν ολική θυρεοειδεκτομή προ έτους και έλαβε στη συνέχεια 50 mCi I-131 για ablation. Λόγω υψηλών τιμών Tg έλαβε επιπρόσθετα 100 mCi I-131. Α) Στο Rx-WBS απεικονίζονται δύο εστίες καθήλωσης του ραδιοϊωδίου εκατέρωθεν της μέσης γραμμής (βέλη), χωρίς να είναι σαφές εάν εντοπίζονται στη θυρεοειδική κοίτη. Β) SPECT/CT μελέτη: Επιλεγμένη εγκάρσια τομή στον τράχηλο στο ύψος της εστίας επί τα δεξιά της μέσης γραμμής, στην οποία φαίνεται η εντόπιση του ευρήματος στην θυρεοειδική κοίτη. Γ) SPECT/CT μελέτη: Παρουσιάζονται τομές σε 3 επίπεδα επικεντρωμένες στο δεύτερο εστιακό εύρημα επί τα αριστερά της μέσης γραμμής. Το εν λόγω εύρημα είναι εκτός της θυρεοειδικής κοίτης και παριστά μετάσταση σε υπερκλείδιο λεμφαδένα.
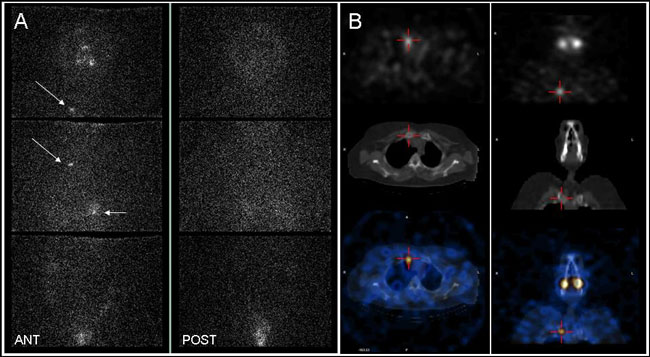
Εικόνα 3.9. Γυναίκα 50 ετών με ιστορικό θυλακιώδους Ca θυρεοειδούς χειρουργηθέντος προ 10ετίας. Λόγω υποτροπής έλαβε στο παρελθόν θεραπεία με Ι-131 δύο φορές. Στη παρούσα φάση ελέγχεται με Dx-WBS, 48 ώρες μετά λήψη 5 mCi I-131. Α) Στο Dx-WBS διακρίνεται εστία καθήλωσης του ραδιοϊωδίου στο κατώτερο τμήμα του τραχήλου δεξιά ή στην είσοδο του θωαρακικού κλωβού (λοξά βέλη), η ακριβής θέση της οποίας πάντως δεν μπορεί να διευκρινισθεί. Το δεύτερο εύρημα στην άνω κοιλιακή χώρα αριστερά παριστά φυσιολογική πρόσληψη του ραδιοφαρμάκου από τον στόμαχο. Β) Στη SPECT/CT μελέτη (εδώ παρουσιάζονται τομές σε εγκάρσιο και μετωπιαίο επίπεδο επικεντρωμένες στο ύποπτο σπινθηρογραφικό εύρημα) καθίσταται εμφανές ότι η εστιακή πρόσληψη εντοπίζεται στην κεφαλή της δεξιάς κλείδας και παριστά οστική μετάσταση.
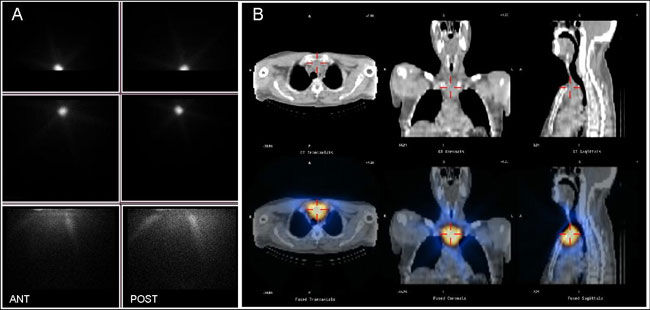
Εικόνα 3.10. Άνδρας 54 ετών μετά θυρεοειδεκτομή για θυλακιώδες Ca θυρεοειδούς. Α) Rx-WBS 7 ημέρες μετά τη λήψη 50 mCi Ι-131 για εκρίζωση μετεγχειρητικού υπολείμματος. Παρατηρείται εντονότατη εστιακή καθήλωση του ραδιοϊωδίου στο κατώτερο τμήμα του τραχήλου ή στην είσοδο του θώρακα, χωρίς να είναι δυνατή η ακριβής εντόπιση. Β) SPECT/CT μελέτη στον τράχηλο και το θώρακα: Παρουσιάζονται τομές σε τρια επίπεδα, επικεντρωμένες στο σπινθηρογραφικό εύρημα. Πρόκειται για μεγάλο οπισθοστερνικά καταδυόμενο θυρεοειδικό υπόλειμμα το οποίο παραλήφθηκε της θυρεοειδεκτομής.

Εικόνα 3.11. Γυναίκα 29 ετών μετά από σχεδόν ολική θυρεοειδεκτομή για θηλώδες Ca θυρεοειδούς. Α) Rx-WBS 7 ημέρες μετά τη λήψη 50 mCi I-131 για εκρίζωση μετεγχειρητικού υπολείμματος. Στον τράχηλο εικονίζεται το θυρεοειδικό υπόλειμμα. Παρατηρείται επίσης εστία πρόσληψης του Ι-131 στην ελάσσονα πύελο αριστερά (βέλος), εύρημα το οποίο αρχικά θεωρήθηκε ότι προκαλείται από την παραμονή ραδιοεπισημασμένων κοπράνων στο σιγμοειδές. Το εύρημα ωστόσο παρέμεινε σταθερό και σε πιο καθυστερημένες λήψεις, 10 ημέρες μετά τη χορήγηση του Ι-131. Β) Στη SPECT/CT μελέτη στην πύελο (εγκάρσιες και μετωπιαίες τομές επικεντρωμένες στο εύρημα). Η εστιακή καθήλωση εντοπίζεται στη θέση της αριστεράς ωοθήκης και πιθανότατα παριστά έκτοπο θυρεοειδικό ιστό (struma ovarii).
3.3. Ενδείξεις
3.3.1. Ολόσωμο scan (Dx–WBS) πριν τη θεραπεία εκρίζωσης (ablation) του θυρεοειδικού υπολείμματος
Πρόκειται για κλασσική ένδειξη, η οποία όμως αμφισβητείται. Οι υποστηρικτές αυτής της ένδειξης παραθέτουν ως πλεονεκτήματα α) την εκτίμηση του μεγέθους του θυρεοειδικού υπολείμματος και β) την πρώιμη ανίχνευση τυχόν μεταστάσεων, προκειμένου και στις δύο περιπτώσεις γ) να σχεδιαστεί το θεραπευτικό πλάνο (ενδεχόμενη συμπληρωματική θυρεοειδεκτομή ή χειρουργικός λεμφαδενικός καθαρισμός του τραχήλου) και να καθοριστούν οι θεραπευτικές δόσεις Ι-131 για τη συνέχεια (50). Η άποψη αυτή υποστηρίζεται, υπό όρους, στις κατευθυντήριες γραμμές της Αμερικάνικης Εταιρείας Θυρεοειδούς(revised ATA guidelines 2009) (18). Σύμφωνα με της οδηγίες του National Comprehensive Cancer Network (NCCN version 2.2013) το Dx-WBS θεωρείται απαραίτητο. Αρνητικό το Dx-WBS και προκλητή Tg<1 ng/ml αίρει την αναγκαιότητα εκρίζωσης του μετεγχειρητικού υπολείμματος (ablation) με Ι-131. Πρόσληψη μόνο στη θυρεοειδική κοίτη απαιτεί δόσεις Ι-131 ablation 30-100 mCi, ενώ επί επιχώριων ή απομακρυσμένων μεταστάσεων προτείνονται δόσεις 100-200 mCi (51).
Ως επιχειρήματα για την παράλειψη του Dx-WBS παρατίθενται: α) Η ύπαρξη σημαντικού θυρεοειδικού υπολείμματος, αλλά και η παρουσία ύποπτων λεμφαδένων στον τράχηλο που ενδεχομένως θα άλλαζαν τη θεραπευτική στρατηγική μπορεί να αποκλεισθούν με ένα μετεγχειρητικό υπερηχογράφημα τραχήλου. β) Η περίπτωση αρνητικού Dx-WBS και προκλητής Tg<1 ng/ml (δηλ. ολικής θυρεοειδεκτομής) είναι σπάνια, πέραν των πολύ εξειδικευμένων χειρουργών. γ) Δεν έχει αποδειχθεί ότι οι προσαρμοσμένες θεραπευτικές δόσεις Ι-131 (ανάλογα με τα ευρήματα του scan) υπερτερούν των σταθερών εμπειρικών για την εκρίζωση του υπολείμματος. γ) Με διαγνωστικές δόσεις Ι-131 μεγαλύτερες των 2-3 mCi υπάρχει ο κίνδυνος, αν και αμφισβητείται, αποπληξίας (stunning) του θυρεοειδικού υπολείμματος (52), γεγονός που συνεπάγεται καθυστέρηση της θεραπείας για μερικούς μήνες. Ωστόσο με τη χρήση του Ι-123 αλλά και με δόσεις Ι-131 μέχρι 2-3 mCi τέτοιος κίνδυνος δεν έχει αποδειχθεί (53) δ) Η ευαισθησία του Dx-WBS είναι σαφώς μικρότερη από αυτήν του Rx-WBS. δ) Ο ασθενής υποβάλλεται σε προετοιμασία δύο φορές, μία για τη διενέργεια του Dx-WBS και μία για τη λήψη της θεραπευτικής ποσότητας του Ι-131. Με την άποψη της παράληψης του Dx-WBS τάσσονται οι Ευρωπαϊκές οδηγίες (European Thyroid Cancer Task Force 2006, ESMO Clinical Practice Guidelines 2012) (41, 54).
3.3.2. Ολόσωμο scan (131I/123I Dx–WBS) στην παρακολούθηση του ασθενούς με διαφοροποιημένο θυρεοειδικό καρκίνο
Η χρησιμότητα του ολόσωμου scan με μικρές διαγνωστικές δόσεις Ι-131 ή με I-123 (Dx-WBS) έχει αμφισβητηθεί τα τελευταία χρόνια, κυρίως λόγω της μικρότερης ευαισθησίας του σε σύγκριση με τη μέτρηση θυρεοσφαιρίνης (Tg) μετά από προκλητή αύξησης της TSH. Ωστόσο, σε ένα μικρό ποσοστό ασθενών (14% σύμφωνα με μια μελέτη (55)) μπορεί το Dx-WBS να είναι θετικό παρά τη φυσιολογική Tg (Tg < 2 ng/ml μετά πρόκληση). Οι κατευθυντήριες οδηγίες (revised ATA guidelines 2009, ESMO Clinical Practice Guidelines 2012) προτείνουν το υπερηχογράφημα τραχήλου και τη μέτρηση της Τg μετά ενδογενή ή εξωγενή πρόκληση, 6-12 μήνες μετά το ablation, χωρίς τη διενέργεια Dx-WBS, τουλάχιστον σε ασθενείς χαμηλού ρίσκου (18,54). Ως χαμηλού κινδύνου στη μετεγχειρητική διαστρωμάτωση θεωρούνται ασθενείς: α) χωρίς τοπική εξωθυρεοειδική επέκταση του καρκίνου, β) χωρίς επιθετικό ιστολογικό τύπο, γ) με πλήρη εξαίρεση του μακροσκοπικά ορατού νεοπλάσματος, γ) χωρίς ενδείξεις επιχώριων ή απομακρυσμένων μεταστάσεων και δ) με πρόσληψη Ι-131 μόνο στη θυρεοειδική κοίτη στο μεταθεραπευτικό scan (Rx-WBS) στη φάση του ablation (18). Το Dx-WBS θεωρείται χρήσιμο σε ασθενείς μέσου και υψηλού ρίσκου, επί παρουσίας αντι-Tg αντισωμάτων ή επί αυξημένων επιπέδων Tg με ή χωρίς πρόκληση. Επειδή η ευαισθησία του είναι μικρή, βάρος δίνεται επίσης σε άλλες διαγνωστικές μεθόδους. Το υπερηχογράφημα τραχήλου από έμπειρο ακτινολόγο θεωρείται η πιο ευαίσθητη μέθοδος για την ανάδειξη τραχηλικών λεμφαδενικών μεταστάσεων (41). Σε ύποπτους λεμφαδένες στον τράχηλο διενεργείται FNA (εάν είναι εφικτή) με μέτρηση της Tg στο έκπλυμα. Επίσης η CT υψηλής ευκρίνειας στον θώρακα και το MRI αναδεικνύουν το πλείστον των πνευμονικών, λεμφαδενικών και οστικών μεταστάσεων. Επί θετικών ευρημάτων, το Dx-WBS θα διερευνήσει την έκταση της νόσου και κυρίως την πρόσληψη RAI σε γνωστές θέσεις υποτροπής ή μεταστάσεων, προκειμένου να τεθεί η ένδειξη θεραπευτικής χορήγησης RAI ή, σε περιορισμένη τοπικά νόσο, χειρουργικής εξαίρεσης. Τα αποτελέσματα του Dx-WBS φέρουν επίσης προγνωστική αξία (56). Όταν τα ευρήματα των άλλων εξετάσεων είναι αρνητικά το Dx-WBS έχει θέση, αλλά συγκεντρώνει μικρές πιθανότητες να είναι θετικό. Εάν το WBS είναι αρνητικό και η Tg < 10 ng/ml εξετάζεται το ενδεχόμενο τυφλής χορήγησης θεραπευτικής δόσης Ι-131 ή η αναμονή με στενή παρακολούθηση. Εάν η Tg είναι > 10 ng/ml τίθεται η ένδειξη για 18F-FDG PET scan (αν και το όριο των 10 ng/ml αμφισβητείται όπως αναφέρεται σε παρακάτω ενότητα). Εάν το PET είναι θετικό, η χορήγηση θεραπευτικού RAI μάλλον δεν έχει θέση, διότι πιθανότατα πρόκειται για μεταστάσεις σχετικά αποδιαφοροποιημένες, οι οποίες δεν προσλαμβάνουν RAI. Εκτιμάται η δυνατότητα χειρουργικής εξαίρεσης ή, αν αυτό δεν είναι δυνατό, άλλες εναλλακτικές θεραπείες. Εάν όμως το PET είναι αρνητικό, η τυφλή χορήγηση θεραπευτικού RAI είναι μια λογική προσέγγιση. Το μεταθεραπευτικό scan (Rx-WBS) ίσως αποκαλύψει εστίες πρόσληψης του Ι-131 που έχουν και διαφύγει του προηγούμενου ελέγχου και κατευθύνει ανάλογα τον περαιτέρω σχεδιασμό της θεραπείας (32).
3.3.3. Ολόσωμο μεταθεραπευτικό scan (Rx–WBS)
Όπως αναφέρθηκε, το Rx-WBS εκτελείται πάντα μετά από θεραπευτική χορήγηση Ι-131. Με τη δόση εκρίζωσης του μετεγχειρητικού θυρεοειδικού υπολείμματος (post-ablation Rx-WBS), τα ευρήματα εκτός από την διαγνωστική, έχουν σημαντική προγνωστική αξία και συμπεριλαμβάνονται στη συνεχιζόμενη διαστρωμάτωση του κινδύνου του ασθενούς (ongoing or late risk assessment) η οποία ενδεχομένως τροποποιεί την αρχική, μετεγχειρητική, διαστρωμάτωση (ESMO Clinical Practice Guidelines 2012) (54).
To Rx-WBS όταν εκτελείται μακράν του ablation , είτε μετά από αιτιολογημένη (δηλ. μετά από θετικό Dx-WBS) ή τυφλή θεραπευτική χορήγηση Ι-131, παρέχει επίσης πολύτιμες πληροφορίες (είτε είναι θετικό ή αρνητικό) για την περαιτέρω διαχείριση του ασθενούς.
3.4. Ερμηνεία, ερμηνευτικές παγίδες
Παρά το γεγονός ότι το ιόν του ιωδίου είναι το ειδικότερο μεταξύ των ραδιοφαρμάκων που χρησιμοποιούνται στην Πυρηνική Ιατρική για τον ιστικό χαρακτηρισμό της θέσης πρόσληψης (θυρεοειδικός ιστός, ορθότοπος, έκτοπος ή μεταστατικός), τα ψευδώς θετικά ευρήματα δεν ελλείπουν. Τα αίτια πρόκλησης των ψευδώς θετικών ευρημάτων ποικίλουν. Κατηγοριοποιούνται στον πίνακα 3.1. Σε αρκετές όμως περιπτώσεις ο μηχανισμός δεν είναι γνωστός. Η Leitha και συν. δημοσίευσαν το 2003 μια λίστα 74 διαφορετικών αιτίων (57), η οποία εμπλουτίστηκε περαιτέρω από τον Oh και συν. το 2012 (58). Τα artifact ραδιομόλυνσης από ραδιοεπισημασμένες εκκρίσεις του ασθενούς (σίελος, ιδρώτας, ούρα, κόπρανα) είναι συχνά, τις περισσότερες φορές εύκολα αναγνωρίσιμα. Δυο τέτοια παραδείγματα δίνονται στις εικόνες 3.12 και 3.13. Η πρόσληψη στο ρινικό βλεννογόνο είναι φυσιολογική, ενίοτε δε εκσεσημασμένη, όπως στο περιστατικό της Εικόνας 3.14. Επίσης συχνή είναι η παρουσία μικρού εμβρυικού υπολείμματος στην πορεία του θυρεογλωσσικού πόρου, το οποίο υπερπλάσσεται μετά τη θυρεοειδεκτομή και ανιχνεύεται στο WBS. Δεν θα πρέπει να συγχέεται με θυρεοειδικό υπόλειμμα στην κοίτη και με λεμφαδενική τραχηλική μετάσταση (Εικόνα 3.15). Παθήσεις των σιελογόνων αδένων (π.χ. λιθίαση, χρόνια σιελαδενίτιδα, όγκος του Warthin, κλπ) μπορούν να προκαλέσουν ασύμμετρη απεικόνισή τους στο WBS και να δημιουργήσουν την λανθασμένη εντύπωση λεμφαδενικής μετάστασης. Η πρόσληψη του ιωδίου στον μαζικό αδένα (ειδικά σε γαλουχία) είναι επίσης φυσιολογική. Σε μεταθεραπευτικά Ι-131 WBS δεν είναι σπάνια η απεικόνιση του θύμου αδένα, όπως φαίνεται στην Εικόνα 3.16. Το εύρημα οφείλεται στην έκφραση του NIS σε επιθηλιακά κύτταρα των σωματίων Hassall του θύμου (59) και δεν πρέπει να εκλαμβάνεται ως λεμφαδενική μετάσταση στο μεσοθωράκιο. Μεταξύ των υπολοίπων λιγότερο συχνών αιτίων αξίζει να αναφερθούν τα κάτωθι: Σμηγματογόνοι κύστεις τριχωτού κεφαλής, χοριοειδή πλέγματα του εγκεφάλου, μηνιγγίωμα, εγκεφαλική γλοίωση μετά από νευροχειρουργικές επεμβάσεις, τεχνητός οφθαλμός, δακρυοκυστίτιδα, παραρρινοκολπίτιδα, οδοντιατρικά σφραγίσματα, πνευμονικές φλεγμονές ειδικές και μη, καρκίνος πνεύμονα, περικαρδίτιδα, οισοφαγοκήλη, οισοφάγος Barett, Μεκκέλειος απόφυση και άλλες θέσεις έκτοπου γαστρικού βλεννογόνου, κύστεις νεφρών και ήπατος, χολολιθίαση, διάταση χοληφόρων, υδρονέφρωση, κυσταδένωμα ωοθήκης, struma ovarii και άλλα τερατώματα, διάφορα νεοπλάσματα καλοήθη και κακοήθη, ψωριασικές πλάκες. Σε αρκετές από αυτές τις περιπτώσεις το SPECT/CT, βάσει της ορθής εντόπισης και των ευρημάτων της CT (έστω και με περιορισμένη ευκρίνεια) μπορεί να δώσει λύσεις ή να προτείνει εναλλακτικές ερμηνείες των ύποπτων ευρημάτων. Τέτοια περιστατικά παρουσιάζονται στις Eικόνες 3.17-3.19.
Πίνακας 3.1. Ταξινόμηση των αιτίων που μπορεί να προκαλέσουν ερμηνευτικές αστοχίες του ολόσωμου σπινθηρογραφήματος με Ι-131/Ι-123
|

Εικόνα 3.12. Στατικές λήψεις στα πλαίσια I-131 WBS, σε πρόσθια (αριστερά) και οπίσθια (δεξιά) προβολή. Artifact ραδιομόλυνσης στα μαλλιά γυναίκας ασθενούς (βέλη).

Εικόνα 3.13. Στατικές λήψεις στην περιοχή της πυέλου στα πλαίσια I-131 WBS, σε πρόσθια (αριστερά) και οπίσθια (δεξιά) προβολή. Στην οπίσθια λήψη εικονίζονται artifact ραδιομόλυνσης στις τσέπες του παντελονιού της ασθενούς, στις οποίες είχε τοποθετήσει χαρτομάντηλα με ρινικές εκκρίσεις.
Εικόνα 3.14. Α) Στατικές λήψεις στην περιοχή της κεφαλής και του τραχήλου (στα πλαίσια I-131 WBS) σε πρόσθια και οπίσθια προβολή. Παρατηρείται εστία ιδιαίτερα έντονης πρόσληψης του ραδιοϊωδίου που προκαλεί αστεροειδές τέχνημα ( collimator penetration artifact) στην πρόσθια προβολή, σε θέση που δεν είναι εύκολο να προσδιοριστεί. Μετά την τοποθέτηση επίπεδης πηγής Co-57 πίσω από τον ασθενή για τη διαγραφή του περιγράμματος του σώματος, καθίσταται εμφανές ότι το εύρημα εντοπίζεται στο ρινικό βλεννογόνο και είναι φυσιολογικό.

Εικόνα 3.15. Ολόσωμο scan μετά τη χορήγηση 5 mCi I-131 (Dx-WBS) σε ασθενή με θηλώδες Ca θυρεοειδούς, ένα έτος μετά τη θυρεοειδεκτομή και τη θεραπεία εκρίζωσης του μετεγχειρητικού υπολείμματος. Α) Στο Dx-WBS διακρίνεται μικρή εστία πρόσληψης του Ι-131 σε υψηλή θέση στον τράχηλο, επί της μέσης τραχηλικής γραμμής. Β) Στη SPECT/CT μελέτη (παρουσιάζονται εγκάρσιες και οβελιαίες τομές επικεντρωμένες στο εύρημα) εντοπίζεται με ακρίβεια η θέση της εστιακής πρόσληψης, μπροστά από το υοειδές οστό. Πρόκειται για κλασσική εντόπιση εμβρυικού θυρεοειδικού ιστού, ο οποίος υπερπλάσσεται μετά τη θυρεοειδεκτομή και ανιχνεύεται στο WBS. Το εύρημα αυτό είναι πολύ συχνό και δεν θα πρέπει να συγχέεται με υπόλειμμα στη θυρεοειδική κοίτη ή με λεμφαδενική μετάσταση.

Εικόνα 3.16. Γυναίκα 36 ετών με πολυεστιακό θηλώδες Ca θυρεοειδούς χειρουργηθέν προ 2ετίας. Έλαβε 50 mCi I-131 για ablation. Τώρα ελέγχεται 8 ημέρες μετά θεραπευτική δόση 100 mCi, που έλαβε λόγω αυξημένης Tg. A) Στο Rx-WBS εικονίζεται λειτουργικό θυρεοειδικό υπόλειμμα το οποίο έχει διαφύγει της θεραπείας εκρίζωσης. Επί πλέον σημειώνεται ήπια έως μέτρια εστιακή καθήλωση του ραδιοίωδίου στο μεσοθωράκιο. Β) Στη SPECT/CT μελέτη το εύρημα εντοπίζεται στο πρόσθιο άνω μεσοθωράκιο, στην ανατομική θέση του θύμου. Η απεικόνιση του θύμου σε μεταθεραπευτικά σπινθηρογραφήματα δεν είναι σπάνια, ιδιαίτερα σε νέους ασθενείς. Δεν έχει σχέση με την αντιδραστική υπερπλασία του θύμου που παρατηρείται μετά από χημειοθεραπεία. Οφείλεται στην πρόσληψη του ιωδιδίου από επιθηλιοειδή κύτταρα του θύμου, τα οποία εκφράζουν στην επιφάνειά τους τον συμμεταφορέα NIS.

Εικόνα 3.17. Έλεγχος 6 ημέρες μετά τη λήψη 50 mCi για εκρίζωση μετεγχειρητικού θυρεοειδικού υπολείμματος. Α) Στο I-131 Rx-WBS διακρίνεται μικρό θυρεοειδικό υπόλειμμα. Παρατηρείται επίσης εστία πρόσληψης σε περιοχή που αρχικά μπορεί να εκληφθεί ως η δεξιά υπογνάθια χώρα (βέλος). Β) Στη SPECT/CT μελέτη (εγκάρσιες και μετωπιαίες τομές επικεντρωμένες στο ύποπτο εύρημα) φαίνεται ότι η εν λόγω εστία αντιστοιχεί σε οδοντικό σφράγισμα. Τέτοια ευρήματα σε παλαιά σφραγίσματα είναι αρκετά συχνά SPECT/CT μελέτες. Ο μηχανισμός πρόσληψης του I-131 σε αυτές τις θέσεις είναι άγνωστος.
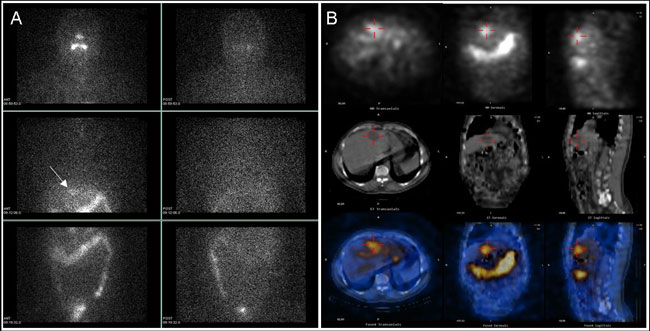
Εικόνα 3.18. Ολόσωμο scan 7 ημέρες μετά τη χορήγηση 100 mCi I-131 (Rx-WBS) σε ασθενή 48 ετών με θυλακιώδες Ca θυρεοειδούς, δύο έτη μετά τη θυρεοειδεκτομή και τη θεραπεία εκρίζωσης του μετεγχειρητικού υπολείμματος. Α) Στο Rx-WBS διακρίνεται εστία πρόσληψης του Ι-131 στο άνω τμήμα του ήπατος. Β) SPECT/CT (παρουσιάζονται τομές σε 3 επίπεδα, επικεντρωμένες στο εύρημα). Φαίνεται ότι η εστία πρόσληψης αντιστοιχεί σε ηπατική κύστη και δεν σχετίζεται με το υποκείμενη νόσο του θυρεοειδούς.
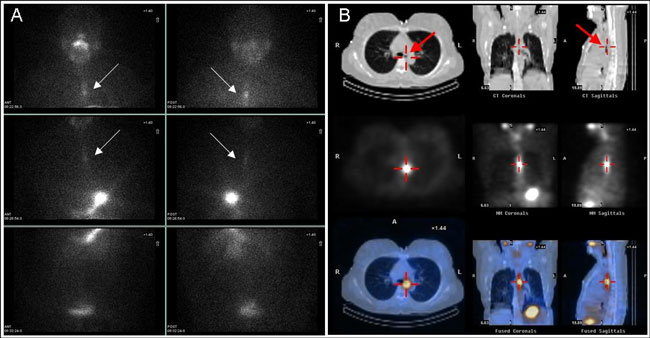
Εικόνα 3.19. Γυναίκα 53 ετών με θηλώδες Ca θυρεοειδούς χειρουργηθέν προ 2ετίας. Έλαβε 50 mCi Ι-131 για ablation και άλλα 100 mCi προ έτους. Τώρα ελέγχεται με διαγνωστικό WBS 48 ώρες μετά τη χορήγηση 5mCi Ι-131. A) Στο Dx-WBS δεν ανιχνεύεται λειτουργικό θυρεοειδικό υπόλειμμα στον τράχηλο. Η έντονη εστία στην αριστερά άνω κοιλιακή χώρα αντιπροσωπεύει φυσιολογική πρόσληψη από το στόμαχο. Σημειώνεται επί πλέον συγκέντρωση του ραδιοϊωδίου στο μεσοθωράκιο (λευκά βέλη), εύρημα το οποίο πιθανά οφείλεται σε παραμονή ραδιοεπισημασμένου σιέλου στον οισοφάγο, ωστόσο δεν μεταβλήθηκε μετά την πόση ύδατος και θεωρήθηκε ύποπτο . Β) Στη SPECT/CT μελέτη που ακολούθησε (εικονίζονται τομές σε τρία επίπεδα επικεντρωμένες στην ύποπτη εστία) επιβεβαιώθηκε η καλοήθης φύση του ευρήματος, καθώς αυτό εντοπίστηκε στον αυλό του οισοφάγου (κόκκινα βέλη).
3.5. Επιγραμματικά – ενότητα 3
- Η χρησιμότητα του 131/123I Dx-WBS (ολόσωμο scan με μικρές/διαγνωστικές δόσεις RAI) πριν από τη θεραπεία εκρίζωσης του μετεγχειρητικού θυρεοειδικού υπολείμματος είναι αμφιλεγόμενη.
- Στην παρακολούθηση του διαφοροποιημένου θυρεοειδικού καρκίνου το Dx-WBS δεν έχει θέση σε ασθενείς χαμηλού κινδύνου. Προτείνεται σε ασθενείς μέτριου και υψηλού κινδύνου, αν και η ευαισθησία του είναι μικρότερη από τις άλλες σύγχρονες απεικονιστικές μεθόδους, κυρίως για να ισχυροποιήσει την ένδειξη θεραπευτικής χορήγησης RAI.
- Το 131I Rx-WBS (μεταθεραπευτικό ολόσωμο scan) έχει σαφώς μεγαλύτερη ευαισθησία από το Dx-WBS και δεν πρέπει να παραλείπεται.
- Η υβριδική σπινθηρογραφική μελέτη SPECT/CT πλεονεκτεί σαφώς της μονοεπίπεδης τεχνικής, και δεν πρέπει να παραλείπεται όταν είναι διαθέσιμη, τουλάχιστον όταν υπάρχουν θετικά ή αμφίβολα ευρήματα στο Dx/Rx WBS.
- Παρά την υψηλή ειδικότητα του WBS, τα ψευδώς θετικά ευρήματα δεν ελλείπουν και θα πρέπει να συνυπολογίζονται στην αξιολόγηση των ευρημάτων. Το SPECT/CT μπορεί επίσης να βοηθήσει σε μερικές περιπτώσεις.
- Tιμές θυρεοσφαιρίνης ≥ 10 ng/ml με αρνητικό Dx-WBS θέτουν την ένδειξη μελέτης με 18F-FDG-PET/CT. Επί αρνητικού PET και εφ’ όσον η χειρουργική εξαίρεση εστιών νόσου που τυχόν έχουν αναδειχθεί από άλλες απεικονιστικές μεθόδους δεν είναι εφικτή, η τυφλή θεραπευτική χορήγηση RAI είναι μια λογική προσέγγιση σε αυτούς τους ασθενείς.
4. Απεικόνιση με τομογραφία ποζιτρονιακής εκπομπής (PET)
4.1. Εισαγωγικά για το PET και το PET/CT
Η τεχνολογία PET (τομογραφία ποζιτρονιακής εκπομπής, positron emission tomography) δεν είναι καινούργια. Χρονολογείται ήδη από τις αρχές της 10ετίας του ’50 και οι πρώτες εφαρμογές της αφορούσαν σε παθήσεις του εγκεφάλου. Ωστόσο για πολλά χρόνια παρέμενε ένα ερευνητικό κυρίως εργαλείο. Τις τελευταίες δύο δεκαετίες υπήρξε μια εκρηκτική είσοδος του PET στην κλινική πράξη, ιδιαίτερα στο πεδίο της ογκολογικής απεικόνισης. Το PET βασίζεται στην ταυτόχρονη (συμπτωτική) ανίχνευση δύο αντιδιαμετρικών ακτίνων γ, οι οποίες προέρχονται από την σύγκρουση (εξαΰλωση) ενός ποζιτρονίου (δηλ. θετικά φορτισμένου ηλεκτρονίου) που εκπέμπεται από ορισμένα ραδιοϊσότοπα και ενός ηλεκτρονίου κάποιου γειτονικού ατόμου. Οι δύο ακτίνες γ μοιράζονται την ενέργεια που προκύπτει από την εξαΰλωση. Η διαδικασία παρουσιάζεται σχηματικά στην Εικόνα 4.1. Στην ανιχνευτική διάταξη, οι ανιχνευτές (κρύσταλλοι σπινθηρισμού) είναι τοποθετημένοι σε διαδοχικούς κυκλικούς δακτυλίους και συνδέονται μεταξύ τους με ηλεκτρονικά κυκλώματα συμπτωτικής ανίχνευσης. Το PET είναι μια αμιγώς τομογραφική τεχνική, κατά την οποία με τη μετακίνηση της εξεταστικής κλίνης επιτυγχάνεται διαδοχική σάρωση του σώματος και παραγωγή μιας τρισδιάστατης ολόσωμης απεικόνισης.
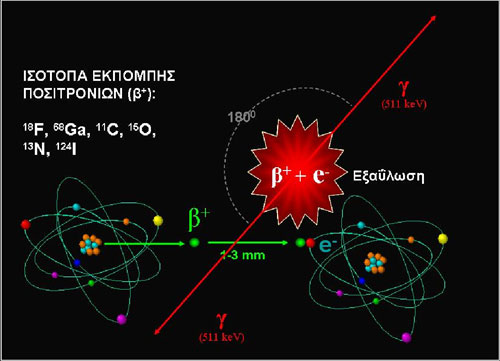
Εικόνα 4.1. Παρουσιάζεται σχηματικά η διαδικασία παραγωγής δύο αντιδιαμετρικών ακτίνων γ, μετά τη σύγκρουση και εξαΰλωση ενός ποζιτρονίου και ενός ηλεκτρονίου. Κάθε ακτίνα γ έχει ενέργεια 511 KeV. Το άθροισμα, 1022 KeV, αντιστοιχεί στο ενεργειακό ισοδύναμο της μάζας του ποζιτρονίου και του ηλεκτρονίου, σύμφωνα με την εξίσωση του Einstein E=mc2. Η αντιδιαμετρική φορά των ακτίνων διατηρεί μηδενική την ορμή του στστήματος, με την προϋπόθεση ότι τα δυο σωματίδια πριν συγκρουστούν είχαν χάσει την κινητική τους ενέργεια και ήταν σχεδόν ακίνητα.
Σχεδόν όλα τα ραδιοϊσότοπα εκπομπής ποζιτρονίων, όπως αυτά απαριθμούνται στην Εικόνα 3.1. είναι βασικά στοιχεία των οργανικών ενώσεων. Είναι δυνατόν λοιπόν να επισημανθεί μια μεγάλη γκάμα βιομορίων με ισότοπα ποζιτρονιακής εκπομπής και να ιχνηθετηθούν έτσι ποικίλες μεταβολικές διεργασίες, φυσιολογικές και παθολογικές. Το γεγονός αυτό αναγορεύει το PET σε κατ’ εξοχήν μέθοδο μοριακής απεικόνισης. Στην πράξη ανακύπτουν σημαντικά προβλήματα από τους βραχείς χρόνους ημισείας ζωής των περισσοτέρων ισοτόπων εκπομπής ποζιτρονίων, όπως φαίνεται στον Πίνακα 4.1. Τα ραδιοϊσότοπα αυτά δεν απαντούν στη φύση. Παράγονται στο κύκλοτρο και επομένως η διανομή τους σε εργαστήρια που βρίσκονται σε απόσταση από τον τόπο παραγωγής προϋποθέτει χρόνους ημισείας ζωής ολίγων τουλάχιστον ωρών, ώστε να είναι εφικτή η χρήση τους στην πράξη. Κατ’ εξαίρεση, για μερικά όπως το Ga-68, διατίθεται γεννήτρια (στήλη) παραγωγής τους, η οποία παραμένει επί μακρόν στο εργαστήριο. Η εστιακή πρόσληψη του ποζιτρονιακού ιχνηθέτη μπορεί να ποσοτικοποιηθεί με τον δείκτη SUV (standardized uptake value), ο οποίος εκφράζει πόσες φορές παραπάνω από μια υποθετική ομοιογενή κατανομή του στο σώμα του ασθενούς (με τιμή SUV=1) είναι η συγκέντρωση στη συγκεκριμένη θέση.
Τα υβριδικά απεικονιστικά συστήματα PET/CT, εμπορικά διαθέσιμα από το έτος 2000 και μετά, προσφάτως δε και το PET/MRI, έδωσαν περαιτέρω ώθηση στις κλινικές εφαρμογές του PET. Όσον αφορά στο PET/CT, τα συστήματα αυτά ενσωματώνουν πολυτομικό αξονικό τομογράφο, 4, 8, 16, 64 ή και 128 τομών , με ξεχωριστό σύστημα στήριξης (gantry). Ένα τέτοιο σύγχρονο PET/CT σύστημα με αξονικό τομογράφο 128 τομών φαίνεται στην Εικόνα 4.2. Η ολόσωμη σάρωση του PET και του CT είναι διαδοχική (όχι ταυτόχρονη). Μετά την ανασύσταση των τομών σε τρία επίπεδα, επισκοπούνται οι εικόνες του PET και του CT ξεχωριστά, επί πλέον δε η εξετάζεται η επιπροβολή τους σε μεικτή εικόνα (fusion). Η υβριδική απεικόνιση προσφέρει τη δυνατότητα ακριβούς εντοπισμού των ευρημάτων του PET, διορθώνει τη φωτονιακή εξασθένηση που υφίσταται η γ-ακτινοβολία κατά τη διέλευσή της από τους ιστούς και αυξάνει τη διαγνωστική ακρίβεια της εξέτασης. Μερικά ψευδώς θετικά ευρήματα του PET μπορεί έτσι να αποφευχθούν, ενώ η CT προσθέτει πολύτιμη ανατομική πληροφορία. Στην Εικόνα 4.3 δίνεται ένα παράδειγμα υβριδικής PET/CT απεικόνισης. Συνήθως δεν χρησιμοποιούνται ακτινολογικά σκιαστικά αντίθεσης, per os ή ενδοφλέβια. Σε επιλεγμένες όμως περιπτώσεις γίνεται μια πλήρης διαγνωστική CT με σκιαστικό, χωρίς να επηρεάζεται η ποιότητα του PET (60).
Πίνακας 4.1. Ισότοπα εκπομπής ποζιτρονίων και οι φυσικοί χρόνοι ημίσειας ζωής τους.
| Ραδιοϊσότοπο | Φυσικός χρόνος ημίσειας ζωής |
| C-11 | 20,5 min |
| N-13 | 10 min |
| O-15 | 2,1 min |
| F-18 | 110 min |
| Rb-82 | 1,3 min |
| Ga-68 | 68,3 min |
| I-124 | 4,2 days |

Εικόνα 4.2. Αριστερά εικονίζεται ένα σύγχρονο PET/CT σύστημα. Πάνω παρουσιάζεται σχηματικά η διάταξη του συστήματος.
Εικόνα 4.3. Παράδειγμα υβριδικής PET/CT απεικονιστικής μελέτης. Παρουσιάζονται επιλεγμένες τομές σε μετωπιαίο και εγκάρσιο επίπεδο, επικεντρωμένες σε εστιακό εύρημα στο αριστερό λαγόνιο. Αριστερά είναι οι εικόνες του PET, στο κέντρο οι αντίστοιχες τομές της CT και δεξιά η μείξη (fusion) των δύο.
4.2. Ραδιοφάρμακα για τον διαφοροποιημένο θυρεοειδικό καρκίνο και το μυελοειδές καρκίνωμα
4.2.1. F-18 Φλουρο-δεοξυ-γλυκόζη (FDG)
Είναι το ραδιοφάρμακο με την ευρύτερες εφαρμογές στην ογκολογία. Η FDG μιμείται τη γλυκόζη και εισέρχεται στα κύτταρα μέσω των μεταφορέων της γλυκόζης (GLUT) και κυρίως μέσω του GLUT-1. Εντός του κυττάρου φωσφορυλιώνεται με τη δράση της εξοκινάσης. Το φωσφορυλιωμένο μόριο FDG-P δεν αποτελεί υπόστρωμα για τη δράση της ισομεράσης της γλυκόζης και έτσι δεν συμμετέχει στο μεταβολικό κύκλο της γλυκόζης. Αποφωσφορυλιώνεται με τη δράση της φωσφατάσης και εξέρχεται από το κύτταρο. Τα καρκινικά κύτταρα παρουσιάζουν πολλαπλάσιους ρυθμούς αερόβιας γλυκόλυσης σε σύγκριση με τα φυσιολογικά και αυτό αποτελεί τη βάση της απεικόνισης με 18F-FDG PET. Εκφράζουν σε αφθονία του μεμβρανικούς υποδοχείς GLUT-1, ενώ επίσης έντονα αυξημένη είναι η δραστηριότητα της εξοκινάσης. Αντίθετα η δραστηριότητα της φωσφατάσης είναι ως επί το πλείστον σημαντικά ελαττωμένη και έτσι η FDG παγιδεύεται εντός του καρκινικού κυττάρου. Ο μηχανισμός μεταβολικής παγίδευσης της FGD στα καρκινικά κύτταρα φαίνεται στην Εικόνα 4.4.
Ο βαθμός πρόσληψης του 18F-FDG από τα καρκινικά κύτταρα σχετίζεται με την πολλαπλασιαστική τους δραστηριότητα και κατά συνέπεια με το κακόηθες δυναμικό τους. Όγκοι με χαμηλή μιτωτική δραστηριότητα, όπως ο καρκίνος του προστάτη, το βρογχοκυψελιδικό καρκίνωμα του πνεύμονα, τα νευροενδοκρινή νεοπλάσματα, μερικά λεμφώματα βραδείας εξέλιξης και ο διαφοροποιημένος θυρεοειδικός καρκίνος έχουν ασθενή πρόσληψη του 18F-FDG, όσο παραμένουν καλά διαφοροποιημένοι. Στο θυρεοειδικό καρκίνο η πρόσληψη της FDG σχετίζεται με την έκφραση των GLUT-1, τη δραστηριότητα της εξοκινάσης και τη έκφραση του επαγόμενου από την υποξία παράγοντα (hypoxia-inducible factor) 1α (HIF-1α). Ο τελευταίος ενεργοποιεί τα γονίδια που κωδικοποιούν τη σύνθεση των GLUT και εκφράζεται αντιστρόφως ανάλογα με το με το βαθμό διαφοροποίησης του καρκινικού κυττάρου. Κατ’ αναλογία, η FDG προσλαμβάνεται εντονότερα από τα πιο αδιαφοροποίητα καρκινώματα. Η έκφραση των GLUT-1 άρα και η πρόσληψη της FDG επάγεται από την TSH, όπως έχει δειχθεί σε πειραματικές μελέτες αλλά και σε κλινικές δοκιμές (61).

Εικόνα 4.4. Σχηματική παρουσίαση του μηχανισμού μεταβολικής παγίδευσης της FDG στα καρκινικά κύτταρα. Η FDG εισέρχεται στο κύτταρο μέσω του μεταφορέα της γλυκόζης GLUT-1 και στη συνέχεια φωσφορυλιώνεται. Η φωσφορυλιωμένη FDG (FDG-P), σε αντίθεση με τη γλυκόζη ( G-P), δεν ακολουθεί τη μεταβολική οδό της αερόβιας γλυκόλυσης. Στα περισσότερα καρκινικά κύτταρα η έκφραση της 6-φωσφατάσης της γλυκόζης είναι ελαττωμένη και έτσι η FDG-P παγιδεύεται και συσσωρεύεται προοδευτικά στο εσωτερικό του κυττάρου.
Η FDG διέρχεται τον αιματοεγκεφαλικό φραγμό και προσλαμβάνεται φυσιολογικά και έντονα από τον εγκέφαλο, σε ποικίλο βαθμό από το μυοκάρδιο (πολύ λιγότερο σε κατάσταση νηστείας, κατά την οποία το μυοκάρδιο καταναλώνει λιπαρά οξέα), τον μαζικό αδένα, το ήπαρ, τους γραμμωτούς μύες (ανάλογα με τη φυσική τους δραστηριότητα) και τους γεννητικούς αδένες. Αποβάλλεται από τους νεφρούς και το έντερο.
Γενικά, τιμές του δείκτη πρόσληψης SUV πάνω από 2-2.5 σε μία εστία, εκτός των θέσεων φυσιολογικής συγκέντρωσης της 18F-FDG, θεωρούνται ενδεικτικές κακοήθειας, αλλά σε καμία περίπτωση παθογνωμονικές. Κύτταρα που συρρέουν σε φλεγμονές, όπως τα μακροφάγα, παρουσιάζουν υψηλούς ρυθμούς γλυκόλυσης και προσλαμβάνουν την 18F-FDG. Εκτός των φλεγμονών, ποικίλα άλλα αίτια, όπως παραλλαγές της φυσιολογικής βιοκατανομής του ραδιοφαρμάκου, υπερμεταβολικές καταστάσεις (π.χ. νόσος Paget, ινώδης δυσπλασία, αντιδραστική υπερπλασία του θύμου, φαιό λίπος κ.ά.) μερικά καλοήθη νεοπλάσματα, artifacts κλπ, μπορεί να οδηγήσουν σε ψευδώς θετικά ευρήματα. Η υπεργλκυκαιμία αντίθετα οδηγεί σε ψευδώς αρνητικά αποτελέσματα, γι αυτό και ο ασθενής εξετάζεται νηστικός και τα επίπεδα γλυκόζης προσδιορίζονται πάντα πριν την εξέταση FDG-PET. Όταν οι τιμές γλυκόζης είναι πάνω από 120-150 mg/dL τότε η εξέταση επαναπρογραμματίζεται. Δεν πρέπει επίσης να έχει προηγηθεί ένεση ινσουλίνης το 4ωρο πριν την εξέταση.
Το 18F-FDG χορηγείται ενδοφλέβια σε δόση 5-10 mCi (185-370 MBq) η οποία κυμαίνεται ανάλογα με το διαθέσιμο PET σύστημα (τα νεότερα απαιτούν μικρότερες δόσεις) και το βάρος του ασθενούς. H απεικόνιση λαμβάνει χώρα 60 περίπου λεπτά αργότερα. Η ενεργός δόση (effective dose) στον ασθενή είναι 3-4 mSv (μετά από χορηγηθείσα δόση 5 mCi) (62).
4.2.2. I-124
Πρόκειται για ισότοπο του ιωδίου, το οποίο εκπέμπει, μεταξύ άλλων τύπων ακτινοβολίας, ποζιτρόνια υψηλής ενέργειας. Ο φυσικός χρόνος ημισείας ζωής του ισοτόπου είναι 4.2 ημέρες, αρκετά μεγάλος σε σύγκριση με τα άλλα ισότοπα εκπομπής ποζιτρονίων. Χορηγείται σε δόση 18-74 MBq (0.5-2 mCi) και η απεικόνιση λαμβάνει χώρα 24-48 ώρες αργότερα. Το PET και το PET/CT με Ι-124 προσφέρουν σαφώς καλύτερη ποιότητα απεικόνισης και υψηλότερη ευαισθησία σε σχέση με το Ι-131/Ι-123 WBS, αλλά και με το SPECT/CT (63).
4.2.3. Ανάλογα της σωματοστατίνης επισημασμένα με γάλλιο-68 (68Ga)
Πρόσφατα, ως γέφυρα για τη σύνδεση ραδιοϊσοτόπων με τα ανάλογα σωματοστατίνης χρησιμοποιείται η χηλική ένωση DOTA (tetraazacyclo-Dοdecane-Tetraacetic Acid), η οποία μπορεί να επισημανθεί με διάφορα ραδιονουκλίδια (111In, 68Ga, 64Cu, 90Y, 177Lu κλπ) για διαγνωστικές και θεραπευτικές χρήσεις. Τα πεπτίδια DOTA-TOC, DOTA-NOC και DOTA-TATE (συνοπτικά DOTA-x) είναι τα πιο γνωστά. Για την απεικόνιση PET επισημαίνονται με 68Ga. Οι ενώσεις 68Ga- DOTA-x συνδέονται με τον υπότυπο 2 του υποδοχέα της σωματοστατίνης (SSTR-2) πολύ ισχυρότερα από ότι το 111In-octreotide (OctreoscanTM). Το DOTA-NOC συνδέεται επίσης με τους SSTR-3 και SSTR-5.
Το 68Ga έχει φυσικό χρόνο ημισείας ζωής 68,3 min. Εκλούεται από γεννήτρια (στήλη) την οποία προμηθεύεται το εργαστήριο άπαξ ετησίως, δεδομένου ότι έχει φυσικό χρόνο ημισείας ζωής 271 ημέρες. Η επισήμανση των παραπάνω ενώσεων με το 68Ga γίνεται εύκολα, γρήγορα και με υψηλή απόδοση της σύνδεσης στο εργαστήριο. Χορηγούνται ενδοφλεβίως σε δόση 100-200 MBq. Η σύνδεση αυτών των πεπτιδίων με τους υποδοχείς σωματοστατίνης είναι ταχεία (το 80% εντός 30 min από τη χορήγηση). Η απεικόνιση με PET/CT scanner λαμβάνει χώρα 60-90 λεπτά αργότερα. Η απορροφούμενη δόση ακτινοβολίας από τον ασθενή (ενεργός δόση) είναι 3,4-6,8 mSv (64).
Τα DOTA-x πεπτίδια χρησιμοποιούνται για τη διερεύνηση των νευροενδοκρινικών νεοπλασμάτων, περιλαμβανομένου και του μυελοειδούς καρκίνου του θυρεοειδούς. Εκεί όπου το PET και η γεννήτρια Ga-68 είναι διαθέσιμα, έχουν αντικαταστήσει το κλασσικό Octreoscan.
4.2.4. F-18 Φλουρο-διυδροξυ-φαινυλαλανίνη (FDOPA)
Η 18F-FDOPA ιχνηθετεί τη διαδικασία αποκαρβοξυλίωσης της L-DOPA, μέσω της αποκαρβοξυλάσης των αρωματικών αμινών, για το σχηματισμό της ντοπαμίνης στους ντοπαμινεργικούς και αδρενεργικούς νευρώνες του εγκεφάλου και των επινεφριδίων. Η 18F-FDOPA έχει χρησιμοποιηθεί για τη μελέτη της νόσου του Parkinson και άλλων εξωπυραμιδικών κινητικών συνδρόμων, καθώς και για τη διερεύνηση των νευροενδοκρινικών όγκων, περιλαμβανομένου του μυελοειδούς καρκίνου του θυρεοειδούς (65). Στο μυελοειδές θυρεοειδικό καρκίνωμα αποτελεί τον πλέον υποσχόμενο PET ραδιοϊχνηθέτη, όπως θα αναφερθεί στη συνέχεια. Για τις μελέτες στον εγκέφαλο προτείνεται προετοιμασία του ασθενούς με λήψη καρβιντόπα per os (αναστολέας της αποκαρβοξυλάσης στην περιφέρεια) πριν χορήγηση της FDOPA, ωστόσο δια την απεικόνιση των νευροενδοκρινικών όγκων δεν υπάρχει συμφωνία για τη χρησιμότητα αυτής της προεργασίας (66). Η 18F-FDOPA χορηγείται σε δόσεις 150-370 MBq (4-10 mCi) και η ακτινική επιβάρυνση του ασθενούς (ενεργός δόση) είναι 3,7-10 mSv.

Εικόνα 4.5. Η σύνθεση της ντοπαμίνης και των κατεχολαμινών στους ντοπαμινικούς και αδρενεργικούς νευρώνες. Η 18F-FDOPA ιχνηθετεί αυτή τη μεταβολική διαδικασία. Η συγκέντρωσή της στα κύτταρα των νευροενδοκρινικών όγκων αντανακλά κυρίως τη δραστηριότητα της β-αποκαρβοξυλάσης των αρωματικών αμινών.PNMT: Phenylethanolamine N-methyltransferase
4.3. Ενδείξεις
4.3.1. Διαφοροποιημένος θυρεοειδικός καρκίνος, αδιαφοροποίητο και αναπλαστικό καρκίνωμα
4.3.1.1. Ο ρόλος του 18F–FDG PET
Το FDG-PET και PET/CT δεν ενδείκνυται για τον την προεγχειρητική διερεύνηση/σταδιοποίηση του θυρεοειδικού καρκίνου. Επίσης δεν προσφέρεται για τον περαιτέρω χαρακτηρισμό των μη λειτουργικών θυρεοειδικών όζων, κυρίως λόγω πτωχής ειδικότητας. Υπάρχουν περιπτώσεις που το FDG-PET, το οποίο διενεργήθηκε για άλλους λόγους, αναδεικνύει εστιακά αυξημένη πρόσληψη σε θυρεοειδικό όζο (PET thyroid incidentalomas). Η πιθανότητα κακοήθειας μετά από αυτό το τυχαίο εύρημα είναι 27-50% (67-69) και τα πιο συχνά καρνινώματα είναι θηλώδη. Αν και όχι ιδιαίτερα υψηλή, αυτή η πιθανότητα θεωρείται αρκετή ώστε να δικαιολογήσει περαιτέρω διερεύνηση, η οποία περιλαμβάνει υπερηχογράφημα και στη συνέχεια ενδεχομένως FNA, όπως αναφέρεται στις κατευθυντήριες οδηγίες (18). Υπάρχουν ενδείξεις ότι τα καρκινώματα που ανιχνεύονται τυχαία σε μελέτες FDG-PET είναι πιο επιθετικά και σχετίζονται με δυσμενέστερους ιστολογικούς τύπους, σε σύγκριση με τα υπόλοιπα (70). Διάχυτα αυξημένη πρόσληψη της FDG στο θυρεοειδή συνηθέστατα σχετίζεται με θυρεοειδίτιδα Hashimoto και λιγότερο συχνά με νόσο Graves (61, 70)
Η κύρια και επίσημη ένδειξη του FDG-PET στο διαφοροποιημένο θυρεοειδικό καρκίνο είναι μετά τη θυρεοειδεκτομή και τη θεραπεία εκρίζωσης του μετεγχειρητικού υπολείμματος, για τη διερεύνηση υψηλών τιμών Tg που υποδηλώνουν εμμένουσα, υποτροπιάζουσα ή μεταστατική νόσο με αρνητικό Ι-131 WBS (18, 41, 54). Η ευαισθησία του FDG-PET σε αυτή την περίπτωση κυμαίνεται μεταξύ 70-95%, με μέση τιμή 88% (71). Με τη χρήση του υβριδικού PET/CT η ευαισθησία είναι υψηλότερη (71). Στην Εικόνα 4.6 παρουσιάζεται ένα περιστατικό με υψηλή Tg, αρνητικό Ι-131 Dx-WBS και θετικό PET/CT. Τα αποτελέσματα του FDG-PET μπορεί να αλλάξουν τη θεραπευτική στρατηγική σε 20-40% των ασθενών (61). Πέραν της διαγνωστικής, τα ευρήματα του FDG-PET φέρουν σημαντική προγνωστική αξία και ανεξάρτητη από άλλους προγνωστικούς παράγοντες, με την έννοια ότι ασθενείς με θετικό FDG-PET έχουν γενικά χειρότερη πρόγνωση. Όσο εντονότερη είναι η πρόσληψη της FDG, όπως αυτή εκφράζεται με την τιμή SUV, και όσο περισσότερες οι εστίες πρόσληψης, τόσο δυσμενέστερη είναι η πρόγνωση (72). Πολλοί προτιμούν τη διενέργεια του FDG-PET μετά δοκιμασία διέγερσης με rhTSH ή διακοπή της LT4, χωρίς ωστόσο αυτό να είναι καθολική και πάγια τακτική.
Καρκινικές εστίες οι οποίες παρουσιάζουν πρόσληψη ιωδίου συνηθέστατα δεν προσλαμβάνουν την FDG και αντίστροφα. Το φαινόμενο αυτό έχει περιγραφεί από παλιά, είναι γνωστό ως “flip-flop phenomenon” (73) και αντικατοπτρίζει τις διαφορές του μεταβολικού φαινότυπου (έκφραση του NIS vs. ενεργοποίηση της γλυκολυτικής μεταβολικής οδού) σε διάφορους βαθμούς διαφοροποίησης των καρκινικών θυρεοειδικών κυττάρων. Ωστόσο υπάρχουν περιπτώσεις όπου στον ίδιο ασθενή άλλες καρκινικές βλάβες προσλαμβάνουν Ι-131 και άλλες FDG, ενώ μερικές μπορεί να συγκεντρώνουν και τα δύο ραδιοφάρμακα (74). Επομένως, σε διάσταση με τις κατευθυντήριες οδηγίες, το θετικό I-131 WBS δεν αποκλείει την ένδειξη για FDG-PET, σε συγκεκριμένους βέβαια ασθενείς με κλινική υποψία νόσου περισσότερο εκτεταμένης από αυτή που αναδεικνύεται στο I-131 WBS. Το όριο της αυξημένης Tg πάνω από το οποίο τίθεται η ένδειξη για FDG-PET στις Αμερικανικές κατευθυντήριες οδηγίες (revised ATA guidelines 2009) καθορίζεται στα 10 ng/ml, μετά από ενδογενή ή εξωγενή πρόκληση (18). Η συχνότητα θετικού PET scan πράγματι αυξάνει όσο υψηλότερα είναι τα επίπεδα της Tg. Όμως, έχουν αναφερθεί θετικά ευρήματα σε ποσοστό μέχρι και 20% των ασθενών με Tg <10 ng/ml (75), που υπογραμμίζουν το γεγονός ότι πραγματικό κατώφλι τιμών Tg που θέτει την ένδειξη για PET δεν υφίσταται και κάθε περίπτωση πρέπει να εξατομικεύεται. Οι Ευρωπαϊκές κατευθυντήριες οδηγίες (European consensus 2006, ESMO guidelines 2012) δεν προσδιορίζουν τέτοιο κατώφλι (41, 54).
Το FDG-PET, όπως αναφέρθηκε, δεν συνιστάται στην προεγχειρητική και την άμεση μετεγχειρητική διερεύνηση του διαφοροποιημένου θυρεοειδικού καρκίνου. Όμως, σε πτωχά διαφοροποιημένα καρκινώματα και σε καρκινώματα από κύτταρα Hürthle, τα οποία γενικά δεν προσλαμβάνουν το Ι-131, καθώς και στο αναπλαστικό καρκίνωμα, το FDG-PET έχει πολύ πιθανά θέση, συνεπικουρώντας τις άλλες απεικονιστικές μεθόδους (US, CT, MRI) για την αρχική σταδιοποίηση της νόσου (18). Τέλος, το FDG-PET μπορεί να χρησιμεύσει για το έλεγχο της ανταπόκρισης σε άλλες, πλην της χορήγησης RAI, θεραπείες (χειρουργική, εμβολισμός με ραδιοσυχνότητα, εξωτερική ακτινοθεραπεία, μοριακά στοχευμένες θεραπείες) (18).
Εικόνα 4.6. Γυναίκα 80 ετών με υποτροπή θυλακιώδους καρκίνου θυρεοειδούς (πρόσφατη αύξηση της Tg), 4 έτη μετά τη θυρεοειδεκτομή. Το 131Ι Dx-WBS (A) ήταν αρνητικό. Το 18F-FDG PET/CT που ακολούθησε (Β) ανέδειξε εστία πρόσληψης του ραδιοφαρμάκου στο πρόσθιο άνω μεσοθωράκιο αριστερά (βέλος). Εικονίζεται η ολόσωμη τρισδιάστατη παρουσίαση (maximum intensity projection, MIP) και εγκάρσια τομή (PET, CT και μείξη των δύο) στο επίπεδο του ευρήματος. Το εύρημα επιβεβαιώθηκε ιστολογικά ότι αφορούσε σε λεμφαδενική μετάσταση του θυρεοειδικού καρκίνου. Οι εικόνες αυτές προέρχονται από το τμήμα Πυρηνικής Ιατρικής του Πανεπιστημιακού Νοσοκομείου της Χαϊδελβέργης (UniversitätsKlinikum Heidelberg, Kopfklinik) και δημοσιεύονται κατόπιν αδείας του Καθηγητού Uwe Haberkorn, τον οποίον ευχαριστούμε για την ευγενική του προσφορά.
4.3.1.2. Ο ρόλος του I24I PET
Το PET με Ι-124 υπερτερεί διαγνωστικά του Ι-131/Ι-123 Dx-WBS , αναδεικνύοντας 12-50% περισσότερες εστίες πρόσληψης από το τελευταίο (63). Η αυξημένη ευαισθησία αποδίδεται στην πολύ υψηλότερη ποιότητα της τομογραφικής PET και ιδιαίτερα της συνδυασμένης PET/CT απεικόνισης απέναντι στο μονοεπίπεδο ολόσωμο scan.
Εκτός της διαγνωστικής αξίας, σημαντική επιπρόσθετη ένδειξη του 124Ι- PET/CT θεωρείται η δυνατότητα ακριβούς δοσιμετρικής μελέτης, προκειμένου να υπολογιστεί και εξορθολογιστεί η θεραπευτική δόση Ι-131 που θα ακολουθήσει (63). Δυστυχώς το Ι-124 είναι προς το παρόν διαθέσιμο σε λίγα κέντρα του εξωτερικού.
4.3.2. Μυελοειδές καρκίνωμα θυρεοειδούς
Μια ευρεία γκάμα ραδιοφαρμάκων έχει στο παρελθόν χρησιμοποιηθεί για τη διερεύνηση του μυελοειδούς καρκίνου του θυρεοειδούς (MTC). Μεταξύ αυτών το διμερκαπτοσουκινικό οξύ επισημαμένο με πεντασθενές Tc-99m (99mTc-V-DMSA) και το ανάλογο της σωματοστατίνης οκτρεοτίδιο, επισημαμένο με In-111 (111In-Octreotide, OctreoscanTM) υπήρξαν τα πιο δημοφιλή. Ωστόσο η ευαισθησία τους ήταν μέτρια, σε γενικές γραμμές κατώτερη από αυτή των σύγχρονων απεικονιστικών τεχνικών. Η μετα-ιωδο-βενζυλγουανιδίνη (MIBG) επισημασμένη με I-131 ή Ι-123 έχει επίσης χαμηλή ευαισθησία, μπορεί όμως να προσφέρει ενδεχομένως μια προοπτική θεραπείας με I-131 MIBG, σε μια υποομάδα ασθενών με θετικό MIBG scan.
4.3.2.1. 18F–FDG PET στο μυελοειδές καρκίνωμα θυρεοειδούς
Το 18F-FDG PET και PET/CT έχει χρησιμοποιηθεί τα τελευταία χρόνια για τη διερεύνηση του MTC. Δεν έχει θέση στην προεγχειρητική διερεύνηση. Μερικούς μήνες μετά το χειρουργείο, υψηλά επίπεδα καλσιτονίνης (Ct) ή/και του καρκινοεμβρυικού αντιγόνου (CEA) υποδηλώνουν υπολειμματική νόσο ή υποτροπή. Τιμές Ct<150 pg/ml συνήθως υποδηλώνουν τοπική νόσο η οποία έχει πιθανότητες εκρίζωσης με χειρουργικό καθαρισμό, ενώ υψηλότερες τιμές συνηθέστερα σχετίζονται με απομακρυσμένες μεταστάσεις και μειωμένες πιθανότητες ριζικής αντιμετώπισης. Όλες οι απεικονιστικές μέθοδοι, περιλαμβανομένου και του FDG-PET, έχουν μικρή ευαισθησία σε τόσο περιορισμένη μετεγχειρητική νόσο. Οι κατευθυντήριες οδηγίες προτείνουν τη διενέργεια μόνο US τραχήλου επί Ct < 150 pg/ml, ενώ περαιτέρω απεικονιστική διερεύνηση συνιστάται σε υψηλότρες τιμές Ct (ATA guidelines 2009) (76). Η ευαισθησία του FDG PET κυμαίνεται ευρέως στη βιβλιογραφία από 17% μέχρι 96% (77,78) αντανακλώντας κυρίως την ετερογένεια των πληθυσμών που έχουν μελετηθεί. Σε δύο πρόσφατες μετα-αναλύσεις, η μέση ευαισθησία ήταν 59% και 68% αντίστοιχα (78,79), υψηλότερη από τις προηγούμενες ραδιοϊσοτοπικές τεχνικές που αναφέρθηκαν και συχνά και από τις άλλες ακτινολογικές μεθόδους (80). Είναι σαφές ότι η ευαισθησία του FDG PET και PET/CT σχετίζεται με τα επίπεδα της Ct και του CEA, καθώς και με τους χρόνους διπλασιασμού τους, δηλαδή με το φορτίο νόσου και την επιθετικότητα του MTC. Έτσι, σε ασθενείς με καλσιτονίνη > 1000 pg/ml και CEA > 5 ng/ml η μέση ευαισθησία είναι 75% και 69% αντίστοιχα, ενώ σε ασθενείς με χρόνο διπλασιασμού του CEA < 24 μήνες 91% (79). Παρά τις όχι υψηλές επιδόσεις του, το FDG-PET έχει θέση στην μετεγχειρητική διερεύνηση του MTC ως συμπληρωματικό των ακτινολογικών μεθόδων, διότι σε μερικούς ασθενείς μπορεί να αλλάξει το θεραπευτικό πλάνο και με αυτή τη λογική προτείνεται από τις κατευθυντήριες οδηγίες (guidelines ATA 2009, ESMO 2012) (54,76)
4.3.2.2. 68Ga–DOTA–x πεπτίδια στο μυελοειδές καρκίνωμα θυρεοειδούς
Στη βιβλιογραφία, ο αριθμός των ασθενών με MTC που έχουν μελετηθεί με 68Ga-DOTA-x PET είναι μικρός προς το παρόν. Φαίνεται ότι οι διαγνωστικές επιδόσεις αυτών των ενώσεων είναι παρόμοιες με το 18F-FDG-PET (80). Στη μεγαλύτερη σειρά 41 ασθενών με υποτροπιάζον MTC στην οποία επιχειρήθηκε ευθεία σύγκριση των ραδιοφαρμάκων, το 68Ga-DOTA-NOC έδειξε υψηλότερη ευαισθησία (76%) από 18F-FDG-PET (63%), αν και διαφορά δεν ήταν στατιστικά σημαντική (81). Η θετική απεικόνιση των μεταστάσεων του MTC με ανάλογα της σωματοστατίνης προσφέρει μια επί πλέον προοπτική, καθώς μπορεί να εξεταστεί η δυνατότητα θεραπευτικής χορήγησης των ίδιων ενώσεων επισημασμένων με ραδιοϊσότοπα που εκπέμπουν β-ακτινοβολία, όπως 90Y-DOTA-TOC ή 177Lu-DOTA-TATE.
4.3.2.3. 18F–FDOPA PET στο μυελοειδές καρκίνωμα θυρεοειδούς
Η 18F-FDOPA έχει χρησιμοποιηθεί τελευταία, σε λιγότερες μελέτες από την 18F-FDG, για τη διερεύνηση του MTC, με ενθαρρυντικά αποτελέσματα.
Σε πρόσφατη μετα-ανάλυση που περιέλαβε 8 μελέτες επί 146 συνολικά ασθενών, η μέση ευαισθησία του 18F-FDOPA PET (ή PET/CT) ήταν 66%. Σε ασθενείς με Ct>1000 p/ml ή με χρόνο διπλασιασμού της Ct < 24 μήνες η ευαισθησία ήταν 86% και στις δύο περιπτώσεις (82). Θα πρέπει να σημειωθεί ότι στους περισσότερους ασθενείς το 18F-FDOPA PET διενεργήθηκε μετά από αρνητικό λοιπό απεικονιστικό έλεγχο. Επίσης, στην πλειοψηφία των μελετών που το 18F-FDOPA PET συγκρίθηκε με τη συμβατική απεικόνιση (US, CT, MRI), η ευαισθησία και η ειδικότητά του ήταν υψηλότερες (80). Σε σύγκριση με την 18F-FDG, η ευαισθησία της 18F-FDOPA είναι επίσης υψηλότερη (μέση τιμή 70% έναντι 44%, σε μελέτες απ’ ευθείας σύγκρισης των δύο ραδιοφαρμάκων) (66). Ωστόσο, ενίοτε αναδεικνύονται βλάβες που προσλαμβάνουν 18F-FDG, ενώ είναι αρνητικές στην 18F-FDOPA. Τα δύο ραδιοφάρμακα ιχνηθετούν διαφορετικές μεταβολικές διεργασίες των καρκινικών κυττάρων (δραστηριότητα της αποκαρβοξυλάσης των αμινών η FDOPA, γλυκολυτική δραστηριότητα η FDG), οι οποίες αντανακλούν άλλοτε άλλο βαθμό διαφοροποίησης του MTC και θα πρέπει να θεωρούνται συμπληρωματικά και όχι ανταγωνιστικά (83). Γενικά φαίνεται ότι η FDG ανιχνεύει καλύτερα τα πιο επιθετικά νεοπλάσματα, ενώ η FDOPA (και τα ανάλογα της σωματοστατίνης που αναφέρθηκαν προηγούμενα) τα περισσότερο διαφοροποιημένα.
Πλην της αυξημένης ευαισθησίας, η χαμηλή συχνότητα ψευδώς θετικών ευρημάτων αποτελεί συγκριτικό πλεονέκτημα του FDOPA PET/CT έναντι των υπολοίπων απεικονιστικών μεθόδων (80). Η περιορισμένη διαθεσιμότητα και το υψηλότερο κόστος του (υψηλότερο από το FDG) είναι μειονεκτήματα. Στην Εικόνα 4.7 παρουσιάζεται ένα περιστατικό MCT με θετικό 18F-FDOPA PET/CT στον τράχηλο και το μεσοθωράκιο.
Εικόνα 4.7. 18F-FDOPA PET/CT σε ασθενής με υποτροπή μυελοειδούς καρκίνου θυρεοειδούς, μετά θυρεοειδεκτομή. Αριστερά εικονίζεται η ολόσωμη τρισδιάστατη παρουσίαση (maximum intensity projection, MIP) και δεξιά δύο επιλεγμένες εγκάρσιες τομές (PET, CT και μείξη των δύο) στον τράχηλο και το θώρακα. Οι εικόνες αυτές προέρχονται από το τμήμα Πυρηνικής Ιατρικής του Πανεπιστημιακού Νοσοκομείου της Χαϊδελβέργης (UniversitätsKlinikum Heidelberg, Kopfklinik) και δημοσιεύονται κατόπιν αδείας του Καθηγητού Uwe Haberkorn, τον οποίον ευχαριστούμε για την ευγενική του προσφορά.
4.4. Επιγραμματικά – ενότητα 4
- Το 18F-FDG PET/CT έχει θέση στην μετεγχειρητική διερεύνηση του διαφοροποιημένου θυρεοειδικού καρκίνου. Η γενική ένδειξη είναι όταν η θυρεοσφαιρίνη είναι ≥ 10 ng/ml και το Dx-WBS αρνητικό, ωστόσο καλό είναι να εξατομικεύεται.
- Θετικό FDG PET συνηθέστατα σχετίζεται με πτωχότερα διαφοροποιημένο καρκίνωμα, το οποίο δεν προσλαμβάνει RAI. Επομένως, η τυφλή θεραπευτική χορήγηση RAI σε αυτές τις περιπτώσεις έχει ελάχιστες πιθανότητες επιτυχίας.
- Το FDG PET/CT, εκτός από τη μετεγχειρητική παρακολούθηση, έχει πολύ πιθανά θέση στην προεγχειτητική σταδιοποίηση του Hürthle cell και γενικά του πτωχότερα διαφοροποιημένου και του αναπλαστικού θυρεοειδικού καρκίνου.
- Στο μυελοειδές καρκίνωμα, η ευαισθησία του FDG PET εξαρτάται από τα επίπεδα καλσιτονίνης, CEA και τους ρυθμούς διπλασιασμού τους και σε γενικές γραμμές δεν είναι ιδιαίτερα υψηλή. Ωστόσο, μπορεί να αλλάξει το θεραπευτικό πλάνο σε ένα ποσοστό ασθενών, γι αυτό και έχει θέση, ως συμπληρωματικό του λοιπού απεικονιστικού ελέγχου.
- Το PET/CT 18F-FDOPA, αν και λιγότερο διαθέσιμο από το 18F-FDG PET/CT , είναι πιθανότερα η πιο ευαίσθητη και πιο ειδική προς το παρόν μέθοδος για τη μετεγχειρητική διερεύνηση του μυελοειδούς καρκίνου.
Βιβλιογραφία
1. Crawford ES, Guarasci DT, Larson SA. A survey of thyroid gland scintigraphy. J Nucl Med Technol. 2009;37:173-8.
2. Chung JK. Sodium iodide symporter: its role in nuclear medicine. J Nucl Med. 2002;43:1188-200.
3. Meller J, Becker W. The continuing importance of thyroid scintigraphy in the era of high-resolution ultrasound. Eur J Nucl Med Mol Imaging. 2002;29 Suppl 2:S425-38.
4. Balon HR, Silberstein EB, Meier DA, Charkes ND, Sarkar SD, Royal HD, Donohoe KJ. Society of Nuclear Medicine Procedure Guideline for Thyroid Scintigraphy. V3.0. Approved September 10, 2006. Available at: http://interactive.snm.org/docs/Thyroid_Scintigraphy_V3.pdf
5. Dizdarevic S, Peters AM. Imaging of multidrug resistance in cancer. Cancer Imaging. 2011;11:1-8.
6. Bürgi H. Iodine excess. Best Pract Res Clin Endocrinol Metab. 2010 Feb;24(1):107-15.
7. Sarkar SD. Benign thyroid disease: what is the role of nuclear medicine? Semin Nucl Med. 2006;36:185-93.
8. Intenzo CM, dePapp AE, Jabbour S, Miller JL, Kim SM, Capuzzi DM. Scintigraphic Manifestations of Thyrotoxicosis. Radiographics. 2003;23:857-69.
9. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, Laurberg P, McDougall IR, Montori VM, Rivkees SA, Ross DS, Sosa JA, Stan MN; American Thyroid Association; American Association of Clinical Endocrinologists. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract. 2011;17:456-520.
10. Pearce EN, Farwell AP, Braverman LE. Thyroiditis. N Engl J Med. 2003 Jun 26;348:2646-55.
11. Loy M, Perra E, Melis A, Cianchetti ME, Piga M, Serra A, Pinna G, Mariotti S. Color-flow Doppler sonography in the differential diagnosis and management of amiodarone-induced thyrotoxicosis. Acta Radiol. 2007;48:628-34.
12. Piga M, Cocco MC, Serra A, Boi F, Loy M, Mariotti S. The usefulness of 99mTc-sestaMIBI thyroid scan in the differential diagnosis and management of amiodarone-induced thyrotoxicosis. Eur J Endocrinol. 2008 Oct;159(4):423-9.
13. Biersack HJ, Biermann K. The Marine-Lenhart syndrome revisited. Wien Klin Wochenschr. 2011 Aug;123(15-16):459-62.
14. Charkes ND. Graves’ disease with functioning nodules (Marine-Lenhart syndrome). J Nucl Med. 1972 Dec;13(12):885-92.
15. Gharib H, Papini E, Paschke R, Duick DS, Valcavi R, Hegedüs L, Vitti P; AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. J Endocrinol Invest. 2010;33(5 Suppl):1-50.
16. Reschini E, Ferrari C, Castellani M, Matheoud R, Paracchi A, Marotta G, Gerundini P. The trapping-only nodules of the thyroid gland: prevalence study. Thyroid. 2006 Aug;16(8):757-62.
17. Kusić Z, Becker DV, Saenger EL, Paras P, Gartside P, Wessler T, Spaventi S. Comparison of technetium-99m and iodine-123 imaging of thyroid nodules: correlation with pathologic findings. J Nucl Med. 1990 Apr;31(4):393-9.
18. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, Mazzaferri EL, McIver B, Pacini F, Schlumberger M, Sherman SI, Steward DL, Tuttle RM. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009 Nov;19(11):1167-214.
19. Görges R, Kandror T, Kuschnerus S, Zimny M, Pink R, Palmedo H, Hach A, Rau H, Tanner C, Zaplatnikov K, Bockisch A, Freudenberg L. Scintigraphically “hot” thyroid nodules mainly go hand in hand with a normal TSH. Nuklearmedizin. 2011;50(5):179-88.
20. Hurtado-López LM, Martínez-Duncker C. Negative MIBI thyroid scans exclude differentiated and medullary thyroid cancer in 100% of patients with hypofunctioning thyroid nodules. Eur J Nucl Med Mol Imaging. 2007 Oct;34(10):1701-3.
21. Theissen P, Schmidt M, Ivanova T, Dietlein M, Schicha H. MIBI scintigraphy in hypofunctioning thyroid nodules–can it predict the dignity of the lesion? Nuklearmedizin. 2009;48(4):144-52.
22. Beristain Hernández JL, Servín Torres E, Sosa Caballero A, Velázquez García JA, Pozzo Bobarín R, Delgadillo Teyer G, Serrano Galeana I, Márquez Hernández A, Bevia Pérez F, Piscil Salazar MA, Ortiz De La Peña Salazar Ilarregui D, Sánchez González FJ, Espinoza Aguilar A. Determination of the diagnostic accuracy of 99mTc sestamibi scanning in patients with thyroid nodule and a definitive histopathological report. Endocrinol Nutr. 2010 Dec;57(10):460-6.
23. Saggiorato E, Angusti T, Rosas R, Martinese M, Finessi M, Arecco F, Trevisiol E, Bergero N, Puligheddu B, Volante M, Podio V, Papotti M, Orlandi F. 99mTc-MIBI Imaging in the presurgical characterization of thyroid follicular neoplasms: relationship to multidrug resistance protein expression. J Nucl Med. 2009 Nov;50(11):1785-93.
24. Giovanella L, Suriano S, Maffioli M, Ceriani L, Spriano G. (99m)Tc-sestamibi scanning in thyroid nodules with nondiagnostic cytology. Head Neck. 2010 May;32(5):607-11.
25. LaFranchi SH. Approach to the diagnosis and treatment of neonatal hypothyroidism. J Clin Endocrinol Metab. 2011 Oct;96(10):2959-67.
26. Panoutsopoulos G, Mengreli C, Ilias I, Batsakis C, Christakopoulou I. Scintigraphic evaluation of primary congenital hypothyroidism: results of the Greek screening program. Eur J Nucl Med. 2001 Apr;28(4):529-33.
27. Clerc J, Monpeyssen H, Chevalier A, Amegassi F, Rodrigue D, Leger FA, Richard B. Scintigraphic imaging of paediatric thyroid dysfunction. Horm Res. 2008;70(1):1-13.
28. Ramtoola S, Maisey MN, Clarke SE, Fogelman I. The thyroid scan in Hashimoto’s thyroiditis: the great mimic. Nucl Med Commun. 1988 Sep;9(9):639-45.
29. Balon HR, Silberstein EB, Meier DA, Charkes ND, Royal HD, Sarkar SD, Donohoe KJ. Society of Nuclear Medicine Procedure Guideline for Thyroid Uptake Measurement. V3.0. Approved September 5, 2006. Available at: http://interactive.snm.org/docs/Thyroid Uptake Measure v3 0.pdf
30. Smith JR, Oates E. Radionuclide Imaging of the Thyroid Gland: Patterns, Pearls, and Pitfalls. Clin Nucl Med. 2004;29:181-193.
31. Silberstein EB, Alavi A, Balon HR, Becker D, Charkes ND, Clarke SEM, Divgi CR, Donohoe KJ, Delbeke D, Goldsmith SJ, Meier DA, Sarkar SD, Waxman AD. Procedure Guideline for Scintigraphy for Differentiated Papillary and Follicular Thyroid Cancer 3.0. Society of Nuclear Medicine, 2006, pp 1-6. Available at:
32. http://interactive.snm.org/docs/Scintigraphy%20for%20Differentiated%20Thyroid%20Cancer%20V3%200%20%289-25-06%29.pdf
33. Intenzo CM, Dam HQ, Manzone TA, Kim SM. Imaging of the thyroid in benign and malignant disease. Semin Nucl Med. 2012 Jan;42(1):49-61.
34. Phan TT, van Tol KM, Links TP, et al: Diagnostic I-131 scintigraphy in patients with differentiated thyroid cancer: No additional value of higher scan dose. Ann Nucl Med 2004;18:641-646.
35. Kulkarni K, Van Nostrand D, Mete M, Burman K, Wartofsky L. Detectability of foci of radioiodine uptake in the thyroid bed and neck comparing pinhole with parallel-hole collimators. Nucl Med Commun. 2011 May;32(5):369-74.
36. Mandel SJ, Shankar LK, Benard F, Yamamoto A, Alavi A. Superiority of iodine-123 compared with iodine-131 scanning for thyroid remnants in patients with differentiated thyroid cancer. Clin Nucl Med. 2001 Jan;26(1):6-9.
37. Thomas DL, Menda Y, Bushnell D. A comparison between diagnostic I-123 and posttherapy I-131 scans in the detection of remnant and locoregional thyroid disease. Clin Nucl Med. 2009 Nov;34(11):745-8.
38. Iwano S, Kato K, Nihashi T, Ito S, Tachi Y, Naganawa S. Comparisons of I-123 diagnostic and I-131 post-treatment scans for detecting residual thyroid tissue and metastases of differentiated thyroid cancer. Ann Nucl Med. 2009 Nov;23(9):777-82.
39. Hung BT, Huang SH, Huang YE, Wang PW. Appropriate time for post-therapeutic I-131 whole body scan. Clin Nucl Med. 2009 Jun;34(6):339-42.
40. Donahue KP, Shah NP, Lee SL, Oates ME. Initial staging of differentiated thyroid carcinoma: continued utility of posttherapy 131I whole-body scintigraphy. Radiology. 2008 Mar;246(3):887-94.
41. Mazzaferri EL, Kloos RT. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab. 2001 Apr;86(4):1447-63.
42. Pacini F, Schlumberger M, Dralle H, Elisei R, Smit JW, Wiersinga W; European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol. 2006 Jun;154(6):787-803.
43. Mariani G, Bruselli L, Kuwert T, Kim EE, Flotats A, Israel O, Dondi M, Watanabe N. A review on the clinical uses of SPECT/CT. Eur J Nucl Med Mol Imaging. 2010 Oct;37(10):1959-85.
44. Yamamoto Y, Nishiyama Y, Monden T, Matsumura Y, Satoh K, Ohkawa M. Clinical usefulness of fusion of 131I SPECT and CT images in patients with differentiated thyroid carcinoma. J Nucl Med. 2003 Dec;44(12):1905-10.
45. Tharp K, Israel O, Hausmann J, Bettman L, Martin WH, Daitzchman M, Sandler MP, Delbeke D. Impact of 131I-SPECT/CT images obtained with an integrated system in the follow-up of patients with thyroid carcinoma. Eur J Nucl Med Mol Imaging. 2004 Oct;31(10):1435-42.
46. Ruf J, Lehmkuhl L, Bertram H, Sandrock D, Amthauer H, Humplik B, Ludwig Munz D, Felix R. Impact of SPECT and integrated low-dose CT after radioiodine therapy on the management of patients with thyroid carcinoma. Nucl Med Commun. 2004 Dec;25(12):1177-82.
47. Ingui CJ, Shah NP, Oates ME. Endocrine neoplasm scintigraphy: added value of fusing SPECT/CT images compared with traditional side-by-side analysis. Clin Nucl Med. 2006 Nov;31(11):665-72.
48. Xue YL, Qiu ZL, Song HJ, Luo QY. Value of ¹³¹I SPECT/CT for the evaluation of differentiated thyroid cancer: a systematic review of the literature. Eur J Nucl Med Mol Imaging. 2013 May;40(5):768-78.
49. Dewaraja YK, Wilderman SJ, Ljungberg M, Koral KF, Zasadny K, Kaminiski MS. Accurate dosimetry in 131I radionuclide therapy using patient-specific, 3-dimensional methods for SPECT reconstruction and absorbed dose calculation. J Nucl Med. 2005 May;46(5):840-9.
50. Song H, He B, Prideaux A, Du Y, Frey E, Kasecamp W, Ladenson PW, Wahl RL, Sgouros G. Lung dosimetry for radioiodine treatment planning in the case of diffuse lung metastases. J Nucl Med. 2006 Dec;47(12):1985-94.
51. Schlumberger M, Berg G, Cohen O, Duntas L, Jamar F, Jarzab B, Limbert E, Lind P, Pacini F, Reiners C, Sánchez Franco F, Toft A, Wiersinga WM. Follow-up of low-risk patients with differentiated thyroid carcinoma: a European perspective. Eur J Endocrinol. 2004 Feb;150(2):105-12.
52. Tuttle RM: National Comprehensive Cancer Network, Clinical Practice Guidelines in Oncology, thyroid cancer. Version 2.2013. Available at: http://www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf
53. Park HM, Perkins OW, Edmondson JW, Schnute RB, Manatunga A. Influence of diagnostic radioiodines on the uptake of ablative dose of I-131. Thyroid. 1994 Spring;4(1):49-54.
54. Silberstein EB. Comparison of outcomes after (123)I versus (131)I pre-ablation imaging before radioiodine ablation in differentiated thyroid carcinoma. J Nucl Med. 2007 Jul;48(7):1043-6.
55. Pacini F, Castagna MG, Brilli L, Pentheroudakis G; ESMO Guidelines Working Group. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012 Oct;23 Suppl 7:vii110-9.
56. Robbins RJ, Chon JT, Fleisher M, Larson SM, Tuttle RM. Is the serum thyroglobulin response to recombinant human thyrotropin sufficient, by itself, to monitor for residual thyroid carcinoma? J Clin Endocrinol Metab. 2002 Jul;87(7):3242-7.
57. Tachi Y, Iwano S, Kato K, Tadokoro M, Naganawa S. Diagnostic whole-body scanning before radioiodine therapy for pulmonary metastases of differentiated thyroid cancer: predictive value and recommendations. Clin Nucl Med. 2008 Dec;33(12):845-51.
58. Leitha T, Staudenherz A. Frequency of diagnostic dilemmas in 131I whole body scanning. Nuklearmedizin. 2003;42(2):55-62.
59. Oh J-R, Ahn B-C. False-positive uptake on radioiodine whole-body scintigraphy: physiologic and pathologic variants unrelated to thyroid cancer. Am J Nucl Med Mol Imaging 2012;2:362-85.
60. Vermiglio F, Baudin E, Travagli JP, Caillou B, Fragu P, Ricard M, Schlumberger M. Iodine concentration by the thymus in thyroid carcinoma. J Nucl Med. 1996 Nov;37(11):1830-1.
61. Patton JA, Townsend DW, Hutton BF. Hybrid imaging technology: from dreams and vision to clinical devices. Semin Nucl Med. 2009 Jul;39(4):247-63.
62. Abraham T, Schöder H. Thyroid cancer–indications and opportunities for positron emission tomography/computed tomography imaging. Semin Nucl Med. 2011 Mar;41(2):121-38.
63. Boellaard R, O’Doherty MJ, Weber WA, Mottaghy FM, Lonsdale MN, Stroobants SG, Oyen WJ, Kotzerke J, Hoekstra OS, Pruim J, Marsden PK, Tatsch K, Hoekstra CJ, Visser EP, Arends B, Verzijlbergen FJ, Zijlstra JM, Comans EF, Lammertsma AA, Paans AM, Willemsen AT, Beyer T, Bockisch A, Schaefer-Prokop C, Delbeke D, Baum RP, Chiti A, Krause BJ. FDG PET and PET/CT: EANM procedure guidelines for tumour PET imaging: version 1.0. Eur J Nucl Med Mol Imaging. 2010 Jan;37(1):181-200.
64. Freudenberg LS, Jentzen W, Stahl A, Bockisch A, Rosenbaum-Krumme SJ. Clinical applications of 124I-PET/CT in patients with differentiated thyroid cancer. Eur J Nucl Med Mol Imaging. 2011 May;38 Suppl 1:S48-56.
65. Virgolini I, Ambrosini V, Bomanji JB, Baum RP, Fanti S, Gabriel M, Papathanasiou ND, Pepe G, Oyen W, De Cristoforo C, Chiti A. Procedure guidelines for PET/CT tumour imaging with 68Ga-DOTA-conjugated peptides: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE. Eur J Nucl Med Mol Imaging. 2010 Oct;37(10):2004-10.
66. Vallabhajosula S. (18)F-labeled positron emission tomographic radiopharmaceuticals in oncology: an overview of radiochemistry and mechanisms of tumor localization. Semin Nucl Med. 2007 Nov;37(6):400-19.
67. Balogova S, Talbot JN, Nataf V, Michaud L, Huchet V, Kerrou K, Montravers F. 18F-fluorodihydroxyphenylalanine vs other radiopharmaceuticals for imaging neuroendocrine tumours according to their type. Eur J Nucl Med Mol Imaging. 2013 Jun;40(6):943-66.
68. Cohen MS, Arslan N, Dehdashti F, Doherty GM, Lairmore TC, Brunt LM, Moley JF. Risk of malignancy in thyroid incidentalomas identified by fluorodeoxyglucose-positron emission tomography. Surgery. 2001 Dec;130(6):941-6.
69. Kang KW, Kim SK, Kang HS, Lee ES, Sim JS, Lee IG, Jeong SY, Kim SW. Prevalence and risk of cancer of focal thyroid incidentaloma identified by 18F-fluorodeoxyglucose positron emission tomography for metastasis evaluation and cancer screening in healthy subjects. J Clin Endocrinol Metab. 2003 Sep;88(9):4100-4.
70. Are C, Hsu JF, Schoder H, Shah JP, Larson SM, Shaha AR. FDG-PET detected thyroid incidentalomas: need for further investigation? Ann Surg Oncol. 2007 Jan;14(1):239-47.
71. Lang BH, Law TT. The role of 18F-fluorodeoxyglucose positron emission tomography in thyroid neoplasms. Oncologist. 2011;16(4):458-66.
72. Dong MJ, Liu ZF, Zhao K, Ruan LX, Wang GL, Yang SY, Sun F, Luo XG. Value of 18F-FDG-PET/PET-CT in differentiated thyroid carcinoma with radioiodine-negative whole-body scan: a meta-analysis. Nucl Med Commun. 2009 Aug;30(8):639-50.
73. Robbins RJ, Wan Q, Grewal RK, Reibke R, Gonen M, Strauss HW, Tuttle RM, Drucker W, Larson SM. Real-time prognosis for metastatic thyroid carcinoma based on 2-(18F)fluoro-2-deoxy-D-glucose-positron emission tomography scanning. J Clin Endocrinol Metab. 2006 Feb;91(2):498-505.
74. Feine U, Lietzenmayer R, Hanke JP, Wöhrle H, Müller-Schauenburg W. 18FDG whole-body PET in differentiated thyroid carcinoma. Flipflop in uptake patterns of 18FDG and 131I). Nuklearmedizin. 1995 Aug;34(4):127-34.
75. Grünwald F, Schomburg A, Bender H, Klemm E, Menzel C, Bultmann T, Palmedo H, Ruhlmann J, Kozak B, Biersack HJ. Fluorine-18 fluorodeoxyglucose positron emission tomography in the follow-up of differentiated thyroid cancer. Eur J Nucl Med. 1996 Mar;23(3):312-9.
76. Vera P, Kuhn-Lansoy C, Edet-Sanson A, Hapdey S, Modzelewski R, Hitzel A, d’Anjou J, Basuyau JP. Does recombinant human thyrotropin-stimulated positron emission tomography with (18F)fluoro-2-deoxy-D-glucose improve detection of recurrence of well-differentiated thyroid carcinoma in patients with low serum thyroglobulin? Thyroid. 2010 Jan;20(1):15-23.
77. Kloos RT, Eng C, Evans DB, Francis GL, Gagel RF, Gharib H, Moley JF, Pacini F, Ringel MD, Schlumberger M, Wells SA Jr. American Thyroid Association Guidelines Task Force. Medullary thyroid cancer: management guidelines of the American Thyroid Association. Thyroid. 2009 Jun;19(6):565-612.
78. Treglia G, Rufini V, Salvatori M, Giordano A, Giovanella L. PET Imaging in Recurrent Medullary Thyroid Carcinoma. Int J Mol Imaging. 2012;2012:324686.
79. Cheng X, Bao L, Xu Z, Li D, Wang J, Li Y. ¹⁸F-FDG-PET and ¹⁸F-FDG-PET/CT in the detection of recurrent or metastatic medullary thyroid carcinoma: a systematic review and meta-analysis. J Med Imaging Radiat Oncol. 2012 Apr;56(2):136-42.
80. Treglia G, Villani MF, Giordano A, Rufini V. Detection rate of recurrent medullary thyroid carcinoma using fluorine-18 fluorodeoxyglucose positron emission tomography: a meta-analysis. Endocrine. 2012 Dec;42(3):535-45.
81. Slavikova K, Montravers F, Treglia G, Kunikowska J, Kaliska L, Vereb M, Talbot J, Balogova S. What is Currently the Best Radiopharmaceutical for the Hybrid PET/CT Detection of Recurrent Medullary Thyroid Carcinoma? Curr Radiopharm. 2013 Jun 6;6(2):96-105.
82. Naswa N, Sharma P, Suman Kc S, Lata S, Kumar R, Malhotra A, Bal C. Prospective evaluation of 68Ga-DOTA-NOC PET-CT in patients with recurrent medullary thyroid carcinoma: comparison with 18F-FDG PET-CT. Nucl Med Commun. 2012 Jul;33(7):766-74.
83. Treglia G, Cocciolillo F, Di Nardo F, Poscia A, de Waure C, Giordano A, Rufini V. Detection rate of recurrent medullary thyroid carcinoma using fluorine-18 dihydroxyphenylalanine positron emission tomography: a meta-analysis. Acad Radiol. 2012 Oct;19(10):1290-9.
84. Kauhanen S, Schalin-Jäntti C, Seppänen M, Kajander S, Virtanen S, Schildt J, Lisinen I, Ahonen A, Heiskanen I, Väisänen M, Arola J, Korsoff P, Ebeling T, Sane T, Minn H, Välimäki MJ, Nuutila P. Complementary roles of 18F-DOPA PET/CT and 18F-FDG PET/CT in medullary thyroid cancer. J Nucl Med. 2011;52:1855-63.
Created: October 28, 2014
Last update: October 28, 2014



