Βασίλης Άθυρος, Κωνσταντίνος Τζιόμαλος
Ιατρική Σχολή, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης
1. Δυσλιπιδαιμίες
Τα κύρια λιπίδια του ανθρώπινου οργανισμού είναι η χοληστερόλη (χρησιμεύει για τη σύνθεση κυτταρικών μεμβρανών, ορμονών των επινεφριδίων και των γονάδων και αποτελεί συστατικό της χολής που εκκρίνει το ήπαρ) και τα τριγλυκερίδια (χρησιμεύουν ως καύσιμη ύλη και ως αποθήκη ενέργειας στο λιπώδη ιστό).
Η διαταραχή (ποσοτική ή ποιοτική) των λιποπρωτεϊνικών σωματιδίων (LDL, HDL, VLDL) που μεταφέρουν τα λιπίδια αυτά προκαλεί τις δυσλιπιδαιμίες [1,2].
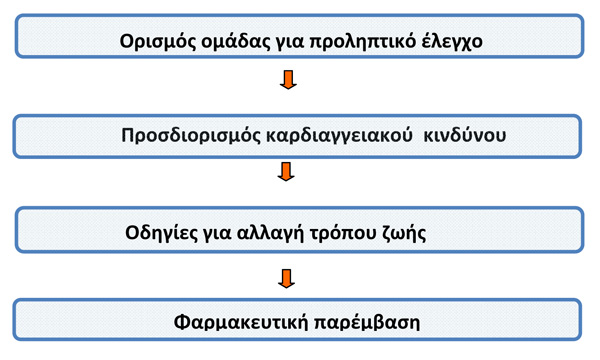
Πίνακας 1. Αλγόριθμος αντιμετώπισης της δυσλιπιδαιμίαςκαι προστασίαςαπό καρδιαγγειακά νοσήματα[3].
Ορισμός ομάδας για προληπτικό έλεγχο [2,3]:
- Άνδρες άνω των 40 ετών και μετα-εμμηνοπαυστικές γυναίκες
- Άτομα με αθηροσκληρωτική νόσο ανεξάρτητα από την ηλικία
- Ασθενείς με σακχαρώδη διαβήτη ανεξάρτητα από την ηλικία
- Ασθενείς με χρόνια νεφρική νόσο
- Άτομα με οικογενειακό ιστορικό πρόωρης στεφανιαίας νόσου
- Άτομα με αρτηριακή υπέρταση
- Άτομα με χρόνιες φλεγμονώδεις νόσους (ερυθηματώδης λύκος, ρευματοειδής αρθρίτις, ψωρίαση)
| Πίνακας 2. Διαστρωμάτωση καρδιαγγειακού κινδύνου σε 3 κατηγορίες και στόχος της LDL-χοληστερόλης για κάθε μία από αυτές [3]. | ||
| Επίπεδο Κινδύνου – Έναρξη θεραπείας αν είναι: | Στόχοι Πρωτογενής LDL-C | Εναλλακτικός ApoB |
| Υψηλός Αρχίστε στατίνη σε όλους τους ασθενείς με:
|
<70 mg/dlή ↓50% LDL-Χ | ApoB<80mg/dl |
| Μέτριος 2 τουλάχιστον παράγοντες κινδύνου χωρίς στεφανιαία νόσο κυρίως όταν:
και κυρίως σε:
|
<100 mg/dlή ↓50% LDL-Χ | ApoB<100mg/dl |
| Χαμηλός 0-2 παράγοντες κινδύνου χωρίς στεφανιαία νόσο
|
<130 mg/dlή ↓50% LDL-Χ | |
Πίνακας 3.Θεραπευτικός φαρμακευτικός αλγόριθμος για την αντιμετώπιση των δυσλιπιδαιμιών [3].

Εάν η αξιολόγηση του καρδιαγγειακού κινδύνου παραμένει ατελής χρησιμοποιούνται οι μηχανές υπολογισμού καρδιαγγειακού κινδύνου [3]
- FraminghamRiskScore [μπορεί να υποτιμήσει τον κίνδυνο σε μερικούς ασθενείς, χρησιμοποιεί την ολική και όχι την LDL-X, δεν περιλαμβάνει το οικογενειακό ιστορικό]
- PROCAMRiskScore [περιλαμβάνει επιπλέον του Framinghamτα τριγλυκερίδια, την ανοχή γλυκόζης νηστείας και το οικογενειακό ιστορικό]
- ReynoldsRiskScore[περιλαμβάνει το οικογενειακό ιστορικό και την hsCRP]
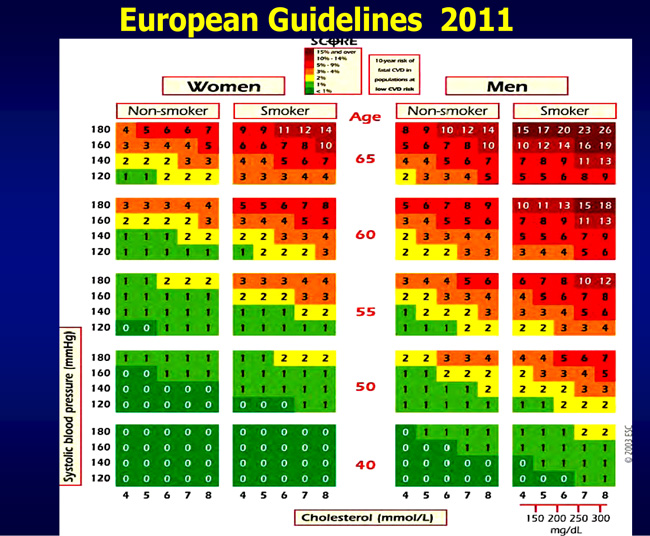
- Score(CVD) των Ευρωπαϊκών Εταιρειών (υπάρχει και αναγνωρισμένη Ελληνική εκδοχή) [χρησιμοποιεί την ολική και όχι την LDL-X, αναφέρεται μόνο στη θνητότητα και όχι στη νοσηρότητα, δεν περιλαμβάνει το οικογενειακό ιστορικό] (εικόνα 1)
Εικόνα 1. Διαγράμματα βάσει των οποίων υπολογίζεται ο κίνδυνος καρδιαγγειακού θανάτου (υψηλό score> 5% στα επόμενα 10 χρόνια) με υπολογισμό της ηλικίας, του φύλου, του καπνίσματος, της ολικής χοληστερόλης και της συστολικής αρτηριακής πίεσης [4].
2. Στατίνες
Ο ακρογωνιαίος λίθος της θεραπείας της δυσλιπιδαιμίας είναι οι στατίνες (τις λαμβάνει το 95% των ατόμων με δυσλιπιδαιμία). Οι στατίνες είναι από τα πιο συχνά συνταγογραφούμενα φάρμακα σε όλη την ιατρική. Οι στατίνες που κυκλοφορούν σήμερα στην Ελλάδα είναι οι παρακάτω (Πίνακας 4) [3].
|
Πίνακας 4. Οι στατίνες που κυκλοφορούν στην Ελλάδα και το δοσολογικό τους εύρος [3]. |
|
| Στατίνη |
Δοσολογικό εύρος |
| Ατορβαστατίνη Λοβαστατίνη Πραβαστατίνη Ροσουβαστατίνη Σιμβαστατίνη Φλουβαστατίνη |
10 – 80 mg |
2.1. Μηχανισμός δράσης των στατινών
Ο κύριος μηχανισμός δράσης τους αφορά την ενδοκυττάριο αναστολή της αναγωγάσης του 3-υδροξυ-μεθυλο-γλουταρυλο συνενζύμου Α (HMG-CoA reductase) που αναστέλλει την σύνθεση του μεβαλονικού οξέος και τελικά της χοληστερόλης [1]. Το κύτταρο, επειδή χρειάζεται τη χοληστερόλη, αυξάνει τους υποδοχείς της LDL στην επιφάνειά του και παίρνει έτσι περισσότερη χοληστερόλη από το αίμα, ρίχνοντας ταυτόχρονα τα επίπεδα της σε αυτό. Αυτός είναι ο υπολιπιδαιμικός μηχανισμός δράσης των στατινών που αποδίδει καρδιαγγειακά οφέλη μετά από κάποιο σημαντικό χρονικό διάστημα. Υπάρχουν όμως και οι πλειοτροπικές δράσεις (πλείον εις τρόπος = με περισσότερους από ένα τρόπους). Αυτές αναστέλλουν την ενδοθηλιακή δυσλειτουργία (αυξάνουν και τη δραστικότητα του μονοξειδίου του αζώτου), την φλεγμονώδη αντίδραση του αρτηριακού τοιχώματος, την οξειδωτική καταπόνηση, την θρομβογενητικότητα και συμβάλλουν στην σταθεροποίηση και τελικά στην υποστροφή των αθηρωματικών πλακών. Η σταθεροποίηση της πλάκας είναι απαραίτητη για την αποφυγή της ρήξης της που προκαλεί αποφράσσοντα τον αυλό της αρτηρίας θρόμβο, ο οποίος είναι υπεύθυνος για την πρόκληση του κλινικού συμβάματος (ΟΕΜ ή ΑΕΕ). Οι παραπάνω μηχανισμοί μπορούν να δρουν συμπληρωματικά με την υπολιπιδαιμική δράση των στατινών και να συμβάλουν σημαντικά κυρίως στην εμφάνιση των πρώιμων καρδιαγγειακών ωφελημάτων. ΟΙ στατίνες δρουν σε όλα τα σημεία που εμπλέκονται στην παθογένεση της αθηρωματικής πλάκαςκαι της αθηροθρόμβωσης (Εικόνα 2)[1].

Εικόνα 2. Μηχανισμός πρόκλησης αθηροσκλήρωσης και τα σημεία δράσης των στατινών [1].
2.2. Βασικές αρχές της θεραπείας με στατίνες
Πριν την έναρξη της υπολιπιδαιμικής αγωγής απαιτείται ο προσδιορισμός των λιπιδαιμικών παραμέτρων [ολική χοληστερόλη, τριγλυκερίδια, HDL-X και υπολογισμός της LDL-X [από την εξίσωση LDL-X = ολική χοληστερόλη – (τριγλυκερίδια/5 +HDL-Χ) ] μετά νηστεία 12-14h, παράλληλα με τον προσδιορισμό των επιπέδων της γλυκόζης, της TSH (για τον αποκλεισμό υποκείμενου υποθυρεοειδισμού), καθώς και των τρανσαμινασών (AST/ALT) και της CPK για τον έλεγχο της εμφάνισης ανεπιθύμητων ενεργειών. Επανάληψη εργαστηριακού ελέγχου (λιπιδίων για τον έλεγχο της αποτελεσματικότητας και ηπατικών ενζύμων και CPK για τον έλεγχο της ασφάλειας) μετά 12 εβδομάδες; απαιτείται διακοπή της αγωγής εάν ALT>3 φορές τις ανώτερες φυσιολογικές τιμές (ΑΦΤ) ή CK> 5 φορές τις ΑΦΤ ή σε ασθενείς με επίμονες έντονες μυαλγίες. Πρέπει να επισημανθεί ότι δεν χρειάζεται η διακοπή της θεραπείας με στατίνες ή η αναβολή έναρξης της αγωγής σε άτομα με μικρές αυξήσεις των τρανσαμινασών ή της CPK, ενώ παράλληλα σε αυτούς τους ασθενείς επιβάλλεται η αναζήτηση άλλων υποκείμενων αιτιών αύξησης των ηπατικών ή μυϊκών ενζύμων. Επανάληψη προσδιορισμού αυτών των παραμέτρων σε ασθενείς που πέτυχαν τους στόχους της αγωγής 1-2 φορές το χρόνο ή σε περιπτώσεις αλλαγής του θεραπευτικού σχήματος [2,3].
Η επιλογή του φαρμάκου και η δοσολογία του εξαρτώνται από την απαιτούμενη ποσοστιαία μεταβολή της LDL-Χ που είναι απαραίτητη για την επίτευξη των στόχων. Οι στατίνες χορηγούνται το βράδυ πριν τη νυχτερινή κατάκλιση (η χοληστερόλη συντίθεται το βράδυ). Η υπολιπιδαιμική αγωγή είναι θεραπεία εφ’ όρου ζωής ενώ έχει ιδιαίτερη σημασία η συμμόρφωση των ασθενών στην αγωγή. Πρέπει να υπογραμμισθεί ότι ο διπλασιασμός της δόσης μιας στατίνης έχει ως αποτέλεσμα μέση επιπρόσθετη μείωση της LDL-Χ κατά 6% [2,3].
2.3. Οι στατίνες στην πρόληψη των καρδιαγγειακών συμβαμάτων
Κλινικές μελέτες έχουν δείξει ότι οι στατίνες μειώνουν σημαντικά τον κίνδυνο καρδιαγγειακού (ΚΑ) θανάτου και μη θανατηφόρων συμβαμάτων [έμφραγμα μυοκαρδίου (ΕΜ), αγγειακό εγκεφαλικό επεισόδιο (ΑΕΕ), κ.α.] σε ασθενείς με αποδεδειγμένη στεφανιαία νόσο, αλλά και σε άλλους που βρίσκονται σε μέτριο ή αυξημένο ΚΑ κίνδυνο [3].

Εικόνα 3. Μηχανισμός ρήξης της αθηρωματικής πλάκας και δημιουργίας θρόμβου, που αποφράσσει τον αυλό του αγγείου και προκαλεί το κλινικό σύμβαμα (στα σημεία αυτά δρουν οι στατίνες για να αποτρέψουν τη ρήξη) [3].
Ποια τα κριτήρια έναρξης θεραπείας με στατίνες; Μόνο το επίπεδο του συνολικού καρδιαγγειακού κινδύνου (ΚΑΚ) και όχι τα αρχικά επίπεδα της LDL-Χ. Ο συνολικός ΚΑΚ δεν καθορίζεται μόνο από την LDL-Χ (αλλά και από ηλικία, φύλο, αρτηριακή υπέρταση, σακχαρώδη διαβήτη, κάπνισμα, περιορισμένη φυσική δραστηριότητα κ.ά.) καθορίζει όμως τους νέους(αυστηρούς) στόχους για την LDL-Χ [3].
Πρωτοπαθής ή δευτεροπαθής πρόληψη των καρδιαγγειακών συμβαμάτων;Δεν πρέπει να μιλάμε πλέον για πρωτογενή ή δευτερογενή πρόληψη αλλά για άτομα υψηλού κινδύνου (επιθετική αγωγή για να πιάσουμε τους στόχους) και άτομα μέτριου ή χαμηλού κινδύνου (λιγότερο επιθετική αγωγή) αλλά οι στόχοι της χοληστερόλης και στις δύο περιπτώσεις πρέπει να καθορίζονται από τον συνολικό ΚΑΚ. Όλα αυτά γιατί το 50% των ασθενών που εμφανίζει ΟΕΜ δεν έχει υψηλή χοληστερόλη, το 40% των ασθενών με ΟΕΜ πεθαίνει πριν φθάσει στο νοσοκομείο και το 6-8% πεθαίνει την πρώτη εβδομάδα (δηλαδή οι μισοί ασθενείς πεθαίνουν άμεσα). Ζωντανό παράδειγμα η μελέτη JUPITER. Σε αυτή η LDL-Χ ήταν 108 mg/dl, αλλά οι ασθενείς, οι οποίοι δεν είχαν ιστορικό στεφανιαίας νόσου ή ισοδυνάμων (“πρωτογενούς” πρόληψης με την παλαιά θεώρηση) είχαν λίγο αυξημένη ηλικία (>50 ετών οι άνδρες και >60 ετών οι γυναίκες), μεταβολικό σύνδρομο, υπέρταση, οικογενειακό ιστορικό στεφανιαίας νόσου, τα οποία εκφράζονταν ως υψηλή hsCRP (3.8 mg/L),η οποία χρησιμοποιήθηκε ως δείκτης της χρόνιας ήπιας φλεγμονής του αρτηριακού τοιχώματος που προκαλεί ο αυξημένος συνολικός ΚΑΚ. Η χορήγηση ροσουβαστατίνης 20 mg/ημέρα στους ασθενείς αυτούς (n=8.857) προκάλεσε σε λιγότερο από 2 χρόνια 44% ελάττωση των καρδιαγγειακών συμβαμάτων και 20% ελάττωση της ολικής θνητότητας σε σύγκριση με το εικονικό φάρμακο (n=8.864) (εικόνα 4).

Εικόνα 4. Καμπύλες συμβαμάτων και ποσοστό ελάττωσης καρδιαγγειακών επεισοδίων στη μελέτη JUPITERμε ροσουβαστατίνη 20 mg/ημέρα έναντι εικονικού φαρμάκου [5].
2.4. Οι στατίνες στην θεραπεία της δυσλιπιδαιμίας σε ειδικές ομάδες ασθενών
2.4.1. Χρόνια σταθερή στεφανιαία νόσος
Το 1994 για πρώτη φορά η μελέτη επιβίωσης στεφανιαίων ασθενών ScandinavianSimvastatinSurvivalStudy (4S) (εικόνα 5) [6] έδειξε ότι η χορήγηση στατίνης μπορεί να ελαττώσει σημαντικά την καρδιαγγειακή νοσηρότητα και θνητότητα αλλά (πολύ σημαντικό) και την ολική θνητότητα με σιμβαστατίνη έναντι εικονικού φαρμάκου σε βάθος 5-ετίας σε ασθενείς με προηγούμενο ΕΜ. Αυτό επέφερε άρδην αλλαγή στο τρόπο θεραπευτικής αντιμετώπισης της στεφανιαίας νόσου. Ακολούθησαν οι μελέτες CARE (ΗΠΑ-1996) [7]και LIPID (Αυστραλία-1998) [8], που χρησιμοποίησαν πραβαστατίνη, με ανάλογα αποτελέσματα.

Εικόνα 5. Καμπύλες επιβίωσης και ποσοστό ελάττωσης καρδιαγγειακών επεισοδίων στη μελέτη 4S με σιμβαστατίνη 26 mg/ημέρα έναντι εικονικού φαρμάκου σε στεφανιαίους ασθενείς [6].
Το 2002 δημοσιεύτηκε η μελέτη HeartProtectionStudy (HPS) [9]. Αυτήέδειξε ότι η χορήγηση σιμβαστατίνης (40 mg/ημέρα) έναντι εικονικού φαρμάκου σε βάθος 5ετίας μπορεί να ελαττώσει σημαντικά (24%) την καρδιαγγειακή νοσηρότητα και θνητότητα με σε ασθενείς με προηγούμενο ΕΜ, περιφερική αρτηριακή νόσο, σακχαρώδη διαβήτη (δύο ισοδύναμα της στεφανιαίας νόσου) ή τους συνδυασμούς τους (εικόνα 6).
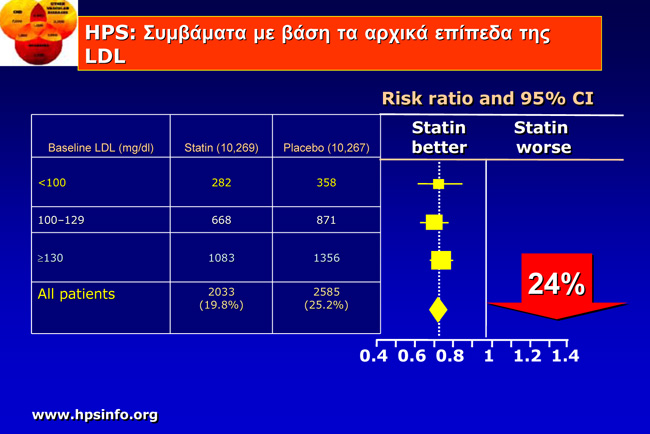
Εικόνα 6. Καμπύλες επιβίωσης και ποσοστό ελάττωσης καρδιαγγειακών επεισοδίων στη μελέτη HPS με σιμβαστατίνη 40 mg/ημέρα έναντι εικονικού φαρμάκου σε ασθενείς με στεφανιαία νόσο, περιφερική αρτηριακή νόσο, σακχαρώδη διαβήτη και συνδυασμούς των 3 [9].
Τηνίδιαεβδομάδατου 2002 δημοσιεύτηκεημελέτη GREek Atorvastatin and Coronary heart disease Evaluation (GREACE) [10].Αυτή ήταν μια προοπτική, τυχαιοποιημένη, ελεγχόμενη με ομάδα ελέγχου μελέτη επιβίωσης που περιέλαβε 1.600 έλληνες ασθενείς με προηγούμενο ΕΜ.

Εικόνα 7. Απόλυτη επίπτωση καθώς και απόλυτη και σχετική ελάττωση του κινδύνου καρδιαγγειακού επεισοδίου σε ασθενείς με προηγούμενο ΕΜ στη δομημένη φροντίδα (ατορβαστατίνη 24 mg/ημέρα) έναντι της συνήθους [10].
Οι 800 υποβλήθηκαν σε δομημένη φαρμακευτική αγωγή για όλους τους παράγοντες κινδύνου καρδιαγγειακής νόσου και επιπλέον σε υπολιπιδαιμική αγωγή με ατορβαστατίνη με στόχο την επίτευξη επιπέδων LDL-Χ < 100 mg/dl (σύμφωνα με τις κατευθυντήριες αγωγής της εποχής-targetbasedtreatment) ενώ οι υπόλοιποι 800 υποβλήθηκαν σε αγωγή δευτερογενούς πρόληψης από τον θεράποντα ιατρό που οι ίδιοι επέλεξαν (συνήθης φροντίδα). Αυτό έγινε γιατί το 1998 που άρχισε η μελέτη δεν ήταν ηθικό να χορηγηθεί στους μισούς ασθενείς εικονικό φάρμακο, δεδομένου ότι είχε ήδη αποδειχθεί η χρησιμότητα της χορήγησης στατινών σε ασθενείς με προηγούμενο ΕΜ. Η χορήγηση ασπιρίνης, β-αποκλειστή, αναστολέα του μετατρεπτικού ενζύμου της αγγειοτενσίνης στους ασθενείς και των 2 ομάδων δεν διέφερε σημαντικά, γιατί αυτές ήταν καθιερωμένες θεραπείες από χρόνια. Όσον αφορά τη χορήγηση στατίνης, σχετικά καινούριο φάρμακο για την εποχή, στην ομάδα δομημένης φροντίδας πήραν όλοι ατορβαστατίνη (μέση δόση 24 mg/ημέρα) και το 95% έπιασε το στόχο της LDL-Χ < 100 mg/dl, λόγω της αναγκαστικής τιτλοποίησης της δόσης της ατορβαστατίνης. Αντίθετα στην ομάδα της συνήθους φροντίδας μόνο το 12% των ασθενών πήραν διάφορες στατίνες και μόνο το 3% έπιασε τον στόχο της LDL-Χ < 100 mg/dl, κυρίως γιατί δεν έγινε τιτλοποίηση της δόσης της στατίνης. Αρά οι όποιες διαφορές κατεγράφησαν μεταξύ των δύο ομάδων οφείλονταν στην υπολιπιδαιμική φαρμακευτική αγωγή. Κατεγράφη στην ομάδα της δομημένης φροντίδας, σε σύγκριση με την ομάδα της συνήθους φροντίδας, μέση μείωση όλων των καρδιαγγειακών συμβαμάτων κατά 51% (p<0,00001) [10], ελάττωση της ολικής και της στεφανιαίας θνητότητας, ελάττωση της καρδιαγγειακής νοσηρότητας και της επεμβατικής επαναιμάτωσης, αλλά και του ΑΕΕ (εικόνα 7). Η μελέτη, που ήταν προγραμματισμένη για να διαρκέσει 5 χρόνια, διεκόπη στα 3 χρόνια γιατί έδωσε πολύ σημαντικά οφέλη στην ομάδα δομημένης φροντίδας, όπως έδειξε ενδιάμεση ανάλυση και δεν κρίθηκε ηθική η συνέχισή της. Οι καμπύλες συμβαμάτων άρχισαν να αποκλίνουν από τους πρώτες μήνες της μελέτης. Τακαλά αποτελέσματα στα 3 χρόνια, το πρώιμο όφελός από τους πρώτους μήνες, και το τεράστιο μέγεθος της ελάττωσης των συμβαμάτων (51%) ήταν πρωτόγνωρα για την εποχή της δημοσίευσης (2002).
Το 2005 δημοσιεύτηκε η μελέτη TreatingtoNewTargets (TNT) [11]. Τεράστια (n=10.001 στεφανιαίοι ασθενείς), διπλή-τυφλή, τυχαιοποιημένη, προοπτική, ελεγχόμενη μελέτη επιβίωσης με ατορβαστατίνη 80 mg/ημέρα έναντι 10 mg/ημέρα. Η μελέτη αυτή είχε 18 προσχεδιασμένες υπο-μελέτες. Για πρώτη φορά η ομάδα ελέγχου αποτελείται από άτομα που παίρνουν ενεργό θεραπεία με στατίνη,ατορβαστατίνη 10 mg/ημέρα, η οποία ελαττώνει την ΚΑ νοσηρότητα και θνητότητα κατά 36-52% ακόμη και στην πρωτογενή πρόληψη.Η ΤΝΤ έδειξε ότι τα 80 mg/ημέρα ατορβαστατίνης ελαττώνουν την νοσηρότητα και θνητότητα κατά 22% περαιτέρω απ’ ότι η ατορβαστατίνη 10 mg/ημέρα. Έτσι η ΤΝΤ έδειξε ότι αυτή και η GREACE ελάττωσαν τη θνητότητα από στεφανιαία νόσο και την ολική θνητότητα (εικόνα 8) σε επίπεδα ανάλογα του γενικού πληθυσμού της ιδίας ηλικίας χωρίς όμως στεφανιαία νόσο. Εξάλειψαν δηλαδή τον επιπρόσθετο κίνδυνο της προϋπάρχουσας στεφανιαίας νόσου και των ισοδυνάμων της.
Η θεραπεία με στατίνες προκάλεσε ελάττωση των ΚΑ συμβαμάτων στη “δευτερογενή” πρόληψη μεγαλύτερη από το άθροισμα της ελάττωσης που προκάλεσαν η ασπιρίνη, η δημιουργία των στεφανιαίων μονάδων, η εισαγωγή της θρομβόλυσης, η επείγουσα επεμβατική αντιμετώπιση και η εισαγωγή των αντιαιμοπεταλιακών μαζί.

Εικόνα 8. Απόλυτα ποσοστά ολικής θνητότητας στις ομάδες ενεργού θεραπείας με στατίνες και στις ομάδες ελέγχου σε όλες τις μελέτες επιβίωσης “δευτερογενούς” πρόληψης* [6-11]. *Οι μελέτες PROSPER και CARE δεν μπόρεσαν να δείξουν ελάττωση της ολικής θνητότητας
2.4.2. Αρτηριακή υπέρταση-Σακχαρώδης διαβήτης
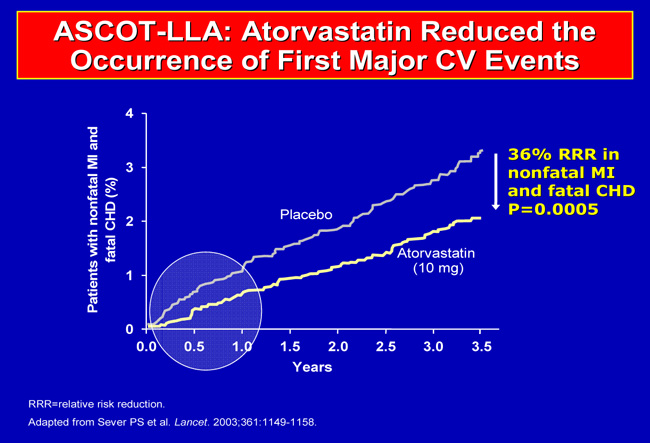
Ήδη από τη δεκαετία του 1990 υπήρχαν στοιχεία, κυρίως από την τεράστια μελέτη MultipleRiskFactorIntervention (MRFIT) Study [12], που έδειχναν ότι η αρτηριακή υπέρταση και η δυσλιπιδαιμία έχουν πολλαπλασιαστική δράση στην αύξηση της καρδιαγγειακής νοσηρότητας και θνητότητας (3 – πλασιασμός η κάθε μία και 11-πλασιασμός οι δύο μαζί). Υπερτασιολόγοι και λιπιδιολόγοι κλεισμένοι στα στενά πλαίσια της ειδικότητάς τους δεν μπορούσαν να συνθέσουν την γενικότερη εικόνα. Έτσι μόνο το 2003 η μελέτη Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT-LLA) [13] περιέλαβε ≈10.000 υπερτασικούς ασθενείς για να διερευνήσει το συνδυασμένο αποτέλεσμα της νεότερης αντιυπερτασικής αγωγής (αποκλειστής διαύλων ασβεστίου και εάν απαιτούνταν αναστολέας του μετατρεπτικού ενζύμου έναντι β-αποκλειστήκαι εάν απαιτούνταν θειαζιδικό διουρητικό) και της υπολιπιδαιμικής αγωγής με ατορβαστατίνη έναντι εικονικού φαρμάκου.Τα αποτελέσματα (εικόνα 9) έδειξαν ότι η ατορβαστατίνη έναντι του εικονικού φαρμάκου σχετίστηκε με μια κατά 36% ελάττωση του μη θανατηφόρου ΕΜ και της θανατηφόρου στεφανιαίας νόσου, ενώ όταν συνδυάζονταν με τη “νεότερη” αντιυπερτασική αγωγή η μείωση αυτή έφτανε το 52% έναντι του εικονικού φαρμάκου. Η μελέτη διεκόπη σχεδόν στα 3 χρόνια λόγω πρώιμου οφέλους και οι καμπύλες συμβαμάτων άρχισαν να αποκλίνουν από τους πρώτους μήνες. Αυτό και το μέγεθος του κλινικού οφέλους, επιβεβαίωσαν πλήρως τα 3 μείζονα ευρήματα [13] που είχε παρουσιάσει η GREACE ένα χρόνο πριν. Κανένα άλλο φάρμακο δεν μπορεί να προκαλέσει τέτοια ελάττωση των ΚΑ συμβαμάτων σε ασθενείς με αρτηριακή υπέρταση.
Εικόνα 9. ASCOT-LLA: Καμπύλες συμβαμάτων σε υπερτασικούς ασθενείς με “φυσιολογικά” επίπεδα LDL-X (130 mg/dl) που έπαιρναν ατορβαστατίνη 10 mg/ημέρα σε σύγκριση με υπερτασικούς σε εικονικό φάρμακο [13].
Επίσης από τη δεκαετία του 1990 υπήρχαν στοιχεία ότι ο σακχαρώδης διαβήτης αυξάνει το κίνδυνο για καρδιαγγειακό θάνατο κατά 3 έως 5 φορές ανεξάρτητα από άλλους παράγοντες κινδύνου (άρα για όλα τα επίπεδα κινδύνου) [12]. Οι μεγάλες μελέτες επιβίωσης, με εξαίρεση την ΤΝΤ και την GREACE, είχαν αποκλείσει τους ασθενείς με σακχαρώδη διαβήτη και γι’ αυτό τα επιδημιολογικά στοιχεία δεν είχαν επιβεβαιωθεί από παρεμβατικές μελέτες επιβίωσης. Το 2004 αυτό άλλαξεόταν δημοσιεύτηκε η μελέτη Collaborative Atorvastatin Diabetes Study (CARDS) [14]που περιέλαβε ασθενείς με σακχαρώδη διαβήτη τύπου 2 (ΣΔΤ2) χωρίς στεφανιαία νόσο κατά την έναρξη της μελέτης. Ο σχεδιασμός της μελέτης ήταν ίδιος με αυτόν της ASCOT-LLA μόνο που αντί για υπερτασικούς περιέλαβε διαβητικούς. Τα αποτελέσματα ήταν ανάλογα με αυτά της ASCOT-LLA (εικόνα 10) [14]. Κανένα άλλο φάρμακο ή συσκευή ή διαδικασία δεν μπορεί να προκαλέσει τέτοια ελάττωση των ΚΑ συμβαμάτων σε ασθενείς με ΣΔΤ2.
Εικόνα 10. CARDS: Καμπύλες συμβαμάτων σε ασθενείς με σακχαρώδη διαβήτη τύπου 2 χωρίς στεφανιαία νόσο και “φυσιολογικά” επίπεδα LDL-X (120 mg/dl) που έπαιρναν ατορβαστατίνη 10 mg/ημέρα σε σύγκριση με ασθενείς με σακχαρώδη διαβήτη τύπου 2 σε εικονικό φάρμακο [14].
Τα τελευταία χρόνια αμφισβητείται το κατά πόσον ο κίνδυνος των ασθενών με ΣΔΤ2 είναι ίδιος με αυτό του προηγούμενου εμφράγματος, το κατά πόσοδηλαδή ο ΣΔΤ2 είναι πάντα ισοδύναμο στεφανιαίας νόσου. Οι οδηγίες ακόμη μέχρι και το 2011 πάντως συνιστούσαν χορήγηση στατίνης σε ασθενείς με ΣΔΤ2 μετά την ηλικία των 40 ετών, ανεξαρτήτως των επιπέδων των λιπιδίων [3,4].
2.4.3. Οξέα στεφανιαία σύνδρομα
Όλες οι στατίνες δεν είναι ίδιες. Η μελέτη PROVE-IT [15] έδειξε ότι η ατορβαστατίνη προκαλεί μεγαλύτερη μείωση των καρδιαγγειακών συμβαμάτων σε σύγκριση με την πραβαστατίνη σε ασθενείς με οξέα στεφανιαία σύνδρομα σε βάθος 2-ετίας (εικόνα 11). Σε κάθε περίπτωση υπήρξε σημαντικότατο κλινικό όφελος στην ομάδα αυτή του πολύ υψηλού κινδύνου [15].
Εικόνα 11. PROVE-IT: Καμπύλες συμβαμάτων σε ασθενείς με οξέα στεφανιαία σύνδρομα που πήραν για 2 χρόνια πραβαστατίνη ή ατορβαστατίνη στις μέγιστες δόσεις τους [15].
2.4.4. Χρόνια νεφρική νόσος
Η χρόνια νεφρική νόσος είναι ανεξάρτητος και σημαντικός παράγοντας κινδύνου καρδιαγγειακών παθήσεων (εικόνα 12) [16]. Αυτό έχει πολύ μεγάλη σημασία γιατί αφορά σε μεγάλα τμήματα του πληθυσμού. Στις ΗΠΑ, όπου υπάρχουν στοιχεία, το Εθνικό Ίδρυμα Νεφρολογίας ανακοίνωσε πρόσφατα ότι 26 εκατομμύρια Αμερικανοί (1/9) έχουν κάποιο βαθμό χρόνιας νεφρικής νόσου και ότι ένα εξαιρετικά μεγάλο και ανησυχητικό ποσοστό (1/3 ενήλικες, 73 εκατομμύρια άτομα) είναι σε κίνδυνο εμφάνισης χρόνιας νεφρικής νόσου επειδή έχουν ένα ή περισσότερους παράγοντες κινδύνου, όπως υψηλή αρτηριακή πίεση, διαβήτη, δυσλιπιδαιμία ή οικογενειακό ιστορικό νεφρικής νόσου. Τα στάδια 1 και 2 δεν συνδέθηκαν με ιδιαίτερα αυξημένο κίνδύνο ΚΑΝ, το στάδιο 3 όμως θεωρείται υψηλού κινδύνου, και τα στάδια 4 και 5 πάρα πολύ υψηλού κινδύνου. Ενδεικτικό είναι ότι 8 εκατομμύρια Αμερικανοί πάσχουν από χρόνια νεφρική νόσο σταδίου 3, ενώ μόνο 500 χιλιάδες από σταδίου 4 ή 5 (παρόλο ότι η νόσος είναι εξελικτική). Αυτό οφείλεται στο γεγονός ότι οι σταδίου 3 ασθενείς πεθαίνουν από ΕΜ ή ΑΕΕ πριν προλάβουν να μεταπέσουν στα επόμενα στάδια.
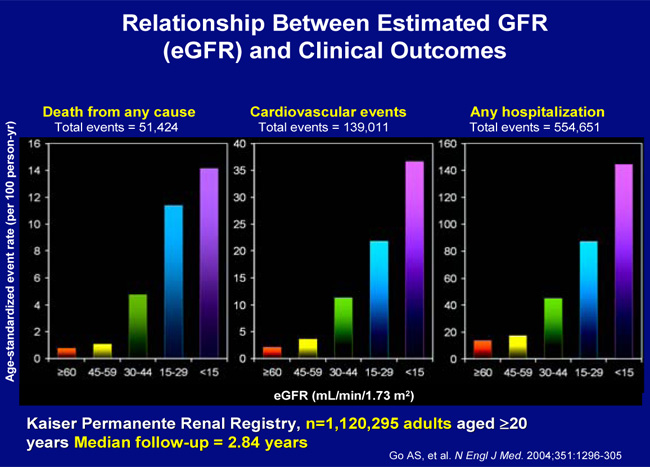
Εικόνα 12. KaiserPermanenteRenalRegistry (>1 εκατομμύριο ασθενείς): Ολική θνητότητα, καρδιαγγειακά συμβάματα και νοσηλείες σε νοσοκομείο ασθενών με χρόνια νεφρική νόσο ανάλογα με το στάδιό της [16].
Για πρώτη φορά το 2004 μια εκ’ των υστέρων ανάλυση της μελέτης GREACE έδειξε ότι η ατορβαστατίνη βελτίωσε τη νεφρική λειτουργία (το μοναδικό φάρμακο που το κάνει από όλα ανεξαιρέτως τα φάρμακα) και ότι αυτό μεταφράζεταισε κλινικόόφελός (εικόνα 13)[17].
Εικόνα 13. GREACE-RenalFunction: Ελάττωση της καρδιαγγειακής νοσηρότητας-θνητότητας με την βελτίωση της νεφρικής λειτουργίας και αύξηση με την επιδείνωσή της [17].
Μετά από 3 χρόνια η εκ’ των υστέρων ανάλυση της μελέτης ΤΝΤ έδειξε ότι η στατίνη μπορεί να προκαλέσει υποστροφή της χρόνιας νεφρικής νόσου (μέχρι και 10%) και να ελαττώσει τον ΚΑΚ σε διπλάσιο ποσοστό απ’ ότι σε άτομα που έχουν φυσιολογική νεφρική λειτουργία (32% έναντι 15%) [18] (εικόνα 14).

Εικόνα 14. ΤΝΤ-RenalFunction: Ελάττωση της καρδιαγγειακής νοσηρότητας-θνητότητας σε ασθενείς με χρόνια νεφρική νόσο διπλάσια από αυτή των ατόμων με φυσιολογική νεφρική λειτουργία [18].
2.4.5. Επεμβατική επαναιμάτωση, μεταβολικό σύνδρομο, αγγειακό εγκεφαλικό επεισόδιο, μη αλκοολική λιπώδης νόσος του ήπατος
Σε όλες αυτές τις καταστάσεις [19-21] η θεραπεία με στατίνες προσφέρει σημαντικά κλινικά οφέλη (Εικόνα 15).
Εικόνα 15. Πολλαπλά κλινικά οφέλη απο την θεραπεία με στατίνες σε όλο το φάσμα των παραγόντων κινδύνου των ασθενών.
2.5. Συμπεράσματα
Υπάρχουν αποδείξεις για σημαντικό κλινικό όφελος (ελάττωση των καρδιαγγειακών συμβαμάτων μέχρι 60%) με τη χρήση στατίνης σε ασθενείς με:
- Αρτηριακή υπέρταση
- Σακχαρώδη διαβήτη
- Οξέα στεφανιαία σύνδρομα
- Επεμβατική Επαναιμάτωση
- Χρόνια (σταθερή) Στεφανιαία Νόσο
- Χωρίς άλλους παράγοντες κινδύνου
- Με Σ. Διαβήτη
- Με μεταβολικό Σύνδρομο
- Με Χρόνια Νεφρική Νόσο
- Με Καρδιακή Ανεπάρκεια
- Γυναίκες και Άνδρες
- Αγγειακό Εγκεφαλικό Επεισόδιο
3. Άλλα υπολιπιδαιμικά φάρμακα για την επίτευξη των στόχων της LDLχοληστερόλης
Όπως ήδη αναφέρθηκε, ο ακρογωνιαίος λίθος της θεραπείας της δυσλιπιδαιμίας είναι οι στατίνες. Για την επίτευξη των στόχων της LDL χοληστερόλης συνιστάται η χορήγηση της μέγιστης ανεκτής δόσης ισχυρής στατίνης. Ωστόσο, με δεδομένους τους επιθετικούς στόχους της LDL χοληστερόλης, ορισμένοι ασθενείς δεν θα επιτύχουν τον στόχο με την μέγιστη ανεκτή δόση ισχυρής στατίνης. Σε αυτούς τους ασθενείς απαιτείται η προσθήκη δεύτερου υπολιπιδαιμικού φαρμάκου. Επίσης, ορισμένοι ασθενείς δεν μπορούν να ανεχθούν τις στατίνες διότι εμφανίζουν μυαλγίες ή αύξηση των τρανσαμινασών. Και σε αυτούς τους ασθενείς θα χρειαστεί προσθήκη δεύτερου υπολιπιδαιμικού φαρμάκου στην μέγιστη ανεκτή δόση στατίνης ή αν καμία στατίνη δεν είναι ανεκτή ακόμη και στην ελάχιστη δόση, μονοθεραπεία με άλλο υπολιπιδαιμικό φάρμακο [3,4].
Στις παραπάνω κατηγορίες ασθενών, οι θεραπευτικές επιλογές είναι οι εξής : α) προσθήκη ρητίνης δέσμευσης χολικών οξέων, β) προσθήκη νικοτινικού οξέος και γ) προσθήκη εζετιμίμπης.
3.1. Ρητίνες δέσμευσης χολικών οξέων
3.1.1. Μηχανισμός δράσης
Οι ρητίνες δέσμευσης χολικών οξέων δρουν δεσμεύοντας τα χολικά οξέα στο έντερο σχηματίζοντας αδιάλυτα σύμπλοκα που αποβάλλονται στα κόπρανα. Αυτό έχει ως συνέπεια τη διακοπή της εντεροηπατικής κυκλοφορίας των χολικών οξέων με αποτέλεσμα την ελάττωση της ηπατικής δεξαμενής χολικών οξέων που οδηγεί στην αυξημένη σύνθεση χολικών οξέων στο ήπαρ. Η τελευταία προκαλεί ελάττωση της συγκέντρωσης χοληστερόλης στο ηπατοκύτταρο με αποτέλεσμα την αυξημένη έκφραση των υποδοχέων της LDL στην επιφάνεια των ηπατοκυττάρων, την αυξημένη πρόσληψη LDL από την κυκλοφορία, με τελικό αποτέλεσμα την ελάττωση των συγκεντρώσεων της LDL χοληστερόλης στο αίμα [22,23].
3.1.2. Επίδραση στο λιπιδαιμικό προφίλ
Η κύρια ρητίνη δέσμευσης χολικών οξέων που χρησιμοποιείται στην Ελλάδα είναι η κολεσεβελάμη. Στη συνιστώμενη δόση (3,75 g ημερησίως), η κολεσεβελάμη ελαττώνει την LDL χοληστερόλη κατά 12-19% όταν χορηγείται ως μονοθεραπεία και κατά 9-16% όταν προστίθεται σε αγωγή με στατίνη. Παράλληλα, η κολεσεβελάμη προκαλεί μικρή αύξηση της HDL χοληστερόλης κατά 4-8%. Αντίθετα, η κολεσεβελάμη δεν μεταβάλλει τα τριγλυκερίδια σε ασθενείς με φυσιολογικά επίπεδα τριγλυκεριδίων ενώ σε ασθενείς με τριγλυκερίδια > 150 mg/dl και σε διαβητικούς ασθενείς αυξάνει τα τριγλυκερίδια κατά 18-21% [22,23].
3.1.3. Επίδραση σε άλλους παράγοντες καρδιαγγειακού κινδύνου
Σε ασθενείς με σακχαρώδη διαβήτη τύπου 2, η χορήγηση κολεσεβελάμης (3,75 g ημερησίως) ελαττώνει την HbA1c κατά 0,50%. Η ελάττωση αυτή είναι παρόμοια σε ασθενείς που λαμβάνουν μετφορμίνη, σουλφονυλουρίες ή ινσουλίνη και είναι μεγαλύτερη σε ασθενείς με HbA1c> 8%. Ο μηχανισμός με τον οποίο προκαλείται η ελάττωση της HbA1c με την κολεσεβελάμη δεν είναι γνωστός, ενδεχομένως οφείλεται σε αύξηση των επιπέδων των glucagon-likepeptide 1 (GLP-1) και glucose-dependentinsulinotropicpolypeptide (GIP) [22,23].
Η κολεσεβελάμη επίσης φαίνεται να ελαττώνει τα επίπεδα της hsCRP και άλλων δεικτών αρτηριακής φλεγμονής [22,23].
3.1.4. Επίδραση σε ενδιάμεσα τελικά σημεία και στα καρδιαγγειακά συμβάματα
Δεν υπάρχουν μελέτες επίδρασης της κολεσεβελάμης σε δείκτες υποκλινικής αθηροσκλήρωσης ή στα καρδιαγγειακά συμβάματα. Παλαιότερες μικρές μελέτες με άλλες ρητίνες δέσμευσης χολικών οξέων (χολεστυραμίνη, κολεστιπόλη) έδειξαν καθυστέρηση της εξέλιξης της αθηροσκλήρωσης των στεφανιαίων αρτηριών (όπως εκτιμήθηκε με στεφανιαία αγγειογραφία)[24,25]. Η μοναδική μελέτη που εκτίμησε την επίδραση των ρητινών δέσμευσης χολικών οξέων στα καρδιαγγειακά συμβάματα είναι η LipidResearchClinicsCoronaryPrimaryPreventionTrial [26]. Στην μελέτη αυτή, 3.806 άνδρες μέσης ηλικίας με πρωτοπαθή υπερχοληστερολαιμία και χωρίς εγκατεστημένη καρδιαγγειακή νόσο τυχαιοποιήθηκαν να λάβουν χολεστυραμίνη ή εικονικό φάρμακο. Μετά από μέσο διάστημα παρακολούθησης 7,4 ετών, η χολεστυραμίνη ελάττωσε τον κίνδυνο εμφάνισης του πρωτεύοντος καταληκτικού σημείου (θάνατος από στεφανιαία νόσο και μη θανατηφόρο έμφραγμα μυοκαρδίου) κατά 19% (p< 0,05) (Εικόνα 16). Διαπιστώθηκε επίσης ελάττωση του κινδύνου θανάτου από στεφανιαία νόσο κατά 24% και του κινδύνου μη θανατηφόρου εμφράγματος του μυοκαρδίου κατά 19% στους ασθενείς που έλαβαν χολεστυραμίνη. Επίσης ελαττώθηκε ο κίνδυνος θετικής δοκιμασίας κόπωσης, στηθάγχης και επέμβασης αορτοστεφανιαίας παράκαμψης κατά 25, 20 και 21% αντίστοιχα στους ασθενείς που έλαβαν χολεστυραμίνη. Ωστόσο, ηχολεστυραμίνηδενελάττωσετηνολικήθνησιμότητα. Επιπλέον, η μελέτη αυτή δημοσιεύτηκε το 1984, πριν την ευρεία εφαρμογή των στατινών στην κλινική πράξη, και δεν είναι σαφές αν τα ευρήματά της ισχύουν και στην σημερινή κλινική πράξη [26].

Εικόνα 16. LipidResearchClinicsCoronaryPrimaryPreventionTrial. Ελάττωση των καρδιαγγειακών συμβαμάτων με χορήγηση χολεστυραμίνης σε άνδρες με υπερχοληστερολαιμία και χωρίς εγκατεστημένη καρδιαγγειακή νόσο [26].
3.1.5. Ασφάλεια
Οι παλαιότερες ρητίνες δέσμευσης χολικών οξέων δεν ήταν καλά ανεκτές λόγω συχνών παρενεργειών από το γαστρεντερικό σύστημα (διάρροια, δυσκοιλιότητα, μετεωρισμός). Η κολεσεβελάμη φαίνεται να είναι καλύτερα ανεκτή, αλλά οι υπάρχουσες μελέτες είναι μικρής διάρκειας (ως 6 μήνες) και δεν είναι γνωστό αν η συμμόρφωση στην μακροχρόνια (ισόβια) αγωγή θα είναι εξίσου καλή στην καθημερινή κλινική πράξη [22,23].
Επειδή οι ρητίνες δέσμευσης χολικών οξέων μπορεί να προκαλέσουν αύξηση των τριγλυκεριδίων, θα πρέπει να χορηγούνται με προσοχή σε ασθενείς με τριγλυκερίδια > 300 mg/dl. Αντίθετα, δεν απαιτείται προσαρμογή της δόσης των φαρμάκων αυτών σε ασθενείς με επηρεασμένη νεφρική λειτουργία [22,23].
Τέλος, οι ρητίνες δέσμευσης χολικών οξέων δεσμεύουν άλλα φάρμακα όταν χορηγούνται ταυτόχρονα. Η κολεσεβελάμη φαίνεται να δεσμεύει άλλα φάρμακα λιγότερο από τις παλαιότερες ρητίνες, αλλά θα ήταν δόκιμο να χορηγείται τουλάχιστον 1 ώρα πριν ή τουλάχιστον 4 ώρες μετά από άλλα φάρμακα [22,23].
3.1.6. Δοσολογικό σχήμα
Το δοσολογικό σχήμα της κολεσεβελάμης είναι 6 δισκία των 625 mg μια φορά την ημέρα ή 3 δισκία δύο φορές την ημέρα.
3.2. Νικοτινικό οξύ
3.2.1. Μηχανισμός δράσης
Το νικοτινικό οξύ ελαττώνει τα τριγλυκερίδια ελαττώνοντας την παραγωγή VLDL από το ήπαρ (μέσω αναστολής της διακυλ-γλυκερόλης-ακυλ-τρανσφεράσης 2) και την παροχή ελεύθερων λιπαρών οξέων από το λιπώδη ιστό προς το ήπαρ (μέσω αναστολής της ορμονοευαίσθητης λιπάσης του λιπώδους ιστού). Η ελαττωμένη παραγωγή VLDL οδηγεί σε ελάττωση και των επιπέδων της LDL χοληστερόλης. Τέλος, το νικοτινικό οξύ αυξάνει τα επίπεδα της HDL χοληστερόλης κυρίως αυξάνοντας την σύνθεση της apoA1 στο ήπαρ [27].
3.2.2. Επίδραση στο λιπιδαιμικό προφίλ
Το νικοτινικό οξύ ασκεί ευμενή επίδραση σε όλες τις λιπιδαιμικές παραμέτρους. Σε γενικές γραμμές ισχύει ο κανόνας του 20%, δηλαδή το νικοτινικό οξύ ελαττώνει την LDL χοληστερόλη κατά 20%, αυξάνει την HDL χοληστερόλη κατά 20% και ελαττώνει τα τριγλυκερίδια κατά 20%. Πάντως, η ελάττωση των τριγλυκεριδίων συνήθως είναι μεγαλύτερη (25-30%)[27,28].
3.2.3. Επίδραση σε άλλους παράγοντες καρδιαγγειακού κινδύνου
Το νικοτινικό οξύ είναι το μοναδικό εγκεκριμένο υπολιπιδαιμικό φάρμακο που ελαττώνει τα επίπεδα της Lp(α), μιας αθηρογόνου λιποπρωτεΐνης, κατά 30%. Όπως και τα άλλα υπολιπιδαιμικά φάρμακα, το νικοτινικό οξύ ελαττώνει τα επίπεδα της hsCRP και άλλων δεικτών αρτηριακής φλεγμονής [27].
3.2.4. Επίδραση σε ενδιάμεσα τελικά σημεία και στα καρδιαγγειακά συμβάματα
Σε μικρές μελέτες, το νικοτινικό οξύ καθυστέρησε την εξέλιξη της αθηροσκλήρωσης των καρωτίδων (όπως εκτιμήθηκε με υπερηχογράφημα ή με μαγνητική αγγειογραφία) σε σύγκριση με το placeboσε ασθενείς που ήδη λάμβαναν στατίνη [29,30]. Στην μελέτη ARBITER 6-HALTS (ArterialBiologyfortheInvestigationoftheTreatmentEffectsofReducingCholesterol 6-HDLandLDLTreatmentStrategies) σε 208 ασθενείς με στεφανιαία νόσο ή ισοδύναμα που λάμβαναν στατίνη και είχαν LDL χοληστερόλη < 100 mg/dl, η προσθήκη νικοτινικού οξέος για 14 μήνες ελάττωσε το πάχος του έσω-μέσω χιτώνα των καρωτίδων ενώ η προσθήκη εζετιμίμπης δεν είχε σημαντική επίδραση [31].
Όσον αφορά την επίδραση του νικοτινικού οξέος στα καρδιαγγειακά συμβάματα, σε μια παλιά μελέτη, τηνCoronaryDrugProject, που συμπεριέλαβε 8.341 άνδρες με ιστορικό εμφράγματος, η χορήγηση νικοτινικού οξέος για 6,5 έτη ελάττωσε το θάνατο από καρδιαγγειακά αίτια και το μη θανατηφόρο έμφραγμα μυοκαρδίου κατά 14% σε σύγκριση με το placebo(Εικόνα 17) [32]. Ωστόσο, η μελέτη αυτή δημοσιεύτηκε το 1975, πριν την ευρεία εφαρμογή των στατινών στην κλινική πράξη, και δεν είναι σαφές αν τα ευρήματά της ισχύουν και στην σημερινή κλινική πράξη [32].
Εικόνα 17. CoronaryDrugProject. Ελάττωση των καρδιαγγειακών συμβαμάτων με χορήγηση νικοτινικού οξέος σε άνδρες με ιστορικό εμφράγματος [32].
ΠιοπρόσφαταδημοσιεύτηκαντααποτελέσματατηςμελέτηςAtherothrombosis Intervention in Metabolic Syndrome with Low HDL/High Triglycerides: Impact on Global Health Outcomes (AIM-HIGH) [33]. Στην μελέτη αυτή, 3.414 ασθενείς με εγκατεστημένη καρδιαγγειακή νόσο υπό αγωγή με σιμβαστατίνη και μέση τιμή LDL χοληστερόλης 76 mg/dl τυχαιοποιήθηκαν να λάβουν νικοτινικό οξύ 1,5-2 g ημερησίως ή placebo. Μετά από μέσο διάστημα παρακολούθησης 3 ετών, η μελέτη διακόπηκε πρόωρα γιατί ο κίνδυνος εμφάνισης του πρωτεύοντος καταληκτικού σημείου (θάνατος από στεφανιαία νόσο, μη θανατηφόρο έμφραγμα μυοκαρδίου, ισχαιμικό ΑΕΕ, νοσηλεία για οξύ στεφανιαίο σύμβαμα, στεφανιαία επαναιμάτωση, αγγειοπλαστική ή ενδαρτηρεκτομή καρωτίδων) δε διέφερε μεταξύ των ασθενών που έλαβαν νικοτινικό οξύ ή placebo(Εικόνα 18)[33]. Ωστόσο, η μελέτη AIM-HIGH είχε σημαντικούς περιορισμούς, καθώς περιέλαβε μικρό σχετικά αριθμό ασθενών και καταγράφηκε μικρός σχετικά αριθμός καρδιαγγειακών συμβαμάτων με αποτέλεσμα να μην έχει στατιστική ισχύ για να δείξει σημαντική διαφορά μεταξύ του νικοτινικού οξέος και του placebo στα καρδιαγγειακά συμβάματα. Πολύ πρόσφατα ανακοινώθηκε ότι σε μια πολύ μεγαλύτερη μελέτη, η HeartProtectionStudy 2 – TreatmentofHDLtoReducetheIncidenceofVascularEvents (HPS2-THRIVE), στην οποία συγκρίθηκε το νικοτινικό οξύ (σε συνδυασμό με λαροπιπράντη)με placebo σε 25.673 ασθενείς με εγκατεστημένη καρδιαγγειακή νόσο υπό αγωγή με στατίνη, δε διαπιστώθηκε ελάττωση του πρωτεύοντος τελικού σημείου (θάνατος από στεφανιαία νόσο, μη θανατηφόρο EM, ισχαιμικό ΑΕΕ, στεφανιαία επαναιμάτωση) στους ασθενείς που έλαβαν νικοτινικό οξύ [34].

Εικόνα 18. Μελέτη ΑΙΜ-HIGH. Μη υπεροχή του συνδυασμού στατίνης-νικοτινικού έναντι της μονοθεραπείας με στατίνη σε ασθενείς με εγκατεστημένη καρδιαγγειακή νόσο [33].
3.2.5. Ασφάλεια
Η συχνότερη ανεπιθύμητη ενέργεια του νικοτινικού οξέος είναι η έξαψη (flushing) που οφείλεται στην παραγωγή προσταγλανδίνης D2 από τα κύτταρα του Langerhans στο δέρμα, η οποία προκαλεί αγγειοδιαστολή στα αγγεία του δέρματος. Το σκεύασμα νικοτινικού οξέος που κυκλοφορεί στην Ελλάδα περιέχει νικοτινικό οξύ σε συνδυασμό με λαροπιπράντη, η οποία αναστέλλει τον υποδοχέα της προσταγλανδίνης D2. Αποτέλεσμα είναι η ελάττωση της συχνότητας της έξαψης [28].
Άλλες ανεπιθύμητες ενέργειες του νικοτινικού οξέος είναι διαταραχές από το γαστρεντερικό σύστημα, μυοπάθεια (μυϊκοί πόνοι, αύξηση CPK) και αύξηση των τρανσαμινασών. Επίσης, το νικοτινικό οξύ αυξάνει τα επίπεδα του ουρικού οξέος (περίπου κατά 14,7%), της γλυκόζης (περίπου κατά 4 mg/dl) και της HbA1c(περίπου κατά 0,2%). Τέλος, το νικοτινικό οξύ θα πρέπει να χορηγείται με προσοχή σε ασθενείς με χρόνια νεφρική νόσο και αντενδείκνυται σε ασθενείς με ενεργό πεπτικό έλκος [27].
3.2.6. Δοσολογικό σχήμα
Συνιστάται η χορήγηση ενός δισκίου ημερησίως για 1 μήνα. Στην συνέχεια, συνιστάται η χορήγηση δύο δισκίων ημερησίως. Τα δισκία θα πρέπει να λαμβάνονται ολόκληρα, μαζί με τροφή, το βράδυ ή πριν την κατάκλιση. Θα πρέπει να αποφεύγεται η λήψη οινοπνεύματος, καυτών ροφημάτων ή πικάντικων τροφών κατά την ώρα λήψης του νικοτινικού οξέος.
3.3. Εζετιμίμπη
3.3.1. Μηχανισμός δράσης
Η εζετιμίμπη ελαττώνει τα επίπεδα της LDL χοληστερόλης ελαττώνοντας την απορρόφηση της χοληστερόλης από το λεπτό έντερο μέσω αναστολής του υποδοχέα NiemannPickC1-like1 [35].
3.3.2. Επίδραση στο λιπιδαιμικό προφίλ
Η προσθήκη εζετιμίμπης σε στατίνη ελαττώνει την LDL χοληστερόλη κατά 24% ενώ ως μονοθεραπεία η εζετιμίμπη ελαττώνει την LDL χοληστερόλη κατά 19%. Η εζετιμίμπη έχει αμελητέα επίδραση στην HDL χοληστερόλη και στα τριγλυκερίδια [36].
3.3.3. Επίδραση σε άλλους παράγοντες καρδιαγγειακού κινδύνου
Όπως και τα άλλα υπολιπιδαιμικά φάρμακα, η εζετιμίμπη ελαττώνει τα επίπεδα της hsCRP και άλλων δεικτών αρτηριακής φλεγμονής [35].
3.3.4. Επίδραση σε ενδιάμεσα τελικά σημεία και στα καρδιαγγειακά συμβάματα
Στην μελέτη EzetimibeandSimvastatininHypercholesterolemiaEnhancesAtherosclerosisRegression (ENHANCE), ο συνδυασμός εζετιμίμπης και σιμβαστατίνης δεν ελάττωσε το πάχους του έσω-μέσου χιτώνα των καρωτίδων περισσότερο από την μονοθεραπεία με σιμβαστατίνη [37]. Όπως ήδη αναφέρθηκε, στην μελέτη ARBITER 6-HALTS η προσθήκη νικοτινικού οξέος για 14 μήνες ελάττωσε το πάχος του έσω-μέσω χιτώνα των καρωτίδων ενώ η προσθήκη εζετιμίμπης δεν είχε σημαντική επίδραση [31].
Όσον αφορά την επίδραση της εζετιμίμπης στα καρδιαγγειακά συμβάματα, στην μελέτη SimvastatinandEzetimibeinAorticStenosis (SEAS),που συμπεριέλαβε 1.873ασθενείς με ασυμπτωματική στένωση της αορτικής βαλβίδας, ο συνδυασμός σιμβαστατίνης και εζετιμίμπης δεν ελάττωσε σημαντικά την εμφάνιση του πρωτεύοντος καταληκτικού σημείου (θάνατος από καρδιαγγειακά αίτια, αντικατάσταση αορτικής βαλβίδας, μη θανατηφόρο έμφραγμα, ισχαιμικό ΑΕΕ, νοσηλεία για ασταθή στηθάγχη, καρδιακή ανεπάρκεια, στεφανιαία επαναιμάτωση) σε σύγκριση με το placebo μετά από 52 μήνες παρακολούθησης [38]. Πιο πρόσφατα, στην μελέτη StudyofHeartandRenalProtection (SHARP), που συμπεριέλαβε 9.270 ασθενείς με χρόνια νεφρική νόσο, ο συνδυασμός σιμβαστατίνης και εζετιμίμπης ελάττωσε σημαντικά την εμφάνιση του πρωτεύοντος καταληκτικού σημείου (θάνατος από στεφανιαία νόσο, μη θανατηφόρο έμφραγμα, ισχαιμικό ΑΕΕ, στεφανιαία επαναιμάτωση) σε σύγκριση με το placebo μετά από 4,9 έτη παρακολούθησης (Εικόνα 19) [39]. Ωστόσο, δεν είναι σαφές αν το όφελος στην συγκεκριμένη μελέτη προήλθε μόνο από την χορήγηση της σιμβαστατίνης ή αν η εζετιμίμπη συνέβαλε στην ελάττωση των καρδιαγγειακών συμβαμάτων. Με άλλα λόγια, δεν είναι γνωστό αν για την ίδια ελάττωση της LDL χοληστερόλης, η εζετιμίμπη ελαττώνει τα καρδιαγγειακά συμβάματα εξίσου με τις στατίνες. Το ερώτημα αυτό ενδεχομένως να απαντηθεί από την μελέτη IMPROVE-IT, στην οποία 18.141 ασθενείς με οξύ στεφανιαίο σύμβαμα έχουν τυχαιοποιηθεί να λάβουν σιμβαστατίνη σε συνδυασμό με εζετιμίμπη ή με placebo. Η μελέτη έχει ολοκληρώσει την ένταξη ασθενών και αναμένονται τα αποτελέσματά της [40].

Εικόνα 19. Μελέτη SHARP. Ελάττωση των καρδιαγγειακών συμβαμάτων με τον συνδυασμό σιμβαστατίνης-εζετιμίμπης έναντι placebo σε ασθενείς με χρόνια νεφρική νόσο [39].
3.3.5. Ασφάλεια
Η εζετιμίμπη είναι γενικά καλά ανεκτή και δεν έχει σημαντικές ανεπιθύμητες ενέργειες.Ενδεχομένως μπορούν να εμφανιστούν παρενέργειες από το γαστρεντερικό σύστημα και αύξηση των τρανσαμινασών. Δεν χρειάζεται τροποποίηση της δόσης της εζετιμίμπης σε ασθενείς με χρόνια νεφρική νόσο.
3.3.6. Δοσολογικό σχήμα
Η συνιστώμενη δόση είναι 1 δισκίο ημερησίως,οποιαδήποτε ώρα της ημέρας, με ή χωρίς τροφή.
3.4. Συμπεράσματα
Όπως φαίνεται από τα παραπάνω, σε ασθενείς που δεν επιτυγχάνουν τον στόχο της LDL χοληστερόλης με την μέγιστη ανεκτή δόση στατίνης ή σε ασθενείς με δυσανεξία ακόμη και στην ελάχιστη δόση διαφορετικών στατινών, οι διαθέσιμες επιλογές (προσθήκη κολεσεβελάμης, νικοτινικού οξέος ή εζετιμίμπης) έχουν περιορισμένα στοιχεία για την επίδρασή τους στα καρδιαγγειακά συμβάματα. Οι τρέχουσες κατευθυντήριες οδηγίες προτείνουν και τα τρία φάρμακα χωρίς να τα ιεραρχούν [3,4]. Με δεδομένη την έλλειψη στοιχείων, γίνεται ακόμη πιο εμφανής η σημασία της χορήγησης της μέγιστης ανεκτής δόσης ισχυρών στατινών για την επίτευξη των στόχων της LDL χοληστερόλης, καθώς οι στατίνες στις δόσεις αυτές έχουν αποδείξει πέραν κάθε αμφιβολίας την ασφάλειά τους και την αποτελεσματικότητά τους στην ελάττωση των καρδιαγγειακών συμβαμάτων. Μόνο σε ασθενείς που δεν επιτυγχάνουν τον στόχο της LDL χοληστερόλης με την μέγιστη ανεκτή δόση ισχυρής στατίνης ή σε ασθενείς που δεν ανέχονται ακόμη και την ελάχιστη δόση διαφορετικών στατινών θα πρέπει να χορηγούνται επιπλέον φάρμακα (κολεσεβελάμη, νικοτινικό οξύ ή εζετιμίμπη) για την επίτευξη των στόχων της LDL χοληστερόλης.
4. Άλλα υπολιπιδαιμικάφάρμακαγιατηνεπίτευξητωνστόχωντηςnon–HDLχοληστερόλης
Όπως ήδη αναφέρθηκε, ο ακρογωνιαίος λίθος της θεραπείας της δυσλιπιδαιμίας είναι οι στατίνες. Για την επίτευξη των στόχων της LDL χοληστερόλης συνιστάται η χορήγηση της μέγιστης ανεκτής δόσης ισχυρής στατίνης. Ωστόσο, σε ασθενείς υψηλού καρδιαγγειακού κινδύνου (Πίνακας 2), αν μετά την επίτευξη του στόχου της LDL χοληστερόλης με μονοθεραπεία με στατίνη τα τριγλυκερίδια είναι > 200 mg/dl, δευτερεύων στόχος της υπολιπιδαιμικής αγωγής είναι η non-HDL χοληστερόλη < 100 mg/dl (ολική χοληστερόλη – HDL χοληστερόλη) [3,4]. Αυτό συμβαίνει διότι η non-HDL χοληστερόλη αντικατοπτρίζει το σύνολο των κυκλοφορούντων αθηρογόνων λιποπρωτεϊνών (LDL, IDL, VLDL). Τα αυξημένα επίπεδα non-HDL χοληστερόλης αποτελούν ανεξάρτητο παράγοντα καρδιαγγειακού κινδύνου (δηλαδή ακόμη και όταν ληφθούν υπόψη τα επίπεδα της LDL χοληστερόλης)[41]. Με άλλα λόγια, οι ασθενείς υψηλού καρδιαγγειακού κινδύνου, ακόμα και μετά την επίτευξη των στόχων της LDL χοληστερόλης με χορήγηση στατίνης, εξακολουθούν να έχουν σημαντικό κίνδυνο για καρδιαγγειακά συμβάματα (υπολειπόμενος καρδιαγγειακός κίνδυνος), και σε αυτόν τον υπολειπόμενο κίνδυνο συμβάλλουν τα αυξημένα επίπεδα non-HDL χοληστερόλης (Εικόνα 20).
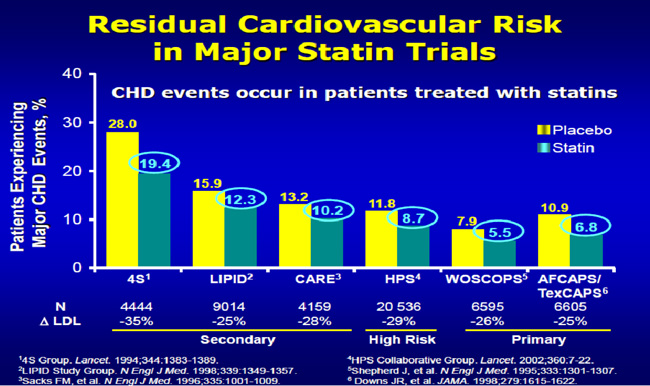
Εικόνα 20. Υπολειπόμενος καρδιαγγειακός κίνδυνος σε ασθενείς που λαμβάνουν στατίνη.
Στους παραπάνω ασθενείς, οι θεραπευτικές επιλογές είναι οι εξής : α) προσθήκη στην στατίνη φιβράτης, β) προσθήκη στην στατίνη ω-3 λιπαρών οξέων και γ) προσθήκη στην στατίνη νικοτινικού οξέος. Για το νικοτινικό οξύ έχει ήδη γίνει αναφορά στην προηγούμενη ενότητα.
4.1. Φιβράτες
4.1.1. Μηχανισμός δράσης
Οι φιβράτες είναι αγωνιστές των υποδοχέων peroxisomeproliferator-activatedreceptor-α (PPARα), η ενεργοποίηση των οποίων ρυθμίζει την μεταγραφή διαφόρων γονιδίων που εμπλέκονται στον μεταβολισμό των λιπιδίων [42].
4.1.2. Επίδραση στο λιπιδαιμικό προφίλ
Οι φιβράτες ελαττώνουν τα τριγλυκερίδια κατά 20-50% και αυξάνουν την HDLχοληστερόλη κατά 10-35%. Οι φιβράτες επίσης ελαττώνουν την LDL χοληστερόλη κατά 5-20% αλλά σε ασθενείς με τριγλυκερίδια > 400 mg/dl μπορεί να προκαλέσουν αύξηση της LDL χοληστερόλης κατά 10-15% [42].
4.1.3. Επίδραση σε άλλους παράγοντες καρδιαγγειακού κινδύνου
Η φενοφιβράτη είναι η μόνη φιβράτη που ελαττώνει τα επίπεδα του ουρικού οξέος. Όπως και τα υπόλοιπα υπολιπιδαιμικά φάρμακα, οι φιβράτες ελαττώνουν τα επίπεδα της hsCRP και άλλων δεικτών αρτηριακής φλεγμονής [42].
Αντίθετα, όλες οι φιβράτες αυξάνουν την κρεατινίνη ορού αλλά δεν είναι σαφές αν αυτή η αύξηση αντικατοπτρίζει έκπτωση της νεφρικής λειτουργίας ή οφείλεται σε αυξημένη παραγωγή κρεατινίνης ή σε άλλο μηχανισμό [42].
4.1.4. Επίδραση στα καρδιαγγειακά συμβάματα
Αρκετές παλιές μελέτες εκτίμησαν την επίδραση της μονοθεραπείας με φιβράτες στα καρδιαγγειακά συμβάματα. Στην μελέτη HelsinkiHeartStudy σε 4.081 άνδρες χωρίς εγκατεστημένη καρδιαγγειακή νόσο και στην μελέτη VeteranAffairsHighDensityLipoproteinCholesterolInterventionTrial (VA-HIT) σε 2.531 άνδρες με στεφανιαία νόσο, η μονοθεραπεία με γεμφιβροζίλη ελάττωσε σημαντικά τα καρδιαγγειακά συμβάματα σε σύγκριση με το placebo [43,44]. Αντίθετα, στην μελέτη BezafibrateInfarctPrevention (BIP) σε 3.090 ασθενείς με στεφανιαία νόσο, η μονοθεραπεία με μπεζαφιβράτη δεν ελάττωσε τα καρδιαγγειακά συμβάματα περισσότερο από το placebo [45]. Επίσης, στην πιο πρόσφατη μελέτη FenofibrateInterventionandEventLoweringinDiabetes (FIELD) σε 9.795 ασθενείς με σακχαρώδη διαβήτη τύπου 2, η μονοθεραπεία με φενοφιβράτη δεν ελάττωσε τα καρδιαγγειακά συμβάματα περισσότερο από το placebo(Εικόνα 21) [46].
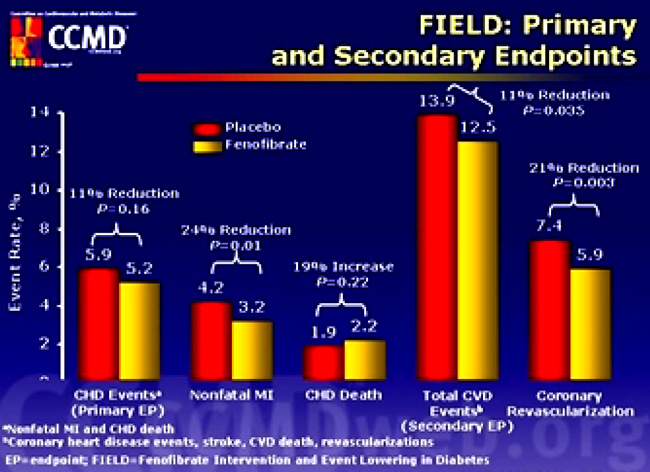
Εικόνα 21. Μελέτη FIELD.Η μονοθεραπεία με φενοφιβράτη δεν ελάττωσε τα καρδιαγγειακά συμβάματα περισσότερο από το placeboσε ασθενείς με σακχαρώδη διαβήτη τύπου 2 [46].
Ωστόσο, όλες οι παραπάνω μελέτες εκτίμησαν την επίδραση της μονοθεραπείας με φιβράτη στα καρδιαγγειακά συμβάματα. Η μοναδική μελέτη που εκτίμησε την επίδραση του συνδυασμού φιβράτης και στατίνης στα καρδιαγγειακά συμβάματα είναι η μελέτη ActiontoControlCardiovascularRiskinDiabetes (ACCORD). Στην μελέτη αυτή, 5.518 ασθενείς με σακχαρώδη διαβήτη τύπου 2 τυχαιοποιήθηκαν να λάβουν σιμβαστατίνη σε συνδυασμό με φενοφιβράτη ή placebo. Μετά από 4,7 έτη παρακολούθησης, η συχνότητα εμφάνισης του πρωτεύοντος καταληκτικού σημείου (θάνατος από καρδιαγγειακά αίτια, μη θανατηφόρο έμφραγμα, ισχαιμικό ΑΕΕ) δε διέφερε μεταξύ των δύο ομάδων (Εικόνα 22) [47]. Ωστόσο, και στις 3 παραπάνω μελέτες που δεν έδειξαν σημαντική ελάττωση των καρδιαγγειακών συμβαμάτων με φιβράτες (BIP, FIELD και ACCORD), στην υποομάδα των ασθενών με αυξημένα τριγλυκερίδια (>200 mg/dl) διαπιστώθηκε ελάττωση των καρδιαγγειακών συμβαμάτων με τη χορήγηση φιβράτης. Ωστόσο, τα αποτελέσματα αυτών των αναλύσεων υποομάδων θα πρέπει να αντιμετωπίζονται με επιφύλαξη.

Εικόνα 22. Μελέτη ACCORD.Ο συνδυασμός σιμβαστατίνης και φενοφιβράτης δεν ελάττωσε τα καρδιαγγειακά συμβάματα περισσότερο από τον συνδυασμό σιμβαστατίνης και placeboσε ασθενείς με σακχαρώδη διαβήτη τύπου 2 [47].
4.1.5. Ασφάλεια
Οι κύριες ανεπιθύμητες ενέργειες των φιβρατών είναι από το γαστρεντερικό σύστημα, μυοπάθεια και αύξηση των τρανσαμινασών. Θα πρέπει να τονιστεί ότι ο συνδυασμός γεμφιβροζίλης με οποιαδήποτε στατίνη αντενδείκνυται απόλυτα γιατί αυξάνει σημαντικά τον κίνδυνο ραβδομυόλυσης. Αντίθετα, ο συνδυασμός φενοφιβράτης με στατίνη είναι ασφαλής, όπως φάνηκε στην μελέτη ACCORD, στην οποία η συχνότητα αύξησης των τρανσαμινασών και της CPK ήταν παρόμοια στους ασθενείς που έλαβαν σιμβαστατίνη και φενοφιβράτη και στους ασθενείς που έλαβαν σιμβαστατίνη και placebo [47].
Όπως ήδη αναφέρθηκε, όλες οι φιβράτες προκαλούν αύξηση της κρεατινίνης. Επιπλέον, η φενοφιβράτη αντενδείκνυται σε ασθενείς με ρυθμό σπειραματικής διήθησης < 50 ml/min. Η γεμφιβροζίλη μπορεί να χορηγηθεί σε μειωμένη δόση (1 δισκίο των 600 mg μια φορά την ημέρα) σε ασθενείς με ρυθμό σπειραματικής διήθησης 30-60 ml/min αλλά αντενδείκνυται σε ασθενείς με ρυθμό σπειραματικής διήθησης <30 ml/min. Ωστόσο, όπως ήδη αναφέρθηκε, αντενδείκνυται απόλυτα ο συνδυασμός γεμφιβροζίλης με οποιαδήποτε στατίνη λόγω του κινδύνου ραβδομυόλυσης.
4.1.6. Δοσολογικό σχήμα
Το δοσολογικό σχήμα της φενοφιβράτης είναι 1 δισκίοτων 200 mgμια φορά την ημέρα.Το δοσολογικό σχήμα της γεμφιβροζίλης είναι 1 δισκίο των 600 mgδύο φορές την ημέρα.
4.2. ω-3 λιπαρά οξέα
4.2.1. Μηχανισμός δράσης
Τα ω-3 λιπαρά οξέα είναι το εικοσαπεντανοϊκό και τα δοκοσαεξανοϊκό οξύ. Ο μηχανισμός δράσης τους δεν είναι πλήρως διευκρινισμένος αλλά φαίνεται ότι δρουν μέσω αλληλεπίδρασης με τους υποδοχείς PPAR και μέσω ελάττωσης της σύνθεσης της apoB [48].
4.2.2. Επίδραση στο λιπιδαιμικό προφίλ
Τα ω-3 λιπαρά οξέα σε δόση 4g ημερησίως ελαττώνουν τα τριγλυκερίδια περίπου κατά 30%. Αντίθετα, η επίδραση των ω-3 λιπαρών οξέων στην LDL και την HDL χοληστερόλη είναι αμελητέα [48].
4.2.3. Επίδραση σε άλλους παράγοντες καρδιαγγειακού κινδύνου
Όπως και τα υπόλοιπα υπολιπιδαιμικά φάρμακα, τα ω-3 λιπαρά οξέα ελαττώνουν τα επίπεδα της hsCRP και άλλων δεικτών αρτηριακής φλεγμονής [48]. Τα ω-3 λιπαρά οξέα φαίνεται επίσης να ασκούν αντιαρρυθμικές δράσεις και ελάττωσαν τον κίνδυνο αιφνίδιου θανάτου σε ασθενείς με στεφανιαία νόσο [48,49].
4.2.4. Επίδραση σε ενδιάμεσα τελικά σημεία και στα καρδιαγγειακά συμβάματα
Λίγες και μικρές μελέτες κατέληξαν σε αντικρουόμενα αποτελέσματα όσον αφορά την επίδραση των ω-3 λιπαρών οξέων στην αθηροσκλήρωση των καρωτίδων και των στεφανιαίων αρτηριών (ελάττωση ή καμία επίδραση)[48]. Όσον αφορά την επίδραση των ω-3 λιπαρών οξέων στα καρδιαγγειακά συμβάματα, αυτή εκτιμήθηκε μόνο στην μελέτη JapanEPALipidInterventionStudy (JELIS), στην οποία 18.645 Ιάπωνες με ολική χοληστερόλη >250 mg/dl τυχαιοποιήθηκαν να λάβουν στατίνη σε συνδυασμό με εικοσαπεντανοϊκό οξύ 1,8 g ημερησίως ή στατίνη σε συνδυασμό με placebo [50]. Μετά από 4,6 έτη παρακολούθησης, η χορήγηση εικοσαπεντανοϊκού οξέος ελάττωσε το πρωτεύον καταληκτικό σημείο (αιφνίδιος καρδιακός θάνατος, έμφραγμα, ασταθής στηθάγχη, στεφανιαία επαναιμάτωση) κατά 19% (p = 0,011)(Εικόνα 23)[50]. Ωστόσο, δεν είναι σαφές αν τα αποτελέσματα αυτής της μελέτης ισχύουν και σε Καυκάσιους. Θα πρέπει να αναφερθεί ότι τα ω-3 λιπαρά οξέα σε μικρή δόση (1 g ημερησίως) έχουν δείξει ελάττωση της ολικής και καρδιαγγειακής θνησιμότητας σε ασθενείς με έμφραγμα του μυοκαρδίου ή με καρδιακή ανεπάρκεια, ενδεχομένως λόγω ελάττωσης του αιφνίδιου θανάτου μέσω των αντιαρρυθμικών δράσεων τους[49,51]. Αντίθετα, μια πολύ πρόσφατη μελέτη δεν έδειξε ελάττωση των καρδιαγγειακών συμβαμάτων σε ασθενείς με διαταραχή γλυκόζης νηστείας με την ίδια δόση ω-3 λιπαρών οξέων (1 g ημερησίως) [52].

Εικόνα 23. Μελέτη JELIS.Το εικοσαπεντανοϊκό οξύ ελάττωσε τα καρδιαγγειακά συμβάματα περισσότερο από το placeboσε Ιάπωνες ασθενείς με υπερχοληστερολαιμία [50].
4.2.5. Ασφάλεια
Τα ω-3 λιπαρά οξέα είναι γενικά καλά ανεκτά και δεν έχουν σημαντικές ανεπιθύμητες ενέργειες, εκτός από διαταραχές από το γαστρεντερικό σύστημα. Μπορούν επίσης να χορηγηθούν σε ασθενείς με χρόνια νεφρική νόσο χωρίς να απαιτείται τροποποίηση της δόσης τους.
4.2.6. Δοσολογικό σχήμα
Το δοσολογικό σχήμα των ω-3 λιπαρών οξέωνγια την αντιμετώπιση της υπερτριγλυκεριδαιμίας είναι 2 ως 4 g ημερησίως σε δύο δόσεις. Η μέγιστη ελάττωση των τριγλυκεριδίων επιτυγχάνεται με την χορήγηση 4 g ημερησίως. Ενδείκνυνται επίσης σε δόση 1 g ημερησίως σε ασθενείς με έμφραγμα μυοκαρδίου.
1.3. Συμπεράσματα
Όπως φαίνεται από τα παραπάνω, σε ασθενείς υψηλού καρδιαγγειακού κινδύνου που έχουν τριγλυκερίδια > 200 mg/dl μετά την επίτευξη του στόχου της LDL χοληστερόλης με στατίνη, οι διαθέσιμες επιλογές (προσθήκη στην στατίνη φενοφιβράτης, νικοτινικού οξέος ή ω-3 λιπαρών οξέων) έχουν περιορισμένα στοιχεία για την επίδρασή τους στα καρδιαγγειακά συμβάματα. Οι τρέχουσες κατευθυντήριες οδηγίες προτείνουν και τα τρία φάρμακα χωρίς να τα ιεραρχούν [3,4]. Η επιλογή θα πρέπει να εξατομικεύεται λαμβάνοντας υπόψη τα συνοδά νοσήματα (π.χ. χρόνια νεφρική νόσος), την ασφάλεια και το κόστος.
5. Αντιμετώπιση των ασθενών με τριγλυκερίδια> 450 mg/dl
Όπως ήδη αναφέρθηκε, σε όλους τους ασθενείς ο στόχος της υπολιπιδαιμικής αγωγής είναι η LDL χοληστερόλη και το φάρμακο εκλογής για την επίτευξη του στόχου της LDL είναι οι στατίνες. Μοναδική εξαίρεση σε αυτόν τον κανόνα αποτελούν οι ασθενείς με τριγλυκερίδια > 450 mg/dl. Στους ασθενείς αυτούς, ο στόχος της υπολιπιδαιμικής αγωγής είναι τα τριγλυκερίδια και φάρμακο εκλογής είναι οι φιβράτες. Αυτό συμβαίνει διότι οι ασθενείς αυτοί διατρέχουν άμεσο κίνδυνο παγκρεατίτιδας. Δεύτερη επιλογή είναι η χορήγηση νικοτινικού οξέος ή ω-3 λιπαρών οξέων. Επιβάλλεται επίσης η αποχή από το αλκοόλ, η απώλεια βάρους και σε ασθενείς με σακχαρώδη διαβήτη η βελτιστοποίηση του γλυκαιμικού ελέγχου.
6. Τελικά συμπεράσματα
Τα αυξημένα επίπεδα LDL χοληστερόλης αποτελούν μείζονα παράγοντα καρδιαγγειακού κινδύνου και η ελάττωσή τους με στατίνες ελαττώνει την καρδιαγγειακή νοσηρότητα και θνησιμότητα τόσο σε ασθενείς με εγκατεστημένη καρδιαγγειακή νόσο όσο και σε άτομα χωρίς καρδιαγγειακή νόσο. Επομένως, σε όλους τους ασθενείς ο στόχος της υπολιπιδαιμικής αγωγής είναι η LDL χοληστερόλη και το φάρμακο εκλογής για την επίτευξη του στόχου της LDL χοληστερόλης είναι οι στατίνες. Πρέπει να τονιστεί και πάλι ότι ο στόχος της LDL χοληστερόλης δεν είναι ο ίδιος για όλους τα άτομα αλλά εξαρτάται από τον καρδιαγγειακό κίνδυνο και είναι τόσο χαμηλότερος όσο μεγαλύτερος είναι ο κίνδυνος. Ασθενείς με εγκατεστημένη καρδιαγγειακή νόσο, σακχαρώδη διαβήτη ή χρόνια νεφρική νόσο είναι υψηλού κινδύνου και ο στόχος της LDL χοληστερόλης είναι < 70 mg/dl. Σε όλα τα άλλα άτομα επιβάλλεται ο προσδιορισμός του συνολικού καρδιαγγειακού κινδύνου με τον κατάλληλο αλγόριθμο (Framingham ή SCORE), καθώς αυτός θα καθορίσει και τον στόχο της LDLχοληστερόλης.
Εκτός από την LDL χοληστερόλη, η non-HDL χοληστερόλη επίσης αυξάνει τον καρδιαγγειακό κίνδυνο ενώ η HDL χοληστερόλη ασκεί αντιαθηρογόνες δράσεις. Τα αυξημένα επίπεδα non-HDL χοληστερόλης και τα χαμηλά επίπεδα HDL χοληστερόλης συμβάλλουν στον υπολειπόμενο καρδιαγγειακό κίνδυνο, δηλαδή τον κίνδυνο που εξακολουθούν να διατρέχουν οι ασθενείς μετά την επίτευξη των στόχων της LDL χοληστερόλης με χορήγηση στατίνης. Συνεπώς, σε υψηλού καρδιαγγειακού κινδύνου ασθενείς που έχουν τριγλυκερίδια > 200 mg/dl μετά την επίτευξη του στόχου της LDL χοληστερόλης με στατίνη, δευτερεύων στόχος της υπολιπιδαιμικής αγωγής είναι επίπεδα non-HDL χοληστερόλης < 100 mg/dl και οι επιλογές περιλαμβάνουν την προσθήκη στη στατίνη φενοφιβράτης, νικοτινικού οξέος ή ω-3 λιπαρών οξέων.
Τέλος, μοναδική εξαίρεση στα παραπάνω είναι ασθενείς με τριγλυκερίδια > 450 mg/dl, στους οποίους λόγω του κινδύνου παγκρεατίτιδας στόχος της υπολιπιδαιμικής αγωγής είναι τα τριγλυκερίδια και φάρμακο εκλογής είναι οι φιβράτες.
Βιβλιογραφία
1. ‘Αθυρος Β, Κοντόπουλος Α. Διαταραχές του μεταβολισμού των λιποπρωτεϊνών. Από τη δυσλιπιδαιμία στην αθηροσκλήρωση.Θεσσαλονίκη, UniversityStudioPress, 1998.
2. ExpertPanelonDetectionEvaluationandTreatmentofHighBloodCholesterolinAdultsExecutiveSummaryoftheThirdReport of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) JAMA 2001;285:2486-97.
3. Ελισάφ M, Πίτσαβος X, Λυμπερόπουλος E, Άθυρος B. Κατευθυντήριες οδηγίες της Ελληνικής Εταιρείας Αθηροσκλήρωσης για τη διάγνωση και αντιμετώπιση των δυσλιπιδαιμιών. ΕλληνικήΕπιθεώρησηΑθηροσκλήρωσης 2011;2:163-8.
4. Reiner Z, Catapano AL, De Backer G. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS) Eur Heart J 2011;32:1769-818.
5. Ridker PM, Danielson E, Fonseca FA. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008;359:2195-207.
6. Scandinavian Simvastatin Survival Study Group Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S) Lancet 1994;344:1383-9.
7. Sacks FM, Pfeffer MA, Moye LA. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators. N Engl J Med 1996;335:1001-9.
8. The Long-Term Intervention with Pravastatin in Ischaemic Disease Study Group Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998;339:1349-57.
9. Heart Protection Study Collaborative Group MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002;360:7-22.
10. Athyros VG, Papageorgiou AA, Mercouris BR. Treatment with atorvastatin to the National Cholesterol Educational Program goal versus ‘usual’ care in secondary coronary heart disease prevention. The GREek Atorvastatin and Coronary-heart-disease Evaluation (GREACE) study. Curr Med Res Opin2002;18:220-8.
11. LaRosa JC, Grundy SM, Waters DD. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352:1425-35.
12. Neaton JD, Wentworth D. Serum cholesterol, blood pressure, cigarette smoking, and death from coronary heart disease. Overall findings and differences by age for 316,099 white men. Multiple Risk Factor Intervention Trial Research Group. Arch Intern Med 1992;152:56-64.
13. Sever PS, Dahlöf B, Poulter NR, et al; ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial–Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003;361:1149-58.
14. Colhoun HM, Betteridge DJ, Durrington PN, Hitman GA, Neil HA, Livingstone SJ, Thomason MJ, Mackness MI, Charlton-Menys V, Fuller JH; CARDS investigators. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004;364:685-96.
15. Cannon CP, Braunwald E, McCabe CH. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004;350:1495-504.
16. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351:1296-305.
17. Athyros VG, Mikhailidis DP, Papageorgiou AA, et al. The effect of statins versus untreated dyslipidaemia on renal function in patients with coronary heart disease. A subgroup analysis of the Greek atorvastatin and coronary heart disease evaluation (GREACE) study.J Clin Pathol 2004;57:728-34.
18. Shepherd J, Kastelein JJ, Bittner V; Treating to New Targets Investigators. Effect of intensive lipid lowering with atorvastatin on renal function in patients with coronary heart disease: the Treating to New Targets (TNT) study. Clin J Am Soc Nephrol 2007;2:1131-9.
19. Pasceri V, Patti G, Nusca A, Pristipino C, Richichi G, Di Sciascio G; ARMYDA Investigators. Randomized trial of atorvastatin for reduction of myocardial damage during coronary intervention: results from the ARMYDA (Atorvastatin for Reduction of MYocardial Damage during Angioplasty) study. Circulation 2004;110:674-8.
20. Amarenco P, Bogousslavsky J, Callahan A 3rd, et al; Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355:549-59.
21. AthyrosVG, TziomalosK, GossiosTD, etal; GREACEStudyCollaborativeGroup. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis. Lancet 2010;376:1916-22.
22. Tziomalos K, Karagiannis A, Mikhailidis DP, Athyros VG. Colesevelam: A new and improved bile acid sequestrant? Curr Pharm Des in press.
23. Florentin M, Liberopoulos EN, Mikhailidis DP, Elisaf MS. Colesevelam hydrochloride in clinical practice: a new approach in the treatment of hypercholesterolaemia. Curr Med Res Opin2008;24:995-1009.
24. Brensike JF, Levy RI, Kelsey SF,et al. Effects of therapy with cholestyramine on progression of coronary arteriosclerosis: results of the NHLBI Type II Coronary Intervention Study. Circulation 1984;69:313-24.
25. Watts GF, Lewis B, Brunt JN, et al. Effects on coronary artery disease of lipid-lowering diet, or diet plus cholestyramine, in the St Thomas’ Atherosclerosis Regression Study (STARS). Lancet 1992;339:563-9.
26. The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA 1984;251:351-64.
27. Athyros VG, Tziomalos K, Mikhailidis DP, Pagourelias ED, Kakafika AI, Skaperdas A, Hatzitolios A, Karagiannis A. Do we need a statin-nicotinic acid-aspirin mini-polypill to treat combined hyperlipidaemia? Expert OpinPharmacother2007;8:2267-77.
28. Maccubbin D, Bays HE, Olsson AG, et al. Lipid-modifying efficacy and tolerability of extended-release niacin/laropiprant in patients with primary hypercholesterolaemia or mixed dyslipidaemia. Int J Clin Pract2008;62:1959-70.
29. Taylor AJ, Sullenberger LE, Lee HJ, Lee JK, Grace KA. Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol (ARBITER) 2: a double-blind, placebo-controlled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004;110:3512-7.
30. Lee JM, Robson MD, Yu LM, et al. Effects of high-dose modified-release nicotinic acid on atherosclerosis and vascular function: a randomized, placebo-controlled, magnetic resonance imaging study. J Am Coll Cardiol 2009;54:1787-94.
31. Taylor AJ, Villines TC, Stanek EJ, et al. Extended-release niacin or ezetimibe and carotid intima-media thickness. N Engl J Med 2009;361:2113-22.
32. The Coronary Drug Project Research Group. Clofibrate and niacin in coronary heart disease. JAMA 1975;231:360-81.
33. AIM-HIGH Investigators, Boden WE, Probstfield JL, Anderson T, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med2011;365:2255-67.
34. http://www.hps2-thrive.org/HPS2THRIVE%20RELEASEUSWIREVERSIONfinal.pdf
35. Katsiki N, Theocharidou E, Karagiannis A, Athyros VG, Mikhailidis DP. Ezetimibe therapy for dyslipidemia: an update. Curr Pharm Des (in press).
36. Pearson TA, Ballantyne CM, Veltri E, Shah A, Bird S, Lin J, Rosenberg E,Tershakovec AM. Pooled analyses of effects on C-reactive protein and low density lipoprotein cholesterol in placebo-controlled trials of ezetimibe monotherapy or ezetimibe added to baseline statin therapy. Am J Cardiol2009;103:369-74.
37. Kastelein JJ, Akdim F, Stroes ES, et al; ENHANCE Investigators. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008;358:1431-43.
38. Rossebø AB, Pedersen TR, Boman K, et al; SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med 2008;359:1343-56.
39. Baigent C, Landray MJ, Reith C, et al; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011;377:2181-92.
40. http://clinicaltrials.gov/ct2/show/NCT00202878
41. Emerging Risk Factors Collaboration, Di Angelantonio E, Sarwar N, Perry P, et al. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009;302:1993-2000.
42. Tziomalos K, Athyros VG. Fenofibrate: a novel formulation (Triglide) in the treatment of lipid disorders: a review. Int J Nanomedicine 2006;1:129-47.
43. Frick MH, Elo O, Haapa K, et al. Helsinki Heart Study: primary prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med1987;317:1237-45.
44. Rubins HB, Robins SJ, Collins D, et al. Gemfibrozil for the secondary prevention of CAD in men with low levels of high-density lipoprotein cholesterol: Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med 1999;341:410-8.
45. The BIP Study Group. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease: the Bezafibrate Infarction Prevention (BIP) Study. Circulation 2000;102:21-7.
46. Keech A, Simes RJ, Barter P, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): a randomized controlled trial. Lancet 2005;366:1849-61.
47. ACCORD Study Group, Ginsberg HN, Elam MB, Lovato LC, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med2010;362:1563-74.
48. Tziomalos K, Athyros VG, Karagiannis A, Mikhailidis DP. Omega-3 fatty acids: how can they be used in secondary prevention? CurrAtheroscler Rep 2008;10:510-7.
49. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. GruppoItaliano per lo Studio dellaSopravvivenzanell’Infartomiocardico. Lancet 1999;354:447-55.
50. Yokoyama M, Origasa H, Matsuzaki M, et al.: Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomized open-label, blinded endpoint analysis. Lancet 2007;369:1090-8.
51. Gissi-HF Investigators, Tavazzi L, et al. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372:1223-30.
52. ORIGIN Trial Investigators, Bosch J, Gerstein HC, Dagenais GR, et al. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med2012;367:309-18.
Created: October 2, 2016
Last update: October 2, 2016