Αναστασία Θεοδωροπούλου, Απόστολος Βαγενάκης
Ενδοκρινολογικό Τμήμα Πανεπιστημίου Πατρών
1. Ιώδιο
Tο ιώδιο είναι ένα στοιχείο που υπάρχει στον ανθρώπινο οργανισμό σε ελάχιστες ποσότητες (15-20 mg, περίπου το 0,02 x 10-3 του βάρους του σώματος). Ο μοναδικός γνωστός βιολογικός ρόλος του είναι η συμμετοχή του στην σύνθεση των θυρεοειδικών ορμονών. Συνεπώς επί σοβαρής ελλείψεως επηρεάζεται η ορμονοσύνθεση των Τ4 και Τ3.
Η μέση ημερήσια πρόσληψη ιωδίου που χρειάζεται για την φυσιολογική ορμονοσύνθεση είναι 150 μg ημερησίως για τους εφήβους και τους ενήλικες, και 175 μg και 200 μg ημερησίως κατά την κύηση και τον θηλασμό αντίστοιχα. (1) Σε ιωδοπενικές περιοχές της Ευρώπης συνιστάται μέση ημερήσια πρόσληψη ιωδίου 90 μg ημερησίως. (2) Η ιδανική ημερήσια πρόσληψη καθορίζεται στο επίπεδο των 200 μg ιωδίου στους ενήλικες αφού συνοδεύεται από τα χαμηλότερα φυσιολογικά επίπεδα της TSH. (3)
Το φυσιολογικό άτομο προσλαμβάνει με την διατροφή περίπου 120 μg ιωδίου ημερησίως, ποσότητα που σχεδόν εξ΄ ολοκλήρου απορροφάται από το στόμαχο και το λεπτό έντερο, ενώ μικρή ποσότητα φαίνεται να εκκρίνεται ενεργητικά από το παχύ έντερο (Σχήμα 1). Τα 120 μg ιωδίου που προσλαμβάνονται ημερησίως εισερχονται στο εξωκυττάριο υγρό και αποτελούν την εξωθυρεοειδική δεξαμενή του μη ορμονικού ιωδίου (περίπου 250 μg). Καθημερινά προσλαμβάνονται ενεργητικά από τον θυρεοειδή περίπου 120 μg Ι– (Απόλυτο Ποσό Προσλαμβανόμενου Ιωδίου, Αbsolute Iodine Uptake AIU), και κατανέμονται στην ονομαζόμενη ενδοθυρεοειδική δεξαμενή που περιέχει περίπου 8000 μg Ι. Από εκεί, 60 μg ιωδίου περίπου επιστρέφουν ημερησίως στην εξωθυρεοειδική δεξαμενή, προερχόμενα από την περιφερική αποϊωδίωση των μονο- και διϊωδοτυροσινών και από την περιφερική μετατροπή της Τ4 σε Τ3. Περίπου 60 μg Ι– υπό μορφή Τ4 και Τ3, εισέρχονται στην περιφερική δεξαμενή ιωδίου (όπου αντιστοιχούν συνολικά περίπου 600 μg Ι– ορμονικού ιωδίου υπό μορφή Τ4 και Τ3). Από το ποσό των 60 μg Ι– που εκκρίνονται ημερησίως από τον θυρεοειδή, περίπου 48 μg Ι επιστρέφουν στην εξωθυρεοειδική δεξαμενή του μη ορμονικού ή ανόργανου ιωδίου (250 μg Ι–) και 12 μg Ι– (3% της ημερήσιας πρόσληψης) αποβάλλονται με τα κόπρανα. Περίπου 110 μg Ι– (97% της ημερήσιας πρόσληψης) απεκκρίνονται από τούς νεφρούς και με τον τρόπο αυτό διατηρείται το φυσιολογικό ημερήσιο ισοζύγιο. (4) (Σχήμα 1) Η ποσότητα του ιωδίου που συγκεντρώνεται στον θυρεοειδή αδένα εξαρτάται από την πρόσληψη του ιωδίου και από την ποσότητα που ήδη υπάρχει στον θυρεοειδή. Ο φυσιολογικός θυρεοειδής αδένας προσλαμβάνει περίπου 10-30% του χορηγούμενου ιωδίου με την διατροφή, αλλά το ποσοστό αυτό αυξάνεται όταν μειώνεται η ημερήσια παροχή ιωδίου. Έτσι η πρόσληψη ιωδίου έχει αντίστροφη σχέση με την συγκέντρωσή του στον ορό, ενώ η αποβολή από τους νεφρούς φαίνεται ότι είναι ανεξάρτητη από την συγκέντρωσή του στον ορό.

Σχήμα 1. Μεταβολισμός Ιωδίου
Υπό φυσιολογικές συνθήκες ο θυρεοειδής αδένας περιέχει περίπου 5000 – 10000 μg ιωδίου που βρίσκεται αποθηκευμένο κύρια στην Tg. Αυτή η μεγάλη ποσότητα ιωδίου χρησιμεύει ως αποθήκη για την σύνθεση των ορμονών ακόμη και όταν η πρόσληψη είναι μειωμένη. Υπό φυσιολογικές συνθήκες η μεγαλύτερη ποσότητα ιωδίου που κυκλοφορεί στο πλάσμα είναι υπό μορφή οργανικού ιωδίου.
1.1. Πρόσληψη ιωδίου
Ο Wolff είχε περιγράψει τον θυρεοειδή αδένα “ως ένα αποτελεσματικό συλλέκτη ενός σπάνιου στοιχείου, του ιωδίου”. (5)
Πρώτο βήμα στην σύνθεση και την αποθήκευση των θυρεοειδικών ορμονών αποτελεί ο μηχανισμός πρόσληψης και συγκέντρωσης του ιωδίου (iodide) από τον εξωκυττάριο χώρο στο θυρεοειδικό κύτταρο. Η πρόσληψη γίνεται από το συνμεταφορέα Ιωδίου (NIS: Sodium Iodide Symporter). Το γονίδιο που ευθύνεται για την παραγωγή της πρωτεΐνης αυτής εντοπίσθηκε στο χρωμόσωμα 19p12-13.2. (6, 7) Πρόκειται για μια γλυκοπρωτεΐνη που αποτελείται από 643 αμινοξέα, με Μοριακό Βάρος 70-90 kDa η οποία εντοπίζεται στο πλαγιοβασικό άκρο της μεμβράνης του κυττάρου. O NIS αποτελείται από 13 διαμεμβρανικές περιοχές, ένα εξωκυττάριο αμινοτελικό άκρο και ένα ενδοκυττάριο καρβοξυτελικό. Στο εξωκυττάριο αμινοτελικό άκρο βρίσκονται τρείς δυνητικές θέσεις γλυκοζυλίωσης.
Ο συνμεταφορέας ιωδίου ευθύνεται για την μεταφορά δύο ιόντων Νατρίου και ενός ιόντος Ιωδίου. Η διαμεμβρανική διαφορά Νa+, προσφέρει την απαραίτητη ενέργεια (Κ+ Να–ΑΤΡάση) για την ενεργητική πρόσληψη του Ιωδίου. Ήδη ο Wolff από το 1964 (5) είχε προτείνει την ύπαρξη ενός συστήματος ενεργούς μεταφοράς ιωδίου από τον εξωκυττάριο χώρο εντός του θυλακιώδους κυττάρου που συνδέεται με την μεταφορά Να+. (Σχήμα 2)
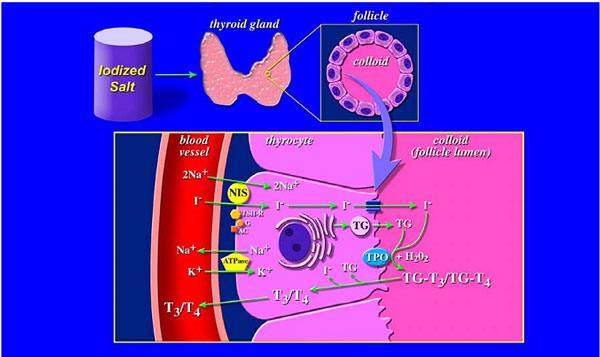
Σχήμα 2. Schematic representation of the biosynthetic pathway of thyroid hormones in the thyroid. (Made by Krista M.D.La Perle).
AC, adenylate cyclase; G, G-protein; NIS, sodium iodide symporter; T4, thyroxine; Tg, Thyroglobulin; TPO, thyroperoxidase; and TSH-R, Thyroid stimulating hormone receptor.
Το εσωτερικό των θυρεοειδικών κυττάρων διατηρεί αρνητικό δυναμικό σε σχέση με τον εξωκυττάριο χώρο και την κοίτη του θυλακίου που αντιστοιχεί σε 40-50 mV (+). (8) Η διαφορά δυναμικού ανάμεσα στην κοίτη και τον εξωκυττάριο χώρο είναι μικρή ή και μηδαμινή. Έτσι το Ι– συγκεντρώνεται στην βασική μεμβράνη και μεταφέρεται ενεργητικά κατά μήκος της κορυφής της μεμβράνης του θυλακίου στην κοίτη, ενάντια στο ηλεκτρικό δυναμικό.
Πειραματικά δεδομένα έδειξαν ότι η TSH διεγείρει την έξοδο του Ι– μέσα σε λίγα λεπτά από την κορυφαία πλευρά της μεμβράνης του θυλακίου στην κοίτη (9, 10), και η δραστηριότητα αυτή της TSH επιτελείται δια μέσου του c- AMP. Στην ίδια περιοχή της μεμβράνης εντοπίζεται η θυρεοειδική υπεροξειδάση (ΤΡΟ) καθώς και το σύστημα που δημιουργεί H2O2, που αποτελούν απαραίτητα στοιχεία για την οργανοποίηση του ιωδίου.
O ρυθμός της μεταφοράς του ιωδίου είναι ανάλογος με την συγκέντρωση του εξωκυττάριου Νa+ όπως φαίνεται από διάφορες μελέτες (11, 12). Φαίνεται ότι ο μεταφορέας ιωδίου θα πρέπει να δεσμεύεται στα ιόντα Νa+ στην εξωτερική επιφάνεια των κυττάρων και έτσι να μεταφέρει τα ιόντα Ι–, ενώ η Κ+ Νa+ ΑΤΡάση διατηρεί την ηλεκτρική και χημική διαφορά που οδηγεί την επανέξοδο του Νa+ από το κύτταρο. Για την μεταφορά ενός Ι– μέσα στο θυρεοειδικό κύτταρο χρειάζονται περισσότερα του ενός ιόντα Νa+.
Διάφορα ανιόντα μπορεί να λειτουργήσουν ως ανταγωνιστές στην διαδικασία μεταφοράς ιωδίου. Τα ανιόντα αυτά σε αύξουσα σειρά από άποψη ανασταλτικής ικανότητας είναι: TcO4–> ClO4–> ReO4–> BFO4–> SCN– > I– > N O3–>Br– > Cl–. Η απελευθερούμενη ενέργεια κατά την διάρκεια της ανταλλαγής τους ρυθμίζει τον βαθμό της ανταγωνιστικής ικανότητας. (13)
Μετά την ενεργό πρόσληψη του ιωδίου κατά μήκος της πλαγιοβασικής μεμβράνης, το ιώδιο μεταφέρεται στο κορυφαίο άκρο της μεμβράνης και από εκεί στην κοίτη του θυλακίου. Η μεταφορά από το κορυφαίο άκρο της μεμβράνης στην κοίτη φαίνεται ότι γίνεται δια μέσου μιας διαμεμβρανικής πρωτεΐνης της πεντρίνης (pendrin), που αποτελείται από 780 αμινοξέα. Το γονίδιο PDS που κωδικοποιεί την πεντρίνη εντοπίσθηκε στο χρωμόσωμα 7q31. (14)
Η πεντρίνη φαίνεται ότι παίζει σημαντικό ρόλο στην φυσιολογία του θυρεοειδούς αδένος. Μεταφέρει ιώδιο και χλώριο από τον ενδοκυττάριο χώρο στην κοίτη του θυλακίου και είναι απαραίτητη για την οργανοποίηση του ιωδίου στην θυρεοσφαιρίνη (Τg). (14)
H TSH δια μέσου του cAMP, διεγείρει την έκφραση του γονιδίου NIS και την παραγωγή της αντίστοιχης πρωτεΐνης (15), ενώ δεν φαίνεται να επηρεάζει την έκφραση του γονιδίου PDS και την παραγωγή της πεντρίνης. (16) Η Τg φαίνεται ότι αυξάνει σημαντικά τα επίπεδα PDS mRNA. Έτσι όταν έχει συσσωρευτεί μια σημαντική ποσότητα Τg έτοιμη για ιωδίωση, διεγείρεται η πεντρίνη με σκοπό την εξασφάλιση σημαντικών ποσοτήτων ιωδίου. (16)
1.2. Χημική φύση του ενδοθυρεοειδικού ιωδίου (iodine)
1.2.1. Οργανικό Ιώδιο (19 S Θυρεοσφαιρίνη)
Το μεγαλύτερο μέρος του ιωδίου (iodine) στον φυσιολογικό θυρεοειδή βρίσκεται ενσωματωμένο στην θυρεοσφαιρίνη (Tg). Η περιεκτικότητα ιωδίου στο φυσιολογικό μόριο της θυρεοσφαιρίνης ποικίλλει από 0,1% (17) μέχρι 1,1% (18) και συναρτάται από την πρόσληψη ιωδίου. Έχουν αναπτυχθεί ειδικές τεχνικές για τον υπολογισμό της κατανομής των ιωδοαμινοξέων στην θυρεοσφαιρίνη. (19)
Σε ένα φυσιολογικό μόριο της θυρεοσφαιρίνης περιεκτικότητας 0,52% σε ιώδιο αντιστοιχεί ο ακόλουθος απόλυτος αριθμός μορίων ιωδιωμένων αμινοξέων: Μονοϊωδοθυρονίνη (MIT) 6,45, Διϊωδοθυρονίνη (DIT) 4,78, Θυροξίνη (T4) 2,28, Τριϊωδοθυρονίνη (T3) 0,29.
Οι τιμές αυτές αντιστοιχούν σε συνολικό αριθμό 27 ατόμων ιωδίου ανά μόριο θυρεοσφαιρίνης, εκ των οποίων 10 άτομα (37%) είναι υπό την μορφή θυρεοειδικών ορμονών και 16 άτομα (59%) υπό την μορφή ιωδοτυροσινών. Η μικρή διαφορά που υπάρχει ανάμεσα στο ολικό ιώδιο και το άθροισμα του ιωδίου υπό μορφή ιωδοαμινοξέων οφείλεται μάλλον στην αποϊωδίωση κατά την πρωτεόλυση της Tg. Η κατανομή των ιωδοαμινοξέων στον θυρεοειδή ποικίλλει αναλόγως με τον βαθμό ιωδίωσης της θυρεοσφαιρίνης (17,20,21).
1.2.2. Ανόργανο Ιώδιο
Το ποσό του ολικού ενδοθυρεοειδικού ιωδίου που βρίσκεται υπό ανόργανο μορφή είναι συνήθως χαμηλό, αλλά κατά πολλές φορές μεγαλύτερη από αυτή του ορού.
Πηγές προέλευσης του ανόργανου ιωδίου του θυρεοειδούς είναι:
- To εξωγενές ιώδιο που μεταφέρεται από τον ορό.
- Το ενδογενές ιώδιο που παράγεται από την αποϊωδίωση των ιωδιωμένων ουσιών στον θυρεοειδή αδένα.
Αποτελεί θέμα συζητήσεων το ποσοστό ανταλλαγής εξωγενούς ανόργανου και ενδογενούς εξ’ αποϊδιώσεως ιωδίου. Από πειράματα σε επίμυες φαίνεται ότι το ενδοθυρεοειδικό ιώδιο σε κάποιο στάδιο δεν είναι διαθέσιμο για οργανική δέσμευση αλλά παρ’ όλα αυτά διατίθεται σε μια κοινή δεξαμενή με το εξωτερικό μεταφερόμενο ιώδιο. (22)
1.2.3. Particulate (protein) Bound Iodine (PBI)
Μια σημαντική ποσότητα του ολικού ιωδίου του θυρεοειδούς (@ 10%) βρίσκεται συχνά υπό αυτή την μορφή. (23)
Αυτό το ιώδιο προσδιορίζεται ως το ιώδιο που καθιζάνει σε 100000 ´ g μετά από φυγοκέντρηση μίας ώρας. Η φυσιολογική σημασία αυτής της μορφής ιωδίου είναι ακόμη υπό έρευνα. Τούλάχιστον μια ποσότητα αυτού του ιωδίου φαίνεται να είναι υπό μορφή 19S Tg. (24)
1.2.4. Ελεύθερα ιωδιωμένα αμινοξέα και ιωδιωμένα πεπτίδια.
Mικρό ποσοστό του ιωδίου του θυρεοειδούς βρίσκεται υπό μορφή ελεύθερων ιωδιωμένων αμινοξέων.
Στους επίμυς οι τιμές αυτές έχουν υπολογισθεί και ποικίλλουν, ως ΜΙΤ (Μονοϊωδοθυρονίνη) από 0,01% μέχρι 0,1% και ως DIT (Διϊωδοθυρονίνη) από 0,03% σε 0,05% του ολικού ιωδίου. (25). Το ποσό της ελεύθερης θυροξίνης (fT4) υπολογίσθηκε σε 0,5% (26), που αντιστοιχεί σε συγκέντρωση περίπου 100 φορές μεγαλύτερη της κυκλοφορούσης στον ορό θυροξίνης (Τ4). Δεν έχει διευκρινισθεί ακόμη αν αυτά τα ιωδοπεπτίδια συμμετέχουν στην ρύθμιση της βιοσύνθεσης των θυρεοειδικών ορμονών. (27)
Μια άλλη μορφή ιωδοπρωτεΐνης, η 27S, έχει περιγραφεί στα περισσότερα ζωικά είδη και αποτελεί το 10-15% της διαλυτής πρωτεΐνης του θυρεοειδούς. (28) Φαίνεται ότι μάλλον προέρχεται από την 19S Tg, αλλά η λειτουργία της παραμένει άγνωστη.
2. Ορισμός περίσσειας Ιωδίου
Η χορήγηση επιπλέον 200-500 μg ιωδίου εκτός της ημερησίας πρόσληψης από την διατροφή, δεν φαίνεται να επηρεάζει την θυρεοειδική λειτουργία. Ανάλογα με το ποσό του χορηγούμενου ιωδίου η θυρεοειδική λειτουργία τροποποιείται ως ακολούθως. (29)
α) Σχετικά χαμηλές ποσότητες ιωδίου ως προανεφέρθει δεν επηρεάζουν την πρόσληψη του, τον μεταβολισμό του και την ενσωμάτωση του στα αμινοξέα. Στην περίπτωση αυτή η ολική ενδοθυρεοειδική συγκέντρωση του ιωδίου ως T4 και T3 αυξάνει και η αύξηση αυτή είναι ανάλογη με την δοσολογία του ιωδίου που χορηγείται.
β) Μέτριες δόσεις ιωδίου μειώνουν το ποσοστό πρόσληψης I131. Η αναλογία του νεοσχηματισθέντος οργανικού ιωδίου μειώνεται, καθώς επίσης και τα ποσοστά των νεοσχηματισθέντων T4 και T3, αλλά αυξάνεται ο απόλυτος ρυθμός της οργανικής ιωδίωσης και της σύνθεσης T4 και T3.
γ) Μεγάλες δόσεις ιωδίου μειώνουν και το ποσοστό της πρόσληψης αλλά και τον απόλυτο ρυθμό οργανοποίησης ιωδίου (Wolff-Chaikoff effect), και αναστελλουν εν μέρει την πρωτεόλυση της θυρεοσφαιρίνης
δ) Πολύ μεγάλες ποσότητες ιωδίου προκαλούν ταχύ κορεσμό του μηχανισμού μεταφοράς ιωδίου.
Ο θυρεοειδής αδένας λοιπόν διαθέτει διάφορους μηχανισμούς που τον προστατεύουν από την έκθεση στην περίσσεια ιωδίου. Ως αυτορρύθμιση του θυρεοειδούς, ορίσθηκε αρχικά η ικανότητα ρύθμισης του μεταβολισμού του ιωδίου από τον θυρεοειδή αδένα ανεξάρτητα από την TSH, ή από άλλους εξωγενείς παράγοντες. Αποτέλεσμα της αυτορρυθμιστικής αυτής διαδικασίας είναι η διατήρηση της φυσιολογικής θυρεοειδικής λειτουργίας, παρά τις ευρείες διακυμάνσεις στην ημερήσια πρόσληψη ιωδίου. Έτσι αν και η ημερήσια πρόσληψη παρουσιάζει μεγάλες διακυμάνσεις, σε περιοχές με επάρκεια ιωδίου, οι συγκεντρώσεις των θυρεοειδικών ορμονών καθώς και της TSH παραμένουν σταθερές. Ακόμη και σε περιοχές με ήπια ιωδοπενία, τα περισσότερα άτομα είναι ευθυρεοειδικά με φυσιολογικές συγκεντρώσεις θυρεοειδικών ορμονών και TSH.
Ο μηχανισμός αυτορρύθμισης όπως φαίνεται από μελέτες θυρεοειδικού ιστού πειραματόζωων μετά την χορήγηση μεγάλων ποσοτήτων ιωδίου, χαρακτηρίζεται διαδοχικά από αναστολή της οργανοποίησης του ιωδίου και από διαφυγή από την οξεία αυτή ανασταλτική δράση. Σε υποφυσεκτομηθέντα ζώα παρατηρούνται αλλαγές στην πρόσληψη Ι131. Η ταχεία ανασταλτική δράση της περίσσειας ιωδίου (φαινόμενο Wolff-Chaikoff) είναι παροδική και η διαφυγή από αυτή συμβαίνει παρά την συνεχιζόμενη χορήγηση ιωδίου. Το ότι το φαινόμενο διαφυγής παρατηρείται και σε υποφυσεκτομηθέντα ζώα, υποδηλώνει ότι η διαδικασία αυτή δεν εξαρτάται από αλλαγές στην έκκριση TSH. Υποφυσεκτομηθέντα ποντίκια εμφανίζουν μεγαλύτερη πρόσληψη I131 από τα μη ιωδοπενικά και η χορήγηση TSH αυξάνει έτι περαιτέρω την πρόσληψη αυτή.(30)
2.1. Ταχεία ανασταλτική δράση της περίσσειας ιωδίου
Η ανασταλτική δράση της περίσσειας ιωδίου τεκμηριώθηκε για πρώτη φορά πριν 40 χρόνια περίπου από τους Morton ME, Chaikoff IL καιWolff J το 1944-48. (31,32)
Στα πειράματα των Morton και συνεργατών (31) η έγχυση 100 μg ιωδίου σεσημασμένου με ραδιενεργό ιώδιο σε επίμυες, προκάλεσε ταχεία μείωση της συγκέντρωσης του οργανικού ιωδίου στον ορό. Η οργανοποίηση του ιωδίου ανεστάλη όταν η συγκέντρωση του ανόργανου ιωδίου στον ορό ήταν περίπου 20 -30 μg/dl. Όταν η συγκέντρωση μειώθηκε κάτω από αυτό το όριο, τότε άρχισε πάλι η οργανοποίηση του νεοσυγκεντρωθέντος ιωδίου. Αυτή η αναστολή της σύνθεσης του ενδοθυρεοειδικού οργανικού ιωδίου, παρουσία ανόργανου ιωδίου (αναστολή της οργανοποίησης), ως αποτέλεσμα της απότομης αύξησης του ιωδίου στον θυρεοειδή αποκαλείται φαινόμενο Wolff-Chaikoff.
Οι δράσεις της περίσσειας ιωδίου εξασκούνται σε διάφορα επίπεδα του ενδοθυρεοειδικού μεταβολισμού που περιλαμβάνουν την πρόσληψη ιωδίου και την οργανοποίηση, τον ενδιάμεσο μεταβολισμό και ίσως την πρωτεόλυση και την απελευθέρωση των ορμονών. (33).
Παρά τις πολλές αναφορές που υπάρχουν για τις δράσεις της περίσσειας ιωδίου στον θυρεοειδή, πολύ λίγα γνωρίζουμε για τον μηχανισμό που είναι υπεύθυνος για το φαινόμενο Wolff-Chaikoff. (34) Στην ουσία ο μηχανισμός αυτός παραμένει άγνωστος, αλλά φαίνεται ότι εξαρτάται από την συγκέντρωση του ενδοθυρεοειδικού ανόργανου ιωδίου, ενώ συνάμα έχει παρατηρηθεί και μείωση στην συγκέντρωση της ΤΡΟ και της παραγωγής H2O2.
Αρκετές από τις δράσεις του ιωδίου καταργούνται με την χορήγηση των αντιθυρεοειδικών ουσιών όπως θειοκυανικά ή μεθιμαζόλη. Η μεθιμαζόλη αναστέλλει τις δράσεις της περίσσειας ιωδίου στην έκφραση του mRNAs c-myc και TGF-β1,στην μεταφορά των αμινοξέων, στην τοξικότητα (νέκρωση) επί των κυττάρων, και στην αναστολή της παραγωγής H2O2,αλλά δεν επηρεάζει την έκφραση των μορίων HLA τάξης I.
2.2. Διαφυγή από την οξεία ανασταλτική δράση του ιωδίου
Όταν η συνεχής χορήγηση περίσσειας ιωδίου διατηρείται και η συγκέντρωση του ιωδίου του ορού παραμένει υψηλή (100-200 μg/dl), η ανασταλτική δράση του ιωδίου εξαφανίζεται και αυξάνεται και πάλι η οργανοποίηση του, επαναλαμβάνονται οι ιωδιώσεις και ο σχηματισμός των Τ4 και Τ3 επανέρχεται στα φυσιολογικά επίπεδα.
Αυτό το φαινόμενο αποκαλείται διαφυγή από το φαινόμενο Wolff-Chaikoff. Μελέτες του μηχανισμού διαφυγής, υποδηλώνουν ότι το φαινόμενο αυτό χαρακτηρίζεται από μειωμένη ικανότητα του θυρεοειδούς να συγκεντρώσει αρκετό ιώδιο, ώστε να αναστείλει την οργανοποίηση του ιωδίου. (115) Ο μηχανισμός δεν είναι γνωστός. Πιθανολογείται ότι ευθύνεται κάποιο ιωδοπεπτίδιο. Ορισμένες από τις ουσίες που έχουν προταθεί ότι μπορεί να εμπλέκονται σε αυτή την διαδικασία είναι το ιωδιωμένο αραχιδονικό οξύ και ή ιωδολακτόνη. Το ιωδιωμένο αραχιδονικό οξύ μειώνει την μεταφορά ιωδίου, αλλά είναι λίγο παράδοξο η ίδια ουσία που είναι υπεύθυνη για την αναστολή της οργανοποίησης από την μια πλευρά, να ευθύνεται και για την διαδικασία προσαρμογής, (που είναι αυτή που επιτρέπει την επανέναρξη της οργανοποίησης) από την άλλη. Οι αλλαγές πάντως που παρατηρούνται μετά την χορήγηση φαρμακολογικών δόσεων ιωδίου στην μεταφορά του ιωδίου, το πιθανότερο είναι ότι οφείλονται σε αλλαγές στην αντλία Νατρίου, και όχι τόσο στην δημιουργία ιωδοστοιχείων. Το κλείσιμο της πύλης της εισόδου του ιωδίου στο θυρεοειδικό κύτταρο, συντελεί στην ελάττωση του ενδοθυρεοειδικού ανόργανου ιωδίου, αφού το μη οργανοποιηθέν ιώδιο εξέρχεται από τον αδένα.
Έτσι παρά την συνεχιζόμενη έκθεση του θυρεοειδούς αδένος στις φαρμακολογικές δόσεις ιωδίου, επέρχεται μείωση της στάθμης του ανόργανου ιωδίου στον θυρεοειδή, ελαττώνεται το (υποθετικό) ιωδοπεπτίδιο και επανασυντίθεται ο μεταφορέας Ιωδίου (NIS), με αποτέλεσμα να επιτραπεί και πάλι η είσοδος του κατάλληλου ποσού ιωδίου ούτως ώστε να επιτραπούν οι ιωδιώσεις. Όλες αυτές οι δράσεις δεν ελέγχονται από την TSH.
Πρόσφατες μελέτες δείχνουν ότι η ελάττωση της πρόσληψης ιωδίου συνοδεύεται από μείωση της σύνθεσης του NIS. Οι μελέτες αυτές διερεύνησαν την σχέση ανάμεσα στην χορήγηση φαρμακολογικών δόσεων ιωδίου και την έκφραση του NIS. (35) Μετά την χορήγηση φαρμακολογικών δόσεων ιωδίου σε επίμυς τόσο οξέως όσο και χρονίως, έγινε προσδιορισμός των Τ4, Τ3, TSH στον ορό καθώς και του NIS, του υποδοχέα της TSH, ΤΡΟ, Τg, και της αντίστοιχης NIS πρωτεΐνης στον θυρεοειδικό ιστό. Η ομάδα των επίμυων με χρόνια έκθεση στο ιώδιο, παρουσίασε μείωση των Τ4 και Τ3 ορού την 1η ημέρα χορήγησης που επανήλθαν στις φυσιολογικές τιμές την 6η ημέρα. Η TSH παρέμεινε αμετάβλητη. Αντίθετα η ομάδα των επίμυων με οξεία χορήγηση ιωδίου δεν παρουσίασε καμία αλλαγή στα επίπεδα ορού των Τ4, Τ3 και TSH. Όσο αναφορά την συγκέντρωση του NIS mRNA και της αντίστοιχης πρωτεΐνης στον θυρεοειδικό ιστό μειώθηκε την 1η και 6η ημέρα μετά την χρόνια χορήγηση ιωδίου. Στην ομάδα οξείας χορήγησης ιωδίου τα επίπεδα NIS mRNA μειώθηκαν 6 και 24 ώρες μετά την χορήγηση, ενώ αυτά της πρωτεΐνης παρουσίασαν μείωση στις 24 ώρες. Η χορήγηση ιωδίου δεν επηρέασε τα επίπεδα mRNA του υποδοχέα της TSH και της Τg. Τα ευρήματα αυτά υποδηλώνουν ότι η χορήγηση ιωδίου στα ποντίκια έχει ως αποτέλεσμα μείωση των επιπέδων τόσο του NIS mRNA όσο και της αντίστοιχης NIS πρωτεΐνης, πιθανώς μέσω μεταγραφικού μηχανισμού.
Οι φαρμακολογικές δόσεις ιωδίου επηρεάζουν επίσης και την πρωτεόλυση της Tg, με αποτέλεσμα ταχεία αναστολή της έκκρισης Τ4 και Τ3. Πράγματι η μελέτη θυρεοειδών αδένων από ζώα που έχουν εκτεθεί σε ιώδιο δείχνει μείωση της πρωτεολυτικής δραστηριότητας του ενζύμου. (29)
Σύμφωνα με τούς Nagataki και συν. (34) όμως, το ότι η περίσσεια ιωδίου αναστέλλει την πρωτεόλυση της Tg δεν μπορεί να εξηγήσει την ισορροπία μεταξύ σχηματισμού και απελευθέρωσης ορμονών στην χρόνια χορήγηση φαρμακολογικών δόσεων ιωδίου. Ακόμη και οι μεγάλες δόσεις που έχουν ανασταλτική δράση στην οργανοποίηση του ιωδίου, όταν χορηγούνται χρονίως την αυξάνουν. Έτσι αν υπάρχει αναστολή της πρωτεόλυσης της Tg, ο θυρεοειδής χρειάζεται τεράστια ικανότητα αποθήκευσης της μεγάλης ποσότητας του οργανοποιημένου ιωδίου. Αυτό όμως δεν φαίνεται να συμβαίνει όπως αποδείχθηκε από πειράματα σε ποντίκια. Σύμφωνα λοιπόν με τον Nagataki, η περίσσεια του οργανοποιημένου ιωδίου θα πρέπει να απελευθερώνεται από τον θυρεοειδή ως μη ορμονικό ιώδιο, αφού η έκκριση των ορμονών δεν φαίνεται φαινομενικά να αυξάνει κάτω από αυτές τις συνθήκες. Πάντως ο μηχανισμός ή η ουσία με την οποία ρυθμίζεται η απελευθέρωση του ιωδίου δεν έχει διευκρινισθεί.
Οι αλλαγές στην θυρεοειδική λειτουργία ακόμα και μετά τη χορήγηση μέσης ποσότητας φαρμακολογικών δόσεων ιωδίου, χαρακτηρίζεται όχι μόνον από την αποβολή ιωδίου από τον θυρεοειδή, αλλά και με ποιοτικές αλλαγές στην βιοσύνθεση των θυρεοειδικών ορμονών.(34)
Οι Νagataki και συνεργάτες χορήγησαν σε επίμυς προοδευτικά αυξανόμενες δόσεις ιωδίου (2,5-250 μg) συγχρόνως με ιχνηθέτη Ι131 και στη συνέχεια μελέτησαν την ενσωμάτωση Ι131 στα διαφορετικά ιωδοαμινοξέα του θυρεοειδούς. [σχήμα 3] Παρατήρησαν δύο φάσεις απάντησης. Αυξανόμενη η χορηγούμενη δόση του Ι131 σε 50 μg, το ποσοστό του ραδιενεργούς ιωδίου στον θυρεοειδή, ως ανόργανο ιώδιο αυξάνει και το ποσοστό των 131I ιωδοαμινοξέων ως T4 και T3 μειώνεται. Το κλάσμα Ι131 MIT/DIT έως τα 50 μg επίσης αυξάνεται και στη συνέχεια μειώνεται Όπως και για το ολικό νεοσχηματισθέν οργανικό ιώδιο, οι αλλαγές στην συνολική οργανοποίηση είναι διφασικές. Ο σχηματισμός T4 και T3 παρουσιάζει πιο δραστική μείωση απ’ ότι η συνολική οργανοποίηση.
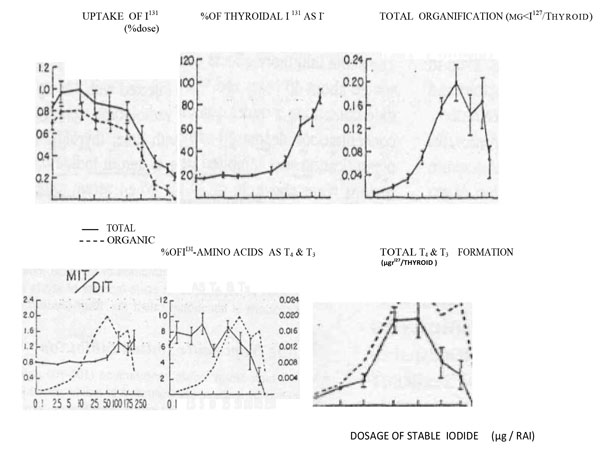
Σχήμα3. Μελέτη του μεταβολισμού του ιωδίου σε επίμυς, 30 λεπτά μετά την χορήγηση προοδευτικά αυξανόμενων φαρμακολογικών δόσεων ραδιενεργούς ιωδίου. Στον άξονα των χ, οι δόσεις του χορηγούμενου ιωδίου.
- Uptake of Ι131 : Ποσοστό πρόσληψης ραδιενεργούς ιωδίου.
- Total: Ολικό ενδοθυρεοειδικό Ιώδιο.
- Organic: ορμονικό ενδοθυρεοειδικό Ιώδιο.
- % of thyroidal I131 as I–: ποσοστό ιωδίου ως ανόργανο ιώδιο.
- Total organification: συνολική οργανοποίηση.
- ΜΙΤ: Μονοιωδοθυρονίνη
- DIT: Διιωδοθυρονίνη
Nagataki S, Ingbar SH. Relation between qualitative and quantitative alterations in thyroid hormone synthesis induced by varying doses of iodide. Endocrinology 1964:74: 731. Από: (Leslie J. DeGroot. Endocrinology. 3rd edition, 1995, p 242).
Η αναστολή της απελευθέρωσης των ορμονών από την περίσσεια ιωδίου παραμένει ένα γνωστό φαινόμενο στην νόσο Graves, ενώ είναι γνωστές οι ευεργετικές δράσεις της χορήγησης φαρμακολογικών δόσεων ιωδίου στην θεραπεία της θυρεοτοξίκωσης.
Εν κατακλείδι, το φαινόμενο της διαφυγής μπορεί να εξηγήσει γιατί δεν αναπτύσσεται υποθυρεοειδισμός στα ζώα ή στους ανθρώπους που λαμβάνουν εξωγενώς μεγάλες ποσότητες ιωδίου για μεγάλο χρονικό διάστημα. Ο ακριβής μηχανισμός που ευθύνεται για την μειωμένη πρόσληψη ιωδίου από το θυρεοειδικό κύτταρο μετά από χρόνια χορήγηση φαρμακολογικών δόσεων ιωδίου, παραμένει άγνωστος.
3. Αυτορρυθμιστικοί μηχανισμοί στον άνθρωπο
3.1. Οξεία ανασταλτική δράση και διαφυγή
Η οξεία χορήγηση μικρών ή μετρίων ποσοτήτων ιωδίου οδηγεί σε γραμμική αύξηση της απόλυτης πρόσληψης ιωδίου (AIU). (29,34)
Όταν η χορηγούμενη δόση ιωδίου φθάσει ένα συγκεκριμένο επίπεδο πάνω από 1 mg/ημερησίως η πρόσληψη του I131 μειώνεται, αλλά η AIU (που υπολογίζεται από το προσλαμβανόμενο I131 του θυρεοειδούς και από τα επίπεδα του ανόργανου ιωδίου του ορού ή των ούρων), αυξάνεται καθώς αυξάνεται η ποσότητα του χορηγούμενου ιώδιο. Όταν η δοσολογία φθάσει τα 2 mg/ημερησίως ή περισσότερο η χορήγηση KClO4 ή θυοκυανικών έχει ως αποτέλεσμα την αποβολή της χορηγούμενης ιχνηθέτιδας δόσης I131 από τον θυρεοειδή, που υποδηλώνει ανάλογη μείωση της οργανοποίησης του ιωδίου.
Κατά τον Nagataki και συν. η θετική δοκιμασία εκφόρτισης με KClO4 δηλεί την σχετική μάλλον μείωση της δυνατότητας οργανοποίησης του θυρεοειδούς σε σχέση με τα προσφερόμενα μεγάλα ποσά ιωδίου και όχι την απόλυτη μείωση της ικανότητας οργανοποίησης. Πάντως στον άνθρωπο δεν υπάρχουν σαφείς ενδείξεις, ότι η συνολική οργανοποίηση είναι μειωμένη επί περίσσειας ιωδίου, όπως και δεν υπάρχει επιβεβαίωση για την ύπαρξη ενός οξέως φαινομένου Wolff Chaikoff. Η χορήγηση μεγάλων δόσεων ιωδίου έχει ως αποτέλεσμα σημαντική μείωση της πρόσληψης του I131, σε τέτοιο βαθμό ώστε δεν είναι δυνατός ο προσδιορισμός της απόλυτης πρόσληψης. Έτσι δεν είναι δυνατόν να αποδειχθεί ούτε η ύπαρξη του φαινομένου Wolff-Chaikoff ούτε η διαφυγή από αυτό.
Σε ασθενείς με υπερθυρεοειδισμό λόγω νόσου Grave’s, η οξεία χορήγηση ιωδίου μειώνει την συγκέντρωση T4 και T3 του ορού και βελτιώνει το υπερθυρεοειδικό σύνδρομο.
Τα αποτελέσματα της οξείας χορήγησης ιωδίου φαίνεται ότι οφείλονται στην αναστολή της πρωτεόλυσης της θυρεοσφαιρίνης και κατά συνέπεια της απελευθέρωσης των ορμονών στην περιφέρεια, ενώ δεν υπάρχουν σαφή δεδομένα που να υποστηρίζουν την ύπαρξη ενός φαινομένου Wolff Chaikoff σε αυτούς τους ασθενείς.
3.2. Χρόνια χορήγηση ιωδίου στον άνθρωπο
Καθώς τα επίπεδα ανόργανου ιωδίου του ορού αυξάνουν μειώνεται και η πρόσληψη I131 από τον θυρεοειδή. Κατά την χρόνια χορήγηση ιωδίου παρά το γεγονός ότι η πρόσληψη του ιωδίου από τον θυρεοειδή μειώνεται, η AIU αυξάνεται. Οι ποσότητες ιωδίου που χρησιμοποιήθηκαν σε αυτές τις μελέτες κυμαίνονται από 100 μg έως 16 mg ημερησίως. Και σε αυτή την περίπτωση η δοκιμασία εκφόρτισης με KClO4 ήταν θετική, αλλά αυτό δεν αποτελεί απαραίτητα δείκτη μείωσης της απόλυτης οργανοποίησης.
Η μελέτη φυσιολογικού θυρεοειδικού ιστού δύο ώρες μετά την χορήγηση ιωδίου I131 (ιώδιο ορού 5 μg/100ml), έδειξε ότι το οργανικό ιώδιο αντιστοιχούσε σε περισσότερο από το 85% του ολικού ενδοθυρεοειδικού I131. (29,34)
Τα επίπεδα ορού του πρωτεϊνικού δεσμευμένου ιωδίου (ΡΒΙ), των ιωδοθυρονινών, και ο ρυθμός αποδόμησης της θυροξίνης δεν επηρεάζονται από την χρόνια έκθεση σε φαρμακολογικές δόσεις ιωδίου. Η παρατήρηση αυτή παρέχει περαιτέρω ενδείξεις ότι η έκκριση των θυρεοειδικών ορμονών (τουλάχιστον της θυροξίνης) δεν επηρεάζονται από την χρόνια χορήγηση ιωδίου. (29,34)
Η έλλειψη αλλαγών στην έκκριση των θυρεοειδικών ορμονών παρά την αύξηση της AIU πιθανά εξηγείται όπως και στα πειραματόζωα με την αλλαγή στην ισορροπία χρήσεως ενδογενούς και εξωγενούς ιωδίου. Συμπερασματικά, η συνεχής χορήγηση μεγάλων ποσοτήτων ιωδίου οδηγεί σε μείωση της πρόσληψης ιωδίου, που συνοδεύεται όμως από αύξηση της απόλυτης πρόσληψης (ΑΙU), ενώ παραμένουν ανεπηρέαστες οι συγκεντρώσεις των T4 και T3 ορού.
Οι γνώσεις μας γύρω από την περιεκτικότητα του θυρεοειδούς σε ιωδοαμινοξέα και την σχέση τους με το ολικό ενδοθυρεοειδικό ιώδιο, μετά από έκθεση σε φαρμακολογικές δόσεις ιωδίου, είναι πολύ περιορισμένες. Οι Reinwein και συνεργάτες μελέτησαν την ενδοθυρεοειδική συγκέντρωση ιωδίου, σε φυσιολογικά άτομα και σε άτομα που είχαν εκτεθεί σε αυξημένες ποσότητες ιωδίου. Η μέση συγκέντρωση ιωδίου στα φυσιολογικά άτομα υπολογίσθηκε σε 325,1 ± 47,2 μg/gr ιστού, με την ολική ποσότητα ιωδίου για τον θυρεοειδή αδένα να αντιστοιχεί σε 10,01 mg. Η χορήγηση φαρμακολογικών δόσεων ιωδίου δεν φαίνεται ότι επηρέασε τα αποτελέσματα αυτά. Οι ενδοθυρεοειδικές συγκεντρώσεις στα άτομα που είχαν εκτεθεί σε ιώδιο ήταν: του ολικού ενδοθυρεοειδικού ιωδίου 413,6 ± 96,5 μg/gr ιστού και της Τ4 147,8 ± 50,3 μg/gr ιστού, ενώ στους μάρτυρες οι αντίστοιχες τιμές ήταν 319,8 ± 39,0 μg/gr ιστού και 69,9 ± 13,0 μg/gr ιστού. Η σχέση Τ4/Τ3 στην μελέτη αυτή δεν φάνηκε να εξαρτάται από την συγκέντρωση του ολικού ενδοθυρεοειδικού ιωδίου, σε αντίθεση με την εξάρτηση που παρουσιάζει η σχέση Τ4/Τ3 στην ιωδοπενική βρογχοκήλη. Υπήρξε γραμμική συσχέτιση ανάμεσα στην ενδοθυρεοειδική συγκέντρωση ιωδίου και την ενδοθυρεοειδική συγκέντρωση των T4, T3, rT3, ενώ καμία συσχέτιση δεν βρέθηκε ανάμεσα στην ενδοθυρεοειδική συγκέντρωση ιωδίου και το κλάσμα T4/ T3. (36)
Σε μια άλλη πρόσφατη μελέτη (37) επιβεβαιώθηκε η ύπαρξη αυτορρυθμιστικών μηχανισμών στον άνθρωπο με στόχο την εξασφάλιση φυσιολογικής θυρεοειδικής λειτουργίας κατά την διάρκεια της χρόνιας χορήγησης φαρμακολογικών δόσεων ιωδίου.
Στην μελέτη αυτή συμμετείχαν 41 ασθενείς, οι οποίοι υπεβλήθησαν σε θυρεοειδεκτομή για διάφορα αίτια. Σε 33 ασθενείς χορηγήθηκε Ιωδιούχο Κάλιο (Lugol) 80-100 mg ημερησίως επί 15 ημέρες, και χειρουργήθηκαν ανά ομάδες σε διάφορους χρόνους (0, 5, 10, 15, 20 ημέρες) μετά την διακοπή χορήγησης του ιωδίου, ενώ οι υπόλοιποι ασθενείς χρησιμοποιήθηκαν ως μάρτυρες. Κατά την διάρκεια της θυρεοειδεκτομής ελήφθησαν τμήματα υγιούς θυρεοειδικού ιστού από διάφορες περιοχές και προσδιορίσθηκαν η ενδοθυρεοειδική συγκέντρωση Τ4 και Τ3 και η συγκέντρωση του ενδοθυρεοειδικού ιωδίου. Στα φυσιολογικά άτομα που δεν έλαβαν φαρμακολογικές δόσεις ιωδίου κυμαίνοντο 429,58 ± 226,47 μg/gr στον ιστό, και το ενδοθυρεοειδικό ιώδιο (Ιntrathyroidal Ηormonal Ιodine -HI) 199,95 ± 81,88 μg/gr στον ιστό. Η ενδοθυρεοειδική συγκέντρωση T3 και T4 ήταν 18 ± 7 μg/gr ιστού και 291 ± 118 μg/gr ιστού αντίστοιχα. Μετά την χορήγηση ιωδίου παρατηρήθηκε αύξηση της συγκέντρωσης του ολικού ενδοθυρεοειδικού ιωδίου 664,6 (± 213,9) μg/gr ιστού. Η αύξηση αυτή αφορά το μη ορμονικό ιώδιο, που περιλαμβάνει το ιώδιο που βρίσκεται σε ανόργανη μορφή και υπό μορφή ιωδοτυροσυνών. Αντίθετα η περιεκτικότητα του ορμονικού ιωδίου, που αντικατροπτίζει την ενδοθυρεοειδική περιεκτικότητα σε Τ4 και Τ3 δεν επηρεάζεται 216,8 (± 55,9) μg/gr ιστού. Η διατήρηση σταθερής ενδοθυρεοειδικής συγκέντρωση των T4 και T3 παρά την συνεχή χορήγηση ιωδίου, υποδηλώνει ότι ο θυρεοειδής αδένας έχει διαφύγει από την ανασταλτική δράση των φαρμακολογικών δόσεων ιωδίου στην ορμονοσύνθεση, και έτσι δεν αναπτύσσει υποθυρεοειδισμό.
3.3. Ο άξονας υποθάλαμος – υπόφυση – θυρεοειδής επί καταστάσεων περίσσειας ιωδίου σε φυσιολογικά άτομα
Η δυνατότητα του θυρεοειδούς να ρυθμίζει τον μεταβολισμού του ιωδίου ανεξάρτητα από την TSH ονομάσθηκε αυτορρύθμιση του θυρεοειδούς. Ο ορισμός αυτός εισήχθη όταν η TSH επροσδιορίζετο με βιολογικές μεθόδους, που εστερούντο μεγάλης ευαισθησίας.
Με την ανάπτυξη ευαίσθητων μεθόδων μέτρησης τόσο για την TSH όσο και για τα ελεύθερα κλάσματα T4 και T3, κατέστει δυνατόν να προσδιορισθούν οι αλλαγές στην συγκέντρωση αυτών των ορμονών στον ορό μετά την χορήγηση φαρμακολογικών δόσεων ιωδίου. (34)
Είναι γνωστό ότι η TSH διεγείρει την πρόσληψη και την απελευθέρωση του ιωδίου από τα θυρεοειδικά κύτταρα, ενώ έχει δράση και στην οργανοποίηση του ιωδίου.
Η αύξηση της πρόσληψης ιωδίου που επάγεται από την TSH χρειάζεται την σύνθεση RNA και πρωτεϊνών και συνοδεύεται από την είσοδο Νατρίου και κατανάλωση ενέργειας. (38) Η TSH διεγείρει την έκφραση του γονιδίου του συνμεταφορέα Νατρίου Ιωδίου (ΝΙS) (15), ενώ φαίνεται ότι ρυθμίζει και την μετά την μεταγραφή έκφραση του ΝΙS. Ο τρόπος φωσφωρυλίωσης του ΝΙS εξαρτάται από την TSH, καθώς και η έκφρασή του στην βασική πλευρά της μεμβράνης του κυττάρου. Επί απουσίας TSH ο ΝΙS μεταφέρεται από την μεμβράνη στον ενδοκυττάριο χώρο, και έτσι χάνει την ικανότητά του να μεταφέρει ιώδιο κατά μήκος της μεμβράνης. (39)
Η TSH προκαλεί ταχεία απελευθέρωση ιωδίου από τα θυρεοειδικά κύτταρα μέσω μεταβολικών οδών που δεν χρήζουν πρωτεϊνικής σύνθεσης (40,41).
Η TSH ευοδώνει την διαδικασία οργανοποίησης του ιωδίου, μια διαδικασία για την οποία είναι απαραίτητη η δημιουργία Η2Ο2. H TSH διεγείρει την δημιουργία Η2Ο2, (42,43,44) και την έκφραση του γονιδίου της θυρεοειδικής υπεροξειδάσης (45,46,47).
Στα φυσιολογικά άτομα που λαμβάνουν μέτριες ή μεγάλες δόσεις ιωδίου η απάντηση της TSH στην δοκιμασία TRH είναι αυξημένη, και αυτό αποτελεί δείκτη της ήπιας αντιθυρεοειδικής δράσης του ιωδίου.
Οι Garder D.F και συν. (48) με σκοπό να μελετήσουν αν οι διαταραχές στην θυρεοειδική λειτουργία εξαρτώνται από την δοσολογία του χορηγούμενου ιωδίου, χορήγησαν διάφορες δόσεις ιωδίου για 14 συνεχείς ημέρες. Μελέτησαν συνολικά 30 φυσιολογικά άτομα που έλαβαν 500, 1500 ή 4500 μg ιωδίου ημερησίως. Η χορήγηση μικρών δόσεων ιωδίου (500 μg ημερησίως) δεν επηρέασαν τα κυκλοφορούντα επίπεδα ιωδοθυρονινών, αλλά η απάντηση της TSH στην δοκιμασία TRH ήταν αυξημένη, που υποδηλώνει την αντιθυρεοειδική δράση ακόμη και αυτής της μικρής ποσότητας ιωδίου. Η χορήγηση μεγαλύτερων δόσεων ιωδίου συνοδεύθηκε από μείωση των περιφερικών θυρεοειδικών ορμονών και σημαντική αύξηση της TSH. Φαίνεται λοιπόν ότι σε φυσιολογικά άτομα η επιπλέον χορήγηση 200-500 μg ιωδίου πέραν της ποσότητας ιωδίου που προσλαμβάνεται ημερησίως με την διατροφή σε περιοχές με επάρκεια ιωδίου, δεν επηρεάζει σημαντικά την θυρεοειδική λειτουργία. (48)
Παρόμοια ευρήματα αναφέρονται και με την χορήγηση μεγαλύτερων δόσεων ιωδίου. Από διάφορες πειραματικές μελέτες προέκυψε ότι η χορήγηση φαρμακολογικών δόσεων ιωδίου, 50 – 250 mg ημερησίως για 10 – 14 ημέρες, είχε ως συνέπεια μικρή αλλά σημαντική μείωση των T4 και T3 ορού, μικρή αντιροπιστική αύξηση της TSH και εκσεσημασμένη απάντηση της TSH στην δοκιμασία TRH, σε άτομα με φυσιολογική θυρεοειδική λειτουργία. (49, 50) Η ημερήσια χρήση Ιωδιούχου αντισηπτικού στην στοματική κοιλότητα (polyvynilpyrrolidone iodine) για 6 μήνες, που είχε ως αποτέλεσμα την ημερήσια απορρόφηση 3 mg ιωδίου ημερησίως, προκάλεσε μικρή αλλά σημαντική αύξηση της TSH, που υποχώρησε μετά την διακοπή της χρήσης του ιωδίου. (51)
Αντίθετα είναι τα αποτελέσματα μιας άλλης μελέτης στην οποία φάνηκε ότι η οξεία αύξηση της συγκέντρωσης του ιωδίου του ορού, περίπου 90 φορές πάνω από τις βασικές τιμές, που επιτυγχάνεται με την χορήγηση σκιαγραφικού Ιodapamid για την εκτέλεση χολαγγειοπαγκρεατογραφίας, δεν συνοδεύετο από σημαντικές αλλαγές στη συγκέντρωση των FT4, FT3 και TSH. (51)
Σε μια άλλη πρόσφατη μελέτη (37), επιβεβαιώθηκε ότι για την διατήρηση της σταθερής παραγωγής των T4 και T3 κατά την χρόνια χορήγηση ιωδίου (80 mg ιωδίου), συμμετέχει και η υπόφυση. Η TSH στα άτομα που έλαβαν φαρμακολογικές δόσεις ιωδίου παρουσίασε στατιστικά σημαντική αύξηση σε σχέση με την ομάδα ελέγχου. Αμέσως μετά την διακοπή χορήγησης του ιωδίου η TSH παρουσίασε προοδευτική πτώση μέχρι την επάνοδό της σε φυσιολογικά επίπεδα. Η αύξηση αυτή της TSH πιθανώς να αντικατοπτρίζει μια προσαρμογή στη μείωση των περιφερικών Τ4, Τ3, fT4 και fT3 (αν και δεν παρουσίαζαν στατιστικά σημαντικές διαφορές σε σχέση με την ομάδα ελέγχου), λόγω της αναστολής που ασκεί η περίσσεια ιωδίου στην απελευθέρωση των ενδοθυρεοειδικών Τ4 και Τ3.
Τα αποτελέσματα των μελετών αυτών υποδηλώνουν ότι η εξωγενής χορήγηση φαρμακολογικών δόσεων ιωδίου σε φυσιολογικά άτομα έχει ήπια αντιθυρεοειδική δράση.
Είναι πιθανό ότι πολλοί παράμετροι του φαινομένου της αυτορρύθμισης μπορεί στην πραγματικότητα να εξαρτώνται από την TSH, και ίσως θα πρέπει να επανεξετασθεί ο ορισμός του.
4. Kλινικές επιπτώσεις από την έκθεση σε περίσσεια ιωδίου
Διάφορα φάρμακα και συντηρητικά τροφών περιέχουν μεγάλες ποσότητες ιωδίου, που απορροφάται είτε άμεσα από τον οργανισμό ως ιώδιο είτε μετά τον μεταβολισμό του φαρμάκου. Διάφορα σκευάσματα βιταμινών περιέχουν ιώδιο σε μέση ποσότητα 150 μg, μια δοσολογία που θεωρείται ότι αντικατροπτίζει τις φυσιολογικές ημερήσιες ανάγκες του οργανισμού. Το ιώδιο ανιχνεύεται σε μεγάλες ποσότητες σε ορισμένα βρογχολυτικά φάρμακα καθώς και στα σκιαγραφικά που χρησιμοποιούντα για απεικονιστικούς σκοπούς στην ακτινολογία (αρτηριογραφία, πυελογραφία, μυελογραφία, υστεροσαλπιγγογραφία).
Σε μερικά ευαίσθητα άτομα ο θυρεοειδής δεν μπορεί να διαφύγει από την ανασταλτική δράση που προκαλεί το ιώδιο στην οργανοποίηση, με αποτέλεσμα την εμφάνιση υποθυρεοειδισμού μετά από μακροχρόνια χρήση του. Αυτή η μορφή υποθυρεοειδισμού είναι παροδική και υποχωρεί με την διακοπή της έκθεσης στο ιώδιο. Η εμφάνιση βρογχοκήλης ή ακόμη και υποθυρεοειδισμού σε άτομα χωρίς υποκείμενη θυρεοειδική δυσλειτουργία είναι σπάνιο φαινόμενο, αν και δεν είναι γνωστή η ακριβής συχνότητα της. Ο μηχανισμός βάσει του οποίου εμφανίζονται αυτές οι αλλαγές δεν είναι πλήρως κατανοητός. (52)
Το 10% του πληθυσμού της Ιαπωνικής νήσου Hokkaido αναπτύσσει βρογχοκήλη εξ΄ ιωδιούχων. Οι κάτοικοι αυτής της νήσου καταναλώνουν μεγάλες ποσότητες τροφής πλούσιας σε ιώδιο (kombu), σε ποσότητες που υπερβαίνουν ημερησίως τα 200 mg. Παρά την ανάπτυξη βρογχοκήλης η εμφάνιση υποθυρεοειδισμού στα άτομα αυτά είναι σπάνια. (40) Παρόμοια ευρήματα αναφέρονται και σε μια περιοχή της Κίνας όπου η ποσότητα ιωδίου που προσλαμβάνεται με το πόσιμο νερό είναι πολύ μεγάλη. Τα επίπεδα Τ3 και Τ4 ορού είναι χαμηλά, ή προς τα χαμηλότερα φυσιολογικά όρια, η TSH είναι αυξημένη και δεν ανιχνεύεται αυξημένο ποσοστό θυρεοειδικών αυτοαντισωμάτων. Η πρόσληψη ραδιενεργού ιωδίου παραδόξως εμφανίζεται φυσιολογική ή υψηλή σε ένα ποσοστό 30% εξ’ αυτών. (125) Παρόμοια ευρήματα παρατηρήθηκαν και σε ασθενείς που ανέπτυξαν υποθυρεοειδισμό μετά την χορήγηση αμιοδαρόνης. Άλλες χρόνιες παθολογικές καταστάσεις στις οποίες μπορεί να προκληθεί υποθυρεοειδισμός και βρογχοκήλη μετά την χρήση ιωδιούχων ουσιών είναι η κυστική ίνωση, το βρογχικό άσθμα και η χρόνια νεφρική ανεπάρκεια. (52)
Ασθενείς με θυρεοειδίτιδα Hashimoto σε ποσοστό 60% εμφανίζουν υποθυρεοειδισμό μετά την λήψη φαρμακολογικών δόσεων ιωδίου (180 mg/ημέρα). Είναι πιθανό ότι αυτό οφείλεται κύρια στην αδυναμία του θυρεοειδούς να διαφύγει από την ανασταλτική δράση του ιωδίου και στην ύπαρξη μόνιμου φαινομένου Wolff-Chaikoff, και όχι τόσο στην αναστολή της απελευθέρωσης των Τ4 και Τ3 από τον θυρεοειδή. Η αύξηση της συγκέντρωσης της TSH δεν φαίνεται ικανή να αποκαταστήσει τις φυσιολογικές συγκεντρώσεις των Τ4 και Τ3, όπως συμβαίνει στα φυσιολογικά άτομα. (52, 54)
Η χορήγηση μεγάλων δόσεων ιωδίου σε ασθενείς με νόσο Graves αποτελούσε την μόνη θεραπευτική αντιμετώπιση αυτών των ασθενών, πρό της ανακάλυψης των αντιθυρεοειδικών φαρμάκων. Οι περισσότεροι ασθενείς ανταποκρίνοντο στην θεραπεία, αλλά σε μερικούς παρατηρείτο υποτροπή της νόσου, ενώ άλλοι ανέπτυσσαν αναστρέψιμο υποθυρεοειδισμό.
Γυναίκες μετά από ύφεση της θυρεοειδίτιδος μετά τοκετό, ανέπτυξαν υποθυρεοειδισμό κατά την χορήγηση ιωδιούχων, που υφέθει όμως με την απομάκρυνση του ιωδίου. Ίδια ευρήματα παρετηρήθησαν και μετά την χορήγηση μεγάλων δόσεων ιωδίου σε ασθενείς μετά από υποξεία θυρεοειδίτιδα. (52)
Υπάρχουν λίγες ενδείξεις για την εμφάνιση υπερθυρεοειδισμού από την χορήγηση μεγάλων δόσεων ιωδίου σε ασθενείς χωρίς υποκείμενη θυρεοειδική νόσο. Αντίθετα φαίνεται ότι το ιώδιο προκαλεί υπερθυρεοειδισμό σε ασθενείς με ιωδοπενική βρογχοκήλη, σε ασθενείς με νόσο Graves που έχουν γίνει ευθυρεοειδικοί μετά την χορήγηση φαρμακευτικής αγωγής, σε ασθενείς με πολυοζώδη βρογχοκήλη που διαμένουν σε ιωδοπενικές περιοχές και σε άτομα με υποκείμενη θυρεοειδική νόσο η οποία όμως δεν είναι γνωστή. (Πίνακας 1,2)


4.1. Υπερθυρεοειδισμός εξ ιωδιούχων σε ενδημικές ιωδοπενικές περιοχές
Η εξάλειψη της ιωδοπενίας είχε ως αποτέλεσμα και την εξαφάνιση της ενδημικής βρογχοκήλης από πολλές χώρες. Η επίπτωση υπερθυρεοειδισμού από περίσσεια ιωδίου σε ιωδοεπαρκείς περιοχές κυμαίνεται από μηδενική όπως στην Αυστρία μέχρι 7% στην Σουηδία μετά την χρήση προγραμμάτων ιωδίωσης. Η επίπτωση υπερθυρεοειδισμού σε περιοχές με ενδημική βρογχοκήλη εκτιμάται περίπου πάνω από 1.7% (55). Η εξέλιξη του υπερθυρεοειδισμού είναι ήπια και συνήθως λύεται αυτόματα.
Οι περισσότεροι ασθενείς που εμφανίζουν υπερθυρεοειδισμό από χορήγηση ιωδίου έχουν πολυοζώδη βρογχοκήλη. Η πλειονότητα αυτών των ασθενών είναι ευθυρεοειδικοί πρό της χορήγησης ιωδίου, αλλά μπορεί να μην είναι κατεσταλμένη η πρόσληψη ραδιενεργού ιωδίου από τον θυρεοειδή ενώ ή TSH μπορεί να είναι χαμηλή ή μη ανιχνεύσιμη και να μην απαντά στην δοκιμασία TRH. Η χορήγηση 200, 400 και 800 mg ιωδίου σε ασθενείς με βρογχοκήλη που διέμεναν στο Σουδάν είχε ως αποτέλεσμα την εμφάνιση 4 περιπτώσεων υπερθυρεοειδισμού, με επίπεδα TSH < 0,1 mU/l σε 5,9% – 16,7% των περιπτώσεων, 12 μήνες μετά την χορήγηση ιωδίου. (56) Παρόμοια αποτελέσματα έχουν αναφερθεί και μετά την χορήγηση ιωδιωμένου άλατος για 2 χρόνια στο Ζαίρ. Από τα 190 άτομα με οζώδη βρογχοκήλη, 14 άτομα (7,4%) εμφάνισαν θυρεοτοξίκωση (57). Οι αλλαγές αυτές διήρκησαν για περισσότερο από ένα χρόνο, και σε κανέναν δεν ανευρέθησαν αντιθυρεοειδικά αντισώματα. (58)
Σε άλλη μελέτη η έκθεση για μικρό χρονικό διάστημα σε περίσσεια ιωδίου (τροφή) σε ιωδοπενικές περιοχές μπορεί να προκαλέσει υπερθυρεοειδισμό. (59)
Φαίνεται λοιπόν ότι η περίσσεια ιωδίου μπορεί να προκαλέσει αυτονομία του θυρεοειδούς, από τη στιγμή που η περίσσεια ιωδίου επιτρέπει στον αυτονομηθέντα ιστό να συνθέτει και να απελευθερώνει περίσσεια θυρεοειδικών ορμονών. Αυτό επιβεβαιώθηκε και σε μελέτες που έγιναν στο Βέλγιο και την Ελλάδα (60, 61), όπου η χορήγηση μικρών ποσοτήτων ιωδίου (0,5 mg/d) σε ασθενείς με αυτόνομους όζους είχε ως αποτέλεσμα την εκδήλωση υπερθυρεοειδισμού.
Όμως τα αποτελέσματα συσχέτισης υπερθυρεοειδισμού εξ ιωδιούχων και αυτοανοσίας θυρεοειδούς παραμένουν αντικρουόμενα. Σε μερικούς ασθενείς ανιχνεύθηκαν Long-Acting Thyroid Stimulator (LATS) ή LATS protector ενώ σε άλλους όχι. (55, 62). Σε άλλη μελέτη η χορήγηση ιωδίου 0.2 and 0.5 mg σε ασθενείς με μικρή διάχυτη βρογχοκήλη, θετικά αντιθυρεοσφαιρνικά και αντιμικροσωμιακά αντισώματα, και χαμηλό ιώδιο ούρων, είχε ως αποτέλεσμα την εμφάνιση υποκλινικού παροδικού υπερθυρεοειδισμού σε 5% των ασθενών αυτών καθώς και αύξηση των τίτλων των αντισωμάτων. Η αύξηση των αντισωμάτων αυτών ήταν παροδική και παρουσίασε μείωση στην συνέχεια. (63)
Στην Αυστρία μετά την αύξηση της ιωδίωσης του άλατος παρατηρήθηκε σημαντική αύξηση των περιπτώσεων Grave’s, από 10,4 σε 20,9 περιπτώσεις ανά 100.000 (64). Οι παρατηρήσεις αυτές υποδηλώνουν ότι ο υπερθυρεοειδισμός που επάγεται από την χορήγηση ιωδίου, μπορεί να πυροδοτείται από την εκδήλωση αυτοανοσίας. Όμως αυτό δεν επιβεβαιώθηκε σε άλλες μελέτες, στις οποίες η αύξηση του τίτλου των αντισωμάτων των αντισωμάτων κατά της θυρεοσφαιρίνης, λιγότερο κατά της υπεροξειδάσης, δεν συνοδεύτηκε από υπερθυρεοειδισμό. (65)
4.2. Υπερθυρεοειδισμός εξ ιωδιούχων σε περιοχές με ιωδοεπάρκεια
Σε περιοχές με επάρκεια ιωδίου η επίπτωση υπερθυρεοειδισμού από την εξωγενή χορήγηση ιωδίου είναι πολύ χαμηλή. Στις ΗΠΑ η επίπτωση βρογχοκήλης είναι πολύ χαμηλή και ανέρχεται σε 3,1%. Σε ασθενείς με βρογχοκήλη η ημερήσια χορήγηση 180 mg ιωδίου για αρκετές εβδομάδες, είχε ως αποτέλεσμα την εμφάνιση σοβαρού υπερθυρεοειδισμού (66). Παρόμοια ευρήματα αναφέρονται και σε άλλες μελέτες από τις ΗΠΑ (67,68). Πιθανώς η εμφάνιση υπερθυρεοειδισμού μετά χορήγηση ιωδίου, να οφείλεται στην ύπαρξη αυτονομίας του θυρεοειδούς.
Άλλες μελέτες έδειξαν ότι η χορήγηση σκιαγραφικών οδήγησε στην εμφάνιση υπερθυρεοειδισμού σε νοσηλευόμενους ηλικιωμένους ασθενείς. (69,70,71) Οι ασθενείς αυτοί είχαν με βάση τα σπινθηρογραφικά ευρήματα πολυοζώδη βρογχοκήλη, και αρνητικά αντισώματα κατά της υπεροξειδάσης. Άλλη μελέτη έδεξε ότι μετά την χορήγηση σκιαγραφικών ήταν πιο συχνή η εμφάνιση υποκλινικού υπερθυρεοειδισμού (72). Σύμφωνα με μερικούς ερευνητές η προληπτική χορήγηση μεθιμαζόλης ή υπερχλωρικού οξέως μία ημέρα προ του ακτινολογικού ελέγχου και για 20 ημέρες μετά, θα μπορούσε να μειώσει τον κίνδυνο εμφάνισης υπερθυρεοειδισμού από την χρήση σκιαγραφικών σε ασθενείς με αυτόνομη βρογχοκήλη (73).
Η μεγάλη διαφορά που παρατηρείται στην συχνότητα εμφάνισης υπερθυρεοειδισμού εξ΄ιωδιούχων μεταξύ ιωδοπενικών περιοχών και περιοχών με επάρκεια ιωδίου, είναι δύσκολο να εξηγηθεί. Είναι πιθανό ότι τα άτομα με ιωδοεπάρκεια να παρουσιάζουν διαφορετική ευαισθησία των αυτορρυθμιστικών μηχανισμών του θυρεοειδούς, που με τη σειρά της καθιστά τον θυρεοειδή πιο ικανό να συγκρατήσει την περίσσεια εξωγενούς ιωδίου και έτσι πιο ανθεκτικό.
4.3. Λανθάνουσα ν. Graves
Το ιώδιο φαίνεται ότι παίζει σημαντικό ρόλο για την εκδήλωση της νόσου Graves, την πορεία της και την απάντηση στην φαρμακευτική αγωγή. Πιθανώς αυτό να οφείλεται στην μείωση της συγκέντρωσης του ενδοθυρεοειδικού ιωδίου που προκαλείται από την λήψη των αντιθυρεοειδικών. H ημερήσια πρόσληψη ιωδίου φαίνεται ότι είναι σημαντικός παράγοντας για την πορεία της ν. Graves. Οι διαφορές που παρατηρούνται στα ποσοστά ύφεσης της νόσου Graves μεταξύ ΗΠΑ και Ευρώπης αποδίδονται κατά ένα μέρος τουλάχιστον, στην μεγαλύτερη πρόσληψη ιωδίου στις ΗΠΑ (75).
H θεραπευτική απάντηση στα αντιθυρεοειδικά φάρμακα είναι ταχύτερη στους ασθενείς με Graves, που ζούν σε ιωδοπενικές περιοχές, αλλά και η δόση των αντιθυρεοειδικών που απαιτείται για την επίτευξη του θεραπευτικού στόχου είναι μικρότερη (76).
Η χορήγηση μεγάλων δόσεων ιωδίου σε ασθενείς με λανθάνουσα Graves μπορεί να οδηγήσει στην εμφάνιση υπερθυρεοειδισμού. Μια πιθανή εξήγηση είναι το γεγονός ότι η χορήγηση περίσσειας ιωδίου σε υπερθυρεοειδικούς ασθενείς με Graves προκαλεί αύξηση των αντισωμάτων κατά του υποδοχέα TSH (77).
Είναι γνωστό ότι η εκδήλωση της Graves’ εξαρτάται από το γενετικό υπόβαθρο, αλλά φαίνεται ότι η αυξημένη πρόσληψη ιωδίου μπορεί να προκαλέσει την πρώιμη χρονικά εκδήλωση της νόσου (78) και η θεραπεία μπορεί να καταστεί δυσκολότερη.
4.4. Ασθενείς με ιστορικό θυρεοειδοπάθειας
Ασθενείς με ιστορικό θυρεοειδοπάθειας είναι περισσότερο ευάλωτοι στην εκδήλωση υπερθυρεοειδισμού μετά από έκθεση σε φαρμακολογικές δόσεις ιωδίου.
Η χορήγηση 10 σταγόνων ιωδιούχου καλίου (SSKI) για 90 ημέρες σε 11 γυναίκες με θυρεοειδίτιδα μετά τον τοκετό είχε ως αποτέλεσμα την εμφάνιση υπερθυρεοειδισμού σε μία εξ΄αυτών (79). Παροδικός υποκλινικός υπερθυρεοειδισμός εμφανίσθηκε σε 20% των ασθενών με ιστορικό καταστροφικής θυρεοειδίτιδας ή θυρεοτοξίκωσης τύπου ΙΙ από αμιοδαρόνη με αρνητικά αντισώματα κατά της υπεροξειδάσης και κατά του υποδοχέα TSH. (79). Παρόμοια ευρήματα από την χορήγηση εξωγενούς ιωδίου παρατηρήθηκαν και σε ασθενείς με ιστορικό θυρεοτοξίκωσης από ιντερφερόνη (80).
4.5. Θυρεοειδοπάθεια από αμιοδαρόνη
Η αμιοδαρόνη είναι ένα βενζοφουρανικό παράγωγο που περιέχει 75 mg ιωδίου σε 200 g, που χρησιμοποείται για την αντιμετώπιση καρδιακών αρρυθμιών. Το φάρμακο αποθηκεύεται σε πολλούς ιστούς αλλά κυρίως στον λιπώδη ιστό και ο χρόνος ημίσειας ζωής του κυμαίνεται από πολλές εβδομάδες μέχρι 8 μήνες (~100 ημέρες). Στον ανθρώπινο θυρεοειδή η συγκέντρωση αμιοδαρόνης είναι περίπου 20 φορές μεγαλύτερη από αυτή του ορού (81). Ανάμεσα στις δράσεις που ασκεί η αμιοδαρόνη είναι : α) αλλαγή του μεταβολισμού της θυροξίνης στην περιφέρεια β) άμεσες τοξικές δράσεις στο θυρεοειδικό παρέγχυμα γ) δράσεις από το ιώδιο που προέρχεται από την αποιωδίωση της αμιοδαρόνης. (Πίνακας 3)

4.5.1. Δράσεις στην 5΄-αποϊωδινάση
Η αμιοδαρόνη αναστέλλει την δράση της αποϊωδινάσης τύπου 1 (Type I, propyl-thiouracil-sensitive,5’-deiodinase), που είναι υπεύθυνη για το μεγαλύτερο μέρος της περιφερικής παραγωγής Τ3. (82,83) Αυτό έχει ως αποτέλεσμα αύξηση των tΤ4, fT4 και rT3, και μείωση των tΤ3 και fT3 στο πλάσμα και στους περισσότερους ιστούς. Η αμιοδαρόνη φαίνεται ότι έχει πολύ μικρή δράση στην τύπου ΙΙ αποιωδινάση (Type II, propylthiouracil-resistant 5΄-deiodinase) στην υπόφυση και στον εγκέφαλο.
4.5.2. Άμεσες τοξικές δράσεις της αμιοδαρόνης
Η αμιοδαρόνη ασκεί άμεση τοξικότητα στον θυρεοειδικό ιστό. Ο μηχανισμός δεν είναι πλήρως κατανοητός. Το γεγονός ότι η χορήγηση μεθιμαζόλης και υπερχλωρικού οξέως είναι ικανή να προλάβει τις βλάβες του θυρεοειδούς από την έκθεση στην αμιοδαρόνη, υποδηλώνει ότι οι βλάβες αυτές οφείλονται στην περίσσεια ιωδίου. (84,85) Η παρουσία όμως παρόμοιων βλαβών από τη χορήγηση αμιοδαρόνης και σε άλλους ιστούς που δεν έχουν την ικανότητα να συγκεντρώνουν ιώδιο, αφήνει κάποια αμφιβολία στην άποψη ότι οι βλάβες μπορεί να οφείλονται μόνο στην περίσσεια ιωδίου (86,84).
4.5.3. Αμιοδαρόνη και περίσσεια ιωδίου
Ο μεταβολισμός της αμιοδαρόνης περιλαμβάνει την απώλεια ενός αιθυλίου και την αποιωδίωση. Περίπου 10% του οργανικού ιωδίου απελευθερώνεται ως ιώδιο καθημερινά, αλλά δεν είναι γνωστό σε πιο όργανο ακριβώς γίνεται ο κύριος όγκος της αποιωδίωσης. Η συγκέντρωση ανόργανου ιωδίου στο πλάσμα αυξάνει από 0,05 mM σε 2,2 mM, και η αποβολή ιωδίου με τα ούρα αυξάνει από 0,25 mmol/mmol creatinine σε 7 mmol/mmol κρεατινίνης ή και περισσότερο (87). Ως αποτέλεσμα η απόλυτη πρόσληψη ιωδίου από τον θυρεοειδή αυξάνει σε 55 nmol/h. Όμως η πλειονότητα των ασθενών που αντιμετωπίζεται με αμιοδαρόνη έχει προστατευτικούς μηχανισμούς που μπλοκάρουν ή εμποδίζουν την μαζική πρόσληψη ιωδίου (67). Αύξηση στην πρόσληψη ιωδίου εμφανίζουν μόνον οι ασθενείς που θα αναπτύξουν ή έχουν αναπτύξει κάποιας μορφής θυρεοειδοπάθεια. (67)
Η ημερήσια πρόσληψη ιωδίου με την διατροφή είναι καθοριστικός παράγοντας για τον τύπο δυσλειτουργίας που θα εμφανισθεί στον θυρεοειδή. Υποθυρεοειδισμός εμφανίζεται κυρίως σε περιοχές με ιωδοεπάρκεια ενώ στις ιωδοπενικές περιοχές η συχνότερη διαταραχή είναι ο υπερθυρεοειδισμός (θυρεοτοξίκωση).
4.5.4. Θυρεοτοξίκωση από αμιοδαρόνη
Η θυρεοτοξίκωση από αμιοδαρόνη (AIT) μπορεί να εκδηλωθεί ξαφνικά, πρώιμα ή μετά από χρόνια θεραπείας με αμιοδαρόνη (88), ή μπορεί ακόμα να εμφανισθεί πολλά χρόνια μετά την διακοπή χορήγησής της. Οι ασθενείς μπορεί να μην έχουν ιστορικό θυρεοδοπάθειας. Η σχέση άνδρες/γυναίκες είναι 3/1. Συνήθως η AIT δεν συνοδεύεται από αλλαγές στα επίπεδα αντισωμάτων εκτός και αν προυπήρχε ιστορικό θυρεοειδοπάθειας. Η αντιμετώπιση της θυρεοτοξίκωσης από αμιοδαρόνη είναι δυσκολότερη από άλλες μορφές θυρεοτοξίκωσης λόγω του μεγάλου χρόνου ημίσσειας ζωής της αμιοδαρόνης. Η διακοπή του φαρμάκου είναι πολλές φορές αρκετή για την αντιμετώπιση, αλλά γενικά η ύφεση είναι πολύ αργή (89).
Υπερθυρεοειδισμό από αμιοδαρόνη εμφανίζουν ~ 10% των ασθενών που μένουν σε ιωδοπενικές περιοχές, (90, 91). Στις ΗΠΑ ο υπερθυρεοειδισμός είναι λιγότερο συχνός και αυτό οφείλεται στην ιωδοεπάρκεια (90, 92).
H θυρεοτοξίκωση από αμιοδαρόνη είναι αποτέλεσμα δύο διαφορετικών μηχανισμών, και η κλινική εικόνα καθώς και η θεραπευτική αντιμετώπιση είναι διαφορετική. Τις περισσότερες φορές υπεύθυνο για την θυρεοτοξίκωση είναι το ιώδιο που απελευθερώνεται από τον μεταβολισμό του φαρμάκου. Προδιαθεσικοί παράγοντες είναι η μικρο και μακροοζώδης βρογχοκήλη, όπως και η αυτοανοσία (93, 94). Η αμιοδαρόνη είναι υπεύθυνη και για την εμφάνιση καταστροφικής θυρεοειδίτιδας όπως φάνηκε από κλινικές, ιστολογικές και in vitro μελέτες και εκδηλώνεται με βαριά θυρεοτοξίκωση. (94, 84, 95) Οι βλάβες που επάγονται από την αμιοδαρόνη είναι διαφορετικές από αυτές που επάγονται από την περίσσεια ιωδίου, και χαρακτηρίζονται από καταστροφή των σωματιδίων των κυττάρων και σημαντική διαστολή του ενδοπλασματικού δικτύου (81, 94). Τα κλινικά και εργαστηριακά ευρήματα της θυρεοτοξίκωσης από αμιοδαρόνη φαίνονται στον Πίνακα 3.
Η αξιολόγηση της θυρεοειδικής λειτουργίας είναι δύσκολη σε αυτούς τους ασθενείς. Τα επίπεδα Τ4 μπορεί να είναι αυξημένα, τα επίπεδα Τ3 μειωμένα, λόγω της ανασταλτικής δράσης που ασκεί το φάρμακο στην τύπου 5’-αποϊωδινάση ενώ τα επίπεδα TSH μπορεί να είναι φυσιολογικά ή λίγο αυξημένα ή λίγο μειωμένα σε ευθυρεοειδικά άτομα που λαμβάνουν αμιοδαρόνη. Ο υπερθυρεοειδισμός συνοδεύεται από κατεσταλμένα επίπεδα TSH και αυξημένα επίπεδα Τ3 και fT3 καθώς και της SHBG (96). Ο διαχωρισμός μεταξύ υπερθυρεοειδισμού εξ΄ιωδιούχων (τύπου I) και καταστροφικής θυρεοειδίτιδας (τύπου II) μπορεί να γίνει με τον προσδιορισμό των επιπέδων ιντερλευκίνη-6 στον ορό τα οποία εμφανίζονται αυξημένα στην καταστροφική θυρεοειδίτιδα (97) και με την FNA που αναδυκνύει ευρήματα ανάλογα θυρεοειδίτιδας (95). Στην καταστροφική θυρεοειδίτιδα, το uptake θυρεοειδούς είναι πάντα χαμηλό αλλά μπορεί να είναι φυσιολογικό ή λίγο αυξημένο στις ιωδοπενικές περιοχές.
Η αναγνώριση της υποκείμενης ανατομοπαθολογικής βλάβης από την αμιοδαρόνη στον θυρεοειδή είναι πολύ σημαντική για την σωστή θεραπευτική αντιμετώπιση. Σε γενικές γραμμές προτιμάται η διακοπή αγωγής με αμιοδαρόνη. Σε περίπτωση υπερθυρεοειδισμού θα πρέπει να χορηγούνται μεγάλες δόσεις αντιθυρεοειδικών. Αν δεν υπάρξει απάντηση στην θεραπεία μπορεί να χορηγηθεί potassium perchlorate (250 mg 3 φορές την ημέρα), που μπλοκάρει την πρόσληψη ιωδίου μειώνοντας έτσι την ενδοθυρεοειδική συγκέντρωση του ιωδίου (98, 99).
Στην καταστροφική θυρεοειδίτιδα απαιτείται η χορήγηση γλυκοκορτικοειδών. (95, 100) Για την επίτευξη φυσιολογικών επιπέδων Τ3 απαιτείται η χορήγηση μεγάλων δόσεων γλυκοκορτικοειδών για 8 ημέρες τουλάχιστον. Η υποτροπή είναι συχνή, κατά την διάρκεια της προοδευτικής μείωσης της κορτιζόνης (101). Η χειρουργική αντιμετώπιση είναι μια εναλλακτική θεραπεία με καλά αποτελέσματα. (102).
Η καταστροφική θυρεοειδίτιδα από αμιοδααρόνη μπορεί να οδηγήσει σε μόνιμο υποθυρεοειδισμό (95,103), εξ αιτίας της ίνωσης που προκαλείται στον θυρεοειδή (104).
Λόγω της υψηλής συχνότητας διαταραχών της θυρεοειδικής λειτουργίας, η αμιοδαρόνη θα πρέπει να χορηγείται με πολύ προσοχή σε ασθενείς με ιστορικό βρογχοκήλης ή κάποιας θυρεοειδοπάθειας. Προ της χορήγησης θα πρέπει να γίνεται προσεκτική εξέταση, και προσδιορισμός TSH και AbTPO. Σε ασθενείς υπό αγωγή με αμιοδαρόνη τα επίπεδα TSH θα πρέπει να ελέγχονται κάθε 6 μήνες για την έγκαιρη αντιμετώπιση διαταραχών της θυρεοειδικής λειτουργίας.
4.6. Υποθυρεοειδισμός από φαρμακολογικές δόσεις ιωδίου
Η έκθεση ασθενών με αυτοάνοσα νοσήματα του θυρεοειδούς σε μεγάλες ποσότητες ιωδίου οδηγεί στην εκδήλωση υποθυρεοειδισμού (54). Δεδομένης της αυξημένης συχνότητας αυτοανοσίας στον θυρεοειδή, η εκδήλωση υποθυρεοειδισμού ή υποκλινικού υποθυρεοειδισμού μετά την χορήγηση φαρμακολογικών δόσεων ιωδίου είναι πολύ συχνή (105, 106, 107).
H αύξηση TSH μπορεί να είναι αποτέλεσμα της αυτοανοσίας, αλλά μπορεί να οφείλεται επίσης στην άμεση δράση του ιωδίου στα θυρεοειδικά κύτταρα, με καταστολή της θυρεοειδικής λειτουργίας και απόπτωση των θυλακιωδών κυττάρων (108). Το ερώτημα δεν έχει απαντηθεί πλήρως. Τα αποτελέσματα μια μελέτης στην Κίνα, συνηγορούν υπέρ της πρώτης άποψης, αλλά χρειάζονται και άλλες μελέτες (109).
Από την άλλη πλευρά, πολλά άτομα που διαμένουν σε περιοχές με ιωδοεπάρκεια, εμφανίζουν αυξημένα επίπεδα TSH αλλά μη ανιχνεύσιμα αντιθυρεοειδικά αντισώματα (105, 106). Όμως είναι γνωστό ότι μερικά άτομα με αυτοάνοση θυρεοειδίτιδα μπορεί να έχουν αρνητικά αντιθυρεοειδικά αντισώμάτα. Παράλληλα όπως φάνηκε σε πληθυσμιακές μελέτες, σε ασθενείς με αυτοανοσία τα ευρήματα λεμφοκυτταρικής διήθησης όπως φαίνονται από την FNA είναι πολύ συχνότερα σε σχέση με τα επίπεδα αντιθυρεοειδικών αντισωμάτων. (110, 111, 112)
Μελέτη από περιοχή της Βραζιλίας με ιωδοεπάρκεια, έδειξε ότι άτομα με υποκλινικό υποθυρεοειδισμό, υπερηχογραφικά ευρήματα αυτοάνοσης θυρεοειδίτιδας αλλά αρνητικά αντισώματα, έχουν την ίδια πιθανότητα να αναπτύξουν υποθυρεοειδισμό μετά από φαρμακολογικές δόσεις ιωδίου, όπως άτομα με θετικά αντιθυρεοειδικά αντισώματα. (113, 114) Αντίθετα άτομα με υποκλινικό υποθυρεοειδισμό, αρνητικά αντισώματα και φυσιολογικά υπερηχογραφικά ευρήματα έχουν μικρότερο κίνδυνο να εμφανίσουν υποθυρεοειδισμό.
Ένα ερώτημα που τίθεται είναι σε ποιά επίπεδα ιωδίου αυξάνει ο κίνδυνος εμφάνισης υποθυρεοειδισμού; Φαίνεται ότι ο κίνδυνος αυτός σε περιοχές με ιωδοεπάρκεια, αυξάνει και με την χορήγηση μικρών ποσοτήτων ιωδίου, που μπορεί να είναι και μικρότερα από αυτά της φυσιολογικής ημερήσιας πρόσληψης ιωδίου (107).
Η ακριβής σχέση μεταξύ του επιπέδου πρόσληψης ιωδίου και συχνότητας εμφάνισης υποθυρεοειδισμού σε έναν πληθυσμό δεν είναι προς το παρόν ξεκάθαρη. Η συχνότητα υποθυρειοδισμού διαφέρει σημαντικά μεταξύ των χωρών (115). Προφανώς ακόμη και μικρές διαφορές στην πρόσληψη ιωδίου με την δίαιτα είναι σημαντικές, αλλά φαίνεται ότι σημαντικό ρόλο παίζει επίσης και το γενετικό υπόβαθρο (115). Οι Καυκάσιοι εμφανίζουν πιο συχνά αυτοάνοση θυρεοειδίτιδα απ’ ότι οι Αφρικανοί (111) και οι Ιάπωνες (112), ενώ μεταξύ των γηραιών ατόμων η συχνότητα κάποιου βαθμού υπολειτουργίας του θυρεοειδούς είναι μεγαλύτερη στους Καυκάσιους (116, 117).
Βιβλιογραφία
1. Food and Nutrition Board. Committee on Dietary Allowances. US National Research Council. Iodine. In Recommended dietary allowances, 10th ed. Washington, DC: National Academy Press Publishers, 1989:213
2. Delange F. Requirements of iodine in humans. In Delange F, Dunn JT, Glinoer D, eds. Iodine deficiency in Europe. A continuing concern. New York: Plenum Press, 1993:5
3. Moulopoulos DS, Koutras DA, Mantzos J, et al. The relation of serum T4 and TSH with the urinary iodine excretion. J Endocrinol Invest 1988;11:437
4. Βαγενάκης ΑΓ. Μεταβολισμός του ιωδίου, ανακύκλωση πρόσληψη και ορμονική σύνθεση. Εντατική Εκπαίδευση στην Ενδοκρινολογία. 1998:9
5. Wolff J. Transport of iodide and other anions in the thyroid gland. Physiol Rev 1964;44:45
6. Carrasco N. Iodide transport in the thyroi gland. Biochem Biophys Acta. 1993,1154: 65-82.
7. Smanik PA, Liu Q, Furminger TL, et al. Cloning of the human sodium iodide symporter. Biochem Biophys Res Commun 1996, 226: 339-345.
8. Woodbury DM, Woodbury JW. Correlation of micro-electrode potential recordings with histology of rat and guinea pigs thyroid glands. J Physiol (Lond) 1963;169:553
9. Nilsson M, Björkman U, Ekholm R, Ericson L. Iodide transport in primary cultured thyroid follicle cells: evidence of a TSH-regulated channel mediating iodide efflux selectively across the apical domain of the plasma membrane. Eur J Cell Biol 1990;52:270
10. Nilsson M, Björkman U, Ekholm R, Ericson L. Polarized efflux of iodide in porcine thyrocytes occurs via a c-AMP-regulated iodide channel in the apical plasma membrane. Acta Endocrinol (Copenh) 1992;126:67
11. Weiss SJ, Philip NJ, Grollman EF. Iodide transport in a continuos line of cultured cells from rat thyroid. Endocrinology 1984:114:1090
12. Consiglio E, Shifrin S, Yavin Z, et all: Thyroglobulin interactions with thyroid membranes. Relationship between receptor recognition of N-acetylglucosamine residues and the iodine content of thyroglobulin preparations. J Biol Chem 256:10592-10599,1981
13. Wolff J. Iodide transport. Anion selectivity and the iodide ‘trap’. In Reinwein D, Klein E (eds): Diminished Thyroid Hormone Formation. Possible Causes and Clinical Aspects. Stuttgart, FK Schattauer Verlag, 1982, pp 3-15
14. Bidart J-M, Mian C, Lazar V, et al. Expression of pendrin and the pendred syndrome (PDS) gene in human thyroid tissue. J Clin Endocrinol Metab 2000, 85: 2028-2033
15. Kogai T, Endo T, Saito T, Miyazaki A, Kawagughi A, and Onaya T. Regulation by Thyroid Stimulating Hormone of sodium/idine symporter gene expression and protein levels in FRTL-5 cells. Endocrinology 138:2227-2232,1997
16. Royaux I, Suzuki K, Mori A, et al. Pendrin, the protein encoded by the Pendred Syndrome gene (PDS),is an apical porter of iodide in the thyroid and is regulated by thyroglobulin in FRTL-5 cells. Endocrinology 2000, 141: 839-845
17. DeCrombrugghe B, Edelhoch H, Beckers C, De-Visscher M. Effects of iodination on sedimentation and iodoaminoacid synthesis. J Biol Chem 1967;242:5681
18. Magnusson RP, Taurog A, Dorris ML. Mechanisms of thyroid peroxidase and lactoperoxidase-catalyzed reactions involving iodide. J Biol Chem 259:13783-13790, 1984
19. Sorimachi K, Ui N. Comparison of the iodoamino acid distribution in the thyroglobulin obtained from various animal species. Gen Comp Endocrinol 1974;24:38
20. Sorimachi K, Ui N. Comparison of the iodoamino acid distribution in various preparation of hog thyroglobulin with different iodine content and subunit structure. Biochim Biophys Acta 1974;342:30
21. Inoue K, Taurog A. Acute and chronic effects of iodide on thyroid radioiodine metabolism in iodine-deficient rats. Endocrinology 1968;83:279
22. Hildebrandt JD, Scranton JR, Halmi NS. Intrathyroidally generated iodide: its measurement and origins. Endocrinology 1979;105:618
23. Boat TF, Halmi NS. Studies of particulate iodoprotein in the rat thyroid. Endocrinology 1965;77:537
24. Gavaret J-M, Nunez J. 9S thyroid particulate iodoprotein. Biochim Biophys Acta 1975;405:353
25. Taurog A. Biosynthesis of iodoamino acids. In Greep RO, Astwood EB, eds. Handbook of physiology. Vol III. Washington, DC: American Physiological Society, 1974:101
26. Tong W, Taurog A, Chaikoff IL. Nonthyroglobulin iodine of th thyroid gland:II. Free thyroxine and diiodotyrosine. J Biol Chem 1951;191:665
27. Lissitzky S, Gregoire J, Gregoire J, Limozin M. The presence and in vitro activity of free iodinated peptides in the thyroid gland of mammals and men. Gen Comp Endocrinol 1961;1:519
28. Frati L, Bilstad J, Edelhoch H, et al. Biosynthesis of the 27S thyroid iodoprotein. Arch Biochim Biophys 1974;162:126
29. Nagataki S. Effect of excess quantities of iodide. Handbook Physiol 1974;3:329
30. Halmi NS, Spirtos BN. Analysis of the modifying effect of dietary iodine levels on the thyroidal response of hypophysectomized rats to thyrotropin. Endocrinology 1955;56:157
31. Morton ME, Chaikoff IL, Rosenfeld S. Inhibiting effect of inorganic iodide on the formation in vitro of thyroxine and diiodotyrosine by surviving thyroid tissue. J Biol Chem 1944;154:381
32. Wolff J, Chaikoff IL Plasma inorganic iodide as a homeostatic regulator of thyroid function. J Biol Chem 1948;174:555
33. Pisarev M.A. & Kleiman de Pisarev D.L. Journal of Endocrinological Investigation 3,317-329, 1980
34. Nagataki S, Yokoyama N. Autoregulation: effects of iodide. Thyroid,13 pp241,1996
35. Eng PH, Cardona GR, Fang SL, Previti M, Alex S, Carrasco N, Chin WW and Braverman LE. Escape from the acute Wolff Chaikoff effect is associated with a decrease in Thyroid Sodium/Iodide symporter messenger ribonucleic acid and protein. Endocrinology 140:3404-3410, 1999
36. Maenhaut C, Brabant G, Vassart G, Dumont JE. In vitro and in vivo regulation of thyrotropin receptor mRNA levels in dog and human thyroid cells. J Biol Chem 1992; 267:3000
37. A Theodoropoulou, A G. Vagenakis, M Makri, K B. Markou. Thyroid Hormone Synthesis and Secretion in Humans after 80 Milligrams of Iodine for 15 Days and Subsequent Withdrawal. J Clin Endocrinol Metab 92: 212–214, 2007
38. Weiss SJ, Philip NJ, Ambesi-Impiombato FS, Grollman EF. Thyrotropin-stimulated iodide transport mediated by adenosine 3’,5’ monophosphate and dependent on protein synthesis. Endocrinology 1984; 114:1099
39. Riedel C, Levy O, Carrasco N. Post-transcriptional regulation of the sodium/iodide symporter (NIS) by thyrotropin. J Biol Chem 2001, 276: 21458-21463
40. Bidey SP, Tomlinson S. Differential modulation by Ca2+ of iodide transport processes in a cultured rat thyroid cell strain. J Endocrinol 1987; 112:51
41. Nilsson M, Bjorkman U, Ekholm R, Ericson LE. Polarized efflux of iodide in porcine thyrocytes occurs via a cAMP-regulated iodide channel in the apical plasma membrane. Acta Emdocrinol 1992; 126:67
42. Corvilain B, Laurent E, Lecomte M, Vansande J, Dumont JE. Role of the cyclic adenosine 3’,5’ monophosphate and the phosphatidylinositol- Ca2+ cascades in mediating the effects of thyrotropin and iodide on hormone synthesis and secretion in human thyroid slices. J Clin Endocrinol Metab 1994; 79:152
43. Corvilain B, Van Sande J, Laurent E, Dumont JE. The H2O2-generating system modulates protein iodination and the activity of the pentose phosphate pathway in dog thyroid. Endocrinology 1991; 128:779
44. Bjorkman U, Ekholm R. Hydrogen peroxide generation and its regulation in FRTL-5 and porcine thyroid cells. Endocrinology 1992; 130: 393
45. Collison KS, Banga JP, Barnett PS, Kung AWC, McGregor AM. Activation of the thyroid peroxidase gene in human thyroid cells: Effect of thyrotropin, froskolin and phorbol ester. J Mol Endocrinol 1989; 3:1
46. Aza-Blanc P, DiLauro R, Santisteban P. Identification of a cis-regulatory element and a thyroid-specific nuclear factor mediating the hormonal regulation of rat thyroid peroxidase promoter activity. Mol Endocrinol 1993;93: 1297
47. Damante G, DiLauro R. Thyroid-specific gene expression. Biochim Biophys Acta 1994:1218:255
48. Gardner DF, Centor RM, Utiger RD. Effects of low dose oral iodide supplementation on thyroid function in normal men. Clin Endocrinol 1988;28:238
49. Vagenakis AG, Downs P, Braverman LE, Ingbar SH. Control of thyroid hormone secretion in normal subjects receiving iodides. J Clin Invest 52:528-532,1973
50. Snyder DJ, Utiger RD. Inhibition of thyrotropin response to thyrotropin releasing hormone by small quantities of thyroid hormone. J Clin Invest 51:2077-2084,1972
51. Ader AW, Paul TL, Reinhardt W, et al. Effect of mouth rinsing with two polyvinylpyrrolidone-iodine mixtures on iodine absorption and thyroid function. J Clin Endocrinol Metab 1988;66:632
52. K. Markou, N. Georgopoulos, V. Kyriazopoulou and A.G. Vagenakis. Iodide-Induced Hypothyroidism, 2001 Thyroid 11,5: 501-510
53. Vagenakis AG, Rotti E. Effect of excess iodide: clinical aspaects. In Thyroid 14:317,1996
54. Vagenakis AG, Braverman LE. Adverse effects of iodide on thyroid function. Med Clin North Am 1975;59:1075
55. Martin MC, Lima N, Knobel M, Medeiros-Neto G. Natural course of iodine-induced thyrotoxicosis (Jod Basedow) in endemic goiter area: A 5 year follow up. J Endocrinol Invest 1989, 12:239–244.
56. Elnagar B, Eltom L, Karlsson FA, Ermans AM, Gebre-Medhin M, Bourdoux PP. The effects of different doses of oral iodized oil on goiter size, urinary iodine, and thyroid related hormones. J Clin Endocrinol Metab 1995, 80:891–897.
57. Ermans AM, Gullo D, Mugisho SG, Shibangu MT, Tonglet R, Iurato P, Mukalay MW, Mahangaiko E, Bourdoux P. Iodine supplementation must be monitored at the population level in iodine deficient areas [abstract]. Thyroid 5(Suppl 1):S:137, 1995.
58. Bourdoux P, Ermans AM, Mukalay WA, Filetti S, Vigneri R. Iodine induced thyrotoxicosis in Kiwu Zaire. Lancet 1996, 347:552–553.
59. Delange F, de Benoist B, Alnwick D. Risks of iodine-induced hyperthyroidism after correction of iodine deficiency by iodized salt. Thyroid 1999, 9:545–556.
60. Ermans AM, Camus M. Modifications of thyroid function induced by chronic administration of iodide in the presence of “autonomous” thyroid tissue. Acta Endocrinol (Copenh) 1972. 70:463–475.
61. Livadas DP, Koutras PA, Souvatzoglou A, Beckers C. The toxic effects of small iodine supplements in patients with autonomous thyroid nodules. Clin Endocrinol (Oxf) 1977, 7:121–127.
62. Lazarus JH, Parkes AB, John R, N’Diaye M, G Prysor-Jones S. Endemic goitre in Senegal-thyroid function etiological factors and treatment with oral iodized oil. Acta Endocrinol (Copenh) 1992, 126:149–154.
63. Kahaly G, Dienes HP, Beyer J, Hommel G. Randomized, double-blind, placebo-controlled trial of low dose iodide in endemic goiter. J Clin Endocrinol Metab 1997, 82:4049– 4053.
64. Mostbeck A, Galvan G, Bauer P, Eber O, Atefie K, Dam K, Feichtinger H, Fritzsche H, Haydl H, Köhn H, König B, Koriska K, Kroiss A, Lind P, Markt B, Maschek W, Pesl H, Ramschak-schwarzer S, Riccabona G, Stockhammer M, Zechmann W. The incidence of hyperthyroidism in Austria from 1987 to 1995 before and after an increase in salt iodization in 1990. Eur J Nucl Med 1998, 25:367–374.
65. Premawardhana LDKE, Parkes AB, Smyth PPA, Wijeyaratne CN, Jayasinghe A, De Silva DGH, Lazarus JH. Increased prevalence of thyroglobulin antibodies in Sri Lankan schoolgirls—is iodine the cause? Eur J Endocrinol 2000, 143:185–188.
66. Vagenakis AG, Wang CA, Burger A, Maloof F, Braverman LE, Ingbar SH. Iodide induced thyrotoxicosis in Boston. N Engl J Med 1972, 287:523–527.
67. Fradkin JE, Wolff J. Iodide-induced thyrotoxicosis. Medicine 1983, 62:1–20.
68. Rajatanavin R, Safran M, Stoller W, Mordes JP, Braverman LE. Five patients with iodine-induced hyperthyroidism. Am J Med 1984, 77:378–384.
69. Martin FIR, Brian WT, Colman PG, Deam DR. Iodine-induced hyperthyroidism due to nonionic contrast radiography in the elderly. Am J Med 1993, 95:78–82.
70. Martin FI, Deam DR. Hyperthyroidism in elderly hospitalized patients. Clinical features and outcome. Med J Aust 1996, 164:200–203.
71. Steidle B. Iodine-induced hyperthyroidism after contrast media. Animal experimental and clinical studies. In: Taenzer V, Wend S (eds) Recent Developments in Non-Ionic Contrast Media. 1989, Thieme, New York, p 6.
72. Conn JJ, Sebastian MJ, Deam D, Tam M, Martin FIR. A prospective study of the effect of ionic media on thyroid function. Thyroid 1996, 6:107–110.
73. Nolte W, Müller R, Siggelkow H, Emrich D, Hübner M. Prophylactic application of thyrostatic drugs during excessive iodine exposure in euthyroid patients with thyroid autonomy: A randomized study. Eur J Endocrinol 1996, 134:337–341.,
74. Lawrence JE, Lamm SH, Braverman LE. The use of perchlorate for the prevention of thyrotoxicosis in patients given iodine rich contrast agents. J Endocrinol Invest 1999, 22:405–407.
75. Papanastasiou L, Alevizaki M, Piperingos G, Mantzos E, Tseleni-Balafouta S, Koutras D. The effect of iodine administration on the development of thyroid autoimmunity in patients with nontoxic goiter. Thyroid 2000, 10:493–497.
76. Rath TH, Meissl G, Weissel M. Induction of hyperthyroidism in burn patients treated topically with povidone-iodine. Burns 1988, 14:320–322.
77. Yoshinari M, Tokuyama T, Okamura K, Sato K, Kusuda K, Fujishima M. Iodide-induced thyrotoxicosis in a thyroidectomized patient with metastatic thyroid carcinoma. Cancer 1988, 61:1674–1678.
78. Solomon BL, Evanl JE, Burman KD, Wartofskly L. Remission rates with antithyroid drug therapy: Continuing influence of iodine uptake? Ann Intern Med 1987, 107:510–512.
79. Azizi F. Environmental iodine intake affects the response to methimazole in patients with diffuse toxic goiter. J Clin Endocrinol Metab 1985, 61:374–377
80. Wilson R, McKillop JH, Thomson JA. The effect of preoperative potassium iodide therapy on antibody production. Acta Endocrinol (Copenh) 1990, 123:531–534.
81. Laurberg P, Pedersen KM, Vestergaard H et al. High incidence of multinodular toxic goiter in the elderly population in a low iodine intake area vs. high incidence of Graves’ disease in the young in a high iodine intake area: comparative surveys of thyrotoxicosis epidemiology in East-Jutl and Denmark and Iceland. Journal of Internal Medicine 1991; 229: 415–420.
82. Alexander WD, Harden RM, Koutras DA et al. Influence of iodine intake after treatment with antithyroid drugs. Lancet 1965; 2: 866–868.
83. Roti E, Minelli R, Gardini E, Bianconi L, Neri TM, Gavaruzzi G, Ugolotti G, Salvo D, Braverman LE. Impaired intrathyroidal iodine organification and iodine-induced hypothyroidism in euthyroid women with a previous episode of postpartum thyroiditis. J Clin Endocrinol Metab 1991, 73: 958–963.
84. Minelli R, Braverman LE, Giuberti T, Schianchi C, Gardini E, Salvi M, Fiaccadori F, Ugolotti G, Roti E. Effects of excess iodine administration on thyroid function in euthyroid patients with a previous episode of thyroid dysfunction induced by interferon-alpha treatment. Clin Endocrinol (Oxf) 1997, 47:357–361.
85. Smyrk TC, Goellner JR, Brennan MD, Carney JA. Pathology of the thyroid in amiodarone-associated thyrotoxicosis. Am J Surg Path 1987, 11:197–204.
86. Melmed S, Nademanee K, Reed AW, Hendrickson J, Singh BN, Hershman JM. Hyperthyroxinemia with bradycardia and normal Tsh secretion following chronic amiodarone administration. J Clin Endocrinol & Metab 1981, 83:997–1001.
87. Nademanee K, Piwonka RW, Singh BN, Hershman JM (1989) Amiodarone and thyroidfunction. ProgCardiovascDis 31:427–437.
88. Chiovato L, Martino E, Tonochera M, Santini F, Lapi F, Mammoli C, Braverman LE, Pinchera AStudies on the in vitro cytotoxic effect of amiodarone. Endocrinology. 1994, 134:2277–2282.
89. Brennan MD, Erickson DZ, Carney JA, Bahn RS. Non goitrous amiodarone-associated thyrotoxicosis: Evidence of follicular disruption in vitro and in vivo. Thyroid 1995, 5:177–183.
90. Beddows SA, Page SR, Taylor AH, McNerney R, Whitley GS, Johnstone AP, Nussey SN. Cytotoxic effects of amiodarone and desethylamiodarone on human thyrocytes. Biochem Pharmacol 1989, 38:4397–4403.
91. Rao RH, Mc Cready VR, Spathis CS. Iodine kinetic studies during amio-darone treatment. J Clin Endocrinol & Metab 1986, 62:563–568.
92. Newnham HH, Topliss DJ, Legrand BA, Chosich N, Harper RW, Stockigt JR. Amiodarone-induced hyperthyroidism: Assessment of the predictive value of biochemical testing and response to combined therapy with propylthiouracil and perchlorate. Aust NZJ Med 1988, 18:37–44.
93. Martino E, Aghini-Lombardi F, Mariotti S, Bartalena L, Braverman L, Pinchera A. Amiodarone: A common source of iodine-induced thyrotoxicosis. Horm Res 1987a, 26:158 –171.
94. Lombardi A, Martino E, Braverman LE. Amiodarone and the thyroid. Thyroid Today 1990, 23:1–7.
95. Harjai KJ, Licata AA. Effects of amiodarone on thyroid function. Ann Intern Med 1997, 126:63–73.
96. Martino E, Aghini-Lombardi F, Mariotti S, Bartalena L, Lenziardi M, Ceccarelli C, Bambini G, Safran M, Braverman LE, Pinchera A. Amiodarone iodine-induced hypothyroidism risk factors and follow up in 28 cases. Clin Endocrinol (Oxf) 1987, 26:227–237.
97. Monteiro E, Galvao-Teles A, Santos ML, Mourao L, Correira MJ, Tuna JL, Ribeiro C. Antithyroidal antibodies as an early marker for thyroid disease induced by amiodarone. Br Med J 1986, 292:227–228.
98. Safran M, Martino E, Aghini-Lombardi F, Bartalena L, Balzano S, Pinchera A, Braverman LE. Effect of amiodarone on circulating antithyroid antibodies. Br Med J 1988, 297:456–457.
99. Roti E, Minelli R, Gardini E, Bianconi L, Braverman LE. Thyrotoxicosis followed by hypothyroidism in patients treated with amiodarone. Arch Intern Med 1993, 153:886–892.
100. Pitsiavas V, Smerdely P, Li M, Boyages SC. Amiodarone induces a different pattern of ultrastructural change in the thyroid to iodine excess alone in both the BB/W rat and the Wistar rat. Eur J Endocrinol 1997, 137:89–98.
101. Bambini G, Aghini-Lombardi F, Rosner W, Saeed Khan M, Martino E, Pinchera A, Braverman LE, Safran M. Sex hormone-binding globulin in amiodarone-treated patients: A marker for tissue thyrotoxicosis. Arch Intern Med 1987, 147:1781–1785.
102. Bartalena L, Grasso L, Brogioni S, Aghini-Lombardi F, Braverman LE, Martino E. Serum interleukin-6 in amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 1994, 78:423–427.
103. Martino E, Aghini-Lombardi F, Mariotti S, Lenziardi M, Baschieri L, Braverman LE, Pinchera A. Treatment of amiodarone associated hyperthyroidism by simultaneous administration of potassium perchlorate and methimazole. J Endocrinol Invest 1986, 9:201–207.
104. Reichert LJ, Derooy HA. Treatment of amiodarone induced hyperthyroidism with potassium perchlorate and methimazole during amiodarone treatment. Br Med J 1989, 298:1547–1548.
105. Brousolle C, Ducotett X, Martin C, Barbier Y, Bornet H, Noel G, Orgiazzi J. Rapid effectiveness of prednisone and thionamides combined therapy in severe amiodarone iodine-induced thyrotoxicosis: comparison of two groups of patients with apparently normal thyroid glands. J Endocrinol Invest 1989, 12:37–42.
106. Bartalena L, Brogioni S, Grasso L, Bogazzi F, Burelli A, Martino E. Treatment of amiodarone-induced thyrotoxicosis, a difficult challenge: Results of a prospective study. J Clin Endocrinol Metab 1996, 81:2930–2933.
107. Farwell AP, Abend SL, Huang SK, Patwardhan N, Braverman LE. Thyroidectomy for amiodarone-induced thyrotoxicosis. JAMA 1990, 263:1526–1528.
108. Minelli R,Gardini E, Bianconi L, Salvi M, Roti E. Subclinical hypothyroidism, overt thyrotoxicosis and subclinical hypothyroidism: the subsequent phases of thyroid function in a patient chronically treated with amiodarone. J Endocrinol Invest 1992, 15:853–855.
109. Roti E, Bianconi L, De Chiara F, Minelli R, Tosi C, Gardini E, Salvi M, Braverman LE. Thyroid ultrasonography in patients with a previous episode of amiodarone induced thyrotoxicosis. J Endocrinol Invest 1994, 17:259–262.
110. Laurberg P, Pedersen KM, Hreidarsson A et al. Iodine intake and the pattern of thyroid disorders: a comparative epidemiological study of thyroid abnormalities in the elderly in Iceland and in Jutland, Denmark. The Journal of Clinical Endocrinology and Metabolism 1998; 83: 765–769.
111. Szabolcs I, Podoba J, Feldkamp J et al. Comparative screening for thyroid disorders in old age in areas of iodine deficiency, long-term iodine prophylaxis and abundant iodine intake. Clinical Endocrinology 1997l; 47: 87–92.
112. Bulow Pedersen I, Knudsen N, Jørgensen T et al. Large differences in incidences of overt hyper- and hypothyroidism associated with a small difference in iodine intake: a prospective comparative register-based population survey. The Journal of Clinical Endocrinology and Metabolism 2002; 87: 4462–4469.
113. Vitale M, diMatola T, D’Ascoli F et al. Iodide excess induces apoptosis in thyroid cells through a p53-independent mechanism involving oxidative stress. Endocrinology 2000; 141: 598–605.
114. Li Y, Teng D, Shan Z et al. Antithyroperoxidase and antithyroglobulin antibodies in a five-year follow-up survey of populations with different iodine intakes. The Journal of Clinical Endocrinology and Metabolism 2008; 93: 1751–1757.
115. Okayasu I, Hatakeyama S, Tanaka Y et al. Is focal chronic autoimmune thyroiditis an age-related disease? Differences in incidence and severity between Japanese and British. Journal of Pathology 1991; 163: 257–264.
116. Okayasu I, Hara Y, Nakamura K et al. Racial and age-related differences in incidence and severity of focal autoimmune thyroiditis. American Journal of Clinical Pathology 1994; 101: 698–702.
117. Pedersen IB, Knudsen N, Jørgensen T et al. Thyroid peroxidase and thyroglobulin autoantibodies in a large survey of populations with mild and moderate iodine deficiency. Clinical Endocrinology 2003; 58: 36–42.
Created: April 20, 2015
Last update: April 20, 2015

