Ερατώ Ατσάλη
Παιδίατρος, Επ. Συνεργάτης Μονάδας Μεταβολισμού Οστών/ Ρευματολογίας
και Γ΄ Παιδιατρικής Κλινικής Πανεπιστημίου Αθηνών ΠΓΝ Αττικόν
Πολυξένη Νικολαίδου
Ομότιμη Καθηγήτρια Παιδιατρικής Πανεπιστημίου Αθηνών
1. Εισαγωγή
Η οστεοπόρωση αποτελεί μία συστηματική σκελετική νόσο που χαρακτηρίζεται από ελαττωμένη οστική μάζα και διαταραχή της μικροαρχιτεκτονικής των οστών, με αποτέλεσμα τη μείωση της οστικής αντοχής και τον αυξημένο κίνδυνο κατάγματος1. Παραδοσιακά η οστεοπόρωση θεωρείται ως νόσημα της ενηλίκου ζωής, ειδικά των μετεμμηνοπαυσιακών γυναικών, τα τελευταία όμως χρόνια το ενδιαφέρον της επιστημονικής κοινότητας εστιάζεται στην παιδική και εφηβική ηλικία, ιδιαίτερα σε ότι αφορά στην πρόληψη της νόσου. Αναλυτικότερα η απόκτηση της μέγιστης δυνατής, με βάση το γενετικό υλικό, κορυφαίας οστικής μάζας κατά το τέλος της 2ης και την ανατολή της 3ης δεκαετίας ζωής, μειώνει σημαντικά τον κίνδυνο ανάπτυξης οστεοπόρωσης κατά την ενήλικο και υπερήλικο ζωή1. Επιπλέον,ολοένα και περισσότερα περιστατικά οστεοπόρωσης διαγιγνώσκονται ήδη από την παιδική/εφηβική ηλικία, ειδικά σε παιδιά και εφήβους πάσχοντες από χρόνια νοσήματα 1.
Η πλειονότητα των περιστατικών οστεοπόρωσης στην παιδική και εφηβική ηλικία αφορά σε πάσχοντες από κάποιο χρόνιο νόσημα (δευτεροπαθής οστεοπόρωση)1. Το ίδιο το υποκείμενο χρόνιο νόσημα μεσω διαφόρων μηχανισμών (π.χ. παραγωγή φλεγμονωδών κυτταροκινών,διαταραχές στο ορμονικό περιβάλλον) αλλά και η χορηγούμενη φαρμακευτική αγωγή (πχ γλυκοκορτικοειδή) επηρεάζουν την απόκτηση της οστικής μάζας και την κατανομή της στα διαφορετικά διαμερίσματα του οστού (σπογγώδες και φλοιώδες οστούν) ελαττώνοντας έτσι την οστική αντοχή και αυξάνοντας τον κίνδυνο κατάγματος1. Σπανιότερα η διάγνωση της οστεοπόρωσης τίθεται σε παιδιά φαινομενικά υγιή όπου συνήθως ανιχνεύεται κάποιο υποκείμενο γενετικό νόσημα του σκελετού (πρωτοπαθής οστεοπόρωση) 1.
Η διάγνωση της οστεοπόρωσης στους ενήλικες βασίζεται στις τιμές μάζας επιμεταλλωμένου οστού (Bone Mineral Content – BMC) ή/και επιφανειακής οστικής πυκνότητας επιμεταλλωμένου οστου (areal Bone Mineral Density – areal BMD), όπως αυτές υπολογίζονται με τη μέθοδο απορροφησιομετρίας διπλής ενέργειας με ακτίνες X (DXA) (1,2). Στην παιδική ηλικία οι μετρήσεις οστικής πυκνομετρίας δεν επαρκούν για τη διάγνωση της οστεοπόρωσης. Συγκεκριμένα, για τη διάγνωση της οστεοπόρωσης στην παιδική ηλικία οι χαμηλές τιμές BMC ή/και a BMD πρέπει να συνοδεύονται από ανάλογο κλινικό ιστορικό (ιστορικό κλινικά σημαντικού κατάγματος) 3. Η διαδικασία της διάγνωσης φαίνεται να περιπλέκεται ακόμη περισσότερο από τη δυσκολία στην ερμηνεία των αποτελεσμάτων της DXA σε έναν αυξανόμενο οργανισμό, όπως θα αναφερθεί αναλυτικά στη συνέχεια 1.
2. Μέθοδοι απεικόνισης των οστών στον αναπτυσσόμενο οργανισμό
2.1. Απορροφησιομετρία διπλής ενέργειας με ακτίνες X
Η απορροφησιομετρία διπλής ενέργειας με ακτίνες X (DXA), μία δισδιάστατη μέθοδος απεικόνισης των οστών,αποτελεί σήμερα την πιο διαδεδομένη μέθοδο απεικόνισης του σκελετού στην παιδική/εφηβική ηλικία 4. Bασίζεται στο διαφορετικό βαθμό απορρόφησης ακτίνων Χ κατά τη διέλευσή τους μέσα από διαφορετικούς ιστούς του ανθρώπινου οργανισμού (μαλακά μόρια χωρίς λίπος, λίπος, επιμεταλλωμένο οστούν) 4. Με την μέθοδο αυτή επιλέγεται μία δισδιάστατη περιοχή ενδιαφέροντος του οστού, όπως οι οσφυικοί σπόνδυλοι ή το ισχίο (επιφάνεια προβολής) και υπολογίζεται σε αυτήν, in vivo, η μάζα επιμεταλλωμένου οστού [Bone Mineral Content – ΒΜC (gr)] 4. Ο λόγος της μάζας επιμεταλλωμένου οστού ανά επιφάνεια προβολής οστού αποτελεί την (επιφανειακή) οστική πυκνότητα επιμεταλλωμένου οστού [areal Bone Mineral Denstiy – areal BMD = BMC (gr)/bone area (cm²)] 4. Σύμφωνα με τις οδηγίες της διεθνούς κοινότητας κλινικής πυκνομετρίας (Ιnternational Society of Clinical Densitometry-ISCD), οι μετρήσεις στα παιδιά πρέπει να γίνονται στην σπονδυλική στήλη ή/και σε όλο το σώμα (εξαιρώντας το κεφάλι) και όχι στο ισχίο, λόγω σημαντικών ανατομικών αλλαγών της περιοχής του ισχίου στη διάρκεια της αύξησης 3.
Η διάρκεια της εξέτασης δεν ξεπερνά τα δύο λεπτά για την σπονδυλική στήλη και τα τρία λεπτά για την ολόσωμη μέτρηση και το ποσό ακτινοβολίας στο οποίο εκτίθεται ο ασθενής κυμαίνεται από 1-5 μSv, τιμή μικρότερη από αυτή μίας κλασικής ακτινογραφίας θώρακα 4. Η ακρίβεια της DXA. που αφορά στην αναπαραγωγιμότητα των αποτελεσμάτων της, θεωρείται ικανοποιητική 4. Τα αποτελέσματά της στα παιδιά αποδίδονται στην πλειονότητα των περιπτώσεων, με τη μορφή σταθερών αποκλίσεων μετρήσεων που προέρχονται από παιδιά αναλόγου εθνικότητας, φύλου και ηλικίας (z score) και όχι με τη μορφή σταθερών αποκλίσεων από το μέσο όρο της BMC/BMD νεαρών υγιών ατόμων (Τ score) 4.
Ένα από τα βασικότερα μειονεκτήματα της μεθόδου DXA αφορά στη δισδιάστατη φύση της 1. Η DXA δεν λαμβάνει υπόψιν της την 3η διάσταση (βάθος), με αποτέλεσμα να προσμετρά επιφανειακή οστική πυκνότητα (gr/cm2) και όχι αληθή, ογκομετρική, οστική πυκνότητα (γραμμάρια επιμεταλλωμένου οστού/cm3) 4. Η μέτρηση της επιφανειακής οστικής πυκνότητας μπορεί να είναι ιδιαίτερα παραπλανητική στον αυξανόμενο οργανισμό καθώς υποεκτιμά την αληθή ογκομετρική οστική πυκνότητα σε παιδιά με μικρότερα οστά και αντίστροφα 1. Ένα παιδί με μικρότερο ύψος (και επομένως μικρότερο μέγεθος οστών) θα έχει σίγουρα μικρότερη επιφανειακή οστική πυκνότητα (areal BMD) σε σχέση με ένα παιδί ίδιας ηλικίας αλλά ψηλότερο, χωρίς αυτό να σημαίνει απαραίτητα ότι η αληθής, ογκομετρική, οστική του πυκνότητα υπολείπεται (εικόνα 1) 5. Η σύγκριση των αποτελεσμάτων της DXA με τις αντίστοιχες τιμές παιδιών ίδιας χρονολογικής ηλικίας και φύλου μπορεί έτσι να οδηγήσει σε εσφαλμένα συμπεράσματα εάν δεν λαμβάνονται υπόψιν παράγοντες όπως είναι το μέγεθος του σώματος-οστών και το στάδιο ενήβωσης (1,5). Σε παιδιά με χρόνια νοσήματα όπου συχνά παρατηρείται καθυστέρηση στην έναρξη της ήβης ή/και χαμηλό ανάστημα το πρόβλημα αυτό είναι ιδιαίτερα έντονο (1,5). Η Παγκόσμια Κοινότητα Κλινικής Πυκνομετρίας (ISClD) στις πιο πρόσφατες οδηγίες της κατέστησε σαφές ότι τα αποτελέσματα της DXA στα παιδιά πρέπει να εκφράζονται ως σταθερές αποκλίσεις (z scores) από τις αντίστοιχες τιμές παιδιών αναλόγου φύλου και ηλικίας, αφού πρώτα γίνουν οι ΅κατάλληλες΅ διορθώσεις για το μέγεθος των οστών 3. Οι προσπάθειες διόρθωσης των αποτελεσμάτων της DXA με βάση το μέγεθος των οστών δημιουργούν συχνά σύγχυση. Ενας νέος δείκτης ΅ογκομετρικής΅ οστικής πυκνότητας που υπολογίζεται με βάση τις μετρήσεις μάζας επιμεταλλωμένου οστού ανά επιφάνεια προβολής της DXA (BMAD- Βοne Mineral Apparent Density) βασίζεται ουσιαστικά στην παραδοχή ότι τα σπονδυλικά σώματα είναι κυλινδρικά και υπολογίζεται με βάση τον τύπο : BMAD=BMD * [4/3.14* vertebral body width] 1. O δείκτης BMAD δεν φαίνεται να προσφέρει σημαντική βοήθεια και οι υπάρχουσες μελέτες δεν φαίνεται να τον συσχετίζουν περισσότερο (συγκριτικά με την areal BMD) με αυξημένο κίνδυνο κατάγματος στα παιδιά (6,7).
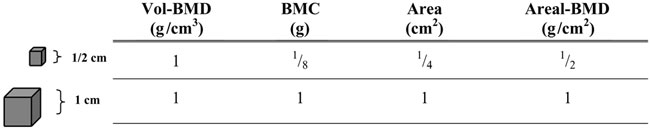
Εικόνα 1. Δύο δομές με διαφορετικό μέγεθος μπορεί να έχουν την ίδια ογκομετρική οστική πυκνότητα (Vol-BMD), διαφορετική όμως επιφανειακή οστική πυκνότητα (areal BMD). BMC: μάζα επιμεταλλωμένου οστού. Area: επιφάνεια οστού
2.2. Περιφερική ποσοτική αξονική τομογραφία (pQCT)
Η περιφερική ποσοτική αξονική τομογραφία (pQCT) δίδει τα τελευταία χρόνια μία νέα οπτική στην απεικόνιση των οστών. Πρόκειται για μία τρισδιάτατη μέθοδο που πραγματοποιείται στην κερκίδα ή την κνήμη με ειδικά μηχανήματα- scanners (STRATEC XCT900, XCT2000, XCT3000 – Densiscan peripheral micro-CT device) τα οποία χρησιμοποιούν διαφορετικά λογισμικά (software 5.4 και 5.5/Bonanalyse για τα μηχανήματα STRATEC, Densiscan software) (εικόνα 2) 8 . Η επιλογή της κερκίδας ή/και της κνήμης μοιάζει ιδανική για την παιδική/εφηβική ηλικία καθώς η πλειονότητα των καταγμάτων σε αυτές τις ηλικιακές ομάδες αφορά στα μακρά οστά 8. Λαμβάνονται τομές σε διαφορετικά σημεία της κνήμης/κερκίδας με τη γραμμή αναφοράς (R) να τοποθετείται στο εγγύτερο όριο της άπω επιφυσιακής πλάκας (9-11). Οι τομές που βρίσκονται περιφερικά αποτελούνται κυρίως από σπογγώδες οστούν ενώ οι τομές στο μέσο της διάφυσης αποτελούνται κυρίως από φλοιώδες οστούν (εικόνα 3) (8,11). Η διάρκεια της εξέτασης είναι 5-10 λεπτά και το ποσό της ακτινοβολίας χαμηλό 8.
H περιφερική ποσοτική αξονική τομογραφία, όντας μία τρισδιάστατη μέθοδος απεικόνισης των οστων, υπολογίζει τιμές αληθούς και όχι επιφανειακής ογκομετρικής οστικής πυκνότητας (8-10). Επιπλέον δίδει ξεχωριστά πληροφορίες για τo σπογγώδες και το φλοιώδες οστούν, πληροφορίες που σχετίζονται όχι μόνο με την οστική μάζα και την (ογκομετρική) οστική πυκνότητα αλλά και με τη γεωμετρία και την αντοχή των οστών (8-10). Δυστυχώς δεν υπάρχει ακόμη ομοφωνία σε ότι αφορά τα ακριβή σημεία μετρήσεων στα διαφορετικά ερενητικά κέντρα και τιμές αναφοράς για τα παιδιά 8. Έτσι η περιφερική ποσοτική αξονική τομογραφία, παρά τα σαφή πλεονεκτήματά της στην απεικόνιση των οστών, χρησιμοποιείται προς το παρόν αποκλειστικά για ερευνητικούς σκοπούς 8.

Εικόνα 2. Μηχάνημα περιφερικής ποσοτικής αξονικής τομογραφίας.

Εικόνα 3. Οι περιφερικές τομές στην περιφερική ποσοτική αξονική τομογραφία (p QCT) δίδουν πληροφορίες σχετικά με το σπογγώδες οστούν (trabecular) ενώ οι τομές στη διάφυση σχετικά με το φλοιώδες οστούν (cortical).
2.3. Άλλες μέθοδοι
Η απεικόνιση των οστών στα παιδιά με ποσοτικό υπερηχογράφημα δεν φαίνεται να έχει ευρεία χρήση λόγω της αδυναμίας σύγκρισης των αποτελεσμάτων ενώ η μαγνητική τομογραφία βρίσκει εφαρμογή στην απεικόνιση των οστών μόνο για ειδικούς ερευνητικούς σκοπούς 1.
3. Αίτια οστεοπόρωσης στην παιδική – εφηβική ηλικία
Η πλειονότητα των περιστατικών οστεοπόρωσης στην παιδική και εφηβική ηλικία αφορά σε παιδιά πάσχοντα από κάποιο υποκείμενο νόσημα, το οποίο αν και δεν προσβάλλει πρωτοπαθώς τον σκελετό, προσβάλλει δευτεροπαθώς τα οστά ελαττώνοντας την οστική αντοχή των (δευτεροπαθής οστεοπόρωση) (1,12,13). Σπανιότερα, το παιδί με οστεοπόρωση πάσχει απο κάποιο κληρονομούμενο νόσημα των οστών ή είναι υγιές (πρωτοπαθής οστεοπόρωση) (1,12,14,15). Στους πίνακες 1 και 2 αναφέρονται τα συχνότερα αίτια πρωτοπαθούς (πίνακας 1) και δευτεροπαθούς (πίνακας 2) οστεοπόρωσης στην παιδική και εφηβική ηλικία.
Πίνακας 1. Συχνότερα αίτια πρωτοπαθούς οστεοπόρωσης στα παιδιά.
| Ιδιοπαθής νεανική οστεοπόρωση |
| Ατελής οστεογένεση |
| Σύνδρομο οστεοπόρωση ψευδογλοίωμα |
| Σύνδρομο Ehlers- Danlos (τύπος 1) |
| Σύνδρομο Marfan |
| Σύνδρομο Bruck |
| Νεανική/πρώιμης έναρξης νόσος Paget |
| Ομοκυστινοuρία |
Πίνακας 2. Συχνότερα αίτια δευτεροπαθούς οστεοπόρωσης στα παιδιά.
| Χρόνια νοσήματα Νεανική ιδιοπαθής αρθρίτιδαNοσήματα συνδετικού ιστού
Κοιλιοκάκη Ιδιοπαθή Φλεγμονώδη Νοσήματα του Εντέρου Μεσογειακή αναιμία HΙV λοίμωξη Μεταμόσχευση οργάνων Νεφροπάθειες (νεφωσικό σύνδρομο) Κυστική Ίνωση Λευχαιμία Νευρογενής Ανορεξία |
| Ενδοκρινολογικές παθήσεις Υπογοναδισμός / Καθυστερημένη ήβηΣύνδρομο Turner
Υπερθυρεοειδισμός Ανεπάρκεια αυξητικής ορμόνης Υπερκορτιζολαιμία Υπερπαραθυρεοειδισμός Υπερπρολακτιναιμία Νεανικός Σακχαρώδης Διαβήτης |
| Νευρομυϊκές παθήσεις Μυική Δυστροφία DuchenneEγκεφαλική παράλυσηΠαρατεταμένη ακινητοποίηση |
| Ενδογενείς διαταραχές του μεταβολισμούΓλυκογονιάσειςΝόσος GaucherΓαλακτοζαιμία |
| ΦάρμακαΓλυκοκορτικοειδήΑντιεπιληπτικά
Μεθοτρεξάτη (σε υψηλές δόσεις) Ηπαρίνη |
3.1. Πρωτοπαθής οστεοπόρωση
Η ιδιοπαθής νεανική οστεοπόρωση αποτελεί μία σπάνια, αγνώστου ατιολογίας μορφή οστεοπόρωσης, με επίπτωση 1/100.000 γεννήσεις (12,16,17). Ορισμένοι ερευνητές αποδίδουν τη νόσο σε ετερόζυγες μεταλλάξεις στο γονίδιο LRP5 14. Η νόσος εκδηλώνεται πριν την εφηβεία (κατά μέσο όρο στα 7 έτη) με αιφνίδια εμφάνιση οστικού άλγους στην σπονδυλική στήλη ή/και στα άκρα (κάτω άκρα κυρίως) και δυσκολία στη βάδιση (12,18). Ο απεικονιστικός έλεγχος αποκαλύπτει συνήθως συμπιεστικά σπονδυλικά κατάγματα ή/και κατάγματα στις μεταφύσεις των μακρών οστών (εικόνα 4) (12,18). Ιστομορφομετρικές μελέτες (βιοψία οστών) έδειξαν διαταραχή στο ρυθμό οστικής ανακατασκευής στις επιφάνειες του σπογγώδους οστού πέριξ της μυελικής κοιλότητας (μείωση της οστικής παραγωγής) με αποτέλεσμα ελαττωμένο αριθμό και πάχος δοκίδων σπογγώδους οστού (12,18).Το γεγονός αυτό φαίνεται να ερμηνεύει την εντόπιση των καταγμάτων (σπονδυλικά σώματα/μεταφύσεις μακρών οστών) (12,18). Η διάγνωση της νόσου τίθεται κατόπιν αποκλεισμού άλλων αιτιών οστεοπόρωσης 18. H νόσος αυτοπεριορίζεται μετά την εφηβεία (συνήθως εντός 3-4 ετών), ωστόσο συχνά παραμένουν σημαντικές οστικές παραμορφώσεις και λειτουργικές διαταραχές (σκολίωση, παραμορφώσεις πλευρών και σπονδύλων), ειδικά στις βαρύτερες μορφές της νόσου (1,12,18). Ο βαθμός αποκατάστασης της ποιότητας των οστών παραμένει αδιευκρίνιστος (1,12).
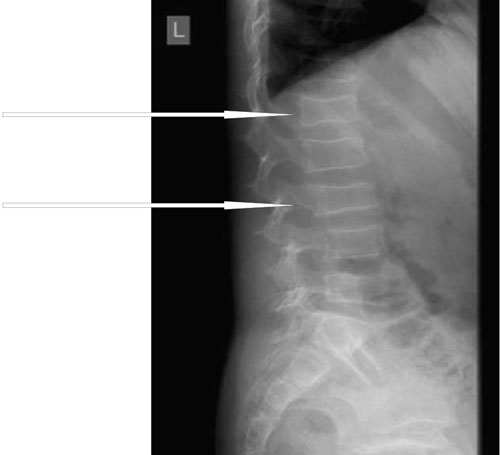
Εικόνα 4. Σπονδυλικά κατάγματα σε κορίτσι με ιδιοπαθή νεανική οστεοπόρωση (Γ΄ Παιδιατρική Κλινική Πανεπιστημίου Αθηνών, ΠΓΝ Ατιικόν).
Η ατελής οστεογένεση αποτελεί το συχνότερο αίτιο πρωτοπαθούς οστεοπόρωσης στα παιδιά (12,20). Το νόσημα οφείλεται στην πλειονότητα των περιπτώσεων σε ετερόζυγες μεταλλάξεις στα γονίδια COL1A1 και COL1A2 (έως 95% των ασθενών) που κωδικοποιούν τις βασικές αλυσίδες α1 και α2 του μορίου του κολλαγόνου τύπου Ι (12,20). Το κολλαγόνο τύπου Ι αποτελεί τη βασική πρωτείνη της θεμέλιας ουσίας των οστών. Δύο α1 και μία α2 αλυσίδες ενώνονται και σχηματίζουν μία τριπλή έλικα (μόριο του κολλαγόνου) που θα υποστεί πολλές ενδοκυττάριες και εξωκυττάριες αλλαγές μέχρι να δημιουργηθούν τα ινίδια κολλαγόνου τύπου Ι (12,20). Μεταλλάξεις σε γονίδια που κωδικοποιούν τις πρωτείνες που συμμετέχουν στις ανωτέρω αλλαγές ενοχοποιούνται για κάποιες από τις σπανιότερες μορφές της νόσου (2-5% των ασθενών) (12,20). Η ατελής οστεογένεση διακρίνεται σε πολλές μορφές με βάση την υποκείμενη γενετική διαταραχή και την κλινική προβολή της νόσου 20. Η παρουσία συμβατού οικογενειακού ιστορικού, μπλε σκληρών, διαταραχών της οδοντοφυίας, υπερελαστικότητας των αρθρώσεων καθώς και οστών μικρού μεγέθους (wormian bones) στο κρανίο συμβάλλουν στην διάγνωση 20.
Το σύνδρομο οστεοπόρωση ψευδογλοίωμα αποτελεί αυτοσωματικό υπολειπόμενο νόσημα που οφείλεται σε μεταλλάξεις στο γονίδιο LRP5 (loss of function) (12,21). Το γονίδιο LRP5 οδηγεί στην παραγωγή της LDL receptor-related protein 5, κορεσέπτορα στο μονοπάτι Wnt, μονοπάτι που έχει διαπιστωθεί τα τελευταία χρόνια να κατέχει σημαίνοντα ρόλο στις κυτταρικές διαδικασίες οστικής κατασκευής και ανακατασκευής (12,21). Η νόσος χαρακτηρίζεται από πρώιμη (σε παιδική ηλικία) εμφάνιση οστεοπόρωσης με συνοδό διαταραχή της όρασης (12,21). Μεταλλάξεις αλλά και πολυμορφισμοί στο ίδιο γονίδιο (LRP5) αλλά και στο γονίδιο LRP6 φαίνεται να σχετίζονται με ελαττωμένη κορυφαία οστική μάζα και οστική πυκνότητα στα παιδιά, μέσω της δράσης των στο μονοπάτι Wnt 12.
Το σύνδρομο Bruck, η κλειδοκρανιακή δυσπλασία, το σύνδρομο Hajdu–Cheney syndrome αλλά και νοσήματα του συνδετικού ιστού όπως είναι το σύνδρομο Ehlers–Danlos και Marfan αποτελούν σπάνια αίτια πρωτοπαθούς οστεοπόρωσης 12.
3.2. Δευτεροπαθής οστεοπόρωση
Χρόνια νοσήματα όπως η νεανική ιδιοπαθής αρθρίτιδα, τα νοσήματα του συνδετικού ιστού, τα ιδιοπαθή φλεγμονώδη νοσήματα του εντέρου, η ινοκυστική νόσος, η μεσογειακή αναιμία, συνοδεύονται από αυξημένο κίνδυνο εμφάνισης δευτεροπαθούς οστεοπόρωσης λόγω της επίδρασης του ίδιου του νοσήματος στα οστά (αυξημένη παραγωγή κυτοκινών, μειωμένη κινητικότητα, δυσαπορρόφηση, υποθρεψία, υποβιταμίνωση D, ορμονικές διαταραχές) αλλά και λόγω της χορηγούμενης φαρμακευτικής αγωγής 12. Παιδιά πάσχοντα από ρευματολογικά νοσήματα παρουσιάζουν ελαττωμένες τιμές BMC και αυξημένο κίνδυνο κατάγματος ακόμη και όταν δεν έχουν λάβει αγωγή με γλυκοκορτικοειδή καθώς η φλεγμονώδης διεργασία, μέσω της αυξημένης παραγωγής κυτταροκινών (IL 1, IL 6,TNFa) οδηγεί σε ανισορροπία ανάμεσα στην οστική παραγωγή και στην οστική απορρόφηση (αυξημένη οστική απορρόφηση ή/και ελαττωμένη οστική παραγωγή) με αποτέλεσμα περιαρθρική αλλά και γενικευμένη οστική απώλεια (12,22). Aνάλογη εικόνα παρουσιάζουν και τα παιδιά με νόσο Crohn όπου έχει διαπιστωθεί αυξημένη παραγωγή TNFa από τα ενεργοποιημένα Τ λεμφοκύτταρα 27. Στα παιδιά με χρόνια φλεγμονώδη νοσήματα η μειωμένη δραστηριότητα, η ελλιπής διατροφή, η αποφυγή της έκθεσης στον ήλιο και η χορηγούμενη φαρμακευτική αγωγή (κυρίως με γλυκοκορτικοειδή) συμβάλλουν περαιτέρω στην ελάττωση της αντοχής των οστών (12,22).
Άτομα πάσχοντα από μεσογειακή αναιμία φαίνεται να παρουσιάζουν ελαττωμένη οστική αντοχή και αυξημένο κίνδυνο κατάγματος, κυρίως στην νεαρή ενήλικο ζωή, λόγω της επέκτασης του μυελού των οστών από την ίδια τη νόσο αλλά και λόγω δευτεροπαθών ορμονικών διαταραχών (καθυστέρηση της ήβης, σακχαρώδης διαβήτης, έλλειψη αυξητικής ορμόνης, διαταραχή της λειτουργίας των παραθυρεοειδών) και άμεσης τοξικής δράσης του σιδήρου στις οστεοβλάστες (12,24). Η καθυστέρηση της ήβης, που οφείλεται κατά κύριο λόγο στην υπερφόρτωση του οργανισμού με σίδηρο (συχνές μεταγγίσεις) φαίνεται να παίζει σημαίνοντα ρόλο στη διαταραχή της ποιότητας των οστών 27.
Αυξημένο κίνδυνο για την εφάνιση παθολογικών καταγμάτων εμφανίζουν και παιδιά με κακοήθη νοσήματα του αιμοποιητικού συστήματος (λευχαιμία) ή/και ιστορικό μεταμόσχευσης μυελού των οστών λόγω τόσο της ιδιας της νόσου (διήθηση από λευχαιμικά κύτταρα) όσο και λόγω της χορηγούμενης φαρμακευτικής αγωγής 12. Μελέτη με περιφερική ποσοτική αξονική τομογραφία κνήμης σε παιδιά με ιστορικό μεταμόσχευσης μυελού των οστών (κατά μέσο όρο 7 χρόνια μετά) κατέδειξε σημαντικά επηρεασμένες τις παραμέτρους (μάζα-πυκνότητα) τόσο του σπογγώδους όσο και του φλοιώδους οστού 12. Αυξημένο κίνδυνο καταγμάτων διατρέχουν και τα παιδιά μετά από μεταμόσχευση συμπαγών οργάνων 24.
Το ορμονικό περιβάλλον είναι εξαιρετικά σημαντικό για την σωστή ανάπτυξη των οστών. Πριν την εφηβεία η αυξητική ορμόνη κατέχει τον πλέον σημαντικό ρόλο για την οστική αύξηση, μέσω της δράσης του αυξητικού παράγοντα της ινσουλίνης (Insulin Growth Factor 1 – IGF 1), ο οποίος ευοδώνει τη δράση των οστεοβλαστών 12. Παιδιά με έλλειψη αυξητικής ορμόνης έχουν ελαττωμένη οστική μάζα και μειωμένο μέγεθος οστών και μυικής μάζας σε σχέση με παιδιά αναλόγου ηλικίας 12. Στη διάρκεια της εφηβείας τα στεροειδή του φύλου αναλαμβάνουν το βασικότερο ρόλο 12. Παθήσεις που προκαλούν καθυστέρηση στην ήβη και δευτεροπαθή υπογοναδισμό (πχ νευρογενής ανορεξία) αλλά και νοσήματα που συνοδεύονται από πρωτοπαθή υπογοναδισμό όπως είναι το σύνδρομο Turner οδηγούν στην εμφάνιση δευτεροπαθούς οστεοπόρωσης 12.Παιδιά με σύνδρομο Turner φαίνεται να έχουν πριν την εφηβεία τον ίδιο κίνδυνο κατάγματος με υγιή παιδιά, ενώ στην ενήλικο ζωή ο κίνδυνος αυτός αυξάνεται, ανάλογα με την χρήση ή μη, ορμονικής υποκατάστασης14. Ο υπερθυροειδισμός, ο πρωτοπαθής υπερπαραθυροειδισμός, η υπερκορτιζολαιμία στα πλαίσια συνδρόμου Cushing και ο σακχαρώδης διαβήτης επηρεάζουν το ρυθμό οστικής κατασκευής/ανακατασκευής διαταράσσοντας την ποιότητα των οστών 12.
Νοσήματα που συνοδεύονται από ελαττωμένη φυσική δραστηριότητα όπως η εγκεφαλική παράλυση και η μυική δυστροφία Duchenne οδηγούν χαρακτηριστικά στην ελάττωση της οστικής αντοχής και την εμφάνιση καταγμάτων ευθραυστότητας 12. Ακόμη και βραχυχρόνια ακινητοποίηση ενός μικρού ασθενή οδηγεί σε μεγάλη απώλεια οστικής αντοχής λόγω έλλειψης φόρτισης των οστών και μείωσης της μυικής μάζας 12. Πολυάριθμες μελέτες καταδεικνύουν τον αυξημένο κίνδυνο κατάγματος σε παιδιά με μυική δυστροφία Duchenne, ακόμη και στα παιδια που δεν λαμβάνουν στεροειδή 14. Mελέτη με περιφερική ποσοτική αξονική τομογραφία (p QCT) κατέδειξε την αδυναμία αύξησης των οστών σε πλάτος (ελαττωμένη περιοστική περίμετρος) σε παιδιά με εγκεφαλική παράλυση λόγω της ελάττωσης των δυνάμεων που ασκούνται στα οστά από τους μύες 27.
Η επάρκεια σε ασβέστιο και βιταμίνη D αλλά και η επάρκεια σε διατροφικούς παράγοντες, όπως οι πρωτεΐνες, ο φώσφορος, το κάλιο, το μαγνήσιο, ο ψευδάργυρος, ο χαλκός και οι βιταμίνες A και C, είναι απαραίτητη για τη σωστή ανάπτυξη των οστών 12. Νοσήματα που συνοδεύονται από μειωμένη πρόσληψη τροφής όπως η νευρογενής ανορεξία, μειωμένη έκθεση στον ήλιο (απαραίτητη για την σύνθεση της βιταμίνης D) όπως τα χρόνια φλεγμονώδη νοσήματα αλλά και νοσήματα που προκαλούν δυσαπορρόφηση (κοιλιοκάκη, ιδιοπαθή φλεγμονώδη νοσήματα του εντέρου) οδηγούν σε δευτεροπαθή οστεοπόρωση 12.
H φαρμακευτική αγωγή που χορηγείται στα παιδιά με χρόνια νοσήματα οδηγεί συχνά σε ελαττωμένη αντοχή των οστών. Χαρακτηριστικό παράδειγμα αποτελούν τα γλυκοκορτικοειδή, φάρμακα που επηρεάζουν την ποιότητα των οστών δρώντας κυρίως στο σπογγώδες οστούν 12. Τα γλυκοκορτικοειδή αυξάνουν την δράση των οστεοκλαστών και επομένως την οστική απορρόφηση επηρεάζοντας τις οστεοκλάστες άμεσα αλλά και έμμεσα (μειωμένη απορρόφηση/αυξημένη αποβολή ασβεστίου, μειωμένη παραγωγή γοναδοτροπινών, στεροειδών του φύλου και IGF1 ) 12. Η άμεση δράση των γλυκοκορτικοειδών στις οστεοκλάστες επιτυγχάνεται μέσω της επίδρασής τους στο στο σύστημα RANK/RANKL-OPG Αναλυτικότερα,τα γλυκοκορτικοειδή ευοδώνουν τη σύνθεση του RANKL ενώ μειώνουν τη σύνθεση της οστεοπρωτογερίνης (OPG), προάγοντας έτσι τη λειτουργία των οστεοκλαστών13. Σε μακροχρόνια χορήγηση τα γλυκοκορτικοειδή ελαττώνουν και την οστική παραγωγή καθώς επάγουν την απόπτωση των ώριμων οστεοβλαστών και οστεοκυττάρων 12. Η μυοπάθεια λόγω της χρήσης γλυκοκορτικοειδών επιδεινώνει περαιτέρω τη δράση των στην ποιότητα των οστών 12.
Αντιεπιληπτικά φάρμακα, τα οποία επάγουν τον καταβολισμό της 1,25 (OH) βιταμίνης D, αντιπηκτική αγωγή καθώς και η χορήγηση υψηλής δόσης μεθοτρεξάτης (χαμηλές δόσεις σε παιδιά με ρευματολογικές παθήσεις δεν φαίνεται να δρούν στα οστά) οδηγούν επίσης στην εμφάνιση δευτεροπαθούς οστεοπόρωσης 22.
4. Προσέγγιση παιδιού με πιθανή οστεοπόρωση
Κάθε παιδί με παθολογικά κατάγματα (κατάγματα μετά από ήπιο τραυματισμό/κατάγματα ευθραυστότητας), εικόνα οστεοπενίας σε ακτινογραφίες οστών ή/και χρόνιο άλγος στα οστά πρέπει να ελέγχεται για πιθανή οστεοπόρωση 1. Ο ορισμός του παθολογικού (χαμηλής ενέργειας) κατάγματος στα παιδιά είναι ιδιαίτερα δυσχερής καθώς στην παιδική ηλικία και μέχρι την ηλικία των 16 ετών, 42-51% των αγοριών και 27-42 % των κοριτσιών θα παρουσιάσουν ένα τουλάχιστον κάταγμα 1. Τα κατάγματα αυτά αφορούν συνήθως τα άνω άκρα (πήχυς, φάλλαγγες και καρπο μετακάρπια οστά) και συνήθως εμφανίζονται πέριξ της ηλικίας των 11 χρονών στα κορίτσια και των 14 χρονών στα αγόρια (1,24). Η αυξημένη επίπτωση των καταγμάτων σε αυτές τις ηλικίες αποδίδεται στην αυξημένη δραστηριότητα των παιδιών την περίοδο αυτή αλλά και στην καθυστέρηση της οστικής επιμετάλλωσης στη διάρκεια της εφηβείας (η επιμετάλλωση έπεται κατά 0.5-0.7 έτη της αύξησης του ύψους/οστών) 1.
Πρόσφατος διαγνωστικός αλγόριθμος συστήνει περαιτέρω έλεγχο προς την κατεύθυνση της οστεοπόρωσης σε κάθε παιδί με 1 τουλάχιστον σπονδυλικό κάταγμα ή 2 τουλάχιστον κλινικά σημαντικά κατάγματα (κατάγματα μακρών οστών) πριν την ηλικία των 10 ετών ή 3 τουλάχιστον κλινικά σημαντικά κατάγματα πριν την ηλικία των 18 ετών, με την προυπόθεση βέβαια ότι τα κατάγματα αυτά προκλήθηκαν μετά από ήπιο ή μέτριας βαρύτητας τραυματισμό 12. Κατάγματα κρανίου, μύτης ή/και δαχτύλων χεριών ή ποδιών δεν θεωρούνται κλινικά σημαντικά 12.
Σε παιδιά με λιγότερα από 2 κλινικά σημαντικά κατάγματα μέχρι την ηλικία των 10 ετών ή λιγότερα από 3 κλινικά σημαντικά κατάγματα μέχρι την ηλικία των 18 ετών λαμβάνεται αναλυτικό ατομικό και οικογενειακό ιστορικό, γίνεται ενδελεχής κλινική εξέταση, εκτιμάται η επάρκεια σε βιταμίνη D και ασβέστιο καθώς και η επαρκής φυσική δραστηριότητα και συστήνεται παρακολούθηση 12 .
Σε παιδιά που κρίνεται σκόπιμος ο περαιτέρω έλεγχος προς την κατεύθυνση της οστεοπόρωσης λαμβάνεται αναλυτικό ατομικό ιστορικό που αφορά στα προηγηθέντα κατάγματα (ηλικία, μηχανισμός κάκωσης, θεραπεία/πρόοδος της πώρωσης του κατάγματος) καθώς και στην πιθανή παρουσία συμπτωματολογίας υποκείμενου νόσηματος 12. Λαμβάνεται οικογενειακό ιστορικό (παρουσία καταγμάτων / οστεοπόρωσης, νοσήματα του εντέρου στην οικογένεια κα) και το παιδί εκτιμάται κλινικά (αύξηση / στάδιο ενήβωσης, παρουσία μπλε σκληρών / κύφωσης / διαταραχών οδοντοφυίας, υπερεκτασιμότητα αρθρώσεων, οστικές παραμορφώσεις) 12. Στη συνέχεια γίνεται έλεγχος οστικής πυκνομετρίας με μέθοδο DXA, απεικονιστικός έλεγχος σπονδυλικής στήλης με απλές ακτινογραφίες και εκτενής εργαστηριακός έλεγχος προς αποκλεισμό αιτιών δευτεροπαθούς οστεοπόρωσης 12.
O εργαστηριακός έλεγχος καθορίζεται με βάση το ιστορικό και την κλινική εξέταση. Ενδεικτικά αναφέρονται:παιδί με χαμηλό ανάστημα, ανεξήγητη σιδηροπενική αναιμία ή/και συμπτώματα από το γαστρεντερικό θα ελεγχθεί προς την κατεύθυνση της κοιλιοκάκης, παιδί με οικογενειακό ιστορικό καταγμάτων και παρουσία μπλε σκληρών προς την κατεύθυνση της ατελούς οστεογένεσης κοκ. Ο εργαστηριακός έλεγχος περιλαμβάνει πάντοτε έλεγχο μεταβολισμού του ασβεστίου (ασβέστιο, φώσφορο, αλκαλική φωσφατάση, 25(ΟΗ)D, παραθορμόνη) προς αποκλεισμό διαταραχών επιμετάλλωσης 12. Μολονότι οι διαταραχές επιμετάλλωσης στην παιδική ηλικία (ραχίτιδα) συνοδεύονται στην πλειονότητα των περιπτώσεων από χαρακτηριστικά κλινικά ευρήματα (ραιβογονία, ραχιτικό κομβολόγιο, ραχιτικό βραχιόλιο κα), καλό είναι να θυμόμαστε ότι η ελλιπής επιμετάλλωση των οστών (ραχίτιδα-οστεομαλακία) δίδει στην DXA εικόνα ανάλογη με την παρουσία οστεοπόρωσης (χαμηλές τιμές BMC/a BMD). Οι δείκτες οστικού μεταβολισμού δεν φαίνεται να βοηθούν στην αιτιολογική διάγνωση της οστεοπόρωσης στην παιδική και εφηβική ηλικία, χρησιμοποιούνται ωστόσο στην παρακολούθηση της θεραπείας, αν αυτή χορηγηθεί 13. Οι δείκτες οστικού μεταβολισμού που συνήθως χρησιμοποιούνται είναι το προπεπτίδιο του τύπου 1 προκολλαγόνου (P1NP) και το καρβοξυτελικό προπεπτίδιο του τύπου 1 κολλαγόνου (P1CP) ως δείκτες οστικής παραγωγής και το καρβοξυ- (CTX) και αμινοξυ- τελικό (NTX) τελοπεπτίδιο του κολλαγόνου τύπου 1 ως δείκτες οστικής απορρόφησης 13. H αξιολόγηση των δεικτών αυτών γίνεται σε σύγκριση με τις τιμές παιδιών αναλόγου φύλου και ηλικίας 13.
Στα παιδιά με ιστορικό παθολογικών καταγμάτων, πριν τον οποιονδήποτε έλεγχο προς την κατεύθυνση της αιτιολογικής διάγνωσης θα πρέπει να ελέγχεται το ενδεχόμενο κακοποίησης. Ιδιαίτερη προσοχή απαιτείται επίσης στα παιδιά με παρουσία ενός ή περισσοτέρων σπονδυλικών καταγμάτων που προκλήθηκαν μετά από ήπιο τραυματισμό καθώς, σπάνια, η εμφάνιση σπονδυλικών καταγμάτων αποτελεί την πρώτη εκδήλωση οξείας λεμφοκυτταρικής λευχαιμίας, ακόμη και πριν την εμφάνιση διαταραχών στο περιφερικό αίμα 1.
5. Διάγνωση της οστεοπόρωσης στην παιδική – εφηβική ηλικία
Αν και η μέθοδος DXA παραμένει η μέθοδος εκλογής για την απεικόνιση των οστών στην παιδική και εφηβική ηλικία, τα αποτελέσματά της δεν επαρκούν για τη διάγνωση της νεανικής οστεοπόρωσης (1,2). Στην ενήλικο ζωή μεγάλες επιδημιολογικές μελέτες έχουν συσχετίσει σαφώς την επιφανειακή πυκνότητα επιμεταλλωμένου οστού (areal BMD), όπως αυτή υπολογίζεται με την μέθοδο DXA, με τον κίνδυνο κατάγματος (1,2) . Για το λόγο αυτό στους ενήλικες τιμές areal BMD χαμηλότερες απο 2.5 σταθερές αποκλίσεις από τις αντίστοιχες τιμές νεαρών ενηλίκων (T-score < −2.5) στοιχειοθετούν την διάγνωση της οστεοπόρωσης (1,2). Κάτι αντίστοιχο δεν συμβαίνει με τα παιδιά. Μελέτες που προσπαθούν να συσχετίσουν χαμηλές τιμές οστικής μάζας (BMC) ή/και επιφανειακής οστικής πυκνότητας (areal BMD), όπως αυτά υπολογίζονται με τη μέθοδο DXA, με αυξημένο κίνδυνο κατάγματος στα παιδιά δίδουν αντικρουόμενα αποτελέσματα, γεγονός που πιθανώς οφείλεταιστις δυσκολίες ερμηνείας των αποτελεσμάτων DXA στον αυξανόμενο οργανισμό 1. Η κλινική σημασία της ανεπίπλεκτης (χωρίς την παρουσία καταγμάτων ευθραυστότητας) χαμηλής areal BMD/BMC στην παιδική ηλικία παραμένει έτσι ασαφής1.
Η διάγνωση της οστεοπόρωσης στα παιδιά και στους εφήβους τίθεται όταν συνυπάρχουν χαμηλές τιμές BMC ή/και a BMD (≤ -2 σταθερές αποκλίσεις σε σχέση με τις τιμές αναφοράς παιδιών αναλόγου φύλου, ηλικίας και μεγέθους οστών, z score ≤ – 2) σε συνδυασμό με την παρουσία κλινικά σημαντικού κατάγματος 3. Ως κλινικά σημαντικό θεωρείται το κάταγμα μακρών οστών των κάτω άκρων, το σπονδυλικό κάταγμα ή η παρουσία τουλάχιστον δύο καταγμάτων μακρών οστών των άνω άκρων, όταν βέβαια αυτά έχουν συμβεί μετά από χαμηλής βίας τραυματισμό (κατάγματα ευθραυστότητας) 3.
6. Θεραπεία
6.1. Υποστηρικτική αγωγή
Όλα τα παιδιά που πάσχουν από οστεοπόρωση πρέπει να ελέγχονται για την πιθανή παρουσία παραγόντων που επιβαρύνουν ή ευοδώνουν τη νόσο (πίνακας 3 ).
Πίνακας 3. Παράγοντες που επιβαρύνουν την διαταραχή στην ποιότητα των οστών
| 1. | Μειωμένη πρόσληψη τροφής / Mειωμένη πρόσληψη ασβεστίου |
| 2. | Μειωμένη δραστηριότητα / Μειωμένο μηχανικό φορτίο στα οστά |
| 3. | Ελαττωμένη έκθεση στον ήλιο |
| 4. | Aυξημένη πρόσληψη αναψυκτικών / Kάπνισμα |
| 5. | Μειωμένη έκκριση ορμονών του φύλου |
Η σωστή διατροφή, ειδικά η επαρκής πρόσληψη ασβεστίου, πρωτεινών και βιταμίνης D, παίζει καθοριστικό ρόλο στην ανάπτυξη των οστών 23. Τυχόν ελαττωμένη πρόσληψη ασβεστίου πρέπει να διορθώνεται, κατά πρότιμηση με διατροφικές παρεμβάσεις 24. Η κάλυψη των αναγκών σε ασβέστιο μέσω της διατροφής βοηθά στην αποφυγή παρενεργειών (δυσκοιλιότητα, κοιλιακό άλγος, μετεωρισμός) που συνοδεύουν τη χρήση συμπληρωμάτων ασβεστίου 23. Αν και δεν υπάρχει ομοφωνία σχετικά με τα βέλτιστα επίπεδα βιταμίνης D (25(ΟΗ)D) στα παιδιά, τιμές μεγαλύτερες από 20 ng/ml θεωρούνται επαρκείς και τιμές άνω των 32 ng/ml βέλτιστες για την σωστή ανάπτυξη των οστών 12. Η έλλειψη βιταμίνης D οδηγεί σε δευτεροπαθή υπερπαραθυρεοειδισμό με καταστροφικές συνέπειες για το οστούν 23. Συμπληρώματα βιταμίνης D χορηγούνται σε παιδιά με χαμηλή τιμή βιταμίνης D, ειδικά όταν συνυπάρχουν παράγοντες κινδύνου όπως ιστορικό προωρότητας, μακροχρόνιος μητρικός θηλασμός χωρίς συμπληρωματική χορήγηση βιταμίνης, δυσαπορρόφηση ή αποφυγή έκθεσης στον ήλιο λόγω υποκείμενου νοσήματος (νοσήματα συνδετικού ιστού)24. Η δόση αλλά και η διάρκεια χορήγησης εξαρτάται από την παρουσία ή μη υποκείμενου νοσήματος: παιδιά με ινοκυστική νόσο χρειάζονται συνεχώς μεγαλύτερο ποσό βιταμίνης D, παιδιά με δυσαπορρόφηση (π.χ. κοιλιοκάκη) πρέπει να λαμβάνουν μεγαλύτερες ποσότητες βιταμίνης D μέχρι να τεθεί η νόσος σε πλήρη έλεγχο, παιδιά που συστηματικά αποφεύγουν τον ήλιο ή λαμβάνουν φάρμακα που διαταράσσουν τον μεταβολισμό της βιταμίνης D πρέπει να λαμβάνουν μακροχόνια αγωγή (23,27) Η αυξημένη κατανάλωση αναψυκτικών φαίνεται να δρά επιβλαβώς στην μάζα των οστών,όπως προκύπτει από μελέτες ειδικά σε κορίτσια, και πρέπει να αποφεύγεται 23.
Η επαρκής φυσική δραστηριότητα θεωρείται ιδιαίτερα σημαντική για τη σωστή ανάπτυξη των οστών καθώς η αύξηση της φυσικής δραστηριότητας σχετίζεται με αύξηση της BMD τόσο σε υγιή παιδιά όσο και σε παιδιά πάσχοντα από χρόνια νοσήματα (12,23). Προτιμώνται οι ασκήσεις που ασκούν μεγαλύτερο μηχανικό φορτίο στα οστά 23. Μελέτες σε παιδιά με μειωμένη κινητικότητα έδειξαν ότι η αύξηση του χρόνου ορθοστάτησης ή/και ήπιας φυσικής δραστηριότητας οδήγησαν σε αύξηση της οστικής πυκνότητας τόσο στην σπονδυλική στήλη όσο και στο ισχίο 24. Η χρησιμοποίηση πλατφόρμας δόνησης σε μικρό αριθμό παιδιών με κινητικά προβλήματα έδειξε σημαντικά αποτελέσματα στην αύξηση της οστικής πυκνότητας στην κνήμη, απαιτούνται ωστόσο μελέτες σε μεγαλύτερο αριθμό ασθενών προκειμένου να καθιερωθεί η ευρεία χρήση της μεθόδου αυτής 24. Υπερβολικά έντονη άσκηση μπορεί να επιφέρει το αντίθετο αποτέλεσμα, όπως έχει παρατηρηθεί σε παιδιά με νευρογενή ανορεξία που αθλούνται υπερεντατικά 23.
Μειωμένη έκκριση στεροειδών του φύλου πρέπει να διορθώνεται προκειμένου να εξασφαλίζεται το κατάλληλο ορμονικό περιβάλλον για την ανάπτυξη των οστών 23.
6.2. Πρωτοπαθής οστεοπόρωση
Παιδιά με μέτριας/σημαντικής βαρύτητας ατελή οστεογένεση καθώς και παιδιά που πάσχουν από σύνδρομο οστεοπόρωση-ψευδογλοίωμα χρήζουν φαρμακευτικής αγωγής προς αποφυγή αυξημένου αριθμού καταγμάτων 23. Τα διφωσφονικά, χημικά ανάλογα του πυροφωσφορικού που δρουν ελαττώνοντας την δράση των οστεοκλαστών, παραμένουν τα φάρμακα εκλογής για την νεανική οστεοπόρωση (12,24). Αν και υπάρχει πολλές κατηγορίες διφωσφονικών που διαφέρουν στη χημική δομή, την οδό χορήγησης και την δραστικότητα, οι περισσότερες μελέτες στα παιδιά έχουν γίνει με την χορήγηση παμιδρονάτης, ενός ενδοφλεβίως χορηγούμενου διφωσφονικού 24. Η χορήγηση παμιδρονάτης σε μεγάλο αριθμό παιδιών με ατελή οστεογένεση (χορήγηση 1-3 mg/kg ενδοφλεβίως κάθε 3-4 μήνες) συνέβαλλε στην μείωση του οστικού πόνου στην περιοχή των καταγμάτων και στην ελάττωση του αριθμού των καταγμάτων (12,23). Ανάλογα αποτελέσματα έχει και η ενδοφλέβια χορήγηση ζολενδρονικού οξέος, που χρησιμοποιείται ιδιαίτερα τα τελευταία χρόνια, ενώ μελέτες με από του στόματος χορηγούμενα διφωσφονικά δίνουν αντικρουόμενα αποτελέσματα 12. Η διάρκεια της θεραπείας δεν είναι σαφώς καθορισμένη 13.
Η χορήγησή των διφωσφονικών φαίνεται να είναι καλά ανεκτή από τα παιδιά 23. Συχνά παρατηρείται γριππώδης συνδρομή μετά την πρώτη έγχυση ενδοφλέβιου διφωσφονικού ενώ περιστασιακά έχουν αναφερθεί περιστατικά οισοφαγίτιδας σε παιδιά που λαμβάνουν αγωγή από το στόμα 23. Προσοχή απαιτείται στην περιπτωση προυπάρχουσας υποβιταμίνωσης D ή υποπαραθυρεοειδισμού όπου η χορήγηση των διφωσφονικών μπορεί να προκαλέσει σοβαρή υπασβεστιαιμία 24. Ελάχιστα περιστατικά ραγοειδίτιδας, σκληρίτιδας ή/και παροδικής ελάττωσης του αριθμού των λεμφοκυττάρων έχουν επίσης αναφερθεί 23. Οι προβληματισμοί που αφορούσαν την επίδραση της αγωγής με διφωσφονικά στην αύξηση/έναρξη της εφηβείας ή/και τις επιφυσιακές πλάκες δεν έχουν επιβεβαιωθεί 23. Όταν τα διφωσφονικά χορηγούνται πριν τη σύγκλειση των επιφύσεων, σκληρυντικές γραμμές εμφανίζονται στις μεταφύσεις των μακρών οστών, χωρίς ωστόσο να επηρεάζεται η σκελετική αύξηση 23. Η ικανότητα των διφωσφονικών να εναποτίθενται στις οστικές επιφάνειες με αυξημένο ρυθμό οστικού μεταβολισμού (σπογγώδες οστούν) για μεγάλο χρονικό διάστημα (χρόνος ημίσειας ζωής αρκετά έτη) έχει προκαλέσει μεγάλο αριθμό συζητήσεων σχετικά με την ασφάλεια χορήγησής τους στα παιδιά 27. Οι Παπαπούλος και Cremers κατέδειξαν αποβολή διφωσφονικών από τα ούρα ασθενών κατά μέσο όρο 7.7 χρόνια μετά τη διακοπή της αγωγής 27. Μολονότι έμβρυα/νεογνά γυναικών που βρίσκονταν σε αγωγή με διφωσφονικά στη φάση της σύλληψης δεν εμφάνισαν ανεπιθύμητες ενέργειες, τα φάρμακα αυτά διέρχονται τον πλακούντα και η χορήγησή τους σε κορίτσια αναπαραγωγικής ηλικίας πρέπει να γίνεται με προσοχή και να συνοδεύεται από αυστηρές μεθόδους αντισύλληψης (14,23). Περιστατικό οστεονέκρωσης της γνάθου σε παιδιά/εφήβους που λαμβάνουν αγωγή με διφωσφονικά δεν έχει αναφερθεί, συνιστάται ωστόσο η εκτίμηση από οδοντίατρο πριν την έναρξη της αγωγής με διφωσφονικά και συνεχίζει να προβληματίζει η χορήγησή τους σε εφήβους όπου είναι συνήθη τα ορθοδοντικά προβλήματα 13.
Η χορήγηση άλλων φαρμακευτικών σκευασμάτων πλην των διφωσφονικών σε παιδιά και εφήβους δεν έχει στοιχειοθετηθεί 23. Αναβολικοί παράγοντες όπως η τεριπαρατίδη έχουν συσχετιστεί με την εμφάνιση οστεοσαρκώματος στον αυξανόμενο οργανισμό και πρέπει να αποφεύγονται 23.
Για την πλειονότητα των υπόλοιπων μορφών πρωτοπαθούς οστεοπόρωσης δεν υπάρχουν σαφείς οδηγίες σε ότι αφορά τη χορήγηση ή μη φαρμακευτικής αγωγής 23. Αν και έχει δοθεί αγωγή με διφωσφονικά σε ορισμένα περιστατικά ιδιοπαθούς νεανικής οστεοπόρωσης, δεν συνιστάται η ευρεία χρήγηση διφωσφονικών στους ασθενείς αυτούς με δεδομένη την αυτόματη ύφεση της νόσου λίγα χρόνια μετά την εμφάνισή της 23.
6.3. Δευτεροπαθής οστεοπόρωση
Τη βάση της θεραπευτικής αγωγής όλων των περιστατικών δευτεροπαθούς οστεοπόρωσης αποτελεί ο έλεγχος της δραστηριότητας του υποκείμενου νοσήματος 23. Αυστηρή δίαιτα άνευ γλουτένης σε παιδιά πάσχοντα από κοιλιοκάκη προστατεύει από την επιβλαβή δράση της νόσου στα οστά 23. Ύφεση της νόσου σε παιδιά με νεανική ιδιοπαθή αρθρίτιδα οδηγεί στην μειωμένη έκκριση φλεγμονωδών κυττοκινών διακόπτωντας την επιδείνωση της περιαρθρικής αλλά και γενικευμένης οστεοπόρωσης 23. Παιδιά με ανθεκτική στην μεθοτρεξάτη πολυαρθρική μορφή νεανικης ιδιοπαθούς αρθρίτιδας παρουσίασαν σημαντική αύξηση στην BMD στην σπονδυλική στήλη μετά τον έλεγχο της νόσου με χορήγηση βιολογικού (anti TNF) παράγοντα 22. Όταν η αντιμετώπιση του υποκείμενου νοσήματος απαιτεί τη χορήγηση φαρμάκων επιβλαβών για τα οστά (πχ γλυκοκορτικοειδή) συνιστάται η χορήγηση της μικρότερης δόσης για το μικρότερο δυνατό χρονικό διάστημα 23.
Η συστηματική χορήγηση φαρμακευτικής αγωγής (διφωσφονικών) σε παιδιά με δευτεροπαθή οστεοπόρωση δεν συνιστάται ευρέως με βάση τα σημερινά βιβλιογραφικά δεδομένα,έχει ωστόσο δοκιμασθεί σε πολλές μελέτες με καλά αποτελέσματα 23. Η πλειονότητα των μελετών αυτών καταδεικνύει αύξηση της BMD μετά τη χορήγηση διφωσφονικών, ενώ λίγες είναι οι μελέτες που αναφέρουν και μείωση στον αριθμό των καταγμάτων (22,23,26,28,29) . Επιπλέον, η προληπτική χορήγηση διφωσφονικών σε παιδιά που πάσχουν από νοσήματα που προκαλούν δευτεροπαθή οστεοπόρωση και έχουν χαμηλή BMD δεν συνιστάται 22. Αντίθετα με τις οδηγίες που υπάρχουν για τους νεαρούς ενήλικες, δεν χορηγούνται προληπτικά διφωσφονικά σε παιδιά που λαμβάνουν μακροχρόνια αγωγή με γλυκοκορτικοειδή, ακόμη και αν τα παιδιά αυτά παρουσιάζουν ελαττωμένη οστική πυκνότητα, μολονότι στο θέμα αυτό υπάρχει διχογνωμία (12,24). Απαιτούνται περισσότερες μελέτες που να καταδεικνύουν μείωση του αριθμού των καταγμάτων μετά τη χορήγηση διφωσφονικών σε παιδιά με υποκείμενο νόσημα και χαμηλή BMD, ώστε να δικαιολογείται η προφυλακτική χορήγησή τους στην παιδική ηλικία 24.
7. Παρακολούθηση παιδιών με οστεοπόρωση
Η παρακολούθηση των παιδιών με οστεοπόρωση γίνεται κλινικά, με έλεγχο της αύξησης και του αριθμού των καταγμάτων και εργαστηριακά με έλεγχο του μεταβολισμού του ασβεστίου και διενέργεια οστικής πυκνομετρίας DXA. Σε παιδιά που λαμβάνουν αγωγή με διφωσφονικά χρησιμοποιούνται και οι δείκτες οστικού μεταβολισμού, οι τιμές των οποίων εκτιμώνται πάντα με βάση τιμές αναφοράς παιδιών αναλόγου φύλου και ηλικίας.23.
Με βάση τις πρόσφατες οδηγίες της ISCD, μέτρηση με DXA πρέπει να γίνεται κατά την πρωτοδιάγνωση σε όλα τα πρωτοπαθή νοσήματα των οστών αλλά και σε χρόνια φλεγμονώδη νοσήματα,ενδοκρινολογικές παθήσεις (που δυνητικά προσβάλλουν τον σκελετό),παιδιά με νευρογενή ανορεξία και παιδιά που πρόκειται να υποβληθούν σε μεταμόσχευση 24. Παιδιά με θαλασσαιμία συστήνεται να κάνουν μέτρηση στην ηλικία των 10 ετών ή όταν υποστούν κάταγμα, όποιο από τα δύο συμβεί νωρίτερα 24. Σε παιδιά με εγκεφαλική παράλυση συστήνεται να γίνεται μέτρηση μετά την εμφάνιση του πρώτου κατάγματος, εφόσον βέβαια οι υπάρχουσες συγκάμψεις επιτρέπουν την ασφαλή αλλά και σωστή τοποθέτηση του παιδιού στο μηχάνημα οστικής πυκνομετρίας 24. Σε παιδιά με σύνδρομο Turner δεν συστήνεται να γίνεται μέτρηση με DXA στην παιδική ηλικία καθώς οι ασθενείς αυτοί δεν φαίνεται να διατρέχουν αυξημένο κίνδυνο κατάγματος πριν την ενήλικο ζωή 24. Για παιδιά με οξεία λεμφοβλαστική λευχαιμία που έχουν πτωχή ανάπτυξη ή/και διατροφή ή γνωστή ενδοκρινοπάθεια (π.χ. ιστορικό ακτινοβόλησης στο κρανίο) συστήνεται η διενέργεια DXA επί εμφάνισης κατάγματος ή οστικού άλγους 24.Με βάση τις οδηγίες της ISCD δεν υπάρχουν σαφή μεσοδιαστήματα για την επανάληψη της μέτρησης DXA ανάλογα με το υποκείμενο νόσημα. Συστήνεται το μεσοδιάστημα ανάμεσα σε δύο μετρήσεις DXA να μην είναι μικρότερο από 6 μήνες 24.
Βιβλιογραφία
- Bianchi M L. Osteoporosis in children and adolescents. Bone 2007;41: 486–495
- Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996; 312:1254–9
- Rauch F, Plotkin H, DiMeglio L, Engelbert RH, Henderson RC, Munns C et al. Fracture Prediction and the Definition of Osteoporosis in Children and Adolescents: The ISCD 2007 Pediatric Official Positions. Journal of Clinical Densitometry: Assessment of Skeletal Health 2008; 11 (1): 22-28
- Binkovitz LA,Henwood MJ. Pediatric DXA: technique and interpretation Pediatr Radiol. 2007; 37(1): 21–31
- Leonard MB, Zemel BS. Assessment of Bone Mineralization in Children and Adolescents. Clinical Reviews in Bone and Mineral Metabolism 2004; 2: 3-18
- Seeman E. Bone quality: the material and structural basis of bone strength. J Bone Miner Metab 2008;26:1-8
- Petit MA, Beck TJ,Kontulainen SA. Examining the developing bone: What do we measure and how do we do it?. J Musculoskelet Neuronal Interact 2005;5:213-224
- Zemel B, Bass S, Binkley T,Ducher G,Macdonald H,Moyer-Mileur L et al. Peripheral Quantitative Computed Tomography in Children and Adolescents: The 2007 ISCD Pediatric Official Positions. Journal of Clinical Densitometry: Assessment of Skeletal Health 2008;11: 59-74
- Stathopoulos KD, Katsimbri P, Atsali E, Metania E,.Zoubos AB and Skarantavos G. Age-Related Differences of Bone Mass, Geometry, and Strength in Treatment Naive Postmenopausal Women.A Tibia pQCT Study. Journal of Clinical Densitometry: Assessment of Skeletal Health 2011;14 (1):33-40
- Atsali E, Zoubos AB, Stathopoulos KD, Stefos E, Bournazos I, Papadimitriou A et al. Estimation of bone strength parameters and response to treatment in McCune Albright syndrome using Peripheral Quantitative Computed Tomography (pQCT) of the tibia. Case report. J Clin Densitom 2012;15(4):461-6
- Specker BL, Schonenau E.Quantitive bone analysis in children : current methods and recommendations. J Pediatr 2005;146:726-731
- Uziel Y , Zifman E, Hashkes PJ. Osteoporosis in children: pediatric and pediatric rheumatology perspective: a review. Pediatric Rheumatology 2009; 7:16
- Bishop N, Braillon P, Burnham J,Cimaz R,Davies J, Fewtrell M et al. Dual-Energy X-ray Aborptiometry Assessment in Children and Adolescents with Diseases that May Affect the Skeleton: The 2007 ISCD Pediatric Official Positions. Journal of Clinical Densitometry: Assessment of Skeletal Health 2008;11: 29-42
- Ferrari S,Bianchi M. L,. Eisman JA,Foldes AJ,Adami S,Wahl A et al. Osteoporosis in young adults: pathophysiology, diagnosis and management. Osteoporos Int;published on line 9 June 2012
- Κrassas GE. Idiopathic Juvenile Osteoporosis. Annals of the New York Academy of Sciences 2000;900:409-412
- Lorenc RS. Idiopathic Juvenile Osteoporosis.Calcif Tissue Int 2002; 70:395-397
- Rauch F, Travers R Norman ME, Taylor A, Parfitt AM ,Glorieux FH. Τhe Bone Formation Defect in Idiopathic Juvenile Osteoporosis is Surface Specific. Bone 2002; 31:85-89
- Cundy T. Recent Advances in Osteogenesis Imperfecta. Calfif Tissue Int 2012;90:439-449
- Streeten EA, McBride D,Puffenberger E,Hoffman ME,Pollin TI,Donelly P et al. Osteoporosis- Pseudoglioma syndrome: Description of 9 new cases and beneficial respond to bisphosphonatesd.Bone 2008;43:584-590
- Smith EMD, Foster1 HE, Beresford MW. Adding to complexity: comorbidity in paediatric rheumatic disease. Rheumatology 2013;52:22-33
- Bianchi M. How to manage osteoporosis in children. Best Practice & Research Clinical Rheumatology 2005;19: 991–1005,
- Shaw NJ. Management of osteoporosis in children. European Journal of Endocrinology 2008;159 S33–S39
- Miller PD. Unrecognized and Unappreciated Secondary Causes of Osteoporosis. Endocrinol Metab Clin N Am2012; 41:613–628
- Thornton J, Ashcroft DA, Mughal MZ,Ellioti LR,O’Neill TW,Symmons D. Systematic review of effectiveness of bisphosphonates in treatment of low bone mineral density and fragility fractures in juvenile idiopathic arthritis. Arch Dis Child 2006;91:753_61.
- Papapoulos SE, Cremers SC: Prolonged bisphosphonate release after treatment in children. N Engl J Med 2007;356:1075-1076.
- Fehlings D, Switzer L, Agarwal P, Wong C, Sochett E, Stevenson R et al. Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: a systematic review. Dev Med Child Neurol 2012; 54:106-16
- Bachrach SJ, Kecskemethy HH, Harcke HT, Hossain J. Decreased fracture incidence after 1 year of pamidronate treatment in children with spastic quadriplegic cerebral palsy. Dev Med Child Neurol 2010 52:837-42
- Thornton J, Ashcroft D, O’Neill T, Elliott R, Adams J, Roberts C et al. A systematic review of the effectiveness of strategies for reducing fracture risk in children with juvenile idiopathic arthritis with additional data on long-term risk of fracture and cost of disease management. Health Technol Assess 2008;12:121-208
- Outi M. Causes, mechanisms and management of paediatric osteoporosis. Nat Rev Rheumatol 2013;9:465-475
- Rauch F, Travers R, Norman ME, Taylor A, Parfitt AM ,Glorieux FH. Deficient Bone Formation in Idiopathic Juvenile Osteoporosis: A Histomorphometric Study of Cancellous Iliac Bone. J Bone Miner Res 2000;15:957-963
Created: February 25, 2015
Last update: February 25, 2015

