Στέλλα Καουρή, Βάνια Βλασοπούλου
Τμήμα Ενδοκρινολογίας – Διαβητολογικό Κέντρο
ΓΝΑ «Ο Ευαγγελισμός», Αθήνα
Εισαγωγή
Η Τοξική Πολυοζώδης Βρογχοκήλη (ΤΠΒ) ορίζεται η κατάσταση στην οποία τουλάχιστον ένας (τοξικό αδένωμα- ΤΑ) ή περισσότεροι όζοι του θυρεοειδούς, –συνήθως σε έδαφος γνωστής προϋπάρχουσας οζώδους θυρεοειδικής νόσου– αυτονομούνται και υπερλειτουργούν. Το τοξικό αδένωμα αναφέρεται στη βιβλιογραφία και ως νόσος του Plummer αφού περιγράφηκε πρώτη φορά το 1913 από τον Henry Plummer. Η ΤΠΒ αποτελεί το δεύτερο σε συχνότητα αίτιο υπερθυρεοειδισμού μετά από τη νόσο Graves σε ιωδιοεπαρκείς περιοχές (1,2) . Σε ιωδιοπενικές περιοχές έχει αναφερθεί και σαν πρώτο σε συχνότητα αίτιο και φθάνει ως 60% των περιπτώσεων υπερθυρεοειδισμού (3) .
Η οζώδης θυρεοειδική νόσος, επί απουσίας αντιθυρεοειδικών αντισωμάτων, βάσει επιδημιολογικών μελετών εμφανίζει υψηλή επίπτωση σε ιωδιοπενικές περιοχές (2). Ο θυρεοειδής εμφανίζει μονήρη όζο ή πολλαπλούς όζους (πολυοζώδης) που αποτελεί και τη συνηθέστερη περίπτωση. Οι όζοι ενδέχεται να εμφανίζουν με την πάροδο των ετών προοδευτική αύξηση τόσο του αριθμού όσο και του μεγέθους τους ή παράλληλα κάποιοι να εμφανίζουν κυστική εκφύλιση και ενίοτε κάποιοι αιμορραγία και εκφύλιση. Η θυρεοειδική λειτουργία αποτελεί τη συνισταμένη ισορροπιών μεταξύ σχετικής αυτονομίας των όζων και πιθανής καταστολής του παρακείμενου θυρεοειδικού παρεγχύματος και αποτελεί μια δυναμική κατάσταση με πιθανότητα εξέλιξης σε πλήρη αυτονομία («εν δυνάμει» αυτονομία). Η αυτονομία έχει συσχετισθεί θετικά με τον αριθμό των όζων, αλλά και την αύξηση της ηλικίας του ασθενούς (4). Συνήθως υπάρχει για πολλά έτη (4) ευθυρεοειδισμός (φυσιολογική τιμή TSH, τιμές θυρεοειδικών ορμονών εντός φυσιολογικών ορίων), ο οποίος όμως στη συνέχεια μπορεί να εξελιχθεί σε υποκλινικό υπερθυρεοειδισμό (5) (κατεσταλμένη TSH, τιμές θυρεοειδικών ορμονών εντός φυσιολογικών ορίων) και ακολούθως να εμφανισθεί κλινικός υπερθυρεοειδισμός λόγω εγκατάστασης πλήρους θυρεοειδικής αυτονομίας (κατεσταλμένη TSH, αυξημένες τιμές θυρεοειδικών ορμονών). Στις δύο τελευταίες περιπτώσεις η κατάσταση χαρακτηρίζεται ως «τοξική» και οι όζοι παράγουν θυρεοειδικές ορμόνες ανεξάρτητα από τη δράση της TSH.
1. Επιδημιολογία
Η εμφάνιση της ΤΠΒ οφείλεται σε πολλούς παράγοντες, οι οποίοι αφορούν στην ιωδιο-επάρκεια της εξεταζόμενης περιοχής, στις μεταβολές πρόσληψης ιωδίου μέσω της διατροφής σε προγενέστερα ιωδιοπενικές περιοχές, στο φύλο και στην ηλικία. Η ΤΠΒ είναι 5 φορές συχνότερη στις γυναίκες σε σύγκριση με τους άνδρες και η επίπτωση της νόσου αυξάνεται με την παροδο της ηλικίας (1, 6).
Σε ιωδιοπενικές περιοχές η ΤΠΒ αφορά στο 58% περίπου των περιπτώσεων υπερθυρεοειδισμού, ενώ το ΤΑ το 10%. Ο παγκόσμιος χάρτης καταγραφής των περιοχών με ιωδιο-επάρκεια και ιωδιο-ανεπάρκεια έχει τροποποιηθεί δραματικά την τελευταία εικοσαετία, μετά τη δημιουργία στοχευμένων προγραμμάτων ιωδίωσης του μαγειρικού άλατος (3), με κύριο στόχο τη μείωση των διαταραχών που προκαλούνταν από την ιωδιοπενία. Το 2001 (3) 68% των νοικοκυριών σε πρώην ιωδιοπενικές περιοχές είχε πρόσβαση σε ιωδιωμένο αλάτι σε παγκόσμιο επίπεδο σε σύγκριση με 10% μια δεκαετία νωρίτερα. Στην Ευρώπη περί τα τέλη του 1990, 32 χώρες είχαν ακόμα περιοχές με ήπια ως σοβαρή ιωδιοπενία. Οι πιο ιωδιοπενικές χώρες ήταν αυτές της Ανατολικής Ευρώπης, αλλά και η Δυτική Ευρώπη παρέμενε επηρεασμένη. Εθνικές μελέτες που έγιναν σε 11 χώρες ανέδειξαν –με εξαίρεση την Ολλανδία– ότι καμία δεν είχε φτάσει σε πλήρη ιωδιο-επάρκεια. Στην Ευρώπη, λοιπόν, η πρόσβαση σε ιωδιωμένο αλάτι το 1990 ήταν 5-10% και αυξήθηκε σε 28% το 1999, εντούτοις κατά πολύ χαμηλότερο σε σύγκριση με το παγκόσμιο ποσοστό (7).
Τα επιδημιολογικά δεδομένα από δημοσιεύσεις ανά χώρα μετά τα προγράμματα ιωδίωσης αναφέρουν μία παροδική αύξηση της επίπτωσης του υπερθυρεοειδισμού (7, 8) και ειδικότερα των περιπτώσεων ΤΠΒ σε άτομα άνω των 50 ετών (Ολλανδία (7)), εύρημα σχετικά αναμενόμενο ανατρέχοντας στους παθοφυσιολογικούς μηχανισμούς πρόσληψης του ιωδίου από τον θυρεοειδή αδένα. Το φαινόμενο αυτό αρχικά παρατηρήθηκε στην Τασμανία (9) το 1960, όταν η επίπτωση των περιπτώσεων υπερθυρεοειδισμού αυξήθηκε ραγδαία μετά από πρόγραμμα ταχείας χορήγησης συμπληρωμάτων ιωδίου στη διατροφή. Παρόμοια αύξηση της επίπτωσης του υπερθυρεοειδισμού και ειδικότερα της ΤΠΒ σε άτομα ηλικίας άνω των 60 ετών παρατηρήθηκε και στην Ισπανία, την Ελβετία, τη Ζιμπάμπουε και το Κογκό.
Σε μία μελέτη του 1980 (10), πριν από την ιωδίωση του μαγειρικού άλατος, αυτόνομοι θυρεοειδικοί όζοι (ΤΠΒ) παρατηρήθηκαν στο 57% των ασθενών με ηλικία μεγαλύτερη των 60 ετών σε αντίθεση με ένα πολύ χαμηλότερο ποσοστό της τάξεως του 13% σε μικρότερους σε ηλικία ασθενείς. Επιπλέον σχεδόν όλοι οι τοξικοί όζοι είχαν μέγεθος μεγαλύτερο των 3εκ.
Πρόσφατες επιδημιολογικές μελέτες σε διάφορες χώρες αναφέρουν ένα ευρύ φάσμα συχνότητας εμφάνισης της νόσου που κυμαίνεται από 2% ως 45% (1) και σχετίζεται αντιστρόφως ανάλογα με την ιωδιο-επάρκεια της περιοχής, όπως έχει ήδη αναφερθεί. Δηλαδή, η επίπτωση είναι αντιστρόφως ανάλογη της διατροφικής πρόσληψης ιωδίου από τον πληθυσμό.
Από το Ηνωμένο Βασίλειο (11) η μελέτη Whickham ήταν η πρώτη που εξέτασε συστηματικά τα νοσήματα του θυρεοειδούς σε αντιπροσωπευτικό δείγμα του πληθυσμού και είχε δημοσιευτεί αρχικά το 1975. Είκοσι έτη αργότερα δημοσιεύτηκαν τα αποτελέσματα της επαναξιολόγησης του ίδιου πληθυσμού. Από τα αποτελέσματα αυτά σημειώνεται ότι δεν βρέθηκε καμία συσχέτιση ανάμεσα στην ηλικία και την πιθανή ανάπτυξη υπερθυρεοειδισμού και επιπλέον η συχνότητα εμφάνισης βρογχοκήλης μειώθηκε με την αύξηση της ηλικίας. Μόνο 10% των γυναικών και 2% των ανδρών είχαν πλέον βρογχοκήλη σε αντίθεση με 23% και 5% αντίστοιχα στον πρώτο έλεγχο. Τα ευρήματα αυτά συμβαδίζουν με την από ετών ιωδιο-επάρκεια που παρατηρείται στο Ηνωμένο Βασίλειο.
Σε μία πρόσφατα δημοσιευμένη μελέτη από τη Σουηδία (12), προοπτικού τύπου, τα έτη 2003-2005 ο σκοπός ήταν να εξετασθεί η επίδραση της χορήγησης ιωδίου σε περιοχές με μακρά ιωδιο-επάρκεια. Η συνολική επίπτωση υπερθυρεοειδισμού ήταν 27.6/100.000/έτος. Οι περιπτώσεις κλινικού υπερθυρεοειδισμού ήταν 23.8, ενώ οι περιπτώσεις υποκλινικού υπερθυρεοειδισμού ήταν 3.8. Η επίπτωση της ΤΠΒ ήταν μόλις 4.3 και του τοξικού αδενώματος 1.8, ενώ της νόσου Graves ήταν σαφώς υψηλότερο (21.4). Σημειώνεται ότι οι περιπτώσεις υποκλινικού υπερθυρεοειδισμού αφορούσαν κυρίως στην ΤΠΒ (40.2%) και στο ΤΑ (45.7%), ενώ μόλις 5.9% των ασθενών με νόσο Graves εμφάνιζε υποκλινικό υπερθυρεοειδισμό. Εικάζεται από τους συγγραφείς ότι η επίπτωση του υπερθυρεοειδισμού θα είναι χαμηλή τα επόμενα έτη και ενδεχομένως αντίστοιχη των ευρημάτων τους, δεδομένου ότι έχει επιτευχθεί ιωδιο-επάρκεια σε αρκετές χώρες πλέον.
Παρόμοια ευρήματα είχε μία άλλη σχετικά πρόσφατη Σουηδική μελέτη, στην οποία η επίπτωση της ΤΠΒ ήταν 3,3/100.000 κάτοικοι/έτος, του ΤΑ ήταν 4,9/100.000 κάτοικοι/έτος, ενώ της νόσου Graves ήταν 24,5/100.000 κάτοικοι/έτος (13).
Μία σχετικά πρόσφατη μελέτη από την Ισπανία (14) σε άτομα άνω των 55 ετών που είχαν υπερθυρεοειδισμό, διαπίστωσε ότι τα αίτια κατανέμονταν ως εξής: ΤΠΒ 43,1%, νόσος Graves 21,4%, ιατρογενής θυρεοτοξίκωση 16,0%, ΤΑ 11,8%, θυρεοτοξίκωση επαγόμενη από ιώδιο (αμιωδαρόνη, ιωδιούχα σκιαγραφικά) 1,2% και υποξεία θυρεοειδίτιδα 1,0%.
Στις Ηνωμένες Πολιτείες Αμερικής (15) η συνολική επίπτωση του υπερθυρεοειδισμού υπολογίζεται σε 1,2% (0,5% κλινικός και 0,7% υποκλινικός) υπολογίζεται ότι περίπου 15-30% των περιπτώσεων υπερθυρεοειδισμού οφείλονται σε ΤΠΒ (6).
2. Στοιχεία Παθολογικής Ανατομικής
2.1. Μακροσκοπικά χαρακτηριστικά
Η πολυοζώδης βρογχοκήλη, χαρακτηρίζεται από τη διόγκωση του θυρεοειδούς που μπορεί να κυμαίνεται από ήπια ως πολύ μεγάλη. Υπερμεγέθεις θυρεοειδείς με βάρος πάνω από 1.000 γρ. σπάνια συναντούνται πλεόν λόγω της μείωσης της ιωδιοπενίας. Το βάρος των χειρουργικών παρασκευασμάτων θυρεοειδεκτομής για πολυοζώδη βρογχοκήλη, τοξική ή όχι, είναι συνήθως λιγότερο από 200 γρ.
Μακροσκοπικά, συνήθως παρατηρούνται πολλαπλοί όζοι, ενώ σε περιπτώσεις τοξικού αδενώματος παρατηρείται μονήρης όζος. Ωστόσο, η μικροσκοπική εξέταση δείχνει συνήθως παρόμοιες αλλαγές στον ιστό του θυρεοειδούς γύρω από τον κυρίαρχο όζο. Οι όζοι εμφανίζουν ποικίλο μέγεθος. Διαφοροποίηση του κανονικού μεγέθους και σχήματος του θυρεοειδούς, συσχετίζεται με τον αριθμό και το μέγεθος των όζων και η διόγκωση του θυρεοειδούς μπορεί να είναι συμμετρική ή ασύμμετρη. Οι επιφάνειες διατομής τυπικά εμφανίζουν οζώδη, ετερογενή εμφάνιση. Περιοχικά μπορεί να έχουν όψη γυαλιστερή και ημιδιαφανή, λόγω του άφθονου κολλοειδούς. Μια σειρά από δευτερεύουσες αλλοιώσεις είναι κοινές και περιλαμβάνουν εστίες με αιμορραγία, ίνωση, κυστική εκφύλιση και ασβεστοποίηση. Οι όζοι μπορεί να περικλείονται εν μέρει από λεπτή ινώδη κάψα.
2.2. Ιστολογικά χαρακτηριστικά
Οι μικροσκοπικές αλλοιώσεις είναι αντίστοιχες με τη μακροσκοπική εμφάνιση. Τα θυρεοειδικά θυλάκια παρουσιάζουν ποικιλία μεγέθους και σχήματος. Κυμαίνονται από μικρά με ελάχιστη ποσότητα κολλοειδούς, ως πολύ μεγάλες κολλοειδείς «λίμνες». Τα μεγάλα θυλάκια συνήθως επενδύονται με πεπλατυσμένο επιθήλιο, ενώ τα μικρότερα θυλάκια επενδύονται από κυβοειδές ή κυλινδρικό επιθήλιο. Ορισμένοι αναφέρονται σε όζους με υψηλή κυτταροβρίθεια λόγω μικροθυλακιώδους ή συμπαγούς προτύπου ανάπτυξης και σπάνιου κολλοειδούς ως «αδενωματώδης όζος», ενώ ο όρος «κολλοειδής όζος» χαρακτηρίζει εκείνους με άφθονο κολλοειδές και χαμηλή πυκνότητα των θυλακικών κυττάρων. Κατά τόπους μπορεί να παρατηρηθεί θυλακικό επιθήλιο με οξυφιλοκυτταρική ή διαυγοκυτταρική μετατροπή. Υποστρόγγυλες αθροίσεις μικρών θυλακίων, γνωστές ως Sanderson polsters, μπορεί να παρατηρηθούν σε μεγάλα θυλάκια, που εκτείνεται από την περιφέρεια μέσα στο κολλοειδές. Τα θυλάκια μπορεί επίσης να εμφανίσουν θηλώδεις αναδιπλώσεις του επιθηλίου. Μεγαλύτερoι όζοι πιθανώς να ασκούν πιεστικά φαινόμενα στον περιβάλλοντα θυρεοειδικό ιστό. Οι όζοι συνήθως περιβάλλονται μερικώς από ινώδη ιστό με ποικίλο πάχος. Ορισμένοι μπορεί να περιβάλλονται εξ ολοκλήρου από μία ινώδη κάψα, οπότε και τίθεται το ερώτημα του θυλακιώδους αδενώματος ή καρκινώματος. Μια ποικιλία από δευτερεύουσες αλλοιώσεις παρατηρούνται συχνά, όπως αιμορραγία και ίνωση. Η αιμορραγία μπορεί να είναι πρόσφατη ή παλαιά. Η παλαιά αιμορραγία χαρακτηρίζεται από την παρουσία μακροφάγων πλήρη σε αιμοσιδηρίνη, αφρώδη ιστιοκύτταρα, κρυστάλλων χοληστερόλης και ικανή ίνωση. Δυστροφική ασβεστοποίηση μπορεί επίσης να παρατηρηθεί λόγω της παλαιάς αιμορραγίας και της νέκρωσης.
Αντιδραστική ενδοθηλιακή υπερπλασία μπορεί να παρατηρηθεί στην πολυοζώδη βρογχοκήλη. Η αντιδραστική ενδοθηλιακή υπερπλασία βρίσκεται μέσα στα αιματώματα του αδένα και αποτελεί μια επανορθωτική διαδικασία. Ιστολογικά χαρακτηρίζεται από ακανόνιστα αγγειακά δίκτυα ή θηλώδεις σχηματισμούς, που επενδύονται από ευμεγέθη ενδοθηλιακά κύτταρα μέσα σε ένα στρώμα από ινώδες ή αιμορραγικό υλικό. Η αντιδραστική ενδοθηλιακή υπερπλασία μπορεί επίσης να προσομοιάζει με ένα αιμαγγείωμα. Αυτές οι αλλοιώσεις συνήθως ανευρίσκονται σε θυρεοειδείς, στους οποίους προηγουμένως διενεργήθηκε βιοψία με λεπτή βελόνα (FNA) και αυτό μπορεί να είναι η υποκείμενη αιτία. Η αντιδραστική ενδοθηλιακή υπερπλασία είναι δυνατόν να διαγνωσθεί λανθασμένα ως αμετάπλαστο καρκίνωμα του θυρεοειδούς ή αγγειοσάρκωμα. Η ενδοθηλιακή φύση των κυττάρων μπορεί να επιβεβαιωθεί με θετική ανοσοέκφραση έναντι του παράγοντα VIII ή έναντι του CD34. Η διάκριση από το αγγειοσάρκωμα στηρίζεται στη συνολική εκτίμηση της πολυοζώδους βρογχοκήλης, καθώς και στο συγκεκριμένο πρότυπο ανάπτυξης του οργανούμενου αιματώματος. Μεταπλαστικές αλλοιώσεις που περιλαμβάνουν μη επιθηλιακά στοιχεία μπορεί να παρατηρηθούν. Η φλεγμονή μπορεί να συνοδεύει την οζώδη υπερπλασία.
3. Μοριακή παθογένεια
Σε θεωρητικό επίπεδο ενεργοποιητικές γενετικές ή σωματικές μεταλλάξεις σε οποιοδήποτε από τα σημαντικά στοιχεία του συστήματος υποδοχέας TSH-cAMP (μετάδοση σήματος) θα μπορούσε να οδηγήσει σε αυτόνομη ανάπτυξη όζων και αυτόνομη παραγωγή θυρεοειδικών κυττάρων.
Εκτιμάται ότι η παρατεταμένη ανεπάρκεια ιωδίου (σε ιωδιοπενικές περιοχές) ταυτόχρονα με τη χρόνια διέγερση από την TSH αυξάνει τον πολλαπλασιασμό των θυλακιωδών κυττάρων και επάγει την εμφάνιση και την έκφραση μεταλλάξεων στον υποδοχέα της TSH (TSHR) (16).
Για την κατανόηση της επαγωγής των μηχανισμών αυτονομίας είναι σημαντική η κατανόηση της δομής και της φυσιολογίας του TSHR (17, 18). Μολονότι το θέμα αυτό θα αναπτυχθεί σε άλλο κεφάλαιο του βιβλίου, εδώ αναφέρονται συνοπτικά κάποια στοιχεία. Ο υποδοχέας της TSH αποτελείται από 7 διαμεμβρανικά τμήματα με 3 εξωκυττάριες και 3 ενδοκυττάριες αγκύλες (loops) (Εικόνα 1).
Ο υποδοχέας είναι συζευγμένος σε μια Gsα πρωτεΐνη η οποία ενεργοποιεί την παραγωγή cAMP. Όταν η TSH συνδέεται στο εξωκυττάριο αμινοτελικό άκρο του TSHR, το ενδοκυττάριο καρβοξυτελικό άκρο αλληλεπιδρά με την Gs (α-υπομονάδα) η οποία διεγείρει την παραγωγή cAMP από ATP. Το cAMP είναι ουσιαστικό για την παραγωγή θυρεοσφαιρίνης, της θυρεοειδικής υπεροξειδάσης και θυρεοειδικών ορμονών όπως και για την έκκριση των ορμονών από τα θυρεοειδικά κύτταρα (μετάδοση σήματος) (19). Συμβάλλει, επίσης, στην ανάπτυξη και τον πολλαπλασιασμό των θυρεοειδικών κυττάρων.
Εικόνα 1. Ο υποδοχέας της TSH αποτελείται από 7 διαμεμβρανικά τμήματα τα οποία ελικοειδώς διαπερνούν την κυτταροπλασματική μεμβράνη. Το αμινοτελικο άκρο εντοπιζεται εξωκυττάρια και το καρβοξυτελικο άκρο στο κυτταροπλασμα.
Επιπλέον, σε υψηλότερες συγκεντρώσεις της TSH υπάρχει ένα ακόμη ρυθμιστικό μονοπάτι (second messenger pathway) στη λειτουργία των θυρεοειδικών κυττάρων, αυτό της φωσφατιδυλο-ινοσιτόλης-Ca++–διακυλογλυκερόλης (PiP2 cascade) (21). Υπάρχουν επίσης ενδείξεις (19) ότι ο υποδοχέας της TSH συνδέεται και με άλλα μέλη της οικογένειας των G πρωτεϊνών (Gβ, Gγ) (18, 19, 22). Στην πλειοψηφία των θυρεοειδικών όζων ανιχνεύονται μεταλλάξεις στον TSHR ή λιγότερο συχνά στη διεγερτική G πρωτεΐνη (23). Ποικίλες μεταλλάξεις στην πρωτεΐνη του TSHR σχετίζονται με μεταγραφή του cAMP ανεξάρτητα από την παρουσία της TSH (Εικόνα 2). Σε θυρεοειδικά κύτταρα με μεταλλαγμένο υποδοχέα αυτός διατηρεί μερικώς την απόκριση του στην TSH σε σύγκριση με τα κύτταρα στα οποία δεν έχει γίνει μετάλλαξη. Η Gs πρωτεΐνη ρυθμίζει την αύξηση και τον πολλαπλασιασμό των κυττάρων. Οταν αυτή η πρωτεΐνη έχει μεταλλαχθεί δρα ως ογκογονίδιο (22). Μεταλλάξεις στην Gs πρωτεΐνη έχουν εντοπισθεί σε περίπου 3-30% των αυτόνομων θυρεοειδικών όζων (24-26).
Έχει διαπιστωθεί ότι η αύξηση του cAMP οδηγεί σε βρογχοκήλη (27) και in vivo διεγείρει τον πολλαπλασιασμό των θυρεοειδικών κυττάρων.
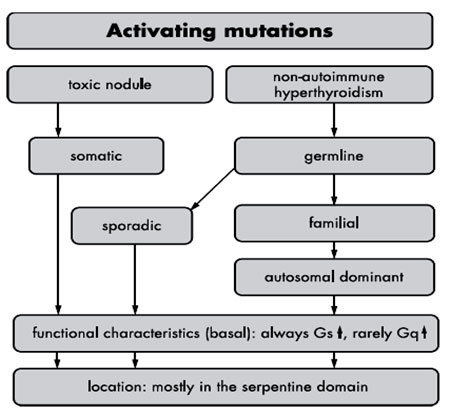
Εικόνα 2. Χαρακτηριστικά των ενεργοποιητικών μεταλλάξεων του TSHR. Αυτές οι μεταλλάξεις μπορεί να συμβούν είτε ως σωματικές ή ως γενετικές. Οι γενετικές είναι σποραδικές ή οικογενείς. Οι ενεργοποιητικές μεταλλάξεις χαρακτηρίζονται πάντα από ενίσχυση του βασικού σήματος ενεργοποίησης της Gs πρωτεΐνης. Κάποιες μεταλλάξεις εμφανίζουν ενίσχυση του σήματος Gq. Σε περίπτωση υπερθυροξιναιμίας οι μεταλλάξεις εντοπίζονται είτε σε ένα (επικρατούσα) ή σε δύο αλλήλια (υπολειπόμενη) κληρονομικότητα.
Στο ΤΑ και στην ΤΠΒ παρατηρείται εστιακή ή διάχυτη υπερπλασία των κυττάρων του θυλακίου, τα οποία αυτονομούνται και λειτουργούν ανεξάρτητα από τη δράση της TSH. Μπορεί να υπάρχει γενετική διαταραχή του TSHR ή επίκτητη σωματική μετάλλαξη. Η ανάλυση κλώνων μέσω της τεχνικής PCR (PCR amplification), είναι συχνά μία χρήσιμη τεχνική στην εντόπιση μεταλλάξεων σε όγκους και νεοπλασίες παρά τους περιορισμούς που υπάρχουν στην εκτέλεση της μεθόδου (2).
3.1. Σωματικές μεταλλάξεις του υποδοχέα της TSH
Συνήθως τα τοξικά αδενώματα αφορούν σε ένα κλώνο θυλακικών κυττάρων, τα οποία μετά τον πολλαπλασιασμό τους λειτουργούν αυτόνομα (2, 20). Στην ΤΠΒ η αυτονομία μπορεί να αφορά σε ένα μόνο όζο ή και περισσότερους (Αυτόνομοι Θυρεοειδικοί Όζοι, ΑΘΟ). Μπορεί να συνυπάρχουν μονοκλωνικοί ή/και πολυκλωνικοί όζοι, οι οποίοι παρουσιάζουν ετερογένεια ως προς τη μορφολογία και τη λειτουργία τους. Οι Parma & συν. (28) ήταν οι πρώτοι που ανίχνευσαν σωματικές μεταλλάξεις σε υπερλειτουργούντες ΑΘΟ, οι οποίες διεγείρουν τον υποδοχέα της TSH (TSHR). Σε άλλες μελέτες η επίπτωση των μεταλλάξεων του TSHR και της Gsα πρωτεΐνης φαίνεται να παρουσιάζει μεγάλο εύρος συχνοτήτων, που κυμαίνεται από 8 ως 82% (26, 28-30). Σε άλλες μελέτες, 20-80% των τοξικών αδενωμάτων και κάποιων ΑΘΟ από πολυοζώδεις βρογχοκήλες παρουσιάζουν σωματικές μεταλλάξεις του TSHR και της Gsα πρωτεΐνης (31). Αυτό το μεγάλο εύρος συχνοτήτων ενδεχομένως να οφείλεται αρχικώς στην τεχνική που χρησιμοποιήθηκε για την εντόπιση των μεταλλάξεων (direct sequencing, single strand conformation polymorfism, denaturing gradient gel electrophoresis).
Οι πρώτες μεταλλάξεις που αφορούσαν σε ΤΑ ήταν σωματικές ενεργοποιητικές μεταλλάξεις της Gsα πρωτεΐνης. Μεταλλάξεις στην αργινίνη 201 και γλουταμίνη 227 οδηγούν σε ενεργοποιητική μετάλλαξη της G πρωτεΐνης, αλλά μάλλον ευθύνονται για λιγότερο από 10% των ΤΑ (21, 26).
Όσον αφορά στις μεταλλάξεις του TSHR, τα μεταλλαγμένα σημεία εντοπίζονται στην τρίτη κυτταροπλασματική αγκύλη (loop) ή στο έκτο διαμεμβρανικό τμήμα του υποδοχέα. Στην ίδια ΤΠΒ μπορεί να ανιχνευθούν διαφορετικές μεταλλάξεις του TSHR σε παρακείμενους όζους.
3.2. Γενετικές ενεργοποιητικές μεταλλάξεις του υποδοχέα της TSH
Γενετικές μεταλλάξεις που ενεργοποιούν τον υποδοχέα της TSH είναι σπάνιες. Μια τέτοια γενικευμένη διαταραχή δεν θα αναμένονταν να προκαλέσει τοξικό αδένωμα (μονήρη όζο), αλλά μάλλον διάχυτη συμμετοχή του αδένα. Παραδείγματα αυτής της διαταραχής έχουν περιγραφεί ως κληρονομική τοξική θυρεοειδική υπερπλασία ή οικογενής μη-αυτοάνοσος υπερθυρεοειδισμός. Τα προσβεβλημένα άτομα αναπτύσσουν τοξική πολυοζώδη βρογχοκήλη που μπορεί να εμφανισθεί από την παιδική ηλικία ως την ενηλικίωση. Μεταδίδεται με τον αυτοσωματικό επικρατούντα χαρακτήρα. Μεταξύ των οικογενειών που έχουν διερευνηθεί, η κάθε μία εμφανίζει διαφορετική μετάλλαξη του TSHR (17, 29, 32). Μεταλλάξεις του TSHR έχουν επίσης περιγραφεί σε παιδιά με συγγενή υπερθυρεοειδισμό (33) και υγιείς γονείς που οφείλονταν σε μια de novo γενετική μετάλλαξη. Οι ασθενείς αυτοί συνήθως εμφανίζουν διάχυτη βρογχοκήλη και πιο σοβαρή νόσο από εκείνους με μη-αυτοάνοσο κληρονομικό υπερθυρεοειδισμό (17).
Σημειώνεται ότι οι ΑΘΟ με ανίχνευση είτε γενετικών ή σωματικών μεταλλάξεων εμφανίζουν μεγάλη ετερογένεια ως προς το φαινότυπο (22). Δηλαδή διαφορετικοί φαινότυποι σχετίζονται με την ίδια σωματική μετάλλαξη του TSHR, γεγονός που υποδηλώνει βλάβη στη μετάδοση του σήματος μετά τον υποδοχέα. Τα ίδια ευρήματα παρατηρούνται και στις γενετικές μεταλλάξεις.
3.3. Δράση αυξητικών παραγόντων
Εξωθυρεοειδικοί παράγοντες μπορεί επίσης να επιδράσουν στο ενδογενές σύστημα και να οδηγήσουν σε ανώμαλο μηχανισμό αύξησης των θυρεοειδικών κυττάρων γεγονός που οδηγεί σε επιταχυνόμενη οζώδη υπερπλασία και ανάπτυξη όζων. Οι κυριότεροι που έχουν μελετηθεί είναι ο TGF-β1 και ο IGF-1.
Transforming Growth Factor β1 (TGF-β1). Ο TGF-β1 φαίνεται ότι εμφανίζει δράσεις αντίθετες με τις δράσεις της TSH και άλλων αυξητικών παραγόντων. Εμποδίζει την πρόσληψη και την οργανοποίηση του ιωδίου, την παραγωγή θυρεοσφαιρίνης και τον πολλαπλασιασμό των κυττάρων του θυλακίου in vitro (2, 34). Η TSH ουσιαστικά διεγείρει την έκφραση του TGF-β1 στα θυρεοειδικά κύτταρα in vitro, γεγονός που θα μπορούσε να εξηγήσει τον πιθανό μηχανισμό δράσης του. Ο TGF-β1 τροποποιεί τη δράση του IGF-1 και των πρωτεϊνών που τον δεσμεύουν, με τρόπο ο οποίος θα μπορούσε να ελαττώσει τον πολλαπλασιασμό των θυρεοειδικών κυττάρων (35). Συνεπώς φαίνεται ότι ο TGF-β1 ελαττώνει την εμφάνιση βρογχοκήλης. Έλεγχος της έκφρασης γονιδίων σε ΑΘΟ με ή χωρίς μεταλλάξεις του υποδοχέα της TSH σε σύγκριση με τον περιβάλλοντα υγιή θυρεοειδικό ιστό έδειξαν ότι υπάρχει απενεργοποίηση αυτής της «κατασταλτικής» ενδοκυττάριας οδού (36). Σε αυτές τις παρατηρήσεις φαίνεται ότι διαπιστώθηκε και μειωμένη έκφραση του TGF-β receptor type III (betaglycan), των Smad 1, 3, και 4, του ERK 1, και του P300. Επιπλέον, παρατηρήθηκαν αυξημένη έκφραση της inhibin, της endoglin, των Smad 6 & 7 και του PAI-1 σε ΑΘΟ (36).
Insulin–growth factor 1 (IGF-1). Αρκετές μελέτες υποστηρίζουν το συνεργιστικό ρόλο του IGF-1 με την TSH στην αύξηση και τον πολλαπλασιασμό των θυρεοειδικών κυττάρων. Αρχικά, βρογχοκήλη παρατηρείται σε ποσοστό μεγαλύτερο του 70% των ασθενών με μεγαλακρία οι οποίοι έχουν υψηλό IGF-1 (37). Οι IGF ενισχύουν τη δράση της TSH και είναι απαραίτητοι για την πλήρη διέγερση των θυρεοειδικών κυττάρων από την TSH in vitro (38). Αυτό διαπιστώνεται σε ασθενείς με πλήρη υποφυσιακή ανεπάρκεια του προσθίου λοβού της υπόφυσης, οι οποίοι όταν θεραπεύονται με αυξητική ορμόνη δεν παρατηρείται καμία αύξηση στο μέγεθος του θυρεοειδούς παρά την αύξηση των επιπέδων του IGF-1. Το ιώδιο φαίνεται να επηρεάζει τα επίπεδα του IGF-1, αφού σε καλλιέργειες θυρεοειδικών κυττάρων η αύξηση του ενδοκυττάριου ιωδίου μείωσε τη μεταγραφή του mRNA του IGF-1, την παραγωγή της πρωτεΐνης και την αύξηση του κυττάρου (39).
4. Συμπτωματολογία – Κλινική εικόνα
Η κλινική εικόνα της θυρεοειδικής αυτονομίας-υπερθυρεοειδισμού διαφοροποιείται ανάλογα με την ηλικία, το μέγεθος της βρογχοκήλης και πιθανά συνυπάρχοντα νοσήματα του ασθενούς (2).
Το φάσμα των κλινικών εκδηλώσεων της ΤΠΒ και του ΤΑ που αφορούν στα συμπτώματα υπερθυρεοειδισμού, ποικίλει. Επιπλέον, δεν είναι σπάνιο σε ασθενείς με ΤΠΒ και ΤΑ, τα συμπτώματα και τα σημεία του υπερθυρεοειδισμού να απουσιάζουν εντελώς (40) όταν ο υπερθυρεοειδισμός είναι ήπιος ή υποκλινικός (41).
Η εγκατάσταση της αυτονομίας των θυρεοειδικών όζων είναι συνήθως προοδευτική και ο μέσος ασθενής με ΤΠΒ/ΤΑ έχει κατά τη διάγνωση συνήθως ηλικία > 50 ετών (2). Η διαφοροποίηση στην εκδήλωση των συμπτωμάτων του υπερθυρεοειδισμού οφείλεται κατά κύριο λόγο στην αυξημένη ηλικία των ασθενών. Δηλαδή, τα τυπικά συμπτώματα του υπερθυρεοειδισμού, ο τρόμος, η απώλεια βάρους με συνοδό αυξημένη όρεξη, η αυξημένη εφίδρωση, η υπερκινησία, η ευερεθιστότητα και η δυσκολία στη νοητική συγκέντρωση, τα οποία εμφανίζονται σε νεαρούς ασθενείς με θυρεοτοξίκωση, συχνά απουσιάζουν (40). Προεξάρχοντα είναι συνήθως τα συμπτώματα από το κυκλοφορικό σύστημα (16) (αρρυθμίες, ταχυκαρδίες, με ή χωρίς συμφορητική καρδιακή ανεπάρκεια, υψηλή συστολική πίεση), απώλεια βάρους και κάποτε ανορεξία. Οι κενώσεις μπορεί να είναι αυξημένες ή και φυσιολογικές σε αριθμό/ημέρα σε αντίθεση με τη νόσο Graves που είναι σχεδόν πάντα αυξημένες (40).
Μία σπάνια οντότητα που δεν απαντάται στην καθημερινή πράξη και είναι δύσκολο να διαγνωσθεί είναι η «απαθητική» (apathetic) θυρεοτοξίκωση (μη συμπτωματική θυρεοτοξίκωση). Περιγράφηκε πρώτη φορά από τον Lahey το 1931 (42). Συνήθως για χρόνια η θυρεοτοξίκωση παραμένει αδιάγνωστη, ο ασθενής είναι μεγάλος σε ηλικία (>70 ετών), εμφανίζει απαθές προσωπείο και κατάθλιψη, με έκδηλη μυϊκή ατροφία των εγγύς μυών (εγγύς μυοπάθεια). Λόγω του ανέκφραστου προσωπείου και της μείωσης της σωματικής δραστηριότητας, συχνά στον ασθενή αποδίδεται ψυχιατρική νόσος. Έχει περιγραφεί σε σπάνιες περιπτώσεις και σε ασθενείς μέσης ηλικίας και ακόμη πιο σπάνια ως σπάνια επιπλοκή υπερθυρεοειδισμού σε παιδιά. Στις σπάνιες περιπτώσεις στις οποίες η ΤΠΒ εμφανίζεται σε παιδιά, υπάρχει συνήθως θετικό οικογενειακό ιστορικό υπερθυρεοειδισμού (Familial Non-Autoimmune Autosomal Dominant Hyperthyroidism – FNAH). Προκαλείται από ενεργοποιητική γενετική μετάλλαξη στο γονίδιο του υποδοχέα της TSH (43) η οποία προκαλεί υπερδιέγερση των θυρεοειδικών κυττάρων και ανεξέλεγκτη παραγωγή θυρεοειδικών ορμονών (44), όπως αναφέρθηκε πιο πάνω (Μοριακή Παθογένεια).
Η υπερπαραγωγή θυρεοειδικών ορμονών στην ΤΠΒ είναι συνήθως λιγότερο εκσεσημασμένη σε σύγκριση με τη νόσο Graves. Η μέτρηση της Τ4 και της Τ3 μπορεί να αποκαλύψει μόνο οριακή αύξηση, ενώ το προέχον εργαστηριακά εύρημα είναι η ανασταλμένη TSH.
Σε πολλές περιπτώσεις το ιστορικό του ασθενούς και η κλινική εξέταση συμβάλλουν δραστικά στη διάγνωση. Στη λήψη του ιστορικού πρέπει πάντα να προσδιορίζεται εάν ο ασθενής έχει εκτεθεί σε μεγάλες δόσεις ιωδίου (θεραπεία με αμιωδαρόνη, ιωδιούχα σκιαγραφικά), οι οποίες μπορεί να επάγουν τη θυρεοτοξίκωση σε ασθενείς με πρότερη ανεπαρκή πρόσληψη ιωδίου. Η European Study Group of Hyperthyroidism αναφέρει ότι 36,8% των ασθενών που παρουσιάσαν υπερθυρεοειδισμό σε ιωδιοπενικές περιοχές είχαν ιστορικό έκθεσης σε μεγάλες δόσεις ιωδίου και επιπλέον από αυτούς το 54% εμφάνισε μη αυτοάνοσης αιτιολογίας υπερθυρεοειδισμό (45). Ο επαγόμενος από αυξημένη χορήγηση ιωδίου υπερθυρεοειδισμός είναι πιο συχνός σε άτομα μεγαλύτερης ηλικίας και ανταποκρίνεται λιγότερο καλά στη θεραπεία με αντιθυρεοειδικά φάρμακα (46).
Στην ΤΠΒ δεν είναι μικρή η πιθανότητα να υπάρχουν συμπτώματα απόφραξης/περιοχικής συμπίεσης λόγω της οζώδους διαμόρφωσης του θυρεοειδούς και του ευμεγέθους αδένα. Μπορεί να υπάρχει ορατή διόγκωση στο λαιμό, δύσπνοια, βήχας ή/και αναφερόμενη ήπια δυσκαταποσία. Αυτό είναι ακόμα πιο πιθανό σε περιπτώσεις αυτόματης αιμορραγίας κάποιων εκ των όζων. Βράγχος φωνής λόγω πίεσης ή παρεσης του παλίνδρομου λαρυγγικού είναι μία σπάνια εκδήλωση της καλοήθους οζώδους θυρεοειδικής νόσου και η ύπαρξη του εγείρει υπόνοια και απαιτεί διερεύνηση για υποκείμενη κακοήθεια.
Σε πολυοζώδεις βρογχοκήλες δεν πρέπει να παραγνωρίζεται η πιθανότητα ύπαρξης θυρεοειδικού καρκινώματος (47) και επιβάλλεται παράλληλος έλεγχος για την ύπαρξη ψηλαφητών ή όχι λεμφαδένων. Σε κάποιες μελέτες η επίπτωση του θυρεοειδικού καρκινώματος έχει βρεθεί υψηλότερη σε περιπτώσεις ΤΠΒ σε σύγκριση με υπερθυρεοειδισμό λόγω νόσου Graves (48-50). Συνήθως το ποσοστό ειναι μικρότερο από 5% (51). Να σημειωθεί όμως ότι σε περιπτώσεις ύπαρξης όζων στον θυρεοειδή με εκδήλωση υπερθυρεοειδισμού λόγω νόσου Graves, αυτό συσχετίζεται με υψηλότερο κίνδυνο ανάπτυξης επιθετικότερου καρκινώματος σε σύγκριση με ΤΠΒ ή/και ΤΑ (50, 52). Σε τέτοια περίπτωση συνιστάται η διενέργεια βιοψίας του/των ύποπτου/ων όζου/ων με λεπτή βελόνη και ο κατάλληλος χειρισμός του ασθενούς εφόσον η κυτταρολογική εξέταση αποβή θετική για κακοήθεια (βλ αντίστοιχο κεφάλαιο).
5. Κλινική εξέταση
Παρατηρώντας τον ασθενή συνήθως υπάρχει ορατή διόγκωση του θυρεοειδούς και ενδεχομένως ευμεγέθης βρογχοκήλη, η οποία όμως δεν συναντάται συχνά σε ιωδιο-επαρκείς περιοχές. Ενδεχομένως να υπάρχουν συμπτώματα απόφραξης, όπως βήχας ή διάταση της σφαγίτιδας. Λεπτός τρόμος μπορεί να παρατηρείται στα άνω άκρα, αλλά σε ηλικιωμένα άτομα μπορεί να μην αξιολογηθεί λόγω της αυξημένης εμφάνισης ιδιοπαθούς τρόμου στην τρίτη ηλικία και συνιστάται προσοχή στην συναξιολόγηση των ευρημάτων.
Τα σημεία υπερθυρεοειδισμού, όπως το ζεστό και υγρό δέρμα αλλά και το λάμπον βλέμμα, δεν είναι πάντα ιδιαίτερα εμφανή, ενώ οι ειδικές για τη νόσο Graves εκδηλώσεις (οφθαλμοπάθεια, προκνημιαίο μυξοίδημα και περιφερική ακροπάθεια) απουσιάζουν.
Ο θυρεοειδής αδένας ψηλαφάται άλλοτε άλλου μεγέθους (συχνά ευμεγέθης), ενδεχομένως ομότιμα διογκωμένος χωρίς σαφείς ψηλαφητούς όζους ή οζώδους συστάσεως με δύο ή περισσότερους ψηλαφητούς όζους στις περιπτώσεις ΤΠΒ. Οι όζοι συνήθως είναι ομαλοί, κινητοί και μη ευαίσθητοι στην ψηλάφηση εκτός και εάν έχουν αιμορραγήσει πρόσφατα. Στις περιπτώσεις ΤΑ συνήθως ψηλαφάται μονήρης όζος. Ο θυρεοειδής ενδέχεται να παρουσιάζει σχετική μείωση της ελαστικότητάς του. Επίσης, πρέπει να σημειωθεί ότι σε ένα ποσοστό 20% των ηλικιωμένων ασθενών με υπερθυρεοειδισμό ο θυρεοειδής ψηλαφάται σκληρής συστάσεως και ανώμαλης υφής, αλλά όχι ιδιαίτερα αυξημένος σε μέγεθος. Στο υπερηχογράφημα που ακολουθεί αποκαλύπτεται η οζώδης βρογχοκήλη.
Σε κάποιες περιπτώσεις η βρογχοκήλη είναι καταδυόμενη και ενδέχεται να προκαλεί πιεστικά φαινόμενα και σύνδρομο απόφραξης άνω κοίλης φλέβας. Συμπίεση των παρακείμενων δομών μπορεί να ταυτοποιηθεί με μετατόπιση της τραχείας και διάταση της έξω σφαγίτιδας. Επιπλέον, το ενδεχόμενο απόφραξης της άνω κοίλης φλέβας ελέγχεται κλινικά ζητώντας από τον ασθενή να σηκώσει ταυτόχρονα τα δυο άνω άκρα τεντωμένα. Εάν υπάρχει συμπίεση της άνω κοίλης φλέβας, τότε παρατηρείται διάταση των φλεβών του προσώπου και του λαιμού και έντονη ερυθρότητα προσώπου (σημείο Pemberton) (53). Εάν ο θυρεοειδής ψηλαφάται σκληρός ή/και καθηλωμένος ταυτόχρονα με ψηλαφητούς λεμφαδένες ή/και βράγχος φωνής πρέπει να αποκλειστεί η πιθανότητα καρκινώματος. Επίσης, εάν ένας όζος ψηλαφάται σκληρός συνιστάται παρακέντηση με λεπτή βελόνη (51). Η ακρόαση του θυρεοειδούς δεν αναδεικνύει το συνεχές φύσημα που παρατηρείται σε περιπτώσεις νόσου Graves (54).
Απο το κυκλοφορικό σύστημα συνήθως διαπιστώνεται ταχυσφυγμία ή αρρυθμία (κολπική μαρμαρυγή) από την εξεταση των περιφερικών σφύξεων. Σε πιο ηλικιωμένους ασθενείς μπορεί να σημειωθεί αυξημένη συστολική πίεση και αυξημένο εύρος πίεσεως.
Το αχίλλειο αντανακλαστικό ενδέχεται να μην εμφανίζει την ταχεία επαναφορά που σημειώνεται στον υπερθυρεοειδισμό απο νόσο Graves λόγω συνυπάρχοντων νοσημάτων που διαταράσσουν τη νευρική αγωγιμότητα (π.χ. νευροπάθεια λόγω σακχαρώδους διαβήτη) ή πίεσης νευρικών ριζών από πιθανές κήλες μεσοσπονδυλίων δίσκων.
6. Διάγνωση
6.1. Ορμονικοί προσδιορισμοί
Η διάγνωση του υπερθυρεοειδισμού γίνεται αρχικά με την μέτρηση των θυρεοειδικών ορμονών στον ορό.
Η μέτρηση της TSH (3ης γενιάς) αποτελεί την πρώτη εξέταση (screening test) σε ασθενείς με κλινικά σημεία ή υποψία υπερθυρεοειδισμού. Η τιμή της βρίσκεται ανεσταλμένη (χαμηλότερη από το κατώτερο φυσιολογικό όριο για τη μέθοδο προσδιορισμού) και ταυτόχρονα με υψηλή τιμή Τ4 και/ή Τ3 τίθεται η διάγνωση του κλινικού υπερθυρεοειδισμού. Εντούτοις, υπάρχουν και ασθενείς οι οποίοι έχουν χαμηλή τιμή TSH (<0.5 mU/mL) με φυσιολογικές τιμές Τ4 και Τ3, που ανήκουν στο φάσμα του υποκλινικού υπερθυρεοειδισμού και οι απόψεις για τη θεραπευτική αντιμετώπισή τους συχνά διίστανται.
Τα επίπεδα της ελεύθερης Τ4 (fT4) μπορεί να είναι αυξημένα ή και εντός φυσιολογικών ορίων. Μεμονωμένη αύξηση της Τ4 παρατηρείται σε περιπτώσεις υπερθυρεοειδισμού επαγόμενου από απότομη ή/και αιφνίδια αύξηση της χορήγησης ιωδίου σε ιωδιοπενικούς ασθενείς ή σε περιπτώσεις λήψης παραγόντων, που μειώνουν την περιφερική μετατροπή της Τ4 σε Τ3 (π.χ. προπρανολόλη, κορτικοστεροειδή, ιωδιούχα σκιαγραφικά, αμιωδαρόνη). Κάποιοι ασθενείς ενδέχεται να έχουν φυσιολογικά επίπεδα fT4 με αύξηση των επιπέδων της Τ3 (Τ3 τοξίκωση). Το ποσοστό αυτό κυμαίνεται στη βιβλιογραφία από 5-46% σε ασθενείς με θυρεοειδικούς όζους. Ενδέχεται οι τιμές των Τ4 και Τ3 να είναι εντός φυσιολογικών ορίων, αλλά είναι σαφώς αυξημένες σε σύγκριση με παλαιότερες εξετάσεις (αν υπάρχουν), στις οποίες ενδεχομένως και η τιμή της TSH να ήταν εντός φυσιολογικών ορίων. Επίσης, συχνά σε ασθενείς με συνυπάρχοντα νοσήματα τα επίπεδα της Τ3 είναι ελαττωμένα. Ο λόγος Τ4/Τ3 είναι συνήθως υψηλότερος σε σύγκριση με τη νόσο Graves (όπου συχνά η απόλυτη τιμή της Τ3 είναι σαφώς υψηλότερη). Σημειώνεται ότι ο τίτλος των αντιθυρεοειδικών αντισωμάτων είναι αρνητικός.
Από τον υπόλοιπο εργαστηριακό έλεγχο στην ΤΠΒ συνήθως απουσιάζουν ευρήματα που υπάρχουν στη νόσο Graves. Εντούτοις, κάποιες φορές διαπιστώνεται οριακή αύξηση ασβεστίου, αυξημένα επίπεδα αλκαλικής φωσφατάσης και φερριτίνης και συνήθως χαμηλή (ή έστω χαμηλότερη από ότι συνήθως) τιμή χαμηλής πυκνότητας χοληστερόλης (LDL).
6.2. Απεικόνιση
6.2.1. Υπερηχογράφημα
Το υπερηχογράφημα δεν έχει τη δυνατότητα να διακρίνει τη λειτουργικότητα των όζων. Εντούτοις δίνει πληροφορίες για το μέγεθός τους, τον ακριβή αριθμό τους, την αγγείωση και την ηχογένειά τους (55). Επιπλέον, επιβεβαιώνει ότι μία ψηλαφητή μάζα στον τράχηλο είναι ενδοθυρεοειδική και καθορίζει τις ανατομικές σχέσεις των θυρεοειδικών όζων με τις παρακείμενες δομές.
Στην περίπτωση του ΤΑ απεικονίζεται συνήθως μονήρης όζος ή/και πολλαπλοί – ένας εκ των οποίων έχει αυτονομηθεί, αν και αυτό δεν είναι συχνό. Εάν το μέγεθος του όζου είναι >3εκ. η πιθανότητα αυτονομίας του είναι πολύ μεγαλύτερη (51). Στην ΤΠΒ απεικονίζονται πολλαπλοί όζοι άλλοτε άλλου μεγέθους. Σε έναν όζο μπορεί να υπερισχύει το κυστικό στοιχείο ή να είναι μικτής ηχογένειας. Εάν υπάρχουν υπερηχογραφικά στοιχεία που εγείρουν την υπόνοια κακοήθειας (ασαφή όρια, κεντρική αγγείωση, στικτές αποτιτανώσεις, υποηχογένεια) συνιστάται η διενέργεια παρακέντησης με λέπτη βελόνα και κυτταρολογική εξέταση του υλικού (FNAC-Fine Needle Aspiration Cytology) (51).
Επιπρόσθετα, με τη χρήση του υπερηχογραφήματος μπορεί να υπολογιστεί κατά προσέγγιση ο όγκος του θυρεοειδούς, ώστε να υπολογιστεί η δόση 131Ι που θα χορηγηθεί (βλ ενότητα θεραπεία με ραδιενεργό ιώδιο).
6.2.2. Σπινθηρογράφημα
Ένδειξη για σπινθηρογράφημα θυρεοειδούς έχουν οι ασθενείς με ανεσταλμένη τιμή TSH, δηλαδή τιμή μικρότερη από το κατώτερο όριο για τη μέθοδο προσδιορισμού. Σύμφωνα με την ταξινόμηση κατά WHO (World Health Organization), οι καλοήθεις θυρεοειδικοί όζοι διακρίνονται σε θερμούς, κανονικούς και ψυχρούς ανάλογα με την πρόσληψη που εμφανίζουν στο γενόμενο σπινθηρογράφημα, η οποία είναι αυξημένη, φυσιολογική ή ελαττωμένη αντίστοιχα (56). Περίπου 85% είναι ψυχροί, 10% είναι φυσιολογικοί και 5% είναι θερμοί, αν και η συχνότητα διαφοροποιείται στις διάφορες χώρες ανάλογα με την πρόσληψη ιωδίου με τη διατροφή (51).
Ως ραδιοφάρμακο χρησιμοποιείται είτε 123I ή 99mTc. Το 123Ι έχει χρόνο ημίσειας ζωής 13 ώρες, χορηγούνται 100-300μCi (3,7-11,1MBq) από το στόμα. Δίνει πολύ καλές εικόνες και πληροφορίες για τη λειτουργικότητα του αδένα. Το 99m Tc έχει χρόνο ημισείας ζωής 6 ώρες, χορηγούνται 2-4mCi (74-148MBq) ενδοφλεβίως. Δίνει σχετικά καλές εικόνες, αλλά δεν δίνει πληροφορίες για τη λειτουργικότητα του θυρεοειδούς παρά μόνο για την πρόσληψη του ραδιοφαρμάκου από τον αδένα. Στην περίπτωση του ΤΑ εμφανίζεται μονήρης περιοχή με αυξημένη πρόσληψη του ραδιοφαρμάκου, ενώ το παρακείμενο παρέγχυμα δεν προσλαμβάνει («ιαπωνική σημαία») ή παρουσιάζει ελαττωμένη πρόσληψη σε σύγκριση με την υπερλειτουργούσα εστία. Στην περίπτωση της ΤΠΒ εμφανίζονται πολλαπλές περιοχές αυξημένης πρόσληψης του ραδιοφαρμάκου (τουλάχιστον δύο) οζώδεις ανάμεσα σε περιοχές που δεν προσλαμβάνουν ή προσλαμβάνουν ασθενώς (Εικόνα 3).
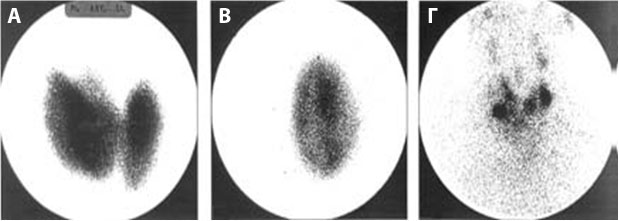
Εικόνα 3. Σπινθηρογραφικές εικόνες σε ν. Graves’ (A), ΤΑ (B) και ΤΠΒ (Γ). Στο ΤΑ και στην ΤΠΒ διακρινονται θερμές, συνήθως οζώδεις περιοχές ανάμεσα σε περιοχές που δεν προσλαμβάνουν το ραδιοφάρμακο. Στο μεν ΤΑ η θερμή εστία είναι μονήρης, ενώ στην ΤΠΒ οι θερμές περιοχές είναι πολλαπλές.
7. Θεραπευτική αντιμετώπιση
Ο χειρισμός των ασθενών με θυρεοειδική αυτονομία είτε αυτή οφείλεται σε μονήρη αυτόνομο θυρεοειδικό όζο (ΤΑ) ή σε σε πολλαπλούς αυτόνομους (ΤΠΒ), όπως τεκμηριώνεται σύμφωνα με τα ανωτέρω, εξαρτάται από τη βαρύτητα του υπερθυρεοειδισμού (1), την ηλικία του ασθενούς και τη γενικότερή του κατάσταση (συνυπάρχουσες παθήσεις και θεραπευτική αγωγή). Η αγωγή με αντιθυρεοειδικά φάρμακα θεωρείται αγωγή πρώτης γραμμής σε όλους τους ασθενείς με κλινικό υπερθυρεοειδισμό. Ο αρχικός στόχος είναι η επίτευξη ευθυρεοειδισμού. Πρέπει να τονιστεί ότι σε περιπτώσεις υποκλινικού υπερθυρεοειδισμού (χαμηλή TSH, <0,5mU/ml, με φυσιολογικές θυρεοειδικές ορμόνες), η απόφαση για χορήγηση θεραπείας λαμβάνεται μετά από συνεκτίμηση των παραγόντων κινδύνου ανάπτυξης επιπλοκών. Οι σοβαρότερες επιπλοκές αφορούν σαφώς στο καρδιαγγειακό συστήμα και την ανάπτυξη συνήθως ταχυαρρυθμιών (κολπική μαρμαρυγή), αλλά και το μυοσκελετικό σύστημα (ποικίλου βαθμού απώλεια οστικής μάζας).
Η θεραπευτική φαρέτρα περιλαμβάνει επίσης τη χορήγηση ραδιενεργού ιωδίου ή τη χειρουργική αφαίρεση του θυρεοειδούς, οι οποίες θεωρούνται θεραπείες εκλογής επειδή δίνουν οριστική λύση εφόσον η ΤΠΒ και το ΤΑ ουσιαστικά ποτέ δεν υποχωρούν (57). Σε κάποια κέντρα διενεργείται επίσης έγχυση αιθανόλης (percutaneous ethanol injection) ή φωτοπηξία (interstitial laser photocoagulation) με υπερηχογραφική καθοδήγηση (58).
7.1. Φαρμακευτική αγωγή
Η αρχική αντιμετώπιση του ασθενούς γίνεται με αντιθυρεοειδικά φάρμακα, τα οποία συνήθως χορηγούνται για ένα ως δύο έτη με στόχο την ύφεση της νόσου. Ως ύφεση ορίζεται ο βιοχημικός ευθυρεοειδισμός ο οποίος διατηρείται ένα έτος μετά την διακοπή των αντιθυρεοειδικών φαρμάκων. Εναλλακτικά, χρησιμοποιούνται μόνο για λίγες (2-8) εβδομάδες, με σκοπό πέραν της βιοχημικής ύφεσης και της άμβλυνσης των συμπτωμάτων, την προετοιμασία του ασθενούς για την οριστική θεραπεία, η οποία θα γίνει είτε με χορήγηση ραδιενεργού ιωδίου ή με ολική θυρεοειδεκτομή. Σε κάποιους ασθενείς μπορεί να διατηρηθεί και για περισσότερο χρόνο εφόσον κρίνονται ακατάλληλοι για χειρουργείο ή δεν επιθυμούν θεραπεία με ραδιενεργό ιώδιο, αν και ο κίνδυνος υποτροπής σε περίπτωση διακοπής τους, είναι αυξημένος.
Τα διαθέσιμα σκευάσματα είναι η μεθιμαζόλη, η καρβιμαζόλη, που μετατρέπεται σε μεθιμαζόλη (αντιστοιχία: 10mg καρβιμαζόλης à 6mg μεθιμαζόλης) και η προπυλθειουρακίλη. Η μεθιμαζόλη έχει μεγαλύτερο χρόνο δράσης και μπορεί να χορηγείται μια φορά την ημέρα, ενώ η προπυλθειουρακίλη έχει μικρό χρόνο δράσης και χορηγείται 2 ή 3 φορές την ημέρα. Η συνήθης δόση έναρξης είναι 20-30mg/ημέρα μεθιμαζόλης, ή 50-150mg 3 φορές/ημέρα προπυλθειουρακίλης, δόσεις που εξαρτώνται από τη βαρύτητα του υπερθυρεοειδισμού. Υψηλότερες δόσεις σχετίζονται με αυξημένη συχνότητα ανεπιθύμητων ενεργειών, ενώ βοηθούν μόνο σε οριακά ταχύτερη άρση του υπερθυρεοειδισμού (59).
Οι συνηθισμένες παρενέργειες είναι η εμφάνιση εξανθήματος, γαστρεντερικές διαταραχές, εμφάνιση πυρετού και αρθραλγίες. Σοβαρότερες, αν και σπάνιες, παρενέργειες είναι η ακοκκιοκυτταραιμία, αγγειίτιδα και ο φαρμακευτικός λύκος. Με την έναρξη της αντιθυρεοειδικής αγωγής πρέπει να δίνονται σαφείς οδηγίες στους ασθενείς να επικοινωνήσουν με τον θεράποντα σε περίπτωση που εμφανίσουν εξάνθημα, έντονη κόπωση, ασαφές κοιλιακό άλγος, πυρετό, κυνάγχη, ανορεξία ή υπικτερική χροιά στα μάτια.
Σε υπερθυρεοειδισμό στην κύηση, χορηγείται προπυλθειουρακίλη γιατί έχει αναφερθεί απλασία του τριχωτού της κεφαλής με τη χρήση μεθιμαζόλης (60), όμως επειδή η ΤΠΒ και το ΤΑ συναντώνται σε ηλικίες συνήθως άνω των 50 ετών δεν είναι σύνηθες να συνυπάρχουν με κύηση.
Ο FDA (US Food and Drug Administration) τον Ιούνιο του 2009 εξέδωσε προειδοποίηση για τη χρήση της προπυλθειουρακίλης και τον κίνδυνο εμφάνισης σοβαρής ηπατοτοξικότητας, ηπατικής ανεπάρκειας ακόμα και θανάτου (61). Έκτοτε η προπυλθειουρακίλη (62) δεν συνιστάται ως θεραπεία πρώτης γραμμής σε υπερθυρεοειδισμό σε μη εγκύους και παιδιά εκτός αν υπάρχει γνωστή αλλεργία στη μεθιμαζόλη.
Παράλληλα, μπορεί να χορηγηθούν β-αναστολείς, που ελαττώνουν τη συσταλτικότητα του μυοκαρδίου και επομένως τις σφύξεις, μειώνουν την αυξημένη εφίδρωση και ελαττώνουν τη νευρικότητα (αν συνυπάρχουν). Ειδικότερα, η προπρανολόλη πέραν των ανωτέρω δράσεων μειώνει και την περιφερική μετατροπή της Τ4 σε Τ3. Σε περίπτωση αντένδειξης χορήγησης β-αναστολέα (π.χ. βρογχικό άσθμα) χορηγούνται άλλα αντιαρρυθμικά (π.χ. διλτιαζέμη) για έλεγχο των περιφερικών σφύξεων. Σε ασθενείς με ήπια θυρεοτοξίκωση λόγω του αυξημένου κινδύνου εμφάνισης κολπικής μαρμαρυγής μπορεί να χορηγηθούν ως μονοθεραπεία.
7.2. Χορήγηση ραδιενεργού ιωδίου
Η θεραπεία με ραδιενεργό ιώδιο (131Ι) χρησιμοποιείται ευρέως για τη θεραπεία των ασθενών με ΤΑ και ΤΠΒ ως οριστική αντιμετώπιση της νόσου (63). Χρησιμοποιείται για 6 δεκαετίες για τη θεραπεία του υπερθυρεοειδισμού, είναι καλά ανεκτή, χωρίς επιπλοκές και σχετικά ασφαλής πλην των περιπτώσεων ασθενών με νόσο Graves που εμφανίζουν οφθαλμοπάθεια (1). Με εξαίρεση την κύηση και το θηλασμό, ουσιαστικά δεν υπάρχει καμία άλλη αντένδειξη για τη χορήγηση 131Ι (1).
Το 131Ι χορηγείται από το στόμα ως διάλυμα ή ως κάψουλα και ταχέως συσσωρεύεται στον θυρεοειδή (64). Η β-ακτινοβολία προκαλεί κυταρόλυση με αποτέλεσμα νέκρωση – καταστροφή του μονήρους αδενώματος ή των αυτόνομων θυρεοειδικών όζων.
Εάν ο ασθενής εμφανίζει πιο έκδηλη και έντονη συμπτωματολογία, είναι ηλικιωμένος ή πάσχει από αλλά νοσήματα, τότε συνιστάται πρώτα αγωγή με αντιθυρεοειδικά φάρμακα με στόχο τον έλεγχο των συμπτωμάτων. Η διακοπή τους γίνεται συνήθως 5-8 ημέρες πριν τη χορήγηση του 131Ι (65). Στους ασθενείς με ηπιότερη συμπτωματολογία μπορεί να μη χορηγηθούν τα αντιθυρεοειδικά σκευάσματα με εξίσου καλά αποτελέσματα (66).
Όσον αφορά στη χορηγούμενη δόση υπάρχουν ποικίλες απόψεις. Συνήθως οι ασθενείς με ΤΠΒ τείνουν να έχουν μικρότερη πρόσληψη του 131I σε σύγκριση με τους ασθενείς που πάσχουν από νόσο Graves. Με αυτό το δεδομένο συνήθως χρειάζονται οριακά μεγαλύτερες δόσεις από τους τελευταίους για την επίτευξη ευθυρεοειδισμού. Χορηγούνται συνήθως από 9 mCi ως 21 mCi (300-800 Mbq) ανάλογα με το μέγεθος του αδένα (63). Η χορήγηση της θεραπευτικής δόσης συνήθως είναι εμπειρική με καλά θεραπευτικά αποτελέσματα. Δεν έχει καθοριστεί η βέλτιστη δόση με την οποία επιτυγχάνεται ύφεση της νόσου (ευθυρεοειδισμός ή υποθυρεοειδισμός). Οι ισορροπίες μεταξύ υπερ-, ευ- και υποθυρεοειδισμού είναι λεπτές (67). Σε διάφορες μελέτες έχει γίνει προσπάθεια εντοπισμού των παραμέτρων οι οποίες μπορούν να προβλέψουν και να καθορίσουν το αποτέλεσμα. Φαίνεται ότι υψηλότερες δόσεις είναι πιο αποτελεσματικές και επιφέρουν την ίαση, αλλά με αυτές αυξάνεται η πιθανότητα εμφάνισης υποθυρεοειδισμού σε άλλοτε άλλο χρόνο (67).
Σε κάποια κέντρα διενεργείται αρχικά σπινθηρογράφημα, συνήθως με 5μCi (1.85 MBq), που δείχνει την κατανομή του ραδιοφαρμάκου και γίνεται ένας αδρός υπολογισμός της δόσης αφού υπολογιστεί ο όγκος του θυρεοειδούς μετά τη διενέργεια υπερηχογραφήματος και τη χρήση μαθηματικού τύπου (63) ή γίνεται δοσιμετρία (63, 68, 69). Επίσης, υπολογίζεται η καθήλωση του ραδιοφαρμάκου στον αδένα. Σε ασθενείς με καθήλωση <20% η χορήγηση προπυλθειουρακίλης ή λιθίου βελτιώνει την πρόσληψη.
Η θεραπεία με 131Ι προκαλεί καταστροφή του ΤΑ ή των αυτόνομων όζων σε μία περίοδο που κυμαίνεται από 6 ως και 22 εβδομάδες. Επειδή ακριβώς αργεί η δράση του, χορηγούνται θειοναμίδες για κάποιο χρονικό διάστημα (συνήθως 6-8 βδομάδες) για έλεγχο των συμπτωμάτων του υπερθυρεοειδισμού. Προοδευτικά παρατηρείται βελτίωση των συμπτωμάτων, προκαλείται συρρίκνωση των όζων και σμίκρυνση του θυρεοειδούς. Η σμίκρυσνη αυτή αναφέρεται 35% σε 3 μήνες και ως 45% μετά από δύο έτη (70). Συνήθως ο υπερθυρεοειδισμός θεραπεύεται, αλλά σε κάποιες περιπτώσεις ενδέχεται να επανεμφανισθεί, οπότε χρειάζεται η χορήγηση δεύτερης δόσης που συνήθως είναι και η οριστική θεραπεία. Αυτό συμβαίνει στην ΤΠΒ σε περιπτώσεις που ο υπερθυρεοειδισμός είναι βαρύς ή/και η βρογχοκήλη ιδιαίτερα μεγάλη. Τα ποσοστά των περιπτώσεων που χρήζουν χορήγηση δεύτερης δόσης 131Ι κυμαίνονται από 2% (71) ως 20% (72). Το ποσοστό ίασης μετά από χορήγηση 131Ι (μετά από μία ή δύο δόσεις) είναι υψηλό και κυμαίνεται από 83-98% (63, 69, 72, 73).
Σε περιπτώσεις ΤΑ το ποσοστό ίασης είναι επίσης υψηλό και ενδεχομένως υψηλότερο από την ΤΠΒ (71). Αναφέρεται ενδεικτικά μια μελέτη που περιελάμβανε 62 ασθενείς οι οποίοι είχαν λάβει 131Ι και όλοι εμφάνισαν ίαση (70). Ο κίνδυνος εμφάνισης υποθυρεοειδισμού υπάρχει και ο ασθενής πρέπει να βρίσκεται σε παρακολούθηση. Συνήθως όμως είναι μικρότερος σε σύγκριση με τη χορήγηση 131Ι σε νόσο Graves, επειδή οι υπερλειτουργούντες όζοι προσλαμβάνουν περισσότερο ραδιοφάρμακο ενώ το παρακείμενο υγιές κατεσταλμένο παρέγχυμα δεν προσλαμβάνει (69). Σε μία πρόσφατη μελέτη με παρακολούθηση ως και 8 έτη μετά τη χορήγηση 131Ι τα ποσοστά εμφάνισης υποθυρεοειδισμού εμφανίστηκαν υψηλά από 32% ως και 73% και αυξάνονταν με την πάροδο του χρόνου (73). Υψηλότερα ποσοστά υποθυρεοειδισμού παρατηρούνται σε ασθενείς που έχουν λάβει αγωγή με αντιθυρεοειδικά φάρμακα. Εάν ο ασθενής λαμβάνει αγωγή με μεθιμαζόλη, το 131Ι πρέπει να χορηγείται πριν η τιμή της TSH ομαλοποιηθεί, έτσι ώστε να μην συσσωρευθεί ραδιοφάρμακο στο παρακείμενο στους όζους (73) θυρεοειδικό παρέγχυμα με στόχο τη μείωση της εμφάνισης υποθυρεοειδισμού (73).
Μετά τη χορήγηση του 131Ι οι ασθενείς πρέπει να παρακολουθούνται αρχικά για την επίτευξη ευθυρεοειδισμού και στη συνέχεια για πιθανή εμφάνιση υποθυρεοειδισμού (66). Η μέτρηση των θυρεοειδικών ορμονών πρέπει να γίνεται αρχικά 6-8 βδομάδες μετά τη χορήγηση του ραδιοφαρμάκου και ακολούθως ανά 4-6 βδομάδες ανάλογα με τα αποτελέσματα των προηγούμενων εξετάσεων και τη σμίκρυνση του μεγέθους του αδένα (73). Η σμίκρυνση αυτή είναι ανάλογη με τη χορηγούμενη δόση.
Στο πρώτο διάστημα μετά τη θεραπεία σε ένα τρίτο περίπου των ασθενών μπορεί να παρατηρηθεί επίταση των συμπτωμάτων του υπερθυρεοειδισμού λόγω της καταστροφής του θυρεοειδικού παρεγχύματος και της απελευθέρωσης των θυρεοειδικών ορμονών στην κυκλοφορία και περίπου 4% αναπτύσσει συμπτώματα μετακτινικής θυρεοειδίτιδας (73). Θυρεοτοξική κρίση είναι μία σπάνια επιπλοκή η οποία συναντάται σε ασθενείς με ευμεγέθεις όζους (74) ή πολύ ψηλές τιμές Τ3 πριν τη χορήγηση. Σε ασθενείς με υψηλές τιμές Τ3 πρέπει να προηγείται αγωγή με αντιθυρεοειδικά φάρμακα, οπως έχει ήδη αναφερθεί (65).
Θεραπεία με 131Ι υπό ανασυνδυασμένη ανθρώπινη TSH. Η σχετικά χαμηλή καθήλωση του 131Ι από τις οζώδεις βρογχοκήλες μπορεί να επηρεάσει την αποτελεσματικότητα της θεραπείας και έτσι απαιτεί αύξηση της χορηγούμενης δόσης (75). Συνεπώς, τα τελευταία έτη έχει δοκιμαστεί (off label) η χορήγηση 131Ι υπό ανασυνδυασμένη ανθρώπινη TSH (recombinant human Thyroid Stimulating Hormone, rh-TSH) με στόχο την αύξηση της πρόσληψης του ραδιοφαρμάκου από τον αδένα (75-77). Έχει, επίσης, χρησιμοποιηθεί σε ασθενείς με μη τοξική πολυοζώδη βρογχοκήλη με στόχο τη μείωση του μεγέθους της βρογχοκήλης (78). Σε αυτές τις περιπτώσεις είναι εφικτή η μείωση της χορηγούμενης δόσης ιωδίου κατά 50-60% από τη συνηθισμένη. Έχει διαπιστωθεί όμως ότι χρειάζεται πολύ μικρότερη δόση rh-TSH από αυτήν που χρησιμοποιείται σε περιπτώσεις θυρεοειδικού καρκινώματος (0,9mg/ημ. σε 2 συνεχόμενες ημέρες). Η δόση που έχει χρησιμοποιηθεί είναι 0.01 ως 0.45-mg rh-TSH (77). Μεγαλύτερες δόσεις rh-TSH έχουν αναφερθεί ότι επάγουν σοβαρή θυρεοτοξίκωση ή/και έντονο οίδημα του αδένα με συνοδό άλγος, με αποτέλεσμα εμφάνιση αποφρακτικών συμπτωμάτων στον τράχηλο (δύσπνοια από συμπίεση της τραχείας ή βράγχος φωνής) (77,79). Σε μία μελέτη στην οποία συμπεριλήφθησαν 41 ασθενείς με κλινικό ή υποκλινικό υπερθυρεοειδισμό σε έδαφος ευμεγέθους οζώδους βρογχοκήλης, οι ασθενείς οι οποίοι τυχαία επιλέγησαν να λάβουν πριν 0,45mg rh-TSH είχαν μεγαλύτερη μείωση (58%) στο μέγεθος της βρογχοκήλης στο 1ο έτος σε σύγκριση με 40% μείωση στην ομάδα που δεν έλαβε. Εντούτοις, οι ασθενείς που είχαν λάβει rh-TSH είχαν επίσης υψηλότερο ποσοστό υποθυρεοειδισμού 65% σε σύγκριση με 21% στην άλλη ομάδα (80), ενδεχομένως λόγω πρόσληψης του ραδιοφαρμάκου και από τις παρακείμενες στους όζους περιοχές του θυρεοειδικού παρεγχύματος.
Λόγω του κινδύνου επιδείνωσης του υπερθυρεοειδισμού ή/και εμφάνισης θυρεοτοξικής κρίσης, δεν συνιστάται η χορήγηση rh-TSH όταν πρόκειται να χορηγηθεί μεγαλύτερη δόση 131Ι, ειδικότερα σε μεγαλύτερους σε ηλικία ασθενείς ή σε αυτούς με υποκείμενο καρδιαγγειακό νόσημα (81).
7.3. Εγχείρηση
Η χειρουργική αφαίρεση του θυρεοειδούς αδένα αποτελεί μία αποτελεσματική και προτεινόμενη θεραπεία για την αντιμετώπιση της ΤΠΒ και του ΤΑ, ειδικά σε πιο μικρούς σε ηλικία ασθενείς. Έχει το πλεονέκτημα σε σύγκριση με τη θεραπεία με 131Ι ότι δίνει οριστική λύση στον υπερθυρεοειδισμό, αφού η πιθανότητα υποτρόπης είναι <1% (1). Παράλληλα αντιμετωπίζει και τα ενδεχόμενα συνυπάρχοντα συμπιεστικά ή/και αποφρακτικά φαινόμενα από την βρογχοκήλη, όπως επίσης και το αισθητικό πρόβλημα από την ύπαρξη ευμεγέθους αδένα. Οπότε σε περιπτώσεις ύπαρξης αποφρακτικών φαινομένων (δύσπνοια, συμπίεση άνω κοίλης), αποτελεί τη θεραπεία εκλογής όπως επίσης και σε πολύ ευμεγέθεις βρογχοκήλες στις οποίες η πιθανότητα υποτροπής του υπερθυρεοειδισμού είναι αυξημένη μετά τη θεραπεία με 131Ι. Επιπλέον, σε ασθενείς με μεγάλες βρογχοκήλες στις οποίες συνυπάρχουν όζοι οι οποίοι παρουσιάζουν ύποπτα υπερηχογραφικά χαρακτηριστικά (βλ παρ. διάγνωση-υπερηχογράφημα) για κακοήθεια επίσης αποτελεί τη θεραπεία εκλογής (82). Συνιστάται ολική ή σχεδόν ολική θυρεοειδεκτομή (1). Για τη διενέργεια της επέμβασης πρέπει ο ασθενής να είναι ευθυρεοειδικός, που επιτυγχάνεται με τη χορήγηση των αντιθυρεοειδικών φαρμάκων.
Οι επιπλοκές της θυρεοειδεκτομής περιλαμβάνουν μόνιμη πάρεση του λαρυγγικού νεύρου (2,3%), μόνιμο υποπαραθυρεοειδισμό (0,5%), παροδικό υποπαραθυρεοειδισμό (2,5%) και την μετεγχειρητική αιμορραγία (1,4%) (1), με τα ποσοστά αυτά να αλλάζουν ανάλογα με την εμπειρία του χειρουργού.
Ο υποθυρεοειδισμός είναι αναπόφευκτος σε ασθενείς οι οποίοι υποβάλλονται σε σχεδόν ολική ή ολική θυρεοειδεκτομή. Σε αυτούς τους ασθενείς η έναρξη υποκατάστασης με θυροξίνη (L-θυροξίνη, L-Τ4) πρέπει να ξεκινήσει άμεσα μετά την επέμβαση σε δοσολογία περίπου 1,6μg/kg σε καθημερινή βάση. Σε 6-8 βδομάδες συνιστάται μέτρηση της TSH με στόχο την τιτλοποίηση της δόσης. Εάν η TSH είναι μεγαλύτερη από το ανώτερο φυσιολογικό όριο συνιστάται αύξηση της δόσης κατά 12 ως 25μg (83). Σε μεγαλύτερους σε ηλικία ασθενείς ή σε αυτούς με υποκείμενη στεφανιαία νόσο χορηγείται μικρότερη δόση, συνήθως 50μg-75μg (83).
8. Παρακολούθηση
Μετά την έναρξη αντιθυρεοειδικών φαρμάκων συνιστάται μέτρηση της fT4 σε 4-6 εβδομάδες. Η TSH αυξάνεται αργότερα λόγω της χρόνιας καταστολής της από τις υψηλές κυκλοφορούσες θυρεοειδικές ορμόνες. Μπορεί να χρειαστεί ως και 6 μήνες για να ομαλοποιηθεί η τιμή της.
Μετά τη θεραπεία με ραδιενεργό ιώδιο στις 4 περίπου εβδομάδες γίνεται η πρώτη μέτρηση fT4, T3 και TSH. Συνήθως χρειάζονται 10 εβδομάδες για να διαπιστωθεί κλινική ανταπόκριση και στο μεσοδιάστημα οι ασθενείς καλύπτονται συνήθως με αντιθυρεοειδικά φάρμακα.
Οι ασθενείς οι οποίοι υποβάλλονται σε θυρεοειδεκτομή συνήθως έχουν ξεκινήσει υποκατάσταση με L-θυροξίνη, οπότε σε 4-6 εβδομάδες μετά την επέμβαση γίνεται προσδιορισμός της TSH για τιτλοποίηση της δόσης.
Οι ασθενείς με υποκλινικό υπερθυρεοειδισμό πρέπει να παρακολουθούνται με έλεγχο θυρεοειδικών ορμονών (41) ανά 6μηνο για την πιθανότητα εμφάνισης κλινικού υπερθυρεοειδισμού και επιλεκτικά θεραπεύονται αυτοί που κυρίως εμφανίζουν καρδιαγγειακά συμπτώματα ή ελάττωση της οστικής μάζας (41).
Η πρόγνωση των ασθενών είναι καλή εφόσον αντιμετωπισθούν θεραπευτικά. Κακή πρόγνωση εμφανίζουν εάν δεν αντιμετωπισθεί ο υπερθυρεοειδισμός τους.
9. Επιγραμματικά
- Τοξική Πολυοζώδης Βρογχοκήλη (ΤΠΒ): Oρίζεται η κατάσταση στην οποία όζοι του θυρεοειδούς –συνήθως σε έδαφος γνωστής προϋπάρχουσας οζώδους θυρεοειδικής νόσου– αυτονομούνται και υπερλειτουργούν.
- Τοξικό Αδένωμα (ΤΑ): Ένας όζος του θυρεοειδούς αυτονομείται και υπερλειτουργεί . Αναφέρεται στη βιβλιογραφία και ως νόσος του Plummer.
- Επιδημιολογία: Η ΤΠΒ αποτελεί το δεύτερο σε συχνότητα αίτιο υπερθυρεοειδισμού μετά από τη νόσο Graves σε ιωδιο-επαρκείς περιοχές. Το ΤΑ αποτελεί το τρίτο σε συχνότητα αίτιο του υπερθυρεοειδισμού. Η επίπτωση της νόσου, που κυμαίνεται από 2% ως 45% και αυξάνεται ευθέως ανάλογα με την αύξηση της ηλικίας, είναι συχνότερη στις γυναίκες (Γ:Α=4:1) και σχετίζεται αντιστρόφως ανάλογα με την ιωδιο-επάρκεια της περιοχής.
- Μοριακή Παθογένεια: Η κυριότερη αιτία είναι σωματικές μεταλλάξεις στον υποδοχέα της TSH που οδηγούν πολλαπλασιασμό των θυλακικών κυττάρων και δημιουργία όζων.
- Κλινική εικόνα: Συμπτώματα και σημεία υπερθυρεοειδισμού σε άτομα άνω των 50 ετών ενδεχομένως λιγότερα έντονα σε σύγκριση με τη νόσο Graves. Συχνά ψηλαφητός θυρεοειδής οζώδους υφής.
- Θεραπεία: Έναρξη με αντιθυρεοειδικά φάρμακα με σκοπό τον αρχικό έλεγχο της νόσου και στη συνέχεια οριστικότερη αντιμετώπιση είτε με ραδιενεργό ιώδιο ή με χειρουργική αφαίρεση του θυρεοειδούς αδένα
Βιβλιογραφία
1. Bahn, R.S., et al., Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract, 2011. 17: p. 456-520.
2. Krohn, K., et al., Molecular pathogenesis of euthyroid and toxic multinodular goiter. Endocr Rev, 2005. 26: p. 504-24.
3. Delange, F., et al., Iodine deficiency in the world: where do we stand at the turn of the century? Thyroid, 2001. 11: p. 437-47.
4. Berghout, A., et al., Interrelationships between age, thyroid volume, thyroid nodularity, and thyroid function in patients with sporadic nontoxic goiter. Am J Med, 1990. 89: p. 602-8.
5. Mai, V.Q. and H.B. Burch, A stepwise approach to the evaluation and treatment of subclinical hyperthyroidism. Endocr Practice 2012. 18: p. 772-80.
6. Reid, J.R. and S.F. Wheeler, Hyperthyroidism: diagnosis and treatment. Am Fam Physician, 2005. 72: p. 623-30.
7. Delange, F., Iodine deficiency in Europe and its consequences: an update. Eur J Nucl Med Mol Imaging, 2002. 29 Suppl 2: p. S404-16.
8. Pedersen, I.B., et al., Surveyance of disease frequency in a population by linkage to diagnostic laboratory databases. A system for monitoring the incidences of hyper- and hypothyroidism as part of the Danish iodine supplementation program. Comput Methods Programs Biomed, 2002. 67: p. 209-16.
9. Stewart, J.C., Epidemiology and pathogenesis of iodine-induced thyrotoxicosis in Northern Tasmania. N Z Med J, 1975. 81: p. 25-6.
10. Hamburger, J.I., Evolution of toxicity in solitary nontoxic autonomously functioning thyroid nodules. J Clin Endocrinol Metab, 1980. 50: p. 1089-93.
11. Vanderpump, M.P., et al., The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol (Oxf), 1995. 43: p. 55-68.
12. Nystrom, H.F., S. Jansson, and G. Berg, Incidence rate and clinical features of hyperthyroidism in a long-term iodine sufficient area of Sweden (Gothenburg) 2003-2005. Clin Endocrinol (Oxf), 2013. 78: p. 768-76.
13. Abraham-Nordling, M., et al., Incidence of hyperthyroidism in Sweden. Eur J Endocrinol, 2008. 165: p. 899-905.
14. Diez, J.J., Hyperthyroidism in patients older than 55 years: an analysis of the etiology and management. Gerontology, 2003. 49: p. 316-23.
15. Singer, P.A., et al., Treatment guidelines for patients with hyperthyroidism and hypothyroidism. Standards of Care Committee, American Thyroid Association. Jama, 1995. 273: p. 808-12.
16. Gencer, B., et al., Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts. Circulation, 2012. 126: p. 1040-9.
17. Wonerow, P., et al., Thyrotropin receptor mutations as a tool to understand thyrotropin receptor action. J Mol Med (Berl), 2001. 79: p. 707-21.
18. Van Sande, J., et al., Somatic and germline mutations of the TSH receptor gene in thyroid diseases. J Clin Endocrinol Metab, 1995. 80: p. 2577-85.
19. Laugwitz, K.L., et al., The human thyrotropin receptor: a heptahelical receptor capable of stimulating members of all four G protein families. Proc Natl Acad Sci U S A, 1996. 93: p. 116-20.
20. Kleinau, G., et al., Novel insights on thyroid-stimulating hormone receptor signal transduction. Endocr Rev, 2013. 34: p. 691-724.
21. Corvilain, B., et al., Somatic and germline mutations of the TSH receptor and thyroid diseases. Clin Endocrinol (Oxf), 2001. 55: p. 143-58.
22. Arturi, F., et al., Thyrotropin receptor mutations and thyroid hyperfunctioning adenomas ten years after their first discovery: unresolved questions. Thyroid, 2003. 13: p. 341-3.
23. Trulzsch, B., T. Nebel, and R. Paschke, The thyrotropin receptor mutation database. Thyroid, 1999. 9: p. 521-2.
24. Holzapfel, H.P., et al., Expression of G(alpha)(s) proteins and TSH receptor signalling in hyperfunctioning thyroid nodules with TSH receptor mutations. Eur J Endocrinol, 2002. 147: p. 109-16.
25. Gozu, H.I., et al., Similar prevalence of somatic TSH receptor and Gsalpha mutations in toxic thyroid nodules in geographical regions with different iodine supply in Turkey. Eur J Endocrinol, 2006. 155: p. 535-45.
26. Trulzsch, B., et al., Detection of thyroid-stimulating hormone receptor and Gsalpha mutations: in 75 toxic thyroid nodules by denaturing gradient gel electrophoresis. J Mol Med (Berl), 2001. 78: p. 684-91.
27. Pisarev, M.A. and D.L. Kleiman de Pisarev, Biochemistry of thyroid regulation under normal and abnormal conditions. J Endocrinol Invest, 1980. 3: p. 317-29.
28. Parma, J., et al., Somatic mutations in the thyrotropin receptor gene cause hyperfunctioning thyroid adenomas. Nature, 1993. 365(6447): p. 649-51.
29. Fuhrer, D., et al., Identification of a new thyrotropin receptor germline mutation (Leu629Phe) in a family with neonatal onset of autosomal dominant nonautoimmune hyperthyroidism. J Clin Endocrinol Metab, 1997. 82: p. 4234-8.
30. Georgopoulos, N.A., et al., Autonomously functioning thyroid nodules in a former iodine-deficient area commonly harbor gain-of-function mutations in the thyrotropin signaling pathway. Eur J Endocrinol, 2003. 149: p. 287-92.
31. Duprez, L., et al., Pathology of the TSH receptor. J Pediatr Endocrinol Metab, 1999. 12 Suppl 1: p. 295-302.
32. Tonacchera, M., et al., Functional characteristics of a variant thyrotropin receptor. Eur J Biochem, 1996. 238: p. 490-4.
33. Kopp, P., et al., Congenital hyperthyroidism caused by a solitary toxic adenoma harboring a novel somatic mutation (serine281–>isoleucine) in the extracellular domain of the thyrotropin receptor. J Clin Invest, 1997. 100: p. 1634-9.
34. Taton, M., et al., General inhibition by transforming growth factor beta 1 of thyrotropin and cAMP responses in human thyroid cells in primary culture. Mol Cell Endocrinol, 1993. 95: p. 13-21.
35. Beere, H.M., et al., Insulin-like growth factor-I production and action in porcine thyroid follicular cells in monolayer: regulation by transforming growth factor-beta. J Endocrinol, 1991. 130: p. 3-9.
36. Eszlinger, M., et al., Gene expression analysis reveals evidence for inactivation of the TGF-beta signaling cascade in autonomously functioning thyroid nodules. Oncogene, 2004. 23: p. 795-804.
37. Gasperi, M., et al., Prevalence of thyroid diseases in patients with acromegaly: results of an Italian multi-center study. J Endocrinol Invest, 2002. 25: p. 240-5.
38. Eggo, M.C., L.K. Bachrach, and G.N. Burrow, Interaction of TSH, insulin and insulin-like growth factors in regulating thyroid growth and function. Growth Factors, 1990. 2: p. 99-109.
39. Hofbauer, L.C., et al., Insulin-like growth factor I messenger ribonucleic acid expression in porcine thyroid follicles is regulated by thyrotropin and iodine. Eur J Endocrinol, 1995. 132: p. 605-10.
40. Cooper, D.S., Hyperthyroidism. Lancet, 2003. 362: p. 459-68.
41. Cooper, D.S. and B. Biondi, Subclinical thyroid disease. Lancet 2012. 379: p. 1142-54.
42. Palacios, A., M.A. Cohen, and R. Cobbs, Apathetic hyperthyroidism in middle age. Int J Psychiatry Med, 1991. 21: p. 393-400.
43. Wiersinga, W.M., (From gene to disease; thyroid stimulating hormone receptor, hyperthyroidism and hypothyroidism). Ned Tijdschr Geneeskd, 2001. 145: p. 869-71.
44. Bertalan, R., et al., Hyperthyroidism caused by a germline activating mutation of the thyrotropin receptor gene: difficulties in diagnosis and therapy. Thyroid, 2010. 20: p. 327-32.
45. Reinwein, D., et al., Hyperthyroidism in Europe: clinical and laboratory data of a prospective multicentric survey. J Endocrinol Invest, 1986. 9 Suppl 2: p. 1-36.
46. Roti, E. and E.D. Uberti, Iodine excess and hyperthyroidism. Thyroid, 2001. 11: p. 493-500.
47. Vaiana, R., et al., Hyperthyroidism and concurrent thyroid cancer. Tumori, 1999. 85: p. 247-52.
48. Pascual Corrales, E., et al., (Incidental differentiated thyroid carcinoma is less prevalent in Graves’ disease than in multinodular goiter). Endocrinol Nutr, 2012. 59: p. 169-73.
49. Fukada, S., (Toxic multinodular goiter). Nihon Rinsho, 2006. 64: p. 2227-32.
50. Berker, D., et al., Prevalence of incidental thyroid cancer and its ultrasonographic features in subcentimeter thyroid nodules of patients with hyperthyroidism. Endocrine, 2011. 39: p. 13-20.
51. Hegedus, L., Clinical practice. The thyroid nodule. N Engl J Med, 2004. 351: p. 1764-71.
52. Pazaitou-Panayiotou, K., K. Michalakis, and R. Paschke, Thyroid cancer in patients with hyperthyroidism. Horm Metab Res, 2012. 44: p. 255-62.
53. Basaria, S. and R. Salvatori, Images in clinical medicine. Pemberton’s sign. N Engl J Med, 2004. 350: p. 1338.
54. Streetman, D.D. and U. Khanderia, Diagnosis and treatment of Graves disease. Ann Pharmacother, 2003. 37: p. 1100-9.
55. Clark, K.J., J.J. Cronan, and F.H. Scola, Color Doppler sonography: anatomic and physiologic assessment of the thyroid. J Clin Ultrasound, 1995. 23: p. 215-23.
56. Okosieme, O.E., et al., The utility of radioiodine uptake and thyroid scintigraphy in the diagnosis and management of hyperthyroidism. Clin Endocrinol (Oxf), 2010. 72: p. 122-7.
57. van Soestbergen, M.J., J.C. van der Vijver, and A.D. Graafland, Recurrence of hyperthyroidism in multinodular goiter after long-term drug therapy: a comparison with Graves’ disease. J Endocrinol Invest, 1992. 15: p. 797-800.
58. Cooper, D.S., et al., Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid, 2009. 19: p. 1167-214.
59. Bahn, R.S., et al., Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract, 2011. 17: p. 456-520.
60. Azizi, F., et al., Thyroid function and intellectual development of infants nursed by mothers taking methimazole. J Clin Endocrinol Metab, 2000. 85: p. 3233-8.
61. FDA, Information for Healthcare Professionals- Propylthiouracil_induced Liver Failure. FDA ALERT (06/04/2009), 2009.
62. Bahn, R.S., et al., The Role of Propylthiouracil in the Management of Graves’ Disease in Adults: report of a meeting jointly sponsored by the American Thyroid Association and the Food and Drug Administration. Thyroid, 2009. 19: p. 673-4.
63. Zingrillo, M., et al., Radioiodine treatment of Plummer and multinodular toxic and nontoxic goiter disease by the first approximation dosimetry method. Cancer Biother Radiopharm, 2007. 22: p. 256-60.
64. Bonnema, S.J., et al., A randomized trial evaluating a block-replacement regimen during radioiodine therapy. Eur J Clin Invest, 2011. 41: p. 693-702.
65. Bonnema, S.J., et al., Continuous methimazole therapy and its effect on the cure rate of hyperthyroidism using radioactive iodine: an evaluation by a randomized trial. J Clin Endocrinol Metab, 2006. 91: p. 2946-51.
66. Koornstra, J.J., et al., Clinical and biochemical changes following 131I therapy for hyperthyroidism in patients not pretreated with antithyroid drugs. Neth J Med, 1999. 55: p. 215-21.
67. Allahabadia, A., et al., Radioiodine treatment of hyperthyroidism-prognostic factors for outcome. J Clin Endocrinol Metab, 2001. 86: p. 3611-7.
68. de Rooij, A., et al., Clinical outcomes after estimated versus calculated activity of radioiodine for the treatment of hyperthyroidism: systematic review and meta-analysis. Eur J Endocrinol, 2009. 161: p. 771-7.
69. Kok, S.W., et al., Clinical outcome after standardized versus dosimetric radioiodine treatment of hyperthyroidism: an equivalence study. Nucl Med Commun, 2000. 21: p. 1071-8.
70. Nygaard, B., et al., Long-term effect of radioactive iodine on thyroid function and size in patients with solitary autonomously functioning toxic thyroid nodules. Clin Endocrinol (Oxf), 1999. 50: p. 197-202.
71. Huysmans, D.A., F.H. Corstens, and P.W. Kloppenborg, Long-term follow-up in toxic solitary autonomous thyroid nodules treated with radioactive iodine. J Nucl Med, 1991. 32: p. 27-30.
72. Erkan, M.E., et al., Efficiency of radioactive I-131 therapy in geriatric patients with toxic nodular goiter. Aging Clin Exp Res, 2012. 24: p. 714-7.
73. Kahraman, D., et al., Development of hypothyroidism during long-term follow-up of patients with toxic nodular goitre after radioiodine therapy. Clin Endocrinol (Oxf), 2012. 76: p. 297-303.
74. McDermott, M.T., et al., Radioiodine-induced thyroid storm. Case report and literature review. Am J Med, 1983. 75: p. 353-9.
75. Duick, D.S. and H.J. Baskin, Utility of recombinant human thyrotropin for augmentation of radioiodine uptake and treatment of nontoxic and toxic multinodular goiters. Endocr Pract, 2003. 9: p. 204-9.
76. Albino, C.C., et al., Recombinant human thyrotropin as adjuvant in the treatment of multinodular goiters with radioiodine. J Clin Endocrinol Metab, 2005. 90: p. 2775-80.
77. Nieuwlaat, W.A., et al., Pretreatment with a single, low dose of recombinant human thyrotropin allows dose reduction of radioiodine therapy in patients with nodular goiter. J Clin Endocrinol Metab, 2003. 88: p. 3121-9.
78. Fast, S., S.J. Bonnema, and L. Hegedus, Radioiodine therapy of benign non-toxic goitre. Potential role of recombinant human TSH. Ann Endocrinol (Paris), 2011. 72: p. 129-35.
79. Nieuwlaat, W.A., et al., Pretreatment with recombinant human TSH changes the regional distribution of radioiodine on thyroid scintigrams of nodular goiters. J Clin Endocrinol Metab, 2001. 86: p. 5330-6.
80. Silva, M.N., et al., Administration of a single dose of recombinant human thyrotrophin enhances the efficacy of radioiodine treatment of large compressive multinodular goitres. Clin Endocrinol (Oxf), 2004. 60: p. 300-8.
81. Giusti, M., et al., Long-term outcome after radioiodine therapy with adjuvant rhTSH treatment: comparison between patients with non-toxic and pre-toxic large multinodular goitre. Endocrine, 2013.
82. Smith, J.J., et al., Toxic nodular goiter and cancer: a compelling case for thyroidectomy. Ann Surg Oncol, 2013. 20: p. 1336-40.
83. Garber, J.R., et al., Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract, 2012. 18: p. 988-1028.
Created: October 26, 2014
Last updated: October 26, 2014


